Гидрирование — это химическая реакция между молекулярным водородом (H 2 ) и другим соединением или элементом, обычно в присутствии катализатора, такого как никель , палладий или платина . Этот процесс обычно используется для восстановления или насыщения органических соединений . Гидрирование обычно представляет собой присоединение пар атомов водорода к молекуле, часто алкену . Для того чтобы реакцию можно было использовать, необходимы катализаторы; некаталитическое гидрирование происходит только при очень высоких температурах. Гидрирование восстанавливает двойные и тройные связи в углеводородах . [1]
Гидрирование состоит из трех компонентов: ненасыщенного субстрата, водорода (или источника водорода) и, неизменно, катализатора . Реакцию восстановления проводят при различных температурах и давлениях в зависимости от субстрата и активности катализатора.
Те же катализаторы и условия, которые используются для реакций гидрирования, также могут привести к изомеризации алкенов из цис в транс . Этот процесс представляет большой интерес, поскольку технология гидрогенизации генерирует большую часть трансжиров в пищевых продуктах. Реакция, при которой связи разрываются при добавлении водорода, называется гидрогенолизом . Это реакция, которая может происходить со связями углерод-углерод и углерод-гетероатом ( кислород , азот или галоген ). Некоторые гидрирования полярных связей сопровождаются гидрогенолизом.
Для гидрирования очевидным источником водорода является сам газ H 2 , который обычно имеется в продаже в качестве хранимой среды в баллоне под давлением. В процессе гидрирования часто используется H 2 под давлением более 1 атмосферы , обычно подаваемого из баллонов и иногда дополненного «подкачивающими насосами». Газообразный водород производится в промышленности из углеводородов с помощью процесса, известного как паровой риформинг . [2] Во многих приложениях водород переносится от молекул-доноров, таких как муравьиная кислота , изопропанол и дигидроантрацен . [3] Эти доноры водорода подвергаются дегидрированию до диоксида углерода , ацетона и антрацена соответственно . Эти процессы называются трансферным гидрированием .
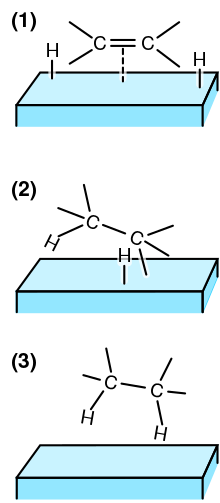
Важной характеристикой гидрирования алкенов и алкинов , как гомогенно, так и гетерогенно катализируемых версий, является то, что присоединение водорода происходит с помощью « син-присоединения », при этом водород поступает с наименее затрудненной стороны. [4] Эту реакцию можно проводить с множеством различных функциональных групп .
За редким исключением, H 2 не реагирует с органическими соединениями в отсутствие металлических катализаторов. Ненасыщенный субстрат хемосорбируется на катализаторе, причем большинство участков покрыто субстратом. В гетерогенных катализаторах водород образует поверхностные гидриды (МГ), из которых водород может переноситься на хемосорбированную подложку. Платина , палладий , родий и рутений образуют высокоактивные катализаторы, работающие при более низких температурах и меньших давлениях H 2 . Катализаторы из недрагоценных металлов, особенно на основе никеля (такие как никель Ренея и никель Урусибара ), также были разработаны в качестве экономичных альтернатив, но они часто работают медленнее или требуют более высоких температур. Компромиссом является активность (скорость реакции) по сравнению со стоимостью катализатора и стоимостью аппарата, необходимого для использования высокого давления. Обратите внимание, что гидрирование, катализируемое никелем Ренея, требует высоких давлений: [8] [9]
Катализаторы обычно делят на два широких класса: гомогенные и гетерогенные . Гомогенные катализаторы растворяются в растворителе, содержащем ненасыщенный субстрат. Гетерогенные катализаторы представляют собой твердые вещества, которые суспендированы в том же растворителе, что и субстрат, или обработаны газообразным субстратом.
Некоторые хорошо известные гомогенные катализаторы указаны ниже. Это координационные комплексы , которые активируют как ненасыщенный субстрат, так и H 2 . Чаще всего эти комплексы содержат металлы платиновой группы, особенно Rh и Ir.

Гомогенные катализаторы также используются в асимметричном синтезе путем гидрирования прохиральных субстратов. Ранней демонстрацией этого подхода стало резус-катализируемое гидрирование енамидов в качестве предшественников препарата L-ДОФА . [10] Для достижения асимметричного восстановления эти катализаторы делают хиральными с использованием хиральных дифосфиновых лигандов. [11] Катализируемое родием гидрирование также использовалось при производстве гербицидов S-метолахлора, в котором используется лиганд типа Йозифоса (называемый Ксилифос). [12] В принципе асимметричное гидрирование может катализироваться хиральными гетерогенными катализаторами, [13] но этот подход остается скорее диковинкой, чем полезной технологией.
Гетерогенные катализаторы гидрирования более распространены в промышленности. В промышленности катализаторы гидрирования драгоценных металлов наносят из раствора в виде мелкодисперсного порошка на носитель, представляющий собой дешевый, объемный, пористый, обычно гранулированный материал, такой как активированный уголь , оксид алюминия , карбонат кальция или сульфат бария . [14] Например, платину на угле получают восстановлением платинохлористоводородной кислоты in situ углеродом. Примерами таких катализаторов являются 5% рутения на активированном угле или 1% платины на оксиде алюминия. Катализаторы из недрагоценных металлов, такие как никель Ренея , обычно намного дешевле и не требуют поддержки. Кроме того, в лаборатории до сих пор используются безнесущие (массивные) катализаторы из драгоценных металлов, такие как платиновая чернь , несмотря на их стоимость.
Как и в гомогенных катализаторах, активность регулируется изменением среды вокруг металла, т. е. координационной сферы . Например, разные грани кристаллического гетерогенного катализатора проявляют различную активность. Это можно изменить, смешивая металлы или используя различные методы подготовки. Аналогичным образом на гетерогенные катализаторы влияют их носители.
Во многих случаях высокоэмпирические модификации включают избирательные «яды». Таким образом, тщательно выбранный катализатор можно использовать для гидрирования некоторых функциональных групп, не затрагивая другие, например, гидрирование алкенов без затрагивания ароматических колец или селективное гидрирование алкинов в алкены с использованием катализатора Линдлара . Например, когда палладий катализатора помещают на сульфат бария и затем обрабатывают хинолином , полученный катализатор восстанавливает алкины только в той степени, в которой это касается алкенов. Катализатор Линдлара был применен для превращения фенилацетилена в стирол . [15]

В трансферном гидрировании используются молекулы-доноры водорода, отличные от молекулярного H 2 . К таким «жертвенным» донорам водорода, которые также могут служить растворителями реакции, относятся гидразин , муравьиная кислота и спирты, такие как изопропанол. [18]
В органическом синтезе трансферное гидрирование полезно для асимметричного гидрирования полярных ненасыщенных субстратов, таких как кетоны , альдегиды и имины , с использованием хиральных катализаторов .
Полярные субстраты, такие как нитрилы , можно гидрировать электрохимически , используя протонные растворители и восстанавливающие эквиваленты в качестве источника водорода. [19]
Присоединение водорода к двойным или тройным связям в углеводородах представляет собой тип окислительно-восстановительной реакции, которая может быть термодинамически выгодной. Например, присоединение водорода к этилену приводит к изменению свободной энергии Гиббса -101 кДж·моль -1 , что является сильно экзотермическим явлением . [11] Например, при гидрировании растительных масел и жирных кислот выделяемого тепла, около 25 ккал на моль (105 кДж/моль), достаточно для повышения температуры масла на 1,6–1,7 °C на йодное число. уронить.
Однако скорость реакции большинства реакций гидрирования незначительна в отсутствие катализаторов. Механизм катализируемого металлами гидрирования алкенов и алкинов хорошо изучен. [20] Прежде всего, мечение изотопов с использованием дейтерия подтверждает региохимию присоединения:
В твердых телах общепринятым механизмом является механизм Хориути- Полани : [21] [22]
На третьем этапе алкильная группа может превратиться в алкен, который может оторваться от катализатора. Следовательно, контакт с катализатором гидрирования обеспечивает цис-транс -изомеризацию. Транс - алкен может повторно ассоциироваться с поверхностью и подвергаться гидрированию. Эти детали частично раскрываются с помощью D 2 (дейтерий), поскольку восстановленные алкены часто содержат дейтерий.
Для ароматических субстратов первое гидрирование протекает наиболее медленно. Продуктом этого этапа является циклогексадиен, который быстро гидрируется и редко обнаруживается. Аналогичным образом циклогексен обычно восстанавливают до циклогексана.
Во многих процессах гомогенного гидрирования [23] металл связывается с обоими компонентами, образуя промежуточный комплекс алкен-металл(H) 2 . Предполагается, что общая последовательность реакций следующая или связанная с ней последовательность стадий:
Изомеризация алкенов часто сопровождает гидрирование. Эта важная побочная реакция протекает путем отщепления бета-гидридом промежуточного алкилгидридного соединения: [24]
Часто высвобождаемый олефин является транс.
Гидрирование азота с получением аммиака проводится в огромных масштабах с помощью процесса Габера-Боша [25] , потребляя примерно 1% мирового энергоснабжения .
Кислород можно частично гидрировать с образованием перекиси водорода , хотя этот процесс не получил коммерческого применения. Одна из трудностей заключается в том, чтобы не допустить, чтобы катализаторы инициировали разложение перекиси водорода с образованием воды. [26] [27]
Каталитическое гидрирование имеет разнообразное промышленное применение. Чаще всего в промышленном гидрировании используются гетерогенные катализаторы. [2]
Пищевая промышленность гидрогенизирует растительные масла, чтобы превратить их в твердые или полутвердые жиры, которые можно использовать в спредах, конфетах, выпечке и других продуктах, таких как маргарин . Растительные масла производятся из полиненасыщенных жирных кислот (имеющих более одной двойной связи углерод-углерод). Гидрирование устраняет некоторые из этих двойных связей. [28]
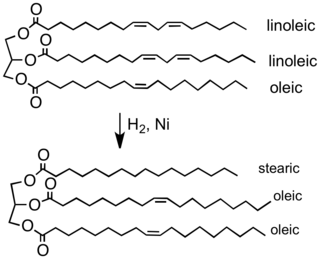
В нефтехимических процессах гидрирование используется для преобразования алкенов и ароматических соединений в насыщенные алканы (парафины) и циклоалканы (нафтены), которые менее токсичны и менее реакционноспособны. Что касается жидкого топлива, которое иногда в течение длительного времени хранится на воздухе, насыщенные углеводороды обладают превосходными свойствами хранения. С другой стороны, алкены имеют тенденцию образовывать гидропероксиды , которые могут образовывать смолы, мешающие работе оборудования для работы с топливом. Например, минеральный скипидар обычно гидрогенизируют. Еще одним применением является гидрокрекинг тяжелых остатков в дизельное топливо. В процессах изомеризации и каталитического риформинга некоторое давление водорода поддерживается для гидрогенолиза кокса , образующегося на катализаторе, и предотвращения его накопления.
Гидрирование — полезный способ превращения ненасыщенных соединений в насыщенные производные. В состав субстратов входят не только алкены и алкины, но и альдегиды, имины и нитрилы [29] , которые превращаются в соответствующие предельные соединения — спирты и амины. Так, алкилальдегиды, которые можно синтезировать оксо- процессом из монооксида углерода и алкена, можно превратить в спирты. Например, 1-пропанол получают из пропиональдегида, полученного из этилена и окиси углерода. Ксилит , полиол , получают гидрированием сахарной ксилозы , альдегида. Первичные амины можно синтезировать путем гидрирования нитрилов , тогда как нитрилы легко синтезируются из цианида и подходящего электрофила. Например, изофорондиамин, предшественник полиуретанового мономера изофорондиизоцианата , получают из изофороннитрила путем тандемного гидрирования нитрила/восстановительного аминирования аммиаком, при этом гидрирование превращает как нитрил в амин, так и имин, образованный из альдегида и аммиака, в еще один амин.
Самым ранним гидрированием было катализируемое платиной присоединение водорода к кислороду в лампе Дёберейнера , устройстве, которое поступило в продажу еще в 1823 году. Французский химик Поль Сабатье считается отцом процесса гидрирования. В 1897 году, опираясь на более раннюю работу Джеймса Бойса , американского химика, работавшего в производстве мыльной продукции, он обнаружил, что следы никеля катализируют присоединение водорода к молекулам газообразных углеводородов в так называемом процессе Сабатье . За эту работу Сабатье получил Нобелевскую премию по химии 1912 года . Вильгельм Норманн получил патент в Германии в 1902 году и в Великобритании в 1903 году на гидрирование жидких масел, что положило начало тому, что сейчас является мировой отраслью. Коммерчески важный процесс Габера-Боша , впервые описанный в 1905 году, включает гидрирование азота. В процессе Фишера-Тропша , о котором сообщалось в 1922 году, окись углерода, которую легко получить из угля, гидрируется до жидкого топлива.
В 1922 году Вурхис и Адамс описали аппарат для проведения гидрирования при давлении выше одной атмосферы. [30] Шейкер Парра, первый продукт, позволяющий проводить гидрирование при повышенном давлении и температуре, был коммерциализирован в 1926 году на основе исследований Вурхиса и Адамса и до сих пор широко используется. В 1924 году Мюррей Рэни разработал тонкоизмельченную форму никеля, которая широко используется для катализа реакций гидрирования, таких как превращение нитрилов в амины или производство маргарина.
В 1930-х годах Кальвин обнаружил, что комплексы меди(II) окисляют H 2 . 1960-е годы стали свидетелями разработки четко определенных гомогенных катализаторов с использованием комплексов переходных металлов, например, катализатора Уилкинсона (RhCl(PPh 3 ) 3 ). Вскоре после этого было обнаружено, что катионные Rh и Ir катализируют гидрирование алкенов и карбонилов. [31] В 1970-х годах асимметричное гидрирование было продемонстрировано при синтезе L-ДОФА , а в 1990-х годах было изобретено Нойори асимметричное гидрирование . [32] На развитие гомогенного гидрирования повлияли работы, начатые в 1930-х и 1940-х годах по оксо-процессу и полимеризации Циглера-Натта .
Для большинства практических целей гидрирование требует металлического катализатора. Однако гидрирование может происходить от некоторых доноров водорода без катализаторов, примерными донорами водорода являются диимид и изопропоксид алюминия , последний иллюстрируется восстановлением Меервейна-Понндорфа-Верли . Некоторые безметалловые каталитические системы были исследованы в академических исследованиях. Одна из таких систем восстановления кетонов состоит из трет -бутанола и трет-бутоксида калия и очень высоких температур. [33] Реакция, изображенная ниже, описывает гидрирование бензофенона :
Исследование химической кинетики [34] показало, что эта реакция является первым порядком для всех трех реагентов, что указывает на циклическое 6-членное переходное состояние .
Другая система безметаллового гидрирования основана на соединении 1 фосфин - борана , которое было названо фрустрированной парой Льюиса . Он обратимо присоединяет диводород при относительно низких температурах с образованием бората фосфония 2 , который может восстанавливать простые затрудненные имины . [35]
Сообщалось , что восстановление нитробензола до анилина катализируется фуллереном , его моноанионом, атмосферным водородом и УФ-светом. [36]
Сегодняшний химик имеет три основных варианта оборудования для гидрирования:
Оригинальная и до сих пор широко применяемая форма гидрирования в учебных лабораториях. Этот процесс обычно осуществляется путем добавления твердого катализатора в круглодонную колбу с растворенным реагентом, из которой был откачан азот или аргон , и герметизации смеси проницаемым резиновым уплотнением. Затем газообразный водород подается из баллона , наполненного H 2 . Полученную трехфазную смесь перемешивают для ускорения перемешивания. Поглощение водорода можно контролировать, что может быть полезно для мониторинга хода гидрирования. Это достигается либо использованием градуированной трубки, содержащей цветную жидкость, обычно водный сульфат меди , либо с помощью манометров для каждого реакционного сосуда.
Поскольку многие реакции гидрирования, такие как гидрогенолиз защитных групп и восстановление ароматических систем, протекают крайне медленно при атмосферной температуре и давлении, популярны системы под давлением. В этих случаях катализатор добавляют к раствору реагента в инертной атмосфере в сосуде под давлением . Водород добавляется непосредственно из баллона или встроенного лабораторного источника водорода, а суспензия под давлением механически встряхивается для обеспечения перемешивания или используется вращающаяся корзина. [37] Последние достижения в технологии электролиза привели к разработке генераторов водорода высокого давления, которые производят водород из воды под давлением до 1400 фунтов на квадратный дюйм (100 бар). Также можно использовать тепло, поскольку давление компенсирует связанное с этим снижение растворимости газа.
Проточное гидрирование стало популярным методом в лабораторных условиях и во все более широком масштабе процесса. Этот метод включает непрерывное пропускание разбавленного потока растворенного реагента через катализатор с неподвижным слоем в присутствии водорода. Используя признанную технологию высокоэффективной жидкостной хроматографии , этот метод позволяет применять давление от атмосферного до 1450 фунтов на квадратный дюйм (100 бар). Также могут использоваться повышенные температуры. В лабораторных системах в системах используется ряд предварительно упакованных катализаторов, что устраняет необходимость взвешивания и фильтрации пирофорных катализаторов.
Каталитическое гидрирование проводится в трубчатом реакторе поршневого типа , заполненном нанесенным катализатором. Давление и температура обычно высокие, хотя это зависит от катализатора. Загрузка катализатора обычно намного ниже, чем при периодическом гидрировании в лабораторных условиях, и к металлу добавляются различные промоторы или используются смеси металлов для улучшения активности, селективности и стабильности катализатора. Использование никеля широко распространено, несмотря на его низкую активность, из-за его низкой стоимости по сравнению с драгоценными металлами.
Газожидкостные индукционные реакторы (гидрогенаторы) также используются для проведения каталитического гидрирования. [38]
{{cite journal}}: CS1 maint: multiple names: authors list (link); Коллективный том , том. 5, с. 743{{cite web}}: CS1 maint: archived copy as title (link)