Парентеральное питание ( ПН ) — введение человеку пищевых продуктов внутривенно , [1] минуя обычный процесс приема пищи и пищеварения. Продукты производятся фармацевтическими предприятиями, производящими рецептуры , или стандартными фармацевтическими компаниями. [2] [3] Человек получает питательную смесь по формуле, включающей глюкозу , соли , аминокислоты , липиды , а также витамины и пищевые минералы . [4] Это называется полным парентеральным питанием ( ППН ) или полной добавкой питательных веществ ( ТНА ), когда значительное количество питательных веществ не получается другими способами, и частичным парентеральным питанием ( ППН ), когда питание также частично энтеральное . Это называется периферическим парентеральным питанием ( ППН ), когда оно вводится через венозный доступ на конечности , а не через центральную вену , как центральное венозное питание ( ЦВН ). [5]
Полное парентеральное питание (ППП) проводят в тех случаях, когда желудочно-кишечный тракт нефункционален из-за нарушения его непрерывности (он блокирован или имеет утечку – свищ ) или из-за нарушения его всасывающей способности. [6] Его использовали у пациентов, находящихся в коме , хотя энтеральное питание обычно предпочтительнее и менее подвержено осложнениям. Парентеральное питание используется для предотвращения недостаточности питания у пациентов, которые не могут получить достаточное количество питательных веществ пероральным или энтеральным путем. [7] Общество медицины критических состояний (SCCM) и Американское общество парентерального и энтерального питания рекомендуют подождать до седьмого дня госпитализации. [8]
Заболевания, при которых потребуется использование TPN, включают: [8]
Полное парентеральное питание может быть единственным возможным вариантом питания пациентов, у которых не функционирует желудочно-кишечный тракт или имеются нарушения, требующие полного покоя кишечника, включая непроходимость кишечника , [9] синдром короткой кишки , [9] гастрошизис , [9] длительную диарею . независимо от причины, [9] очень тяжелая болезнь Крона [9] или язвенный колит , [9] и некоторые заболевания желудочно-кишечного тракта у детей, включая врожденные аномалии желудочно-кишечного тракта и некротизирующий энтероколит . [10]
У пожилых людей существуют физические, физиологические или психические различия , которые потенциально могут привести к плохому потреблению питательных веществ, что потребует от них диетотерапии. [11] Пожилые пациенты более склонны к отсроченному восстановлению мышц по сравнению с более молодым населением. Кроме того, у пожилых пациентов наблюдается более выраженная сердечная и почечная недостаточность, резистентность к инсулину, а также дефицит витаминов и жизненно важных элементов. Пациенты, которые нуждаются в диетотерапии, но имеют противопоказания или не переносят энтеральное питание, являются подходящими кандидатами на парентеральное питание. У пожилых людей он показан, если пероральное или энтеральное питание невозможно в течение 3 дней или когда пероральное или энтеральное питание, вероятно, окажется недостаточным в течение более 7–10 дней. Хотя осложнений парентерального питания, характерных для гериатрической популяции, не существует, осложнения более распространены в этой популяции из-за увеличения сопутствующих заболеваний . [12]
Пациенты, у которых диагностирован рак, независимо от того, проходят ли они лечение амбулаторно или госпитализированы, подвергаются большему риску недостаточности питания и кахексии . Недоедание, связанное с раком, можно объяснить уменьшением потребления пищи, увеличением потребности в энергии и изменением обмена веществ. [13] Пациентов следует оценивать на ранних этапах лечения рака на предмет любого риска, связанного с питанием, например, путем обычного измерения веса и ИМТ. Парентеральное питание показано онкологическим больным, когда доступ к пищеварительному тракту невозможен или этот тракт неэффективен. У больных раком на поздних стадиях использование ПП следует обсуждать в контексте рисков и преимуществ, например, если приблизительная выживаемость превышает 3 месяца и можно ли ожидать, что ПП значительно улучшит качество жизни пациентов. [13]
Неизвестно, улучшает ли домашнее парентеральное питание выживаемость или качество жизни людей со злокачественной кишечной непроходимостью . [14]
Кратковременное ПП можно использовать, если у человека нарушена пищеварительная система (например, из-за перитонита ), и у него достаточно низкий вес, чтобы вызывать опасения по поводу питания во время длительного пребывания в больнице. Долгосрочное ПП иногда используется для лечения людей, страдающих от тяжелых последствий несчастного случая, хирургического вмешательства или расстройства пищеварения. ПН продлила жизнь детям, рожденным с отсутствующими или сильно деформированными органами.
Приблизительно 40 000 человек используют TPN дома в Соединенных Штатах, и поскольку для введения TPN требуется 10–16 часов, это может повлиять на повседневную жизнь. [15] Хотя повседневный образ жизни можно изменить, большинство пациентов согласны с тем, что эти изменения лучше, чем пребывание в больнице. [16] Существует множество различных типов помп, позволяющих ограничить время, в течение которого пациент «подключен». Обычно используется ранцевый насос, обеспечивающий мобильность. Время, необходимое для подключения к капельнице, зависит от ситуации каждого пациента; некоторым требуется один раз в день или пять дней в неделю. [15]
Пациентам важно избегать как можно большего количества изменений в своем образе жизни, связанных с ППП. Это обеспечивает наилучшую ситуацию с психическим здоровьем; Постоянное угнетение может привести к обиде и депрессии . Физическая активность также настоятельно рекомендуется, но пациентам следует избегать контактных видов спорта (повреждение оборудования) и плавания (инфекция). Многим подросткам трудно жить с ППП из-за проблем с образом тела и невозможности участвовать в мероприятиях и мероприятиях. [15]
TPN полностью обходит желудочно-кишечный тракт и обычные методы всасывания питательных веществ. Возможные осложнения, которые могут быть значительными, перечислены ниже. Помимо перечисленных ниже, частые осложнения ППП включают гипофосфатемию, гипокалиемию, гипергликемию, гиперкапнию, снижение уровня меди и цинка, повышение протромбинового времени (если оно связано с повреждением печени), гиперхлоремический метаболический ацидоз и снижение моторики желудочно-кишечного тракта. [8]
Для прохождения раствора требуется хронический внутривенный доступ, а наиболее частым осложнением является инфицирование этого катетера. Инфекция является частой причиной смерти этих пациентов, уровень смертности составляет примерно 15% на одну инфекцию, а смерть обычно наступает в результате септического шока . [17] При использовании центрального венозного доступа предпочтение отдается подключичной (или подмышечной) вене из-за легкости доступа и наименьших инфекционных осложнений по сравнению с введением яремной и бедренной вен. [6]
Осложнения катетера включают пневмоторакс , случайную пункцию артерии и сепсис, связанный с катетером. Частота осложнений на момент установки должна быть менее 5%. Инфекции, связанные с катетером, можно свести к минимуму за счет надлежащего выбора катетера и техники его введения. [18]
При хроническом внутривенном доступе в сосудистой системе остается инородное тело, и тромбы на этой внутривенной линии являются обычным явлением. [19] Смерть может наступить в результате тромбоэмболии легочной артерии , при которой тромб, начинающийся на линии внутривенного вливания, отрывается и попадает в легкие, блокируя кровоток. [20]
Пациенты, находящиеся на парентеральном питании, у которых такие сгустки закупоривают катетер, могут получить тромболитическую промывку для растворения сгустков и предотвращения дальнейших осложнений.
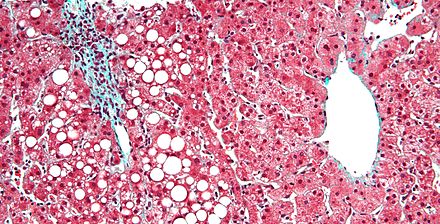
Ожирение печени обычно является более долгосрочным осложнением ППП, хотя при достаточно длительном курсе оно встречается довольно часто. Патогенез обусловлен использованием линолевой кислоты ( компонента жирных кислот омега-6 соевого масла) в качестве основного источника калорий. [21] [22] Заболевания печени, связанные с ППП, поражают до 50% пациентов в течение 5–7 лет, что коррелирует с уровнем смертности 2–50%. Начало этого заболевания печени является основным осложнением, которое приводит пациентов с ППП к необходимости трансплантации кишечника . [23]
Интралипид ( Fresenius-Kabi ), стандартная липидная эмульсия США для полного питания, содержит соотношение n-6/n-3 полиненасыщенных жирных кислот (ПНЖК) 7:1. Напротив, Omegaven имеет соотношение 1:8 и показал многообещающие результаты в многочисленных клинических исследованиях. Таким образом, жиры, богатые n-3, могут изменить течение заболеваний печени, связанных с парентеральным питанием (PNALD). [24]
Поскольку пациентов кормят внутривенно, субъект физически не ест, что приводит к сильным приступам голода (болям). Мозг использует сигналы изо рта ( вкус и запах ) , желудка и желудочно-кишечного тракта (сытость) и крови ( уровень питательных веществ ), чтобы определить сознательное чувство голода . [25] В случаях ППП требования к вкусу, запаху и физической сытости не удовлетворяются, и поэтому пациент испытывает голод, хотя организм получает полноценное питание.
Пациенты, которые принимают пищу, несмотря на неспособность, могут испытывать широкий спектр осложнений, таких как синдром возобновления питания . [26]
Тотальное парентеральное питание повышает риск развития острого холецистита [27] из-за полного выхода из строя желудочно-кишечного тракта, что может привести к застою желчи в желчном пузыре . Другие потенциальные гепатобилиарные дисфункции включают стеатоз , [28] стеатогепатит , холестаз и желчнокаменную болезнь . [29] У шести процентов пациентов, находящихся на ПП более трех недель, и у 100% пациентов, находящихся на ПП более 13 недель, развивается билиарный сладж . Образование сладжа является результатом стаза из-за отсутствия стимуляции кишечника, а не изменениями состава желчи. Осадок в желчном пузыре исчезает через четыре недели нормального перорального питания. Было показано, что введение экзогенного холецистокинина (CCK) или стимуляция эндогенного CCK периодическими импульсами больших количеств аминокислот помогает предотвратить образование осадка. Эти методы лечения обычно не рекомендуются. [30] Предполагается, что такие осложнения являются основной причиной смертности у людей, нуждающихся в длительном полном парентеральном питании, например, при синдроме короткой кишки . [31] У новорожденных с синдромом короткой кишки с длиной кишечника менее 10% от ожидаемой и, следовательно, зависящими от полного парентерального питания, пятилетняя выживаемость составляет примерно 20%. [32]
Младенцы, которых поддерживают на ПП без приема пищи в течение длительного времени, подвергаются риску развития атрофии кишечника. [33]
Гиперчувствительность — редко описываемое, но существенное осложнение терапии парентеральным питанием. Впервые сообщалось в 1965 году [34] , что частота возникновения этих реакций составляет примерно один из 1,5 миллионов пациентов, получающих парентеральное питание. [35] Существует широкий диапазон того, как и когда проявляются эти реакции. Кожные проявления являются наиболее частыми проявлениями. Считается, что гиперчувствительность возникает к отдельным компонентам парентерального питания, причем наиболее часто встречающимся компонентом является внутривенная липидная эмульсия , за которой следуют раствор поливитаминов и раствор аминокислот . [35]
Лекарства
Пациентам, получающим внутривенное парентеральное питание, возможно, также потребуется внутривенное введение лекарств с использованием того же Y-участка . Важно оценить совместимость препаратов с компонентами питания. Несовместимость можно наблюдать физически через изменение цвета, разделение фаз или осаждение. [36]
Метаболические осложнения включают синдром возобновления питания, характеризующийся гипокалиемией , гипофосфатемией и гипомагниемией . Гипергликемия часто встречается в начале терапии, но ее можно лечить добавлением инсулина к раствору парентерального питания. Гипогликемия может возникнуть при резком прекращении парентерального питания. Нарушение функции печени может ограничиваться обратимой холестатической желтухой и жировой инфильтрацией (проявляется повышением трансаминаз). Тяжелая печеночная дисфункция является редким осложнением. [37] В целом, пациенты, получающие парентеральное питание, имеют более высокий уровень инфекционных осложнений. Это может быть связано с гипергликемией. [38]
Беременность может стать причиной серьезных осложнений при попытке правильно дозировать питательную смесь. Поскольку все питание ребенка поступает из кровотока матери, врач должен правильно рассчитать дозировку питательных веществ, чтобы удовлетворить потребности обоих реципиентов и обеспечить их в пригодной для использования форме. Неправильная дозировка может привести ко многим неблагоприятным, трудно угадываемым последствиям, таким как смерть , а также различные степени деформации или другие проблемы развития . [39]
Рекомендуется начинать парентеральное питание после периода естественного питания, чтобы врачи могли правильно рассчитать потребности плода в питании . В противном случае его должна проводить только команда высококвалифицированных врачей, которые могут точно оценить потребности плода. [39]

Решения для полного парентерального питания могут быть адаптированы к индивидуальным потребностям пациента или могут использоваться стандартизированные решения. Использование стандартизированных растворов для парентерального питания экономически эффективно и может обеспечить лучший контроль электролитов сыворотки. [40] В идеале каждый пациент оценивается индивидуально перед началом парентерального питания, а группа, состоящая из врачей-специалистов, медсестер, клинических фармацевтов и дипломированных диетологов , оценивает индивидуальные данные пациента и решает, какую формулу ПП использовать и с какой скоростью инфузии.
Только для получения энергии обычно используются внутривенные растворы сахара с декстрозой или глюкозой . Это не считается парентеральным питанием, поскольку само по себе оно не предотвращает недостаточность питания. Стандартизированные решения также могут различаться у разных разработчиков. Ниже приведены некоторые примеры того, какие композиции они могут иметь. Раствор нормальным пациентам можно вводить как центрально, так и периферически.
Приготовленные растворы обычно состоят из воды и электролитов; глюкоза , аминокислоты и липиды; необходимые витамины , минералы и микроэлементы добавляются или вводятся отдельно. Раньше липидные эмульсии давались отдельно, но становится все более распространенным введение раствора глюкозы, белков и липидов «три в одном». [41] [42]
Отдельные питательные компоненты могут быть добавлены для более точного регулирования их содержания в организме. Это отдельное питательное вещество можно, если возможно, вводить индивидуально или его можно вводить в пакет с питательным раствором или внутривенными жидкостями ( раствором для увеличения объема ), который вводится пациенту.
Введение отдельных компонентов может быть более опасным, чем введение предварительно смешанных растворов, таких как растворы, используемые при полном парентеральном питании, поскольку последние, как правило, уже сбалансированы, например, в отношении осмолярности и способности к периферическому вливанию. Неправильное внутривенное введение концентрированного калия может привести к летальному исходу, но это не представляет опасности, если калий смешан с раствором TPN и разбавлен. [43]
Витамины можно добавлять в заранее приготовленную питательную смесь непосредственно перед введением, поскольку дополнительные витамины могут способствовать порче хранящегося продукта. [ нужна цитация ] Витамины можно добавлять в двух дозах: одна жирорастворимая, другая водорастворимая.Существуют также однодозовые препараты, содержащие как жиро-, так и водорастворимые витамины, такие как Церневит . [44] [45]
Минеральные вещества и микроэлементы для парентерального питания выпускаются в готовых смесях, например Аддавен . [46]
Однако эти дополнительные компоненты парентерального питания подвергались проверке стабильности, поскольку они сильно влияют на стабильность липидных эмульсий, которые служат основой для этих составов. Исследования показали различия в физической и химической стабильности этих растворов для парентерального питания, [47, 48, 49] , что сильно влияет на фармацевтическое производство этих добавок.
Лишь ограниченное число эмульгаторов обычно считается безопасным для парентерального введения, наиболее важным из которых является лецитин . [ нужна медицинская ссылка ] Лецитин может подвергаться биоразложению и метаболизму, поскольку он является неотъемлемой частью биологических мембран, что делает его практически нетоксичным. Другие эмульгаторы могут выводиться только через почки, создавая токсическую нагрузку . Эмульгатором выбора для большинства жировых эмульсий, используемых для парентерального питания, является высокоочищенный яичный лецитин [50] из-за его низкой токсичности и полной интеграции с клеточными мембранами.
Использование эмульгаторов, полученных из яиц, не рекомендуется людям с аллергией на яйца из-за риска реакции. В ситуациях, когда нет подходящего эмульгатора для человека, подверженного риску развития дефицита незаменимых жирных кислот, кулинарные масла можно наносить на большие участки доступной кожи для добавления путем чрескожной абсорбции. [51]
Другой тип жировой эмульсии Omegaven экспериментально используется в США, главным образом, у детей. Он изготовлен из рыбьего жира вместо более широко используемых формул на основе соевого масла. Исследования показали, что использование Omegaven может обратить вспять и предотвратить заболевания печени и холестаз. [52]
Разработан в 1960-х годах доктором Стэнли Дудриком , который, будучи хирургическим ординатором в Пенсильванском университете и работая в лаборатории фундаментальных наук доктора Джонатана Роудса, был первым, кто успешно вскармливал первоначально щенков бигля, а затем новорожденных детей с катастрофическими злокачественными новообразованиями желудочно-кишечного тракта. . [53] Доктор Дудрик сотрудничал с доктором Уиллмором и доктором Варсом, чтобы завершить работу, необходимую для того, чтобы сделать этот метод питания безопасным и успешным. [54]
В 2019 году в Великобритании возникла острая нехватка пакетов TPN из-за ограничений безопасности на единственной производственной площадке, которой управляет Calea. В Национальной службе здравоохранения ситуацию назвали чрезвычайной. [55]