

Метаболизм ( / mə ˈ t æ bə l ɪ zə m / , от греч . μεταβολή metabolē , «изменение») — это набор химических реакций, поддерживающих жизнь в организмах . Три основные функции метаболизма: преобразование энергии пищи в энергию , доступную для запуска клеточных процессов; преобразование пищи в строительные блоки белков , липидов , нуклеиновых кислот и некоторых углеводов ; и устранение метаболических отходов . Эти катализируемые ферментами реакции позволяют организмам расти и размножаться, поддерживать свои структуры и реагировать на окружающую среду. Слово метаболизм может также относиться к сумме всех химических реакций, которые происходят в живых организмах, включая пищеварение и транспортировку веществ в различные клетки и между ними, и в этом случае описанный выше набор реакций внутри клеток называется промежуточным (или промежуточным) метаболизмом.
Метаболические реакции можно разделить на катаболические — расщепление соединений (например, глюкозы до пирувата путем клеточного дыхания ); или анаболические — создание ( синтез ) соединений (таких как белки, углеводы, липиды и нуклеиновые кислоты). Обычно катаболизм высвобождает энергию, а анаболизм потребляет энергию.
Химические реакции метаболизма организованы в метаболические пути , в которых одно химическое вещество преобразуется через ряд шагов в другое химическое вещество, каждый шаг обеспечивается определенным ферментом . Ферменты имеют решающее значение для метаболизма, поскольку они позволяют организмам управлять желаемыми реакциями, требующими энергии и не происходящими сами по себе, связывая их со спонтанными реакциями , которые высвобождают энергию. Ферменты действуют как катализаторы — они позволяют реакции протекать быстрее — и они также позволяют регулировать скорость метаболической реакции, например, в ответ на изменения в среде клетки или на сигналы от других клеток.
Метаболическая система конкретного организма определяет, какие вещества он сочтет питательными , а какие — ядовитыми . Например, некоторые прокариоты используют сероводород в качестве питательного вещества, однако этот газ ядовит для животных. [1] Базовая скорость метаболизма организма — это мера количества энергии, потребляемой всеми этими химическими реакциями.
Поразительной особенностью метаболизма является сходство основных метаболических путей среди совершенно разных видов. [2] Например, набор карбоновых кислот , которые лучше всего известны как промежуточные продукты в цикле лимонной кислоты, присутствует во всех известных организмах, будучи обнаруженным у таких разнообразных видов, как одноклеточная бактерия Escherichia coli и огромные многоклеточные организмы, такие как слоны . [3] Эти сходства в метаболических путях, вероятно, обусловлены их ранним появлением в эволюционной истории , а их сохранение, вероятно, обусловлено их эффективностью . [4] [5] При различных заболеваниях, таких как диабет II типа , метаболический синдром и рак , нормальный метаболизм нарушается. [6] Метаболизм раковых клеток также отличается от метаболизма нормальных клеток, и эти различия можно использовать для поиска мишеней для терапевтического вмешательства при раке. [7]


Большинство структур, из которых состоят животные, растения и микробы, состоят из четырех основных классов молекул : аминокислот , углеводов , нуклеиновых кислот и липидов (часто называемых жирами ). Поскольку эти молекулы жизненно важны для жизни, метаболические реакции либо фокусируются на создании этих молекул во время построения клеток и тканей, либо на их расщеплении и использовании для получения энергии путем их переваривания. Эти биохимические вещества могут быть объединены для создания полимеров, таких как ДНК и белки , важных макромолекул жизни. [8]
Белки состоят из аминокислот, расположенных в линейной цепи, соединенных пептидными связями . Многие белки являются ферментами , катализирующими химические реакции в метаболизме. Другие белки имеют структурные или механические функции, например, те, которые формируют цитоскелет , систему каркаса , которая поддерживает форму клетки. [9] Белки также важны для передачи сигналов клетками , иммунных реакций , клеточной адгезии , активного транспорта через мембраны и клеточного цикла . [10] Аминокислоты также способствуют клеточному энергетическому метаболизму, предоставляя источник углерода для входа в цикл лимонной кислоты ( цикл трикарбоновых кислот ), [11] особенно, когда первичный источник энергии, такой как глюкоза , дефицитен, или когда клетки подвергаются метаболическому стрессу. [12]
Липиды являются наиболее разнообразной группой биохимических веществ. Их основное структурное использование заключается в том, что они являются частью внутренних и внешних биологических мембран , таких как клеточная мембрана . [10] Их химическая энергия также может быть использована. Липиды содержат длинную неполярную углеводородную цепь с небольшой полярной областью, содержащей кислород. Липиды обычно определяются как гидрофобные или амфипатические биологические молекулы, но растворяются в органических растворителях, таких как этанол , бензол или хлороформ . [13] Жиры представляют собой большую группу соединений, которые содержат жирные кислоты и глицерин ; молекула глицерина, присоединенная к трем жирным кислотам с помощью эфирных связей, называется триацилглицеридом . [14] Существует несколько вариаций базовой структуры, включая основные цепи, такие как сфингозин в сфингомиелине , и гидрофильные группы, такие как фосфат в фосфолипидах . Стероиды , такие как стерин, являются еще одним основным классом липидов. [15]
Углеводы — это альдегиды или кетоны , с множеством присоединенных гидроксильных групп, которые могут существовать в виде прямых цепей или колец. Углеводы — самые распространенные биологические молекулы, которые выполняют многочисленные функции, такие как хранение и транспортировка энергии ( крахмал , гликоген ) и структурные компоненты ( целлюлоза в растениях, хитин в животных). [10] Основные углеводные единицы называются моносахаридами и включают галактозу , фруктозу и, что наиболее важно, глюкозу . Моносахариды могут быть связаны друг с другом, образуя полисахариды практически безграничным количеством способов. [16]
Две нуклеиновые кислоты, ДНК и РНК , являются полимерами нуклеотидов . Каждый нуклеотид состоит из фосфата, присоединенного к группе сахара рибозы или дезоксирибозы , которая присоединена к азотистому основанию . Нуклеиновые кислоты имеют решающее значение для хранения и использования генетической информации, а также ее интерпретации посредством процессов транскрипции и биосинтеза белка . [10] Эта информация защищена механизмами репарации ДНК и распространяется посредством репликации ДНК . Многие вирусы имеют геном РНК , например ВИЧ , который использует обратную транскрипцию для создания шаблона ДНК из своего вирусного генома РНК. [17] РНК в рибозимах , таких как сплайсосомы и рибосомы, похожа на ферменты, поскольку она может катализировать химические реакции. Отдельные нуклеозиды производятся путем присоединения азотистого основания к сахару рибозы . Эти основания представляют собой гетероциклические кольца, содержащие азот, классифицируемые как пурины или пиримидины . Нуклеотиды также действуют как коферменты в реакциях переноса метаболических групп. [18]

Метаболизм включает в себя широкий спектр химических реакций, но большинство из них подпадают под несколько основных типов реакций, которые включают перенос функциональных групп атомов и их связей внутри молекул. [19] Эта общая химия позволяет клеткам использовать небольшой набор метаболических промежуточных продуктов для переноса химических групп между различными реакциями. [18] Эти промежуточные продукты переноса групп называются коферментами . Каждый класс реакций переноса групп осуществляется определенным коферментом, который является субстратом для набора ферментов, которые его производят, и набора ферментов, которые его потребляют. Таким образом, эти коферменты непрерывно производятся, потребляются и затем перерабатываются. [20]
Одним из центральных коферментов является аденозинтрифосфат (АТФ), энергетическая валюта клеток. Этот нуклеотид используется для передачи химической энергии между различными химическими реакциями. В клетках содержится лишь небольшое количество АТФ, но поскольку он постоянно регенерируется, человеческое тело может использовать около собственного веса АТФ в день. [20] АТФ действует как мост между катаболизмом и анаболизмом . Катаболизм разрушает молекулы, а анаболизм собирает их вместе. Катаболические реакции генерируют АТФ, а анаболические реакции потребляют его. Он также служит переносчиком фосфатных групп в реакциях фосфорилирования . [21]
Витамин — это органическое соединение, необходимое в небольших количествах, которое не может быть произведено в клетках. В питании человека большинство витаминов функционируют как коферменты после модификации; например, все водорастворимые витамины фосфорилируются или связываются с нуклеотидами, когда они используются в клетках. [22] Никотинамидадениндинуклеотид (НАД + ), производное витамина B 3 ( ниацина ), является важным коферментом, который действует как акцептор водорода. Сотни отдельных типов дегидрогеназ удаляют электроны из своих субстратов и восстанавливают НАД + в НАДН. Эта восстановленная форма кофермента затем является субстратом для любой из редуктаз в клетке, которым необходимо переносить атомы водорода на свои субстраты. [23] Никотинамидадениндинуклеотид существует в клетке в двух родственных формах: НАДН и НАДФН. Форма НАД + /НАДН более важна в катаболических реакциях, в то время как НАДФ + /НАДФН используется в анаболических реакциях. [24]

Неорганические элементы играют важную роль в метаболизме; некоторые из них широко распространены (например, натрий и калий ), в то время как другие функционируют в ничтожно малых концентрациях. Около 99% веса тела человека состоит из элементов углерода , азота , кальция , натрия , хлора, калия , водорода , фосфора , кислорода и серы . Органические соединения (белки, липиды и углеводы) содержат большую часть углерода и азота; большая часть кислорода и водорода присутствует в виде воды. [ 25 ]
Обильные неорганические элементы действуют как электролиты . Наиболее важными ионами являются натрий , калий , кальций , магний , хлорид , фосфат и органический ион бикарбонат . Поддержание точных ионных градиентов через клеточные мембраны поддерживает осмотическое давление и pH . [26] Ионы также имеют решающее значение для нервной и мышечной функции, поскольку потенциалы действия в этих тканях производятся путем обмена электролитами между внеклеточной жидкостью и клеточной жидкостью, цитозолем . [27] Электролиты входят в клетки и выходят из них через белки в клеточной мембране, называемые ионными каналами . Например, сокращение мышц зависит от движения кальция, натрия и калия через ионные каналы в клеточной мембране и Т-трубочках . [28]
Переходные металлы обычно присутствуют в организмах в качестве следовых элементов , причем цинк и железо являются наиболее распространенными из них. [29] Металлические кофакторы тесно связаны с определенными участками в белках; хотя ферментные кофакторы могут быть изменены во время катализа, они всегда возвращаются в свое исходное состояние к концу катализируемой реакции. Металлические микроэлементы попадают в организмы с помощью определенных транспортеров и связываются с запасными белками, такими как ферритин или металлотионеин, когда не используются. [30] [31]
Катаболизм — это набор метаболических процессов, которые расщепляют большие молекулы. Они включают в себя расщепление и окисление молекул пищи. Целью катаболических реакций является обеспечение энергией и компонентами, необходимыми для анаболических реакций, которые строят молекулы. [32] Точная природа этих катаболических реакций различается от организма к организму, и организмы можно классифицировать на основе их источников энергии, водорода и углерода (их основных питательных групп ), как показано в таблице ниже. Органические молекулы используются в качестве источника атомов водорода или электронов органотрофами , в то время как литотрофы используют неорганические субстраты. В то время как фототрофы преобразуют солнечный свет в химическую энергию , [33] хемотрофы зависят от окислительно-восстановительных реакций, которые включают перенос электронов от восстановленных донорных молекул, таких как органические молекулы , водород , сероводород или ионы железа , к кислороду , нитрату или сульфату . У животных эти реакции включают сложные органические молекулы , которые расщепляются до более простых молекул, таких как углекислый газ и вода. Фотосинтетические организмы, такие как растения и цианобактерии , используют схожие реакции переноса электронов для хранения энергии, поглощенной из солнечного света. [34]
Наиболее распространенный набор катаболических реакций у животных можно разделить на три основных этапа. На первом этапе крупные органические молекулы, такие как белки , полисахариды или липиды , расщепляются на более мелкие компоненты вне клеток. Затем эти более мелкие молекулы поглощаются клетками и преобразуются в более мелкие молекулы, обычно ацетилкофермент А (ацетил-КоА), который высвобождает некоторое количество энергии. Наконец, ацетильная группа на ацетил-КоА окисляется до воды и углекислого газа в цикле лимонной кислоты и цепи переноса электронов , высвобождая больше энергии при одновременном восстановлении кофермента никотинамидадениндинуклеотида (НАД + ) в НАДН. [32]
Макромолекулы не могут быть напрямую обработаны клетками. Макромолекулы должны быть разбиты на более мелкие единицы, прежде чем они могут быть использованы в клеточном метаболизме. Для переваривания этих полимеров используются различные классы ферментов. Эти пищеварительные ферменты включают протеазы , которые переваривают белки до аминокислот, а также гликозидгидролазы , которые переваривают полисахариды до простых сахаров, известных как моносахариды . [36]
Микробы просто выделяют пищеварительные ферменты в окружающую среду, [37] [38] в то время как животные выделяют эти ферменты только из специализированных клеток в своих кишечниках , включая желудок и поджелудочную железу , а также в слюнных железах . [39] Аминокислоты или сахара, высвобождаемые этими внеклеточными ферментами, затем закачиваются в клетки активными транспортными белками. [40] [41]

Катаболизм углеводов — это расщепление углеводов на более мелкие единицы. Углеводы обычно попадают в клетки после того, как они были переварены в моносахариды, такие как глюкоза и фруктоза . [42] После попадания внутрь основным путем расщепления является гликолиз , при котором глюкоза превращается в пируват . Этот процесс генерирует молекулу, передающую энергию , НАДН из НАД + , и генерирует АТФ из АДФ для использования в качестве источника энергии для многих процессов внутри клетки. [43] Пируват является промежуточным продуктом в нескольких метаболических путях, но большая его часть преобразуется в ацетил-КоА и поступает в цикл лимонной кислоты , что обеспечивает большее производство АТФ посредством окислительного фосфорилирования . Это окисление потребляет молекулярный кислород и выделяет воду и отходы — углекислый газ. При недостатке кислорода или когда пируват временно вырабатывается быстрее, чем он может быть потреблен циклом лимонной кислоты (как при интенсивной мышечной нагрузке), пируват преобразуется в лактат ферментом лактатдегидрогеназой , процесс, который также окисляет НАДН обратно в НАД + для повторного использования в дальнейшем гликолизе, позволяя продолжать производство энергии. [44] Лактат позже преобразуется обратно в пируват для производства АТФ, где необходима энергия, или обратно в глюкозу в цикле Кори . Альтернативным путем расщепления глюкозы является пентозофосфатный путь , который производит меньше энергии, но поддерживает анаболизм (синтез биомолекул). Этот путь восстанавливает кофермент НАДФ + до НАДФН и производит пентозные соединения, такие как рибозо-5-фосфат для синтеза многих биомолекул, таких как нуклеотиды и ароматические аминокислоты . [45]

Жиры катаболизируются путем гидролиза до свободных жирных кислот и глицерина. Глицерин вступает в гликолиз, а жирные кислоты расщепляются путем бета-окисления с высвобождением ацетил-КоА, который затем поступает в цикл лимонной кислоты. Жирные кислоты высвобождают больше энергии при окислении, чем углеводы. Стероиды также расщепляются некоторыми бактериями в процессе, похожем на бета-окисление, и этот процесс распада включает в себя высвобождение значительных количеств ацетил-КоА, пропионил-КоА и пирувата, которые все могут использоваться клеткой для получения энергии. M. tuberculosis также может расти на липидном холестерине как единственном источнике углерода, и гены, участвующие в пути(ах) использования холестерина, были подтверждены как важные на различных стадиях жизненного цикла инфекции M. tuberculosis . [46]
Аминокислоты либо используются для синтеза белков и других биомолекул, либо окисляются до мочевины и углекислого газа для получения энергии. [47] Путь окисления начинается с удаления аминогруппы трансаминазой . Аминогруппа поступает в цикл мочевины , оставляя дезаминированный углеродный скелет в форме кетокислоты . Некоторые из этих кетокислот являются промежуточными продуктами в цикле лимонной кислоты, например, α- кетоглутарат, образующийся при дезаминировании глутамата . [48] Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза . [49]
При окислительном фосфорилировании электроны, удаленные из органических молекул в таких областях, как цикл лимонной кислоты, переносятся на кислород, а высвобождаемая энергия используется для производства АТФ. Это делается у эукариот серией белков в мембранах митохондрий, называемых цепью переноса электронов . У прокариот эти белки находятся во внутренней мембране клетки . [50] Эти белки используют энергию восстановленных молекул, таких как НАДН, для перекачки протонов через мембрану. [51]

Выкачка протонов из митохондрий создает разницу в концентрации протонов по всей мембране и генерирует электрохимический градиент . [52] Эта сила возвращает протоны обратно в митохондрию через основание фермента, называемого АТФ-синтазой . Поток протонов заставляет субъединицу стебля вращаться, заставляя активный участок домена синтазы изменять форму и фосфорилировать аденозиндифосфат — превращая его в АТФ. [20]
Хемолитотрофия — это тип метаболизма, обнаруженный у прокариот , где энергия получается путем окисления неорганических соединений . Эти организмы могут использовать водород , [53] восстановленные соединения серы (такие как сульфид , сероводород и тиосульфат ), [1] двухвалентное железо (Fe(II)) [54] или аммиак [55] в качестве источников восстановительной энергии, и они получают энергию от окисления этих соединений. [56] Эти микробные процессы важны в глобальных биогеохимических циклах, таких как ацетогенез , нитрификация и денитрификация , и имеют решающее значение для плодородия почвы . [57] [58]
Энергия солнечного света улавливается растениями , цианобактериями , пурпурными бактериями , зелеными серными бактериями и некоторыми простейшими . Этот процесс часто связан с преобразованием углекислого газа в органические соединения в рамках фотосинтеза, который обсуждается ниже. Однако системы улавливания энергии и фиксации углерода могут работать отдельно у прокариот, поскольку пурпурные бактерии и зеленые серные бактерии могут использовать солнечный свет в качестве источника энергии, переключаясь между фиксацией углерода и ферментацией органических соединений. [59] [60]
Во многих организмах захват солнечной энергии в принципе аналогичен окислительному фосфорилированию, поскольку он включает в себя хранение энергии в виде градиента концентрации протонов. Эта движущая сила протонов затем управляет синтезом АТФ. [61] Электроны, необходимые для управления этой цепью переноса электронов, поступают из собирающих свет белков, называемых фотосинтетическими реакционными центрами . Реакционные центры подразделяются на два типа в зависимости от природы присутствующего фотосинтетического пигмента , причем большинство фотосинтетических бактерий имеют только один тип, в то время как растения и цианобактерии имеют два. [62]
В растениях, водорослях и цианобактериях фотосистема II использует энергию света для удаления электронов из воды, выделяя кислород в качестве отходов. Затем электроны поступают в комплекс цитохрома b6f , который использует их энергию для перекачки протонов через тилакоидную мембрану в хлоропласте . [34] Эти протоны возвращаются через мембрану, поскольку они приводят в действие АТФ-синтазу, как и прежде. Затем электроны проходят через фотосистему I и могут быть использованы для восстановления кофермента НАДФ + . [63] Этот кофермент может войти в цикл Кальвина или быть повторно использован для дальнейшего образования АТФ. [ требуется цитата ]
Анаболизм — это набор конструктивных метаболических процессов, в которых энергия, высвобождаемая катаболизмом, используется для синтеза сложных молекул. В общем, сложные молекулы, составляющие клеточные структуры, строятся шаг за шагом из более мелких и простых предшественников. Анаболизм включает три основных этапа. Во-первых, производство предшественников, таких как аминокислоты , моносахариды , изопреноиды и нуклеотиды , во-вторых, их активация в реактивные формы с использованием энергии АТФ, и, в-третьих, сборка этих предшественников в сложные молекулы, такие как белки , полисахариды , липиды и нуклеиновые кислоты . [64]
Анаболизм в организмах может быть разным в зависимости от источника построенных молекул в их клетках. Автотрофы, такие как растения, могут строить сложные органические молекулы в своих клетках, такие как полисахариды и белки, из простых молекул, таких как углекислый газ и вода. Гетеротрофам , с другой стороны, требуется источник более сложных веществ, таких как моносахариды и аминокислоты, для производства этих сложных молекул. Организмы можно дополнительно классифицировать по конечному источнику их энергии: фотоавтотрофы и фотогетеротрофы получают энергию из света, тогда как хемоавтотрофы и хемогетеротрофы получают энергию из реакций окисления. [64]

Фотосинтез — это синтез углеводов из солнечного света и углекислого газа (CO 2 ). У растений, цианобактерий и водорослей оксигенный фотосинтез расщепляет воду, при этом кислород вырабатывается в качестве побочного продукта. Этот процесс использует АТФ и НАДФН, вырабатываемые фотосинтетическими реакционными центрами , как описано выше, для преобразования CO 2 в глицерат-3-фосфат , который затем может быть преобразован в глюкозу. Эта реакция фиксации углерода осуществляется ферментом RuBisCO как часть цикла Кальвина-Бенсона . [65] У растений происходит три типа фотосинтеза: фиксация углерода C3 , фиксация углерода C4 и фотосинтез CAM . Они различаются по пути, по которому углекислый газ попадает в цикл Кальвина, при этом растения C3 напрямую фиксируют CO 2 , в то время как фотосинтез C4 и CAM сначала включает CO 2 в другие соединения, как адаптация к интенсивному солнечному свету и сухим условиям. [66]
У фотосинтетических прокариот механизмы фиксации углерода более разнообразны. Здесь углекислый газ может быть зафиксирован циклом Кальвина-Бенсона, обратным циклом лимонной кислоты [67] или карбоксилированием ацетил-КоА. [68] [69] Прокариотические хемоавтотрофы также фиксируют CO2 через цикл Кальвина-Бенсона, но используют энергию неорганических соединений для проведения реакции. [70]
В углеводном анаболизме простые органические кислоты могут быть преобразованы в моносахариды , такие как глюкоза , а затем использованы для сборки полисахаридов, таких как крахмал . Образование глюкозы из таких соединений, как пируват , лактат , глицерин , глицерат-3-фосфат и аминокислоты, называется глюконеогенезом . Глюконеогенез преобразует пируват в глюкозо-6-фосфат через ряд промежуточных продуктов, многие из которых являются общими с гликолизом . [43] Однако этот путь - это не просто гликолиз, запущенный в обратном направлении, поскольку несколько этапов катализируются негликолитическими ферментами. Это важно, поскольку позволяет регулировать образование и расщепление глюкозы по отдельности и предотвращает одновременную работу обоих путей в бесполезном цикле . [71] [72]
Хотя жир является распространенным способом хранения энергии, у позвоночных , таких как люди, жирные кислоты в этих хранилищах не могут быть преобразованы в глюкозу посредством глюконеогенеза , поскольку эти организмы не могут преобразовывать ацетил-КоА в пируват ; растения могут, но у животных нет необходимого ферментативного аппарата. [73] В результате после длительного голодания позвоночным необходимо производить кетоновые тела из жирных кислот, чтобы заменить глюкозу в тканях, таких как мозг, которые не могут метаболизировать жирные кислоты. [74] У других организмов, таких как растения и бактерии, эта метаболическая проблема решается с помощью глиоксилатного цикла , который обходит стадию декарбоксилирования в цикле лимонной кислоты и позволяет преобразовывать ацетил-КоА в оксалоацетат , где он может быть использован для производства глюкозы. [73] [75] Помимо жира, глюкоза хранится в большинстве тканей как энергетический ресурс, доступный внутри ткани посредством гликогенеза, который обычно использовался для поддержания уровня глюкозы в крови. [76]
Полисахариды и гликаны производятся путем последовательного добавления моносахаридов гликозилтрансферазой из реактивного донора сахарофосфата, такого как уридиндифосфатглюкоза (UDP-Glc), к акцепторной гидроксильной группе на растущем полисахариде. Поскольку любая из гидроксильных групп на кольце субстрата может быть акцептором, полученные полисахариды могут иметь прямые или разветвленные структуры. [77] Полученные полисахариды могут иметь структурные или метаболические функции сами по себе или переноситься на липиды и белки ферментами олигосахарилтрансферазами . [78] [79]

Жирные кислоты производятся синтазами жирных кислот , которые полимеризуют и затем восстанавливают единицы ацетил-КоА. Ацильные цепи в жирных кислотах удлиняются циклом реакций, которые добавляют ацильную группу, восстанавливают ее до спирта, дегидратируют ее до алкеновой группы, а затем снова восстанавливают ее до алкановой группы. Ферменты биосинтеза жирных кислот делятся на две группы: у животных и грибов все эти реакции синтазы жирных кислот осуществляются одним многофункциональным белком типа I, [80] тогда как в растительных пластидах и бактериях отдельные ферменты типа II выполняют каждый шаг в пути. [81] [82]
Терпены и изопреноиды представляют собой большой класс липидов, которые включают каротиноиды и образуют самый большой класс растительных природных продуктов . [83] Эти соединения производятся путем сборки и модификации изопреновых единиц, полученных из реакционноспособных предшественников изопентенилпирофосфата и диметилаллилпирофосфата . [84] Эти предшественники могут быть получены разными способами. У животных и архей мевалонатный путь производит эти соединения из ацетил-КоА, [85] тогда как у растений и бактерий немевалонатный путь использует пируват и глицеральдегид-3-фосфат в качестве субстратов. [84] [86] Одной из важных реакций, в которой используются эти активированные доноры изопрена, является биосинтез стеринов . Здесь изопреновые единицы соединяются, образуя сквален , а затем складываются и формируются в набор колец, образуя ланостерол . [87] Ланостерол затем может быть преобразован в другие стеролы, такие как холестерин и эргостерол . [87] [88]
Организмы различаются по своей способности синтезировать 20 распространенных аминокислот. Большинство бактерий и растений могут синтезировать все двадцать, но млекопитающие могут синтезировать только одиннадцать заменимых аминокислот, поэтому девять незаменимых аминокислот должны быть получены из пищи. [10] Некоторые простые паразиты , такие как бактерии Mycoplasma pneumoniae , не синтезируют все аминокислоты и берут свои аминокислоты непосредственно от своих хозяев. [89] Все аминокислоты синтезируются из промежуточных продуктов в гликолизе, цикле лимонной кислоты или пентозофосфатном пути. Азот обеспечивается глутаматом и глутамином . Синтез заменимых аминокислот зависит от образования соответствующей альфа-кетокислоты, которая затем трансаминируется с образованием аминокислоты. [90]
Аминокислоты превращаются в белки, соединяясь в цепочку пептидных связей . Каждый отдельный белок имеет уникальную последовательность аминокислотных остатков: это его первичная структура . Так же, как буквы алфавита могут быть объединены, чтобы сформировать почти бесконечное множество слов, аминокислоты могут быть связаны в различных последовательностях, чтобы сформировать огромное множество белков. Белки производятся из аминокислот, которые были активированы путем присоединения к молекуле транспортной РНК через эфирную связь. Этот предшественник аминоацил-тРНК производится в АТФ -зависимой реакции, осуществляемой аминоацил-тРНК-синтетазой . [91] Затем эта аминоацил-тРНК является субстратом для рибосомы , которая присоединяет аминокислоту к удлиняющейся белковой цепи, используя информацию о последовательности в матричной РНК . [92]
Нуклеотиды производятся из аминокислот, углекислого газа и муравьиной кислоты в путях, которые требуют большого количества метаболической энергии. [93] Следовательно, большинство организмов имеют эффективные системы для утилизации предварительно сформированных нуклеотидов. [93] [94] Пурины синтезируются как нуклеозиды (основания, присоединенные к рибозе ). [95] И аденин , и гуанин производятся из предшественника нуклеозида инозинмонофосфата , который синтезируется с использованием атомов из аминокислот глицина , глутамина и аспарагиновой кислоты , а также формиата, перенесенного из кофермента тетрагидрофолата . Пиримидины , с другой стороны, синтезируются из основания оротата , которое образуется из глутамина и аспартата. [96]
Все организмы постоянно подвергаются воздействию соединений, которые они не могут использовать в качестве пищи и которые были бы вредны, если бы они накапливались в клетках, поскольку у них нет метаболической функции. Эти потенциально опасные соединения называются ксенобиотиками . [97] Ксенобиотики, такие как синтетические препараты , природные яды и антибиотики, детоксифицируются набором ферментов, метаболизирующих ксенобиотики. У людей к ним относятся цитохром P450 оксидазы , [98] UDP-глюкуронозилтрансферазы , [99] и глутатион S -трансферазы . [100] Эта система ферментов действует в три этапа: сначала окисляет ксенобиотик (фаза I), а затем связывает водорастворимые группы с молекулой (фаза II). Затем модифицированный водорастворимый ксенобиотик может быть выкачан из клеток, а в многоклеточных организмах может дополнительно метаболизироваться перед выведением (фаза III). В экологии эти реакции особенно важны для микробной биодеградации загрязняющих веществ и биоремедиации загрязненных земель и разливов нефти. [101] Многие из этих микробных реакций свойственны многоклеточным организмам, но из-за невероятного разнообразия типов микробов эти организмы способны справляться с гораздо более широким спектром ксенобиотиков, чем многоклеточные организмы, и могут разлагать даже стойкие органические загрязнители, такие как хлорорганические соединения. [102]
Связанной проблемой для аэробных организмов является окислительный стресс . [103] Здесь процессы, включающие окислительное фосфорилирование и образование дисульфидных связей во время сворачивания белка, производят активные формы кислорода, такие как перекись водорода . [104] Эти повреждающие окислители удаляются антиоксидантными метаболитами, такими как глутатион , и ферментами, такими как каталазы и пероксидазы . [105] [106]
Живые организмы должны подчиняться законам термодинамики , которые описывают передачу тепла и работы . Второй закон термодинамики гласит, что в любой изолированной системе количество энтропии (беспорядка) не может уменьшаться. Хотя удивительная сложность живых организмов, по-видимому, противоречит этому закону, жизнь возможна, поскольку все организмы являются открытыми системами , которые обмениваются материей и энергией со своим окружением. Живые системы не находятся в равновесии , а вместо этого являются диссипативными системами , которые поддерживают свое состояние высокой сложности, вызывая большее увеличение энтропии своего окружения. [107] Метаболизм клетки достигает этого, связывая спонтанные процессы катаболизма с неспонтаннными процессами анаболизма. В термодинамических терминах метаболизм поддерживает порядок, создавая беспорядок. [108]
Поскольку среда большинства организмов постоянно меняется, реакции метаболизма должны тонко регулироваться для поддержания постоянного набора условий внутри клеток, состояния, называемого гомеостазом . [109] [110] Метаболическая регуляция также позволяет организмам реагировать на сигналы и активно взаимодействовать с окружающей средой. [111] Для понимания того, как контролируются метаболические пути, важны две тесно связанные концепции. Во-первых, регуляция фермента в пути заключается в том, как его активность увеличивается и уменьшается в ответ на сигналы. Во-вторых, контроль, осуществляемый этим ферментом, заключается в том, как эти изменения его активности влияют на общую скорость пути ( поток через путь). [112] Например, фермент может демонстрировать большие изменения активности (т. е. он сильно регулируется), но если эти изменения оказывают незначительное влияние на поток метаболического пути, то этот фермент не участвует в контроле пути. [113]
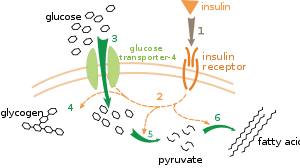
Существует несколько уровней метаболической регуляции. При внутренней регуляции метаболический путь саморегулируется в ответ на изменения уровней субстратов или продуктов; например, уменьшение количества продукта может увеличить поток через путь для компенсации. [112] Этот тип регуляции часто включает аллостерическую регуляцию активности нескольких ферментов в пути. [114] Внешний контроль включает клетку в многоклеточном организме, изменяющую свой метаболизм в ответ на сигналы от других клеток. Эти сигналы обычно имеют форму водорастворимых мессенджеров, таких как гормоны и факторы роста , и обнаруживаются специфическими рецепторами на поверхности клетки. [115] Затем эти сигналы передаются внутрь клетки системами вторичных мессенджеров , которые часто включают фосфорилирование белков. [116]
Очень хорошо понятным примером внешнего контроля является регуляция метаболизма глюкозы гормоном инсулином . [117] Инсулин вырабатывается в ответ на повышение уровня глюкозы в крови . Связывание гормона с рецепторами инсулина на клетках затем активирует каскад протеинкиназ , которые заставляют клетки поглощать глюкозу и преобразовывать ее в молекулы хранения, такие как жирные кислоты и гликоген . [118] Метаболизм гликогена контролируется активностью фосфорилазы , фермента, который расщепляет гликоген, и гликогенсинтазы , фермента, который его производит. Эти ферменты регулируются реципрокным образом, при этом фосфорилирование ингибирует гликогенсинтазу, но активирует фосфорилазу. Инсулин вызывает синтез гликогена, активируя протеинфосфатазы и вызывая снижение фосфорилирования этих ферментов. [119]

Центральные пути метаболизма, описанные выше, такие как гликолиз и цикл лимонной кислоты, присутствуют во всех трех доменах живых существ и присутствовали у последнего универсального общего предка . [3] [120] Эта универсальная предковая клетка была прокариотической и, вероятно, метаногеном, имевшим обширный метаболизм аминокислот, нуклеотидов, углеводов и липидов. [121] [122] Сохранение этих древних путей в ходе более поздней эволюции может быть результатом того, что эти реакции были оптимальным решением их конкретных метаболических проблем, при этом такие пути, как гликолиз и цикл лимонной кислоты, производили свои конечные продукты высокоэффективно и за минимальное количество этапов. [4] [5] Первые пути метаболизма на основе ферментов, возможно, были частями метаболизма пуриновых нуклеотидов, в то время как предыдущие метаболические пути были частью древнего мира РНК . [123]
Было предложено много моделей для описания механизмов, посредством которых развиваются новые метаболические пути. Они включают последовательное добавление новых ферментов к короткому предковому пути, дублирование и затем расхождение целых путей, а также набор уже существующих ферментов и их сборку в новый путь реакции. [124] Относительная важность этих механизмов неясна, но геномные исследования показали, что ферменты в пути, вероятно, имеют общее происхождение, что предполагает, что многие пути развивались поэтапно с новыми функциями, созданными из уже существующих шагов в пути. [125] Альтернативная модель исходит из исследований, которые прослеживают эволюцию структур белков в метаболических сетях, это предполагает, что ферменты повсеместно набираются, заимствуя ферменты для выполнения аналогичных функций в различных метаболических путях (очевидно в базе данных MANET ) [126] Эти процессы набора приводят к эволюционной ферментативной мозаике. [127] Третья возможность заключается в том, что некоторые части метаболизма могут существовать как «модули», которые могут повторно использоваться в различных путях и выполнять схожие функции на различных молекулах. [128]
Помимо эволюции новых метаболических путей, эволюция может также вызывать потерю метаболических функций. Например, у некоторых паразитов метаболические процессы, которые не являются необходимыми для выживания, теряются, и вместо этого готовые аминокислоты, нуклеотиды и углеводы могут быть извлечены из хозяина . [ 129] Аналогичное снижение метаболических возможностей наблюдается у эндосимбиотических организмов. [130]

Классически метаболизм изучается редукционистским подходом, который фокусируется на одном метаболическом пути. Особенно ценным является использование радиоактивных индикаторов на уровне всего организма, ткани и клетки, которые определяют пути от предшественников до конечных продуктов путем идентификации радиоактивно меченых промежуточных продуктов и продуктов. [131] Ферменты, которые катализируют эти химические реакции, затем могут быть очищены , а их кинетика и реакции на ингибиторы исследованы. Параллельный подход заключается в идентификации малых молекул в клетке или ткани; полный набор этих молекул называется метаболомом . В целом, эти исследования дают хорошее представление о структуре и функции простых метаболических путей, но неадекватны при применении к более сложным системам, таким как метаболизм всей клетки. [132]
Представление о сложности метаболических сетей в клетках, содержащих тысячи различных ферментов, дает рисунок справа, показывающий взаимодействия всего лишь между 43 белками и 40 метаболитами: последовательности геномов предоставляют списки, содержащие до 26 500 генов. [133] Однако теперь можно использовать эти геномные данные для реконструкции полных сетей биохимических реакций и создания более целостных математических моделей, которые могут объяснить и предсказать их поведение. [134] Эти модели особенно эффективны, когда используются для интеграции данных о путях и метаболитах, полученных с помощью классических методов, с данными об экспрессии генов из протеомных и ДНК-микрочиповых исследований. [135] Используя эти методы, теперь была создана модель человеческого метаболизма, которая будет направлять будущие открытия лекарств и биохимические исследования. [136] Эти модели теперь используются в сетевом анализе для классификации заболеваний человека по группам, которые разделяют общие белки или метаболиты. [137] [138]
Бактериальные метаболические сети являются ярким примером организации типа «галстук-бабочка» [139] [140] [141] , архитектуры, способной вводить широкий спектр питательных веществ и производить большое разнообразие продуктов и сложных макромолекул, используя относительно небольшое количество промежуточных общих валют. [142]
Основным технологическим применением этой информации является метаболическая инженерия . Здесь организмы, такие как дрожжи , растения или бактерии, генетически модифицируются, чтобы сделать их более полезными в биотехнологии и способствовать производству лекарств, таких как антибиотики , или промышленных химикатов, таких как 1,3-пропандиол и шикимовая кислота . [143] [144] [145] Эти генетические модификации обычно направлены на снижение количества энергии, используемой для производства продукта, увеличение урожайности и сокращение производства отходов. [146]
Термин метаболизм происходит от древнегреческого слова μεταβολή — «метабол» — «изменение», которое, в свою очередь, происходит от μεταβάλλειν — «метабаллейн», что означает «изменять» [147]
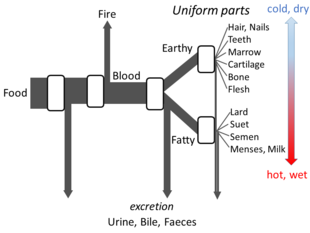
В работе Аристотеля «Части животных» изложено достаточно подробностей его взглядов на метаболизм , чтобы можно было построить модель открытого потока. Он считал, что на каждой стадии процесса материалы из пищи трансформируются, при этом выделяется тепло в виде классического элемента огня, а остаточные материалы выводятся в виде мочи, желчи или фекалий. [148]
Ибн ан-Нафис описал метаболизм в своем труде 1260 года нашей эры под названием « Аль-Рисала аль-Камилийя филь Сиера ан-Набавийя» («Трактат Камила о биографии Пророка»), в котором была следующая фраза: «Как тело, так и его части находятся в непрерывном состоянии растворения и питания, поэтому они неизбежно претерпевают постоянные изменения». [149]
История научного изучения метаболизма охватывает несколько столетий и прошла путь от изучения целых животных в ранних исследованиях до изучения отдельных метаболических реакций в современной биохимии. Первые контролируемые эксперименты по человеческому метаболизму были опубликованы Санторио Санторио в 1614 году в его книге Ars de statica medicina . [150] Он описал, как он взвешивал себя до и после еды, сна , работы, секса, голодания, питья и испражнения. Он обнаружил, что большая часть пищи, которую он принимал, терялась через то, что он назвал « неощутимым потоотделением ».

В этих ранних исследованиях механизмы этих метаболических процессов не были идентифицированы, и считалось, что жизненная сила оживляет живую ткань. [151] В 19 веке, изучая ферментацию сахара в спирт дрожжами , Луи Пастер пришел к выводу, что ферментация катализируется веществами внутри дрожжевых клеток, которые он назвал «ферментами». Он писал, что «спиртовое брожение — это акт, коррелирующий с жизнью и организацией дрожжевых клеток, а не со смертью или гниением клеток». [152] Это открытие, наряду с публикацией Фридрихом Вёлером в 1828 году статьи о химическом синтезе мочевины , [153] примечательно тем, что является первым органическим соединением, полученным из полностью неорганических предшественников. Это доказало, что органические соединения и химические реакции, обнаруженные в клетках, в принципе ничем не отличаются от любой другой части химии.
Именно открытие ферментов в начале 20-го века Эдуардом Бухнером отделило изучение химических реакций метаболизма от биологического изучения клеток и ознаменовало начало биохимии . [154] Масса биохимических знаний быстро росла в течение начала 20-го века. Одним из самых плодовитых из этих современных биохимиков был Ганс Кребс , который внес огромный вклад в изучение метаболизма. [155] Он открыл цикл мочевины, а позже, работая с Гансом Корнбергом , цикл лимонной кислоты и глиоксилатный цикл. [156] [157] [75] Современным биохимическим исследованиям в значительной степени способствовала разработка новых методов, таких как хроматография , рентгеновская дифракция , ЯМР-спектроскопия , радиоизотопная маркировка , электронная микроскопия и моделирование молекулярной динамики . Эти методы позволили обнаружить и детально проанализировать множество молекул и метаболических путей в клетках. [ необходима цитата ]
{{cite book}}: CS1 maint: DOI inactive as of September 2024 (link){{cite book}}: |journal=проигнорировано ( помощь )Вводный
Передовой
Общая информация
Метаболизм человека
Базы данных
Метаболические пути