Сера (также пишется как «сера» на британском английском языке ) — химический элемент ; он имеет символ S и атомный номер 16. Он широко распространен , многовалентен и неметаллический . В обычных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S 8 . Элементарная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре .
Сера — десятый по массе элемент во Вселенной и пятый по распространенности на Земле. Хотя иногда сера встречается в чистой, самородной форме, на Земле она обычно встречается в виде сульфидных и сульфатных минералов . Обладая изобилием в самородной форме, сера была известна еще в древние времена, ее использование упоминалось в Древней Индии , Древней Греции , Китае и Древнем Египте . Исторически и в литературе серу еще называют серой , [7] что означает «горящий камень». [8] Сегодня почти вся элементарная сера производится как побочный продукт удаления серосодержащих примесей из природного газа и нефти . [9] [10] Наибольшее коммерческое использование элемента — производство серной кислоты для сульфатных и фосфорных удобрений , а также другие химические процессы. Сера используется в спичках , инсектицидах и фунгицидах . Многие соединения серы имеют запах, а запахи одорированного природного газа , запаха скунса , неприятного запаха изо рта , грейпфрута и чеснока обусловлены сероорганическими соединениями. Сероводород придает характерный запах гниению яиц и другим биологическим процессам.
Сера является важным элементом для всей жизни, почти всегда в форме сероорганических соединений или сульфидов металлов. Аминокислоты (две протеиногенные : цистеин и метионин , и многие другие некодированные : цистин , таурин и др.) и два витамина ( биотин и тиамин ) являются сероорганическими соединениями, имеющими решающее значение для жизни. Многие кофакторы также содержат серу, включая глутатион , и железо-серные белки . Дисульфиды , связи S–S, придают механическую прочность и нерастворимость (среди прочего) белку кератину , содержащемуся во внешней части кожи, волосах и перьях. Сера является одним из основных химических элементов, необходимых для биохимического функционирования, и является элементарным макроэлементом для всех живых организмов.

Сера образует несколько многоатомных молекул. Самый известный аллотроп — октасера , цикло- S8 . Точечная группа цикло-S 8 — D 4d , а его дипольный момент — 0 D. [11] Октасера представляет собой мягкое твердое вещество ярко-желтого цвета, не имеющее запаха. [a] Он плавится при 115,21 ° C (239,38 ° F), [b] кипит при 444,6 ° C (832,3 ° F). [7] При температуре 95,2 °C (203,4 °F), ниже температуры плавления, циклооктасера начинает медленно превращаться из α-октасеры в β- полиморфную модификацию . [13] Структура кольца S 8 практически не изменяется в результате этого фазового изменения, которое влияет на межмолекулярные взаимодействия. Охлаждение расплавленной серы дает температуру замерзания 119,6 °C (247,3 °F), [14] , поскольку она преимущественно состоит из молекул β- S8 . [c] Между температурами плавления и кипения октасера снова меняет свой аллотроп, превращаясь из β-октасеры в γ-серу, что снова сопровождается более низкой плотностью, но повышенной вязкостью из-за образования полимеров . [13] При более высоких температурах вязкость снижается по мере деполимеризации. Расплавленная сера приобретает темно-красный цвет при температуре выше 200 ° C (392 ° F). Плотность серы около 2 г/см 3 в зависимости от аллотропа; все стабильные аллотропы являются отличными электрическими изоляторами.
Сера сублимирует более или менее при температуре от 20 ° C (68 ° F) до 50 ° C (122 ° F). [18]
Сера нерастворима в воде, но растворима в сероуглероде и, в меньшей степени, в других неполярных органических растворителях, таких как бензол и толуол .
В обычных условиях сера гидролизуется очень медленно с образованием преимущественно сероводорода и серной кислоты :
Реакция включает адсорбцию протонов на S.
8кластеров с последующим диспропорционированием на продукты реакции. [19]
Вторая, четвертая и шестая энергии ионизации серы составляют 2252 кДж/моль, 4556 кДж/моль и 8495,8 кДж/моль соответственно. Состав продуктов реакции серы с окислителями (и степень ее окисления) зависит от того, преодолеет ли выделение энергии реакции эти пороги. Применение катализаторов и/или подвод внешней энергии может изменять степень окисления серы и состав продуктов реакции. В то время как реакция между серой и кислородом при нормальных условиях дает диоксид серы (степень окисления +4), для образования триоксида серы (степень окисления +6) требуется температура 400–600 ° C (750–1100 ° F) и присутствие катализатора.
В реакциях с элементами меньшей электроотрицательности реагирует как окислитель и образует сульфиды, где имеет степень окисления -2.
Сера реагирует почти со всеми другими элементами, за исключением благородных газов, даже с заведомо нереактивным металлом иридием (с образованием дисульфида иридия ). [20] Некоторые из этих реакций требуют повышенных температур. [21]

Сера образует более 30 твердых аллотропов , больше, чем любой другой элемент. [22] Помимо S 8 известно несколько других колец. [23] Удаление одного атома из короны дает S 7 , который имеет более глубокий желтый цвет, чем S 8 . ВЭЖХ- анализ «элементарной серы» обнаруживает равновесную смесь, в основном состоящую из S 8 , но с S 7 и небольшими количествами S 6 . [24] Были подготовлены кольца большего размера, в том числе S 12 и S 18 . [25] [26]
Аморфную или «пластическую» серу получают путем быстрого охлаждения расплавленной серы, например, выливая ее в холодную воду. Рентгеновские кристаллографические исследования показывают, что аморфная форма может иметь спиральную структуру с восемью атомами на виток. Длинные спиральные полимерные молекулы делают коричневатое вещество эластичным , и в массе эта форма напоминает сырую резину. Эта форма метастабильна при комнатной температуре и постепенно возвращается к кристаллическому молекулярному аллотропу, который больше не является эластичным. Этот процесс происходит в течение нескольких часов или дней, но может быть быстро катализирован.
Сера имеет 23 известных изотопа , четыре из которых стабильны: 32 S (94,99% ± 0,26% ), 33 С (0,75% ± 0,02% ), 34 S (4,25% ± 0,24% ) и 36 S (0,01% ± 0,01% ). [27] [28] За исключением 35 S, с периодом полураспада 87 дней, радиоактивные изотопы серы имеют период полураспада менее 3 часов.
Преобладание 32 S объясняется его образованием в так называемом альфа-процессе (один из основных классов реакций ядерного синтеза) во взрывающихся звездах. Другие стабильные изотопы серы образуются в процессах обхода, связанных с 34 Ar, и их состав зависит от типа звездного взрыва. Например, пропорционально больше 33 S поступает от новых , чем от сверхновых . [29]
На планете Земля изотопный состав серы определялся Солнцем. Хотя предполагается, что распределение различных изотопов серы должно быть более или менее равномерным, обнаружено, что доли двух наиболее распространенных изотопов серы 32 S и 34 S различаются в разных образцах. Определение соотношения этих изотопов (δ 34 S) в образцах позволяет сделать предположения об их химической истории, а при поддержке других методов — датировать образцы, оценить температуру равновесия между рудой и водой, определить pH и летучесть кислорода, выявить активность сульфатредуцирующих бактерий в момент формирования пробы или предположить основные источники серы в экосистемах. [30] Однако продолжаются дискуссии о том, какова реальная причина сдвигов δ 34 S, биологической активности или постдепозитарных изменений. [31]
Например, при осаждении сульфидных минералов изотопное равновесие между твердыми и жидкими веществами может вызывать небольшие различия в значениях δ 34 S однородных минералов. Различия между минералами можно использовать для оценки температуры равновесия. Значения δ 13 C и δ 34 S сосуществующих карбонатных минералов и сульфидов можно использовать для определения pH и фугитивности кислорода рудоносного флюида во время рудообразования.
Ученые измеряют изотопы серы в минералах в горных породах и отложениях , чтобы изучить окислительно-восстановительные условия в океанах в прошлом. Сульфатредуцирующие бактерии в морских отложениях фракционируют изотопы серы , поглощая сульфат и производя сульфид . До 2010-х годов считалось, что сульфатредукция может фракционировать изотопы серы до 46 промилл [32] , а фракционирование более 46 промилле, зарегистрированное в отложениях, должно быть связано с диспропорцией соединений серы в отложениях. Эта точка зрения изменилась с 2010-х годов, когда эксперименты показали, что сульфатредуцирующие бактерии могут фракционировать до 66 промилле. [33] Поскольку субстраты для диспропорционирования ограничены продуктом сульфатредукции , изотопный эффект диспропорционирования должен составлять менее 16 промилле в большинстве осадочных условий. [34]
В большинстве лесных экосистем сульфат поступает в основном из атмосферы; выветривание рудных минералов и эвапоритов вносит некоторое количество серы. Сера с особым изотопным составом использовалась для идентификации источников загрязнения, а обогащенная сера добавлялась в качестве индикатора при гидрологических исследованиях. Различия в естественной численности могут быть использованы в системах, где существует достаточная изменчивость 34 S компонентов экосистемы. Было обнаружено, что озера Скалистых гор , в которых, как полагают, преобладают атмосферные источники сульфатов, имеют заметно отличающиеся значения 34 S, чем озера, в которых, как полагают, преобладают водораздельные источники сульфатов.
Радиоактивный 35 S образуется в результате расщепления космическими лучами атмосферного 40 Ar . Этот факт может быть использован для доказательства наличия в различных предметах недавних (не более 1 года) атмосферных осадков. Этот изотоп можно получить искусственно разными способами. На практике используют реакцию 35 Cl + n → 35 S+ p при облучении хлорида калия нейтронами. [35] Изотоп 35 S используется в различных серосодержащих соединениях в качестве радиоактивного индикатора для многих биологических исследований, например, эксперимента Херши-Чейза .
Из-за слабой бета-активности 35S его соединения относительно безопасны , пока они не попадают в организм и не усваиваются организмом. [36]




32 S создается внутри массивных звезд, на глубине, где температура превышает 2,5×10 9 К, в результате слияния одного ядра кремния и одного ядра гелия. [37] Поскольку эта ядерная реакция является частью альфа-процесса , в результате которого образуются элементы в изобилии, сера является 10-м по распространенности элементом во Вселенной .
Сера, обычно в виде сульфида, присутствует во многих типах метеоритов . Обыкновенные хондриты содержат в среднем 2,1% серы, а углистые хондриты могут содержать до 6,6%. Обычно он присутствует в виде троилита (FeS), но есть исключения: углистые хондриты, содержащие свободную серу, сульфаты и другие соединения серы. [38] Отличительные цвета вулканического спутника Юпитера Ио объясняются различными формами расплавленной, твердой и газообразной серы . [39]
Это пятый по массе элемент на Земле. Элементарную серу можно найти вблизи горячих источников и вулканических регионов во многих частях мира, особенно вдоль Тихоокеанского огненного кольца ; такие вулканические месторождения в настоящее время добываются в Индонезии, Чили и Японии. Эти отложения являются поликристаллическими, размер самого большого зарегистрированного монокристалла составляет 22 см × 16 см × 11 см (8,7 дюйма × 6,3 дюйма × 4,3 дюйма). [40] Исторически Сицилия была основным источником серы во время промышленной революции . [41] Озера расплавленной серы диаметром примерно до 200 м (660 футов) были обнаружены на морском дне, связанном с подводными вулканами , на глубинах, где температура кипения воды выше, чем температура плавления серы. [42]
Самородная сера синтезируется анаэробными бактериями, действующими на сульфатные минералы, такие как гипс, в соляных куполах . [43] [44] Значительные отложения в соляных куполах встречаются вдоль побережья Мексиканского залива , а также в эвапоритах в Восточной Европе и Западной Азии. Самородная сера может быть получена только в результате геологических процессов. Ископаемые месторождения серы из соляных куполов когда-то были основой коммерческого производства в США, России, Туркменистане и Украине. [45] В настоящее время коммерческое производство по-прежнему осуществляется на шахте Осик в Польше. Такие источники сейчас имеют второстепенное коммерческое значение, и большинство из них больше не эксплуатируются.
Общие встречающиеся в природе соединения серы включают сульфидные минералы , такие как пирит (сульфид железа), киноварь (сульфид ртути), галенит (сульфид свинца), сфалерит (сульфид цинка) и антимонит (сульфид сурьмы); и сульфатные минералы , такие как гипс (сульфат кальция), алунит (сульфат калия-алюминия) и барит (сульфат бария). На Земле, как и на спутнике Юпитера Ио, элементарная сера естественным образом встречается в виде вулканических выбросов, включая выбросы гидротермальных источников .
Основным промышленным источником серы в настоящее время являются нефть и природный газ . [9]
Обычные степени окисления серы варьируются от -2 до +6. Сера образует устойчивые соединения со всеми элементами, кроме благородных газов .

Поликатионы серы, S2+8, С2+4и С2+16образуются при взаимодействии серы с окислителями в сильнокислом растворе. [46] О цветных растворах, полученных при растворении серы в олеуме, впервые сообщил еще в 1804 году К. Ф. Бухольц, но причина цвета и структура поликатионов были установлены только в конце 1960-х годов. С2+8темно-синий, S2+4желтый и S2+16красный. [13]
Восстановление серы дает различные полисульфиды формулы S2−
х, многие из которых были получены в кристаллической форме. Показательным является производство тетрасульфида натрия :
Некоторые из этих дианионов диссоциируют с образованием анионов-радикалов , таких как S−3придает синий цвет камню лазурит .

Эта реакция подчеркивает отличительное свойство серы: ее способность к катенации (связыванию между собой путем образования цепочек). Протонирование этих полисульфид-анионов приводит к образованию полисульфанов H 2 S x , где x = 2, 3 и 4. [48] В конечном итоге восстановление серы приводит к образованию сульфидных солей:
Взаимное превращение этих видов используется в натриево-серной батарее .
Обработка серы водородом дает сероводород . При растворении в воде сероводород имеет слабокислую реакцию: [7]
Газообразный сероводород и гидросульфид-анион чрезвычайно токсичны для млекопитающих из-за ингибирования способности гемоглобина и некоторых цитохромов переносить кислород аналогично цианиду и азиду (см. ниже, в мерах предосторожности ).
Два основных оксида серы получаются путем сжигания серы:
Наблюдаются многие другие оксиды серы, включая оксиды с высоким содержанием серы, включая монооксид серы , монооксид дисеры , диоксиды дисеры и высшие оксиды, содержащие пероксогруппы.
Сера реагирует с фтором с образованием высокореактивного тетрафторида серы и высокоинертного гексафторида серы . [49] В то время как фтор дает соединения S(IV) и S(VI), хлор дает производные S(II) и S(I). Так, в результате хлорирования серы возникают дихлорид серы , дихлорид дисеры и высшие хлорсульфаны. Сульфурилхлорид и хлорсерная кислота являются производными серной кислоты; Тионилхлорид (SOCl 2 ) — распространенный реагент в органическом синтезе . [50] Бром также окисляет серу с образованием дибромида серы и дибромида дисеры . [50]
Сера окисляет цианид и сульфит с образованием тиоцианата и тиосульфата соответственно.
Сера реагирует со многими металлами. Электроположительные металлы дают полисульфидные соли. Медь, цинк и серебро подвергаются воздействию серы; см . потускнение . Хотя известно множество сульфидов металлов , большинство из них получаются в результате высокотемпературных реакций элементов. [51] Геологи также изучают изотопы сульфидов металлов в горных породах и отложениях, чтобы изучить условия окружающей среды в прошлом Земли. [52]
Некоторые из основных классов серосодержащих органических соединений включают следующие: [53]
Соединения с кратными связями углерод-сера встречаются редко, исключением является сероуглерод — летучая бесцветная жидкость, структурно похожая на диоксид углерода. Его используют в качестве реагента для получения полимерного вискозы и многих сероорганических соединений. В отличие от угарного газа , моносульфид углерода стабилен только в виде чрезвычайно разбавленного газа, встречающегося между солнечными системами. [54]
Сероорганические соединения ответственны за некоторые неприятные запахи разлагающихся органических веществ. Они широко известны как одорант бытового природного газа, запах чеснока и спрей от скунса, а также как компонент неприятного запаха изо рта. Не все органические соединения серы имеют неприятный запах во всех концентрациях: серосодержащий монотерпеноид меркаптан грейпфрута в небольших концентрациях имеет характерный запах грейпфрута, но в более высоких концентрациях имеет характерный тиоловый запах. Сернистый иприт , сильнодействующее нарывное вещество , использовался во время Первой мировой войны как обездвиживающее средство. [55]
Связи сера-сера представляют собой структурный компонент, используемый для придания жесткости резине, подобно дисульфидным мостикам, которые придают жесткость белкам (см. биологическую информацию ниже). В наиболее распространенном типе промышленного «отверждения» или отверждения и упрочнения натурального каучука элементарная сера нагревается вместе с каучуком до такой степени, что химические реакции образуют дисульфидные мостики между изопреновыми звеньями полимера. Этот процесс, запатентованный в 1843 году, сделал каучук основным промышленным продуктом, особенно в автомобильных шинах. Из-за высокой температуры и серы процесс был назван вулканизацией , в честь римского бога кузницы и вулканизма .

Будучи широко доступной в самородной форме, сера была известна еще в древности и упоминается в Торе ( Бытие ). В английских переводах христианской Библии горящую серу обычно называют «серой», что дает начало термину « огненно-серные » проповеди , в которых слушателям напоминают о судьбе вечного проклятия , ожидающей неверующих и нераскаявшихся. Именно в этой части Библии [56] Ад подразумевается под «запахом серы» (вероятно, из-за его связи с вулканической активностью) . Согласно папирусу Эберса , серная мазь использовалась в Древнем Египте для лечения зернистых век. Сера использовалась для окуривания в доклассической Греции ; [57] об этом упоминается в «Одиссее» . [58] Плиний Старший обсуждает серу в книге 35 своей « Естественной истории» , говоря, что ее самым известным источником является остров Мелос . Он упоминает его использование для окуривания, медицины и отбеливания тканей. [59]
Природная форма серы, известная как шилюхуан (石硫黄), была известна в Китае с VI века до нашей эры и найдена в Ханьчжуне . [60] К 3 веку китайцы обнаружили, что серу можно извлечь из пирита . [60] Китайские даосы интересовались воспламеняемостью серы и ее реакционной способностью с некоторыми металлами, однако самое раннее практическое применение серы было обнаружено в традиционной китайской медицине . [60] Уцзин Цзунъяо 1044 года нашей эры описал различные формулы китайского черного пороха , который представляет собой смесь нитрата калия ( KNO
3), древесный уголь и сера. [61]
Индийские алхимики, практикующие «химическую науку» ( санскрит : रसशास्त्र , латинизированный : rasaśāstra ), много писали об использовании серы в алхимических операциях с ртутью, начиная с восьмого века нашей эры. [63] В традиции расашастры серу называют «вонючей» ( गन्धक , гандхака ).
Ранние европейские алхимики присвоили сере уникальный алхимический символ — треугольник на вершине креста (🜍). (Иногда его путают с астрономическим символом скрещенного копья ⚴, обозначающим 2 Паллады .) Вариант, известный как сера, имеет символ, сочетающий в себе крест с двумя перемычками на вершине лемнискаты (🜏). В традиционном лечении кожи элементарная сера использовалась (в основном в кремах) для облегчения таких состояний, как чесотка , стригущий лишай , псориаз , экзема и угри . Механизм действия неизвестен, хотя элементарная сера медленно окисляется до сернистой кислоты, которая (под действием сульфита ) является мягким восстановителем и антибактериальным агентом. [64] [65] [66]

Сера появляется в столбце фиксированной (некислотной) щелочи в химической таблице 1718 года. [68] Антуан Лавуазье использовал серу в экспериментах по горению, написав некоторые из них в 1777 году. [69]
Месторождения серы на Сицилии были доминирующим источником на протяжении более столетия. К концу 18-го века около 2000 тонн серы в год импортировалось в Марсель , Франция, для производства серной кислоты для использования в процессе Леблана . В индустриализирующейся Британии после отмены пошлин на соль в 1824 году спрос на серу из Сицилии резко возрос. Усиление британского контроля и эксплуатации добычи, переработки и транспортировки серы в сочетании с неспособностью этого прибыльного экспорта преобразовать отсталую и обедневшую экономику Сицилии привели к серному кризису 1840 года , когда король Фердинанд II предоставил монополию на добычу, переработку и транспортировку серы. серную промышленность французской фирме, нарушив ранее заключенное в 1816 году торговое соглашение с Великобританией. Мирное решение в конечном итоге было достигнуто Францией. [70] [71]
В 1867 году элементарная сера была обнаружена в подземных месторождениях в Луизиане и Техасе . Для добычи этого ресурса был разработан весьма успешный процесс Фраша . [72]
В конце 18 века мебельщики использовали расплавленную серу для изготовления декоративных инкрустации . [73] Расплавленная сера иногда до сих пор используется для установки стальных болтов в просверленные бетонные отверстия, где требуется высокая ударопрочность для точек крепления напольного оборудования. Чистую порошкообразную серу использовали как лекарственное тонизирующее и слабительное средство. [45]
С появлением контактного процесса большая часть серы сегодня используется для производства серной кислоты для широкого спектра применений, особенно для удобрений. [74]
В последнее время основным источником серы стали нефть и природный газ . Это связано с требованием удаления серы из топлива для предотвращения кислотных дождей и привело к избытку серы. [9]
Сера происходит от латинского слова sulpur , которое было эллинизировано как «сера» из-за ошибочного мнения, что латинское слово пришло из греческого языка. Позднее это написание было интерпретировано как представляющее звук /f/, и в результате появилось написание сера , которое появляется на латыни к концу классического периода . Настоящее древнегреческое слово, обозначающее серу, θεῖον , theion (от более раннего θέειον , theeion ), является источником международного химического префикса тио- . Современное стандартное греческое слово, обозначающее серу, — θείο, theio .
В англо-французской среде XII века это была сера . В 14 веке ошибочно эллинизированная латынь -ph- была восстановлена в среднеанглийском сульфре . К 15 веку в английском языке стали распространены оба варианта полного латинского написания «сера» и «сера» . Параллельное написание f~ph сохранялось в Британии до XIX века, когда это слово было стандартизировано как «сера» . [75] С другой стороны, в Соединенных Штатах была выбрана форма серы , тогда как в Канаде используются обе формы.
ИЮПАК принял написание серы в 1990 или 1971 году, в зависимости от цитируемого источника, [76], как это сделал Номенклатурный комитет Королевского химического общества в 1992 году, восстановив написание серы в Великобритании. [77] Оксфордские словари отмечают, что «в химии и других технических целях... написание -f- теперь является стандартной формой для этого и родственных слов как в британском, так и в американском контексте, а также все чаще используется в общих контекстах. " [78]


Серу можно найти саму по себе, и исторически ее обычно получали именно в этой форме; пирит также был источником серы. [79] В вулканических регионах Сицилии в древние времена ее находили на поверхности Земли, при этом использовался « сицилийский процесс »: залежи серы складывались и складывались в кирпичные печи, построенные на наклонных склонах холмов, с воздушным пространством между ними. . Затем часть серы была распылена, распределена по сложенной руде и подожжена, в результате чего свободная сера растаяла с холмов. В конце концов поверхностные отложения иссякли, и горняки начали выкапывать жилы, которые в конечном итоге усеяли сицилийский ландшафт лабиринтными шахтами. Горное дело было немеханизированным и трудоемким: пикники вытаскивали руду из камня, а горняки или каруси выносили корзины с рудой на поверхность, часто через туннели длиной в милю или более. Когда руда оказывалась на поверхности, ее измельчали и извлекали в плавильных печах. Условия на сицилийских серных рудниках были ужасающими, что побудило Букера Т. Вашингтона написать: «Я не готов прямо сейчас сказать, до какой степени я верю в физический ад на том свете, но серные рудники на Сицилии — это самое близкое к этому. в ад, который я ожидаю увидеть в этой жизни». [80] Серу до сих пор добывают из поверхностных месторождений в более бедных странах с вулканами, таких как Индонезия , и условия труда не сильно улучшились со времен Букера Т. Вашингтона. [81]
Элементарную серу добывали из соляных куполов (в которых она иногда встречается почти в чистом виде) до конца 20 века. Сера теперь производится как побочный продукт других промышленных процессов, например, при нефтепереработке, где сера нежелательна. Считается, что самородная сера под соляными куполами является минералом ископаемого минерального ресурса, образующегося в результате действия анаэробных бактерий на сульфатные отложения. Его удаляли из таких шахт с соляными куполами в основном с помощью процесса Фраша . [45] В этом методе перегретая вода закачивалась в месторождение природной серы для плавления серы, а затем сжатый воздух возвращал расплавленный продукт с чистотой 99,5% на поверхность. На протяжении всего ХХ века в результате этой процедуры производилась элементарная сера, не требующая дальнейшей очистки. Из-за ограниченного количества таких месторождений серы и высокой стоимости их разработки этот процесс добычи серы не использовался широко нигде в мире с 2002 года. [82] [83]

Сегодня сера производится из нефти, природного газа и связанных с ними ископаемых ресурсов, из которых ее получают главным образом в виде сероводорода . [9] Сероорганические соединения , нежелательные примеси в нефти, можно улучшить, подвергнув их гидрообессериванию , которое расщепляет связи C–S: [82] [83]
Образующийся в результате этого процесса сероводород, а также, как он встречается в природном газе, преобразуется в элементарную серу с помощью процесса Клауса . Этот процесс влечет за собой окисление некоторого количества сероводорода до диоксида серы, а затем их сопропорционирование : [82] [83]
Из-за высокого содержания серы в нефтеносных песках Атабаски запасы элементарной серы, образующейся в результате этого процесса, теперь существуют по всей Альберте , Канада. [84] Другой способ хранения серы — использование ее в качестве связующего вещества для бетона, при этом полученный продукт обладает некоторыми желаемыми свойствами (см. серный бетон ). [85]
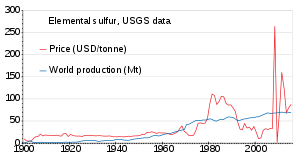
Мировое производство серы в 2011 году составило 69 миллионов тонн (Мт), причем более 15 стран внесли более 1 Мт каждая. Странами, производящими более 5 млн тонн, являются Китай (9,6), США (8,8), Канада (7,1) и Россия (7,1). [86] Производство медленно увеличивалось с 1900 по 2010 год; цена была нестабильной в 1980-х годах и примерно в 2010 году. [87]
Элементарная сера используется главным образом в качестве прекурсора для других химических веществ. Примерно 85% (1989 г.) переводится в серную кислоту (H 2 SO 4 ):

В 2010 году в США было произведено больше серной кислоты, чем любого другого неорганического промышленного химиката. [87] Основное применение кислоты – добыча фосфатных руд для производства удобрений. Другие области применения серной кислоты включают нефтепереработку, переработку сточных вод и добычу полезных ископаемых. [45]
Сера вступает в непосредственную реакцию с метаном с образованием сероуглерода , который используется для производства целлофана и вискозы . [45] Одним из применений элементарной серы является вулканизация каучука, при которой полисульфидные цепи сшивают органические полимеры. Большие количества сульфитов используются для отбеливания бумаги и консервирования сухофруктов . Многие поверхностно-активные вещества и моющие средства (например, лаурилсульфат натрия ) являются производными сульфатов. Сульфат кальция и гипс (CaSO 4 ·2H 2 O) ежегодно добываются в объеме 100 миллионов тонн для использования в портландцементе и удобрениях.
Когда фотография на основе серебра была широко распространена, в качестве «фиксаторов» широко использовались тиосульфаты натрия и аммония . Сера входит в состав пороха («черный порох»).
Аминокислоты , синтезируемые живыми организмами, такие как метионин и цистеин, содержат сероорганические группы ( тиоэфирные и тиоловые соответственно). Антиоксидант глутатион , защищающий многие живые организмы от свободных радикалов и окислительного стресса, также содержит органическую серу. Некоторые культуры , такие как лук и чеснок, также производят различные сероорганические соединения , такие как син -пропанетиал- S -оксид , вызывающий раздражение слез (лук), или диаллилдисульфид и аллицин (чеснок). Сульфаты , обычно встречающиеся в почвах и грунтовых водах, часто являются достаточным естественным источником серы для растений и бактерий. Атмосферные выпадения диоксида серы (SO 2 ) также являются распространенным искусственным источником ( сжигание угля ) серы для почв. В обычных условиях в большинстве сельскохозяйственных почв сера не является лимитирующим питательным веществом для растений и микроорганизмов (см. бочку Либиха ). Однако при некоторых обстоятельствах почвы могут быть обеднены сульфатами , например, если они позже выщелачиваются метеоритными водами ( дождями ) или если потребность в сере для некоторых видов сельскохозяйственных культур высока. Это объясняет, что сера все чаще используется в качестве компонента удобрений . Наиболее важной формой серы для удобрений является сульфат кальция , обычно встречающийся в природе в виде минерального гипса (CaSO 4 ·2H 2 O). Элементарная сера гидрофобна (не растворяется в воде) и не может использоваться непосредственно растениями. Элементарную серу (ES) иногда смешивают с бентонитом , чтобы улучшить истощенные почвы для культур с высокой потребностью в органической сере. Со временем абиотические процессы окисления кислородом воздуха и почвенными бактериями могут окислять и превращать элементарную серу в растворимые производные, которые затем могут быть использованы микроорганизмами и растениями. Сера повышает эффективность других важных питательных веществ для растений, особенно азота и фосфора. [88] Частицы серы, полученные биологическим путем, естественным образом гидрофильны благодаря биополимерному покрытию, и их легче рассеивать по земле при распылении разбавленной навозной жижи, что приводит к более быстрому поглощению растениями.
Потребность растений в сере равна или превышает потребность растений в фосфоре . Это важное питательное вещество для роста растений, образования корневых клубеньков бобовых, а также иммунитета и защитных систем. Дефицит серы получил широкое распространение во многих странах Европы. [89] [90] [91] Поскольку поступления серы в атмосферу продолжают снижаться, дефицит ввода/вывода серы, вероятно, увеличится, если не будут использоваться серные удобрения. Поступление серы в атмосферу снижается благодаря действиям, предпринятым для ограничения кислотных дождей . [92] [88]

Элементарная сера — один из старейших фунгицидов и пестицидов . «Дустрирующая сера», элементарная сера в порошкообразной форме, является распространенным фунгицидом для винограда, клубники, многих овощей и ряда других культур. Обладает хорошей эффективностью против широкого спектра заболеваний мучнистой росы , а также черной пятнистости. В органическом производстве сера является наиболее важным фунгицидом. Это единственный фунгицид, используемый при выращивании яблок в органических хозяйствах против основного заболевания парши яблонь в более холодных условиях. Биосера (биологически полученная элементарная сера с гидрофильными характеристиками) также может использоваться для этих целей.
Сера для опудривания стандартной рецептуры вносится в посевы с помощью сероопылителя или с помощью самолета для опудривания . Смачиваемая сера – это коммерческое название пылеобразной серы, в состав которой входят дополнительные ингредиенты, обеспечивающие смешивание с водой . [85] [93] Он имеет аналогичные применения и используется в качестве фунгицида против плесени и других проблем, связанных с плесенью растений и почвы.
Порошок элементарной серы используется как « органический » (то есть «зеленый») инсектицид ( фактически акарицид ) против клещей . Распространенный метод применения — припудривание одежды или конечностей порошком серы.
Разбавленный раствор извести-серы (полученный путем соединения гидроксида кальция с элементарной серой в воде) используется в качестве ванночки для домашних животных для уничтожения стригущего лишая (грибка) , чесотки и других дерматозов и паразитов .
Серные свечи из почти чистой серы сжигались для окуривания построек и винных бочек, но теперь считаются слишком токсичными для жилых домов.
Сера (в частности, октасульфур , S 8 ) используется в фармацевтических препаратах для кожи для лечения прыщей и других состояний. Он действует как кератолитический агент, а также убивает бактерии, грибки, чесоточных клещей и других паразитов. [94] Осажденная сера и коллоидная сера используются в виде лосьонов , кремов, порошков, мыла и добавок для ванн для лечения обыкновенных угрей , розовых угрей и себорейного дерматита . [95]
Многие лекарства содержат серу. [96] Ранние примеры включают антибактериальные сульфаниламиды , известные как сульфамидные препараты . Более свежий пример — муколитический ацетилцистеин . Сера входит в состав многих защитных молекул бактерий. Большинство β-лактамных антибиотиков, включая пенициллины , цефалоспорины и монобактамы, содержат серу. [53]
Из-за их высокой плотности энергии и наличия серы продолжаются исследования по созданию перезаряжаемых литий-серных батарей . До сих пор карбонатные электролиты вызывали отказы таких аккумуляторов после одного цикла. В феврале 2022 года исследователи из Университета Дрекселя не только создали прототип батареи, выдержавшей 4000 циклов перезарядки, но и обнаружили первую моноклинную гамма-серу, которая оставалась стабильной при температуре ниже 95 градусов по Цельсию. [97]
Сера является важным компонентом всех живых клеток . Это восьмой по распространенности элемент в человеческом организме по весу, [98] примерно равный по содержанию калию и немного превышающий по весу натрий и хлор . [99] В организме человека массой 70 кг (150 фунтов) содержится около 140 граммов (4,9 унции) серы. [100] Основным пищевым источником серы для человека являются серосодержащие аминокислоты, [101] которые содержатся в растительных и животных белках. [102]
В 1880-х годах, изучая Beggiatoa (бактерию, живущую в богатой серой среде), Сергей Виноградский обнаружил, что она окисляет сероводород (H 2 S) в качестве источника энергии, образуя внутриклеточные капли серы. Эту форму обмена Виноградский назвал инороксидацией (окислением неорганических соединений). [103] Другим участником, который продолжал изучать эту тему, был Селман Ваксман . [104] Примитивные бактерии, обитающие вокруг глубоководных океанских вулканических жерл, окисляют сероводород для питания, как обнаружил Роберт Баллард . [10]
Окислители серы могут использовать в качестве источников энергии восстановленные соединения серы, в том числе сероводород, элементарную серу, сульфит , тиосульфат и различные политионаты (например, тетратионаты ). [105] Они зависят от таких ферментов, как серная оксигеназа и сульфитоксидаза , которые окисляют серу до сульфата. Некоторые литотрофы могут даже использовать энергию, содержащуюся в соединениях серы, для производства сахаров — процесс, известный как хемосинтез . Некоторые бактерии и археи используют сероводород вместо воды в качестве донора электронов при хемосинтезе — процессе, похожем на фотосинтез , при котором образуются сахара и используется кислород в качестве акцептора электронов . Хемосинтез на основе серы можно упрощенно сравнить с фотосинтезом:
Существуют бактерии, сочетающие эти два способа питания: зеленые серобактерии и пурпурные серобактерии . [106] Также сероокисляющие бактерии могут вступать в симбиоз с более крупными организмами, позволяя последним использовать сероводород в качестве пищи для окисления. Пример: гигантский трубчатый червь . [107]
Существуют сульфатредуцирующие бактерии , которые, напротив, «дышат сульфатом» вместо кислорода. В качестве источника энергии они используют органические соединения или молекулярный водород. Они используют серу в качестве акцептора электронов и восстанавливают различные окисленные соединения серы обратно в сульфид, часто в сероводород. Они могут расти на других частично окисленных соединениях серы (например, тиосульфатах, тионатах, полисульфидах, сульфитах).
Есть исследования, указывающие на то, что многие месторождения самородной серы в местах, бывших дном древних океанов, имеют биологическое происхождение. [108] [109] [110] Эти исследования показывают, что эта самородная сера была получена в результате биологической активности, но что ответственно за это (сероокисляющие бактерии или сульфатвосстанавливающие бактерии) до сих пор точно неизвестно.
Сера поглощается корнями растений из почвы в виде сульфата и транспортируется в виде эфира фосфорной кислоты. Сульфат восстанавливается до сульфида через сульфит, прежде чем он включается в цистеин и другие сераорганические соединения. [111]
В то время как роль растений в передаче серы животным по пищевым цепям более или менее понятна, роль серобактерий только исследуется. [112] [113]
У всех форм жизни большая часть серы содержится в двух протеиногенных аминокислотах ( цистеине и метионине ), поэтому элемент присутствует во всех белках , содержащих эти аминокислоты, а также в соответствующих пептидах . [114] Некоторое количество серы содержится в некоторых метаболитах, многие из которых являются кофакторами , и сульфатированных полисахаридах соединительной ткани ( хондроитинсульфаты , гепарин ).
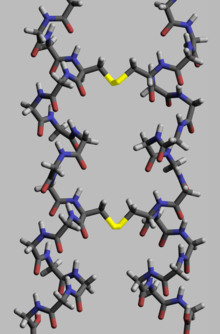
Белкам для выполнения своей биологической функции необходима определенная пространственная геометрия. Формирование этой геометрии осуществляется в процессе, называемом сворачиванием белка , и обеспечивается внутри- и межмолекулярными связями. Процесс имеет несколько этапов. Если на начальных стадиях полипептидная цепь сворачивается за счет водородных связей , то на более поздних стадиях сворачивание обеспечивается (кроме водородных связей) ковалентными связями между двумя атомами серы двух остатков цистеина (так называемые дисульфидные мостики) в разных местах цепи (третичные связи). структура белка), а также между двумя остатками цистеина в двух отдельных субъединицах белка (четвертичная структура белка). Обе структуры легко можно увидеть в инсулине . Поскольку энергия связи ковалентного дисульфидного мостика выше, чем энергия координационной связи или гидрофобного взаимодействия, более высокое содержание дисульфидных мостиков приводит к более высокой энергии, необходимой для денатурации белка . В целом дисульфидные связи необходимы в белках, функционирующих вне клеточного пространства, и они не меняют конформацию (геометрию) белка, а служат его стабилизаторами. [115] Внутри цитоплазмы цистеиновые остатки белков сохраняются в восстановленном состоянии (т.е. в форме -SH) тиоредоксинами . [116]
Это свойство проявляется в следующих примерах. Лизоцим достаточно стабилен, чтобы его можно было применять в качестве лекарственного средства. [117] Перья и волосы обладают относительной прочностью, а содержащийся в них кератин считается неперевариваемым большинством организмов. Однако существуют грибы и бактерии, содержащие кератиназу и способные разрушать кератин.
Многие важные клеточные ферменты используют простетические группы, оканчивающиеся на фрагменты -SH, для проведения реакций с участием ацилсодержащих биохимических веществ: двумя распространенными примерами основного метаболизма являются коэнзим А и альфа-липоевая кислота . [118] Связанные с цистеином метаболиты гомоцистеин и таурин — другие серосодержащие аминокислоты, сходные по структуре, но не кодируемые ДНК и не входящие в первичную структуру белков, принимают участие в различных местах физиологии млекопитающих. [119] [120] Два из 13 классических витаминов, биотин и тиамин , содержат серу и служат кофакторами нескольких ферментов. [121] [122] Во внутриклеточной химии сера действует как переносчик восстанавливающего водорода и его электронов для клеточного восстановления окисления. Восстановленный глутатион , серосодержащий трипептид, является восстановителем благодаря своей сульфгидрильной (–SH) части, полученной из цистеина .
Метаногенез , путь к большей части метана в мире, представляет собой многоступенчатую биохимическую трансформацию углекислого газа . Для этого преобразования требуется несколько сераорганических кофакторов. К ним относятся кофермент М , CH 3 SCH 2 CH 2 SO−3, непосредственный предшественник метана . [123]
Металлопротеины, активным центром которых является ион переходного металла (или металл-сульфидный кластер), часто координируемый атомами серы остатков цистеина [124] , являются важными компонентами ферментов, участвующих в процессах переноса электрона. Примеры включают пластоцианин (Cu 2+ ) и редуктазу закиси азота (Cu–S). Функция этих ферментов зависит от того, что ион переходного металла может подвергаться окислительно-восстановительным реакциям . Другие примеры включают многие белки цинка [125] , а также кластеры железо-сера . Наиболее распространенными являются ферродоксины , которые служат переносчиками электронов в клетках. У бактерий важные ферменты нитрогеназы содержат кластер Fe-Mo-S и являются катализатором , выполняющим важную функцию фиксации азота , превращая атмосферный азот в аммиак, который может быть использован микроорганизмами и растениями для создания белков, ДНК, РНК, алкалоидов. и другие органические соединения азота, необходимые для жизни. [126]
Сера также присутствует в кофакторе молибдена . [127]
Для человека метионин является незаменимой аминокислотой ; цистеин является условно незаменимым и может быть синтезирован из заменимого серина (донором серы в данном случае будет метионин). Диетическая недостаточность редко случается в обычных условиях. Искусственный дефицит метионина пытаются применить при лечении рака [128] , но метод все еще потенциально опасен. [129]
Изолированный дефицит сульфитоксидазы — редкое смертельное генетическое заболевание, препятствующее выработке сульфитоксидазы , необходимой для метаболизма сульфитов до сульфатов. [130]

Хотя элементарная сера лишь минимально впитывается через кожу и малотоксична для человека, вдыхание серной пыли или контакт с глазами или кожей может вызвать раздражение. Чрезмерное употребление серы может вызвать ощущение жжения или диарею [133] , а случаи опасного для жизни метаболического ацидоза были зарегистрированы после того, как пациенты намеренно употребляли серу в качестве народного средства. [134] [135]
Когда сера сгорает на воздухе, образуется диоксид серы . В воде этот газ образует сернистую кислоту и сульфиты; сульфиты — антиоксиданты, подавляющие рост аэробных бактерий и полезная пищевая добавка в небольших количествах. В высоких концентрациях эти кислоты повреждают легкие , глаза и другие ткани . [136] У организмов без легких, таких как насекомые, сульфит в высокой концентрации препятствует дыханию . [137]
Триоксид серы (полученный в результате катализа диоксида серы) и серная кислота также обладают высокой кислотностью и коррозионной активностью в присутствии воды. Концентрированная серная кислота является сильным дегидратирующим агентом, который удаляет доступные молекулы воды и ее компоненты из сахара и органических тканей. [138]
При сжигании угля и/или нефти в промышленности и на электростанциях образуется диоксид серы (SO 2 ), который вступает в реакцию с атмосферной водой и кислородом с образованием сернистой кислоты (H 2 SO 3 ). [139] Эти кислоты являются компонентами кислотных дождей , снижающих pH почвы и пресноводных водоемов, что иногда приводит к существенному ущербу окружающей среде и химическому выветриванию статуй и сооружений. Топливные стандарты все чаще требуют, чтобы производители топлива извлекали серу из ископаемого топлива , чтобы предотвратить образование кислотных дождей. Эта добытая и очищенная сера составляет большую часть производства серы. На угольных электростанциях дымовые газы иногда очищают. Более современные электростанции, использующие синтез-газ, извлекают серу перед сжиганием газа.
Сероводород примерно вдвое менее токсичен, чем цианистый водород , и отравляет по тому же механизму (ингибирование дыхательного фермента цитохромоксидазы ), [140] хотя сероводород с меньшей вероятностью вызывает внезапные отравления от небольших вдыхаемых количеств (около допустимых) . предел воздействия (PEL) 20 частей на миллион) из-за неприятного запаха. [141] Однако его присутствие в окружающем воздухе в концентрации более 100–150 частей на миллион быстро притупляет обоняние, [142] и жертва может вдыхать все большее количество вещества, не замечая этого, пока серьезные симптомы не приведут к смерти. Растворенные сульфидные и гидросульфидные соли токсичны по тому же механизму.
Сигел, Астрид; Фрайзингер, Ева; Сигел, Роланд КО, ред. (2020). Переходные металлы и сера: прочная связь на всю жизнь . Приглашенные редакторы Марта Э. Соса Торрес и Питер М. Х. Кронек. Берлин/Бостон: де Грюйтер. стр. xlv+455. ISBN 978-3-11-058889-7.