Цепь переноса электронов ( ЦПЭ [1] ) представляет собой ряд белковых комплексов и других молекул, которые переносят электроны от доноров электронов к акцепторам электронов посредством окислительно-восстановительных реакций (как восстановление, так и окисление происходят одновременно) и связывают этот перенос электронов с переносом протонов ( ионов H + ) через мембрану . Многие из ферментов в цепи переноса электронов встроены в мембрану .
Поток электронов через электрон-транспортную цепь является экзергоническим процессом . Энергия окислительно-восстановительных реакций создает электрохимический протонный градиент , который управляет синтезом аденозинтрифосфата (АТФ). При аэробном дыхании поток электронов заканчивается молекулярным кислородом в качестве конечного акцептора электронов. При анаэробном дыхании используются другие акцепторы электронов, такие как сульфат .
В цепи переноса электронов окислительно-восстановительные реакции управляются разницей в свободной энергии Гиббса реагентов и продуктов. Свободная энергия, высвобождаемая при преобразовании донора и акцептора электронов с более высокой энергией в продукты с более низкой энергией, в то время как электроны переносятся с более низкого на более высокий окислительно-восстановительный потенциал , используется комплексами в цепи переноса электронов для создания электрохимического градиента ионов. Именно этот электрохимический градиент управляет синтезом АТФ посредством сопряжения с окислительным фосфорилированием с помощью АТФ-синтазы . [2]
В эукариотических организмах цепь переноса электронов и место окислительного фосфорилирования находятся на внутренней митохондриальной мембране . Энергия, высвобождаемая в результате реакций кислорода и восстановленных соединений, таких как цитохром c и (косвенно) NADH и FADH 2, используется цепью переноса электронов для перекачки протонов в межмембранное пространство , создавая электрохимический градиент на внутренней митохондриальной мембране . У фотосинтетических эукариот цепь переноса электронов находится на тилакоидной мембране. Здесь световая энергия управляет транспортом электронов через протонный насос , а результирующий протонный градиент вызывает последующий синтез АТФ. У бактерий цепь переноса электронов может различаться между видами, но она всегда представляет собой набор окислительно-восстановительных реакций, которые сопряжены с синтезом АТФ посредством создания электрохимического градиента и окислительного фосфорилирования через АТФ-синтазу. [3]
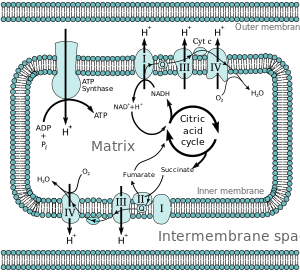
Большинство эукариотических клеток имеют митохондрии , которые производят АТФ из реакций кислорода с продуктами цикла лимонной кислоты , метаболизма жирных кислот и метаболизма аминокислот . На внутренней митохондриальной мембране электроны от НАДН и ФАДН 2 проходят через цепь переноса электронов к кислороду, который обеспечивает энергию, движущую процесс, поскольку он восстанавливается до воды. [4] Цепь переноса электронов включает ферментативный ряд доноров и акцепторов электронов. Каждый донор электронов будет передавать электроны акцептору с более высоким окислительно-восстановительным потенциалом, который, в свою очередь, отдает эти электроны другому акцептору, процесс, который продолжается вниз по ряду, пока электроны не будут переданы кислороду, конечному акцептору электронов в цепи. Каждая реакция высвобождает энергию, потому что донор и акцептор с более высокой энергией преобразуются в продукты с более низкой энергией. Через переданные электроны эта энергия используется для создания протонного градиента через митохондриальную мембрану путем "накачивания" протонов в межмембранное пространство, создавая состояние более высокой свободной энергии, которая имеет потенциал для выполнения работы. Весь этот процесс называется окислительным фосфорилированием , поскольку АДФ фосфорилируется до АТФ с использованием электрохимического градиента, который установили окислительно-восстановительные реакции цепи переноса электронов, вызванные реакциями высвобождения энергии кислородом.
Энергия, связанная с переносом электронов по цепи переноса электронов, используется для перекачивания протонов из митохондриального матрикса в межмембранное пространство, создавая электрохимический протонный градиент ( ΔpH ) через внутреннюю митохондриальную мембрану. Этот протонный градиент в значительной степени, но не исключительно, отвечает за митохондриальный мембранный потенциал (ΔΨ M ). [5] Он позволяет АТФ-синтазе использовать поток H + через фермент обратно в матрикс для генерации АТФ из аденозиндифосфата (АДФ) и неорганического фосфата . Комплекс I (НАДН-кофермент Q-редуктаза; обозначенный как I) принимает электроны от переносчика электронов цикла Кребса никотинамидадениндинуклеотида (НАДН) и передает их коферменту Q ( убихинон ; обозначенный как Q), который также получает электроны от комплекса II ( сукцинатдегидрогеназа ; обозначенный как II). Q передает электроны в Комплекс III ( комплекс цитохрома bc 1 ; обозначен как III), который передает их в цитохром c (cyt c ). Cyt c передает электроны в Комплекс IV ( цитохром c оксидаза ; обозначен как IV).
В митохондриях идентифицировано четыре мембраносвязанных комплекса. Каждый из них представляет собой чрезвычайно сложную трансмембранную структуру, встроенную во внутреннюю мембрану. Три из них являются протонными насосами . Структуры электрически связаны липидорастворимыми переносчиками электронов и водорастворимыми переносчиками электронов. Общую цепь переноса электронов можно обобщить следующим образом:
НАДН, Н + → Комплекс I → Q → Комплекс III → цитохром c → Комплекс IV → H 2 O ↑ Комплекс II ↑ Сукцинат
В комплексе I (NADH-убихинон-оксидоредуктаза, тип I NADH-дегидрогеназа или митохондриальный комплекс I; EC 1.6.5.3) два электрона удаляются из NADH и переносятся на липидорастворимый переносчик, убихинон (Q). Восстановленный продукт, убихинол (QH 2 ), свободно диффундирует внутри мембраны, а комплекс I перемещает четыре протона (H + ) через мембрану, создавая таким образом протонный градиент. Комплекс I является одним из основных мест, в которых происходит преждевременная утечка электронов в кислород, таким образом, являясь одним из основных мест производства супероксида . [6]
Путь электронов следующий:
NADH окисляется до NAD + , путем восстановления флавинмононуклеотида до FMNH 2 в один двухэлектронный шаг. FMNH 2 затем окисляется в два одноэлектронных шага, через промежуточный семихинон . Таким образом, каждый электрон переходит от FMNH 2 к кластеру Fe–S , от кластера Fe-S к убихинону (Q). Передача первого электрона приводит к образованию свободнорадикальной (семихинонной ) формы Q, а передача второго электрона восстанавливает семихиноновую форму до убихинольной формы, QH 2 . Во время этого процесса четыре протона перемещаются из митохондриального матрикса в межмембранное пространство. [7] Когда электроны движутся через комплекс, электронный ток создается вдоль ширины комплекса 180 Ангстрем внутри мембраны. Этот ток обеспечивает активный транспорт четырех протонов в межмембранное пространство на два электрона от NADH. [8]
В комплексе II ( сукцинатдегидрогеназа или сукцинат-CoQ редуктаза; EC 1.3.5.1) дополнительные электроны доставляются в пул хинона (Q), происходящий из сукцината, и переносятся (через флавинадениндинуклеотид (FAD) ) в Q. Комплекс II состоит из четырех белковых субъединиц: сукцинатдегидрогеназа (SDHA); митохондриальная железо-серная субъединица сукцинатдегидрогеназы [убихинон] (SDHB); субъединица комплекса сукцинатдегидрогеназы C (SDHC); и субъединица комплекса сукцинатдегидрогеназы D (SDHD). Другие доноры электронов (например, жирные кислоты и глицерол-3-фосфат) также направляют электроны в Q (через FAD). Комплекс II представляет собой параллельный путь транспорта электронов к комплексу I, но в отличие от комплекса I, в этом пути протоны не транспортируются в межмембранное пространство. Таким образом, путь через Комплекс II вносит меньший вклад в общий процесс цепи переноса электронов.
В комплексе III ( цитохром bc 1 комплекс или CoQH 2 -цитохром c редуктаза; EC 1.10.2.2) Q-цикл способствует градиенту протонов за счет асимметричного поглощения/высвобождения протонов. Два электрона удаляются из QH 2 на сайте Q O и последовательно переносятся на две молекулы цитохрома c , водорастворимого электронного переносчика, расположенного в межмембранном пространстве. Два других электрона последовательно проходят через белок к сайту Q i , где хинонная часть убихинона восстанавливается до хинола. Протонный градиент образуется путем окисления одного хинола ( ) на сайте Q o с образованием одного хинона ( ) на сайте Q i . (В общей сложности перемещаются четыре протона: два протона восстанавливают хинон до хинола и два протона высвобождаются из двух молекул убихинола.)
При снижении переноса электронов (из-за высокого мембранного потенциала или ингибиторов дыхания, таких как антимицин А) Комплекс III может передавать электроны молекулярному кислороду, что приводит к образованию супероксида.
Этот комплекс ингибируется димеркапролом (британский антилюизит, BAL), нафтохиноном и антимицином.
В комплексе IV ( цитохром с оксидаза ; EC 1.9.3.1), иногда называемом цитохромом AA3, четыре электрона удаляются из четырех молекул цитохрома с и переносятся на молекулярный кислород (O 2 ) и четыре протона, образуя две молекулы воды. Комплекс содержит координированные ионы меди и несколько групп гема. В то же время восемь протонов удаляются из митохондриальной матрицы (хотя только четыре перемещаются через мембрану), способствуя градиенту протонов. Точные детали перекачки протонов в комплексе IV все еще изучаются. [9] Цианид является ингибитором комплекса IV.
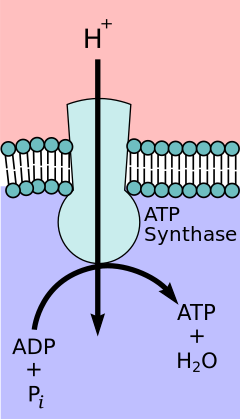
Согласно гипотезе хемиосмотического сопряжения , предложенной лауреатом Нобелевской премии по химии Питером Д. Митчеллом , цепь переноса электронов и окислительное фосфорилирование связаны градиентом протонов через внутреннюю митохондриальную мембрану. Отток протонов из митохондриального матрикса создает электрохимический градиент (протонный градиент). Этот градиент используется комплексом F O F 1 АТФ-синтазы для производства АТФ посредством окислительного фосфорилирования. АТФ-синтазу иногда описывают как Комплекс V цепи переноса электронов. [10] Компонент F O АТФ-синтазы действует как ионный канал , который обеспечивает поток протонов обратно в митохондриальный матрикс. Он состоит из субъединиц a, b и c. Протоны в межмембранном пространстве митохондрий сначала попадают в комплекс АТФ-синтазы через канал субъединицы a . Затем протоны перемещаются в субъединицы c. [11] Количество субъединиц c определяет, сколько протонов требуется для того, чтобы заставить F O совершить один полный оборот. Например, у людей имеется 8 субъединиц c, поэтому требуется 8 протонов. [12] После субъединиц c протоны наконец попадают в матрицу через канал субъединицы a , который открывается в митохондриальный матрикс. [11] Этот рефлюкс высвобождает свободную энергию , произведенную во время генерации окисленных форм переносчиков электронов (NAD + и Q) с энергией, предоставленной O 2 . Свободная энергия используется для запуска синтеза АТФ, катализируемого компонентом F 1 комплекса. [13]
Сопряжение с окислительным фосфорилированием является ключевым шагом для производства АТФ. Однако в определенных случаях разъединение двух процессов может быть биологически полезным. Разобщающий белок термогенин , присутствующий во внутренней митохондриальной мембране бурой жировой ткани , обеспечивает альтернативный поток протонов обратно во внутреннюю митохондриальную матрицу. Тироксин также является естественным разобщающим агентом. Этот альтернативный поток приводит к термогенезу, а не к производству АТФ. [14]
Обратный поток электронов — это перенос электронов через цепь переноса электронов через обратные окислительно-восстановительные реакции. Обычно требуя значительного количества энергии для использования, это может уменьшить окисленные формы доноров электронов. Например, NAD + может быть восстановлен до NADH с помощью Комплекса I. [15] Есть несколько факторов, которые, как было показано, вызывают обратный поток электронов. Однако, необходимо провести больше работы, чтобы подтвердить это. Одним из примеров является блокировка АТФ-синтазы, что приводит к накоплению протонов и, следовательно, более высокой протон-движущей силе , вызывающей обратный поток электронов . [16]
У эукариот НАДН является наиболее важным донором электронов. Соответствующая цепь переноса электронов выглядит следующим образом: НАДН → Комплекс I → Q → Комплекс III → цитохром c → Комплекс IV → O 2 , где Комплексы I, III и IV являются протонными насосами, а Q и цитохром c — подвижными переносчиками электронов. Акцептором электронов для этого процесса является молекулярный кислород.
У прокариот ( бактерий и архей ) ситуация сложнее, поскольку существует несколько различных доноров электронов и несколько различных акцепторов электронов. Обобщенная цепь переноса электронов у бактерий выглядит следующим образом:
Донор Донор Донор ↓ ↓ ↓ дегидрогеназа → хинон → bc 1 → цитохром ↓ ↓ оксидаза(редуктаза) оксидаза(редуктаза) ↓ ↓ Акцептор Акцептор
Электроны могут входить в цепь на трех уровнях: на уровне дегидрогеназы , на уровне пула хинонов или на уровне мобильного цитохромного переносчика электронов. Эти уровни соответствуют последовательно более положительным окислительно-восстановительным потенциалам или последовательно уменьшающимся разностям потенциалов относительно конечного акцептора электронов. Другими словами, они соответствуют последовательно меньшим изменениям свободной энергии Гиббса для общей окислительно-восстановительной реакции.
Отдельные бактерии используют несколько цепей переноса электронов, часто одновременно. Бактерии могут использовать несколько различных доноров электронов, несколько различных дегидрогеназ, несколько различных оксидаз и редуктаз и несколько различных акцепторов электронов. Например, E. coli (при росте в аэробных условиях с использованием глюкозы и кислорода в качестве источника энергии) использует две различные дегидрогеназы НАДН и две различные хинолоксидазы, что в общей сложности дает четыре различных цепи переноса электронов, работающих одновременно.
Общей чертой всех электронно-транспортных цепей является наличие протонного насоса для создания электрохимического градиента на мембране. Бактериальные электронно-транспортные цепи могут содержать до трех протонных насосов, как митохондрии, или они могут содержать два или по крайней мере один.
В современной биосфере наиболее распространенными донорами электронов являются органические молекулы. Организмы, которые используют органические молекулы в качестве источника электронов, называются органотрофами . Хемоорганотрофы (животные, грибы, простейшие) и фотолитотрофы (растения и водоросли) составляют подавляющее большинство всех известных форм жизни.
Некоторые прокариоты могут использовать неорганическую материю в качестве источника электронов. Такой организм называется (хемо)литотрофом («пожиратель камней»). Неорганическими донорами электронов являются водород , оксид углерода , аммиак , нитрит , сера , сульфид , оксид марганца и двухвалентное железо . Литотрофы были обнаружены растущими в скальных образованиях на глубине тысяч метров под поверхностью Земли. Из-за своего объема распространения литотрофы могут фактически превосходить по численности органотрофов и фототрофов в нашей биосфере .
Использование неорганических доноров электронов, таких как водород, в качестве источника энергии представляет особый интерес в изучении эволюции . Этот тип метаболизма должен был логически предшествовать использованию органических молекул и кислорода в качестве источника энергии.
Бактерии могут использовать несколько различных доноров электронов. Когда источником электронов является органическое вещество, донором может быть НАДН или сукцинат, в этом случае электроны поступают в цепь переноса электронов через НАДН-дегидрогеназу (похожую на Комплекс I в митохондриях) или сукцинатдегидрогеназу (похожую на Комплекс II ). Другие дегидрогеназы могут использоваться для обработки различных источников энергии: формиатдегидрогеназа, лактатдегидрогеназа, глицеральдегид-3-фосфатдегидрогеназа, H2 - дегидрогеназа ( гидрогеназа ), цепь переноса электронов. Некоторые дегидрогеназы также являются протонными насосами, в то время как другие направляют электроны в пул хинонов. Большинство дегидрогеназ демонстрируют индуцированную экспрессию в бактериальной клетке в ответ на метаболические потребности, вызванные средой, в которой растут клетки. В случае лактатдегидрогеназы в E. coli фермент используется аэробно и в сочетании с другими дегидрогеназами. Он индуцируется и проявляется при высокой концентрации DL-лактата в клетке. [ необходима цитата ]
Хиноны — это мобильные, растворимые в липидах переносчики, которые перемещают электроны (и протоны) между большими, относительно неподвижными макромолекулярными комплексами, встроенными в мембрану. Бактерии используют убихинон (коэнзим Q, тот же хинон, который используют митохондрии) и родственные хиноны, такие как менахинон (витамин K2 ) . Археи рода Sulfolobus используют кальдариеллахинон. [17] Использование различных хинонов обусловлено небольшими изменениями окислительно-восстановительных потенциалов, вызванными изменениями в структуре. Изменение окислительно-восстановительных потенциалов этих хинонов может соответствовать изменениям акцепторов электронов или вариациям окислительно-восстановительных потенциалов в бактериальных комплексах. [18]
Протонный насос — это любой процесс, который создает протонный градиент через мембрану. Протоны могут физически перемещаться через мембрану, как это видно в митохондриальных комплексах I и IV . Тот же эффект может быть получен путем перемещения электронов в противоположном направлении. Результатом является исчезновение протона из цитоплазмы и появление протона в периплазме. Митохондриальный комплекс III — это второй тип протонного насоса, который опосредован хиноном ( цикл Q ).
Некоторые дегидрогеназы являются протонными насосами, а другие — нет. Большинство оксидаз и редуктаз являются протонными насосами, но некоторые — нет. Цитохром bc 1 — это протонный насос, обнаруженный во многих, но не во всех бактериях (не в E. coli ). Как следует из названия, бактериальный bc 1 похож на митохондриальный bc 1 ( комплекс III ).
Цитохромы — это белки, содержащие железо. Они встречаются в двух совершенно разных средах.
Некоторые цитохромы являются водорастворимыми переносчиками, которые перемещают электроны к и от крупных неподвижных макромолекулярных структур, встроенных в мембрану. Мобильный переносчик электронов цитохрома в митохондриях — это цитохром c . Бактерии используют ряд различных мобильных переносчиков электронов цитохрома.
Другие цитохромы находятся внутри макромолекул, таких как Complex III и Complex IV . Они также функционируют как переносчики электронов, но в совершенно иной, внутримолекулярной, твердотельной среде.
Электроны могут входить в цепь переноса электронов на уровне мобильного цитохрома или хинонового переносчика. Например, электроны от неорганических доноров электронов (нитрит, двухвалентное железо, цепь переноса электронов) вступают в цепь переноса электронов на уровне цитохрома. Когда электроны входят на уровне окислительно-восстановительного потенциала, превышающем NADH, цепь переноса электронов должна работать в обратном направлении, чтобы произвести эту необходимую молекулу с более высокой энергией.
Поскольку существует ряд различных доноров электронов (органическое вещество в органотрофах, неорганическое вещество в литотрофах), существует ряд различных акцепторов электронов, как органических, так и неорганических. Как и в других этапах ETC, для содействия процессу требуется фермент.
Если кислород доступен, он чаще всего используется в качестве конечного акцептора электронов в аэробных бактериях и факультативных анаэробах. Оксидаза восстанавливает O 2 до воды, одновременно окисляя что-то еще. В митохондриях терминальный мембранный комплекс ( комплекс IV ) представляет собой цитохромоксидазу, которая окисляет цитохром. Аэробные бактерии используют ряд различных терминальных оксидаз. Например, E. coli ( факультативный анаэроб) не имеет цитохромоксидазы или комплекса bc 1. В аэробных условиях она использует две различные терминальные хинолоксидазы (обе протонные насосы) для восстановления кислорода до воды.
Бактериальные терминальные оксидазы можно разделить на классы в соответствии с тем, какие молекулы действуют как терминальные акцепторы электронов. Оксидазы класса I являются цитохромоксидазами и используют кислород в качестве терминального акцептора электронов. Оксидазы класса II являются хинолоксидазами и могут использовать различные терминальные акцепторы электронов. Оба эти класса можно подразделить на категории в зависимости от того, какие окислительно-восстановительно-активные компоненты они содержат. Например, терминальные оксидазы класса 1 Heme aa3 намного эффективнее терминальных оксидаз класса 2. [2]
В анаэробных средах в основном используются различные акцепторы электронов, включая нитрат, нитрит, трехвалентное железо, сульфат, углекислый газ и небольшие органические молекулы, такие как фумарат. Когда бактерии растут в анаэробных средах, конечный акцептор электронов восстанавливается ферментом, называемым редуктазой. E. coli может использовать фумаратредуктазу, нитратредуктазу, нитритредуктазу, ДМСО-редуктазу или триметиламин-N-оксидредуктазу в зависимости от доступности этих акцепторов в среде.
Большинство терминальных оксидаз и редуктаз являются индуцируемыми . Они синтезируются организмом по мере необходимости, в ответ на определенные условия окружающей среды.
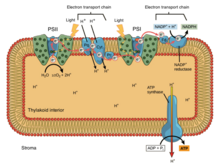
При окислительном фосфорилировании электроны переносятся от донора электронов, такого как НАДН, к акцептору, такому как О2 , через цепь переноса электронов, высвобождая энергию. При фотофосфорилировании энергия солнечного света используется для создания высокоэнергетического донора электронов, который впоследствии может восстанавливать окисленные компоненты и связываться с синтезом АТФ посредством транслокации протонов цепью переноса электронов. [9]
Фотосинтетические цепи переноса электронов, как и митохондриальная цепь, можно рассматривать как особый случай бактериальных систем. Они используют подвижные, жирорастворимые переносчики хинонов ( филлохинон и пластохинон ) и подвижные, водорастворимые переносчики ( цитохромы ). Они также содержат протонный насос . Протонный насос во всех фотосинтетических цепях напоминает митохондриальный комплекс III . Общепринятая теория симбиогенеза предполагает, что обе органеллы произошли от бактерий.
{{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite book}}: |journal=проигнорировано ( помощь )