Ацетальдегид (систематическое название ИЮПАК этаналь ) — органическое химическое соединение с формулой CH 3 CH=O , иногда сокращенно Me CH=O . Это бесцветная жидкость или газ, кипящий при температуре, близкой к комнатной. Это один из важнейших альдегидов , широко встречающийся в природе и производимый в больших масштабах в промышленности. Ацетальдегид встречается в природе в кофе, хлебе и спелых фруктах [11] и вырабатывается растениями. Он также вырабатывается путем частичного окисления этанола ферментом печени алкогольдегидрогеназой и является одной из причин похмелья после употребления алкоголя . [12] Пути воздействия включают воздух, воду, землю или грунтовые воды, а также питье и курение. [13] Потребление дисульфирама ингибирует ацетальдегиддегидрогеназу — фермент, отвечающий за метаболизм ацетальдегида, тем самым вызывая его накопление в организме.
Международное агентство по изучению рака (МАИР) включило ацетальдегид в список канцерогенов Группы 1. [14] Ацетальдегид является «одним из наиболее часто встречающихся в воздухе токсинов с риском возникновения рака более одного на миллион». [ 15]
Ацетальдегид был впервые обнаружен шведским фармацевтом/химиком Карлом Вильгельмом Шееле (1774); [16] затем его исследовали французские химики Антуан Франсуа, граф де Фуркрой и Луи Николя Воклен (1800), [17] и немецкие химики Иоганн Вольфганг Дёберейнером (1821, 1822, 1832) [18] и Юстус фон Либих (1835). [19] [20] В 1835 году Либих назвал его «альдегидом»; [21] позже название было изменено на «ацетальдегид». [22]
В 2013 году мировое производство составило около 438 тысяч тонн. [23] До 1962 года основными источниками ацетальдегида были этанол и ацетилен . С тех пор этилен является доминирующим сырьем . [24]
Основным методом производства является окисление этилена по процессу Ваккера , который включает окисление этилена с использованием гомогенной каталитической системы палладий/медь:
В 1970-х годах мировая мощность процесса прямого окисления Wacker-Hoechst превышала 2 миллиона тонн в год.
Меньшие количества могут быть получены путем частичного окисления этанола в экзотермической реакции. Этот процесс обычно проводится на серебряном катализаторе при температуре около 500–650 °C (932–1202 °F). [24]
Этот метод является одним из старейших способов промышленного получения ацетальдегида.
До появления процесса Вакера и доступности дешевого этилена ацетальдегид получали путем гидратации ацетилена . [25] Эта реакция катализируется солями ртути(II) :
Механизм включает промежуточное звено винилового спирта , который таутомеризуется в ацетальдегид. Реакция проводится при температуре 90–95 °C (194–203 °F), а образовавшийся ацетальдегид отделяется от воды и ртути и охлаждается до 25–30 °C (77–86 °F). В процессе мокрого окисления сульфат железа (III) используется для повторного окисления ртути обратно в соль ртути (II). Полученный сульфат железа (II) окисляется в отдельном реакторе азотной кислотой . [24]
Фермент ацетиленгидратаза, обнаруженный в строго анаэробной бактерии Pelobacter acetylenicus, может катализировать аналогичную реакцию без участия каких-либо соединений ртути. [26] Однако до сих пор он не был доведен до масштабного или коммерческого использования.
Традиционно ацетальдегид получали путем частичной дегидрирования этанола:
В этом эндотермическом процессе пары этанола пропускают при температуре 260–290 °C через катализатор на основе меди. Процесс был когда-то привлекателен из-за ценности побочного продукта водорода [24] , но в настоящее время он экономически невыгоден.
Гидроформилирование метанола с катализаторами, такими как соли кобальта, никеля или железа, также производит ацетальдегид, хотя этот процесс не имеет промышленного значения. Аналогично неконкурентоспособный, ацетальдегид возникает из синтез -газа с умеренной селективностью. [24]

Как и многие другие карбонильные соединения , ацетальдегид таутомеризуется с образованием енола ( винилового спирта ; название ИЮПАК: этенол):
Константа равновесия составляет 6 × 10−7 при комнатной температуре, поэтому относительное количество енольной формы в образце ацетальдегида очень мало. [ 27 ] При комнатной температуре ацетальдегид ( CH3CH =O ) более стабилен, чем виниловый спирт ( CH2 =CHOH ) на 42,7 кДж/моль: [28] В целом кето-енольная таутомеризация происходит медленно, но катализируется кислотами.
Фотоиндуцированная кето-енольная таутомеризация возможна в атмосферных или стратосферных условиях. Эта фототаутомеризация имеет отношение к атмосфере Земли, поскольку виниловый спирт считается предшественником карбоновых кислот в атмосфере. [29] [30]
Ацетальдегид является распространенным электрофилом в органическом синтезе . [31] В реакциях присоединения ацетальдегид является прохиральным . Он используется в основном как источник синтона « CH 3 C + H (OH) » в альдольных реакциях и связанных с ними реакциях конденсации . [32] Реактивы Гриньяра и литийорганические соединения реагируют с MeCHO, давая гидроксиэтилпроизводные . [33] В одной из наиболее впечатляющих реакций присоединения формальдегид в присутствии гидроксида кальция присоединяется к MeCHO, давая пентаэритрит , C(CH 2 OH) 4 и формиат . [34]
В реакции Штрекера ацетальдегид конденсируется с цианидом и аммиаком , давая после гидролиза аминокислоту аланин . [35] Ацетальдегид может конденсироваться с аминами , давая имины ; например, с циклогексиламином , давая N -этилиденциклогексиламин. Эти имины могут быть использованы для направления последующих реакций, таких как альдольная конденсация. [36]
Он также является строительным блоком в синтезе гетероциклических соединений . В одном примере он превращается при обработке аммиаком в 5-этил-2-метилпиридин («альдегид-коллидин»). [37]
Три молекулы ацетальдегида конденсируются с образованием « паральдегида », циклического тримера, содержащего одинарные связи CO. Аналогично конденсация четырех молекул ацетальдегида дает циклическую молекулу метальдегида . Паральдегид можно получить с хорошим выходом, используя катализатор серной кислоты. Метальдегид получается только с выходом в несколько процентов и при охлаждении, часто используя HBr вместо H 2 SO 4 в качестве катализатора. При −40 °C (−40 °F) в присутствии кислотных катализаторов образуется полиацетальдегид. [24] Существует два стереомера паральдегида и четыре метальдегида.
Немецкий химик Валентин Герман Вайденбуш (1821–1893) синтезировал паральдегид в 1848 году, обрабатывая ацетальдегид кислотой (серной или азотной) и охлаждая до 0 °C (32 °F). Он обнаружил весьма примечательный факт: когда паральдегид нагревали со следами той же кислоты, реакция шла в обратном направлении, воссоздавая ацетальдегид. [38]
Хотя виниловый спирт является полимерной формой ацетальдегида (§ Таутомеризация в виниловый спирт), поливиниловый спирт не может быть получен из ацетальдегида.
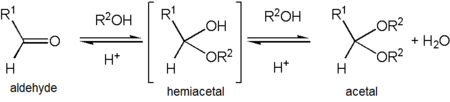
Ацетальдегид образует стабильный ацеталь при реакции с этанолом в условиях, благоприятствующих дегидратации. Продукт, CH 3 CH(OCH 2 CH 3 ) 2 , формально называется 1,1-диэтоксиэтаном, но обычно упоминается как «ацеталь». [39] Это может вызвать путаницу, поскольку «ацеталь» чаще используется для описания соединений с функциональными группами RCH(OR') 2 или RR'C(OR'') 2 , а не для обозначения этого конкретного соединения — на самом деле, 1,1-диэтоксиэтан также описывается как диэтилацеталь ацетальдегида.
Ацетальдегид является предшественником винилфосфоновой кислоты , которая используется для изготовления клеев и ионпроводящих мембран. Последовательность синтеза начинается с реакции с трихлоридом фосфора : [40]
В печени фермент алкогольдегидрогеназа окисляет этанол в ацетальдегид, который затем далее окисляется в безвредную уксусную кислоту ацетальдегиддегидрогеназой . Эти две реакции окисления сопряжены с восстановлением NAD + до NADH . [41] В мозге фермент каталаза в первую очередь отвечает за окисление этанола в ацетальдегид, а алкогольдегидрогеназа играет второстепенную роль. [41] Последние этапы спиртового брожения у бактерий, растений и дрожжей включают превращение пирувата в ацетальдегид и углекислый газ ферментом пируватдекарбоксилазой , за которым следует превращение ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, теперь действующей в противоположном направлении.
У многих жителей Восточной Азии есть мутация ALDH2 , которая делает их значительно менее эффективными в окислении ацетальдегида. При употреблении алкоголя их организм имеет тенденцию накапливать избыточное количество ацетальдегида, вызывая так называемую реакцию алкогольного покраснения . [42] У них появляется характерный румянец на лице и теле, а также «тошнота, головная боль и общий физический дискомфорт». [43] Прием препарата дисульфирам , который ингибирует ALDH2, приводит к аналогичной реакции. См. раздел #Провоцирующие факторы ниже. [44]
Традиционно ацетальдегид в основном использовался в качестве предшественника уксусной кислоты. Это применение сократилось, поскольку уксусная кислота производится более эффективно из метанола с помощью процессов Monsanto и Cativa . Ацетальдегид является важным предшественником производных пиридина , пентаэритрита и кротонового альдегида . Мочевина и ацетальдегид объединяются, чтобы дать полезную смолу . Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат , предшественник винилацетата , который используется для производства поливинилацетата . [24]
Мировой рынок ацетальдегида сокращается. На спрос повлияли изменения в производстве пластификаторных спиртов, которые сместились, поскольку н -масляный альдегид реже производится из ацетальдегида, вместо этого его получают путем гидроформилирования пропилена . Аналогично, уксусная кислота , когда-то производимая из ацетальдегида, производится преимущественно с помощью менее затратного процесса карбонилирования метанола. [45] Влияние на спрос привело к росту цен и, таким образом, замедлению рынка.

Китай является крупнейшим потребителем ацетальдегида в мире, на долю которого в 2012 году пришлось почти половина мирового потребления. Основным использованием было производство уксусной кислоты. Ожидается, что другие виды использования, такие как пиридины и пентаэритрит, будут расти быстрее, чем уксусная кислота, но объемы недостаточны, чтобы компенсировать снижение уксусной кислоты. Как следствие, общее потребление ацетальдегида в Китае может немного вырасти на 1,6% в год до 2018 года. Западная Европа является вторым по величине потребителем ацетальдегида в мире, на долю которого в 2012 году пришлось 20% мирового потребления. Как и в случае с Китаем, ожидается, что рынок ацетальдегида в Западной Европе будет расти лишь очень незначительно на 1% в год в течение 2012–2018 годов. Однако Япония может стать потенциальным потребителем ацетальдегида в ближайшие пять лет из-за нового использования в коммерческом производстве бутадиена . Поставки бутадиена были нестабильными в Японии и остальной Азии. Это должно обеспечить столь необходимый импульс для плоского рынка с 2013 года. [46]
Пороговое предельное значение составляет 25 ppm (STEL/потолок), а MAK (максимальная концентрация на рабочем месте) составляет 50 ppm. При концентрации ацетальдегида 50 ppm не наблюдается раздражения или локального повреждения тканей слизистой оболочки носа . При попадании в организм ацетальдегид быстро метаболизируется в печени в уксусную кислоту. Только небольшая часть выдыхается в неизмененном виде. После внутривенной инъекции период полураспада в крови составляет приблизительно 90 секунд. [24]
Зафиксировано много серьезных случаев острой интоксикации. [24] Ацетальдегид естественным образом распадается в организме человека. [13] [47]
Ацетальдегид является раздражителем кожи, глаз, слизистых оболочек, горла и дыхательных путей. Это происходит при концентрациях всего 1000 ppm. Симптомы воздействия этого соединения включают тошноту , рвоту и головную боль . Эти симптомы могут проявиться не сразу. Порог восприятия ацетальдегида в воздухе находится в диапазоне от 0,07 до 0,25 ppm. [24] При таких концентрациях становится очевидным фруктовый запах ацетальдегида. Раздражение конъюнктивы наблюдалось после 15-минутного воздействия концентраций 25 и 50 ppm, но транзиторный конъюнктивит и раздражение дыхательных путей были зарегистрированы после воздействия 200 ppm ацетальдегида в течение 15 минут.
Ацетальдегид является канцерогенным для человека. [48] [49] В 1988 году Международное агентство по изучению рака заявило: «Имеется достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) у экспериментальных животных ». [50] В октябре 2009 года Международное агентство по изучению рака обновило классификацию ацетальдегида, заявив, что ацетальдегид, входящий в состав алкогольных напитков и вырабатываемый эндогенно из них , является человеческим канцерогеном группы I. [51] Кроме того, ацетальдегид повреждает ДНК [52] и вызывает аномальное развитие мышц, поскольку он связывается с белками. [53]
Ацетальдегид вызывает межцепочечные сшивки ДНК, форму повреждения ДНК. Их можно восстановить с помощью любого из двух путей репарации ДНК, связанных с репликацией. [54] Первый путь называется путем FA, поскольку он использует генные продукты, дефектные у пациентов с анемией Фанкони . Этот путь восстановления приводит к увеличению частоты мутаций и изменению спектра мутаций. [54] Второй путь восстановления требует конвергенции репликативной вилки, разрыва ацетальдегидной сшивки, синтеза транслезии ДНК-полимеразой Y-семейства и гомологичной рекомбинации. [54]
Люди с генетическим дефицитом фермента, ответственного за превращение ацетальдегида в уксусную кислоту, могут иметь больший риск болезни Альцгеймера . "Эти результаты показывают, что дефицит ALDH2 является фактором риска LOAD [болезни Альцгеймера с поздним началом] ..." [55]
Исследование 818 людей, злоупотребляющих алкоголем, показало, что те, кто подвергается воздействию большего количества ацетальдегида, чем обычно, через генетический вариант гена, кодирующего ADH1C , ADH1C*1, подвергаются большему риску развития рака верхних отделов желудочно-кишечного тракта и печени. [56]
Препарат дисульфирам (Антабус) ингибирует ацетальдегиддегидрогеназу, фермент, который окисляет соединение в уксусную кислоту. Метаболизм этанола образует ацетальдегид до того, как ацетальдегиддегидрогеназа образует уксусную кислоту, но при ингибировании фермента ацетальдегид накапливается. Если человек потребляет этанол во время приема дисульфирама, похмельный эффект этанола ощущается быстрее и интенсивнее ( реакция дисульфирам-алкоголь ). Таким образом, дисульфирам иногда используется в качестве сдерживающего средства для алкоголиков, желающих оставаться трезвыми. [44]
Ацетальдегид является потенциальным загрязнителем на рабочем месте, в помещениях и окружающей среде. Более того, большинство людей проводят более 90% своего времени в помещениях, что увеличивает любое воздействие и риск для здоровья человека. [57]
В исследовании во Франции средняя внутренняя концентрация ацетальдегидов, измеренная в 16 домах, была примерно в семь раз выше, чем внешняя концентрация ацетальдегида. В гостиной средний показатель составил 18,1±17,5 мкг·м −3 , а в спальне — 18,2±16,9 мкг·м −3 , тогда как наружный воздух имел среднюю концентрацию 2,3±2,6 мкг·м −3 . [ требуется цитата ]
Был сделан вывод, что летучие органические соединения (ЛОС), такие как бензол, формальдегид, ацетальдегид, толуол и ксилолы, должны считаться приоритетными загрязнителями с точки зрения их воздействия на здоровье. Было отмечено, что в отремонтированных или полностью новых зданиях уровни концентрации ЛОС часто на несколько порядков выше. Основными источниками ацетальдегидов в домах являются строительные материалы, ламинат, полы из ПВХ, лакированные деревянные полы и лакированные пробковые/сосновые полы (находятся в лаке, а не в древесине). Он также находится в пластике, масляных и водных красках, в композитных деревянных потолках, ДСП, фанере, обработанной сосновой древесине и мебели из ламинированной ДСП. [58]
Использование ацетальдегида широко распространено в различных отраслях промышленности, и он может выбрасываться в сточные воды или воздух во время производства, использования, транспортировки и хранения. Источниками ацетальдегида являются выбросы от сгорания топлива стационарными двигателями внутреннего сгорания и электростанциями, которые сжигают ископаемое топливо, древесину или мусор, добыча нефти и газа, нефтеперерабатывающие заводы, цементные печи, лесопильные и деревообрабатывающие заводы и бумажные фабрики. [59] Ацетальдегид также присутствует в выхлопных газах автомобилей и дизельных двигателей . [60] В результате ацетальдегид является «одним из наиболее часто встречающихся токсичных веществ в воздухе с риском возникновения рака, превышающим один на миллион». [15]
Было показано, что природные полисахариды табака , включая целлюлозу , являются основными предшественниками, делающими ацетальдегид важным компонентом табачного дыма . [61] [62] Было показано, что он оказывает синергетический эффект с никотином в исследованиях зависимости на грызунах . [ 63 ] [64] Ацетальдегид также является наиболее распространенным канцерогеном в табачном дыме; он растворяется в слюне во время курения.
Ацетальдегид был обнаружен в дыме каннабиса . Это открытие было сделано благодаря использованию новых химических методов, которые продемонстрировали, что присутствующий ацетальдегид вызывает повреждение ДНК в лабораторных условиях. [65]
Многие микробы производят ацетальдегид из этанола, но они обладают более низкой способностью устранять ацетальдегид, что может привести к накоплению ацетальдегида в слюне, желудочной кислоте и содержимом кишечника. Ферментированная пища и многие алкогольные напитки также могут содержать значительное количество ацетальдегида. Ацетальдегид, полученный в результате мукозального или микробного окисления этанола, табачного дыма и диеты, по-видимому, действует как кумулятивный канцероген в верхнем пищеварительном тракте человека. [66] Согласно «Мнению об ацетальдегиде» Научного комитета Европейской комиссии по безопасности потребителей (SCCS) (2012), предел особого риска для косметических продуктов составляет 5 мг/л, и ацетальдегид не следует использовать в средствах для полоскания рта . [67]
Ацетальдегид может быть получен путем фотоокисления полиэтилентерефталата (ПЭТ) посредством реакции Норриша типа II . [ 68]
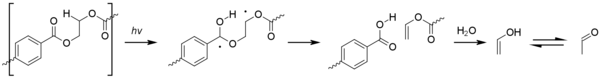
Хотя уровни, получаемые в результате этого процесса, незначительны, ацетальдегид имеет чрезвычайно низкий порог вкуса/запаха , около 20–40 ppb, и может вызывать неприятный привкус в бутилированной воде. [69] Уровень, при котором среднестатистический потребитель может обнаружить ацетальдегид, все еще значительно ниже любой токсичности. [70]
Было показано, что Candida albicans у пациентов с потенциально канцерогенными заболеваниями полости рта вырабатывает ацетальдегид в количествах, достаточных для возникновения проблем. [71]
Je le décrirai dans ce mémoire sous le nom
d'aldehyde
; это название
дегидрогенатного спирта
. [В этих мемуарах я опишу его под названием
альдегид
; это название образовано от
спирта дегидрогенатус
.]
рынок ацетальдегида в 2013 году составлял 438 тысяч тонн.