Масляная кислота ( / ˈ b j uː t ɪ r ɪ k / ; от древнегреческого : βούτῡρον , что означает «масло»), также известная под систематическим названием бутановая кислота , является алкилкарбоновой кислотой с прямой цепью с химической формулой CH 3 CH 2 CH 2 CO 2 H . Это маслянистая, бесцветная жидкость с неприятным запахом . Изомасляная кислота (2-метилпропановая кислота) является изомером . Соли и эфиры масляной кислоты известны как бутираты или бутаноаты . Кислота не встречается широко в природе, но ее эфиры широко распространены. Это распространенный промышленный химикат [7] и важный компонент в кишечнике млекопитающих.
Масляная кислота была впервые обнаружена в неочищенном виде в 1814 году французским химиком Мишелем Эженом Шеврёлем . К 1818 году он очистил её достаточно, чтобы охарактеризовать. Однако Шеврёль не опубликовал свои ранние исследования масляной кислоты; вместо этого он передал свои выводы в виде рукописи секретарю Академии наук в Париже, Франция. Анри Браконно , французский химик, также исследовал состав масла и публиковал свои выводы, что привело к спорам о приоритете. Еще в 1815 году Шеврёль утверждал, что он нашёл вещество, ответственное за запах масла. [8] К 1817 году он опубликовал некоторые из своих выводов относительно свойств масляной кислоты и дал ей название. [9] Однако только в 1823 году он подробно представил свойства масляной кислоты. [10] Название масляная кислота происходит от βούτῡρον , что означает «масло», субстанции, в которой она была впервые обнаружена. Латинское название butyrum (или buturum ) похоже.
Триглицериды масляной кислоты составляют 3–4% масла . Когда масло прогоркает, масляная кислота высвобождается из глицерида путем гидролиза . [11] Это одна из подгруппы жирных кислот, называемых короткоцепочечными жирными кислотами . Масляная кислота является типичной карбоновой кислотой , которая реагирует с основаниями и влияет на многие металлы. [12] Она содержится в животном жире и растительных маслах , коровьем молоке , грудном молоке , сливочном масле , сыре пармезан , запахе тела , рвоте и как продукт анаэробной ферментации (в том числе в толстой кишке ). [13] [14] Она имеет вкус, немного похожий на сливочное масло, и неприятный запах . Млекопитающие с хорошими способностями к обнаружению запаха, такие как собаки , могут обнаружить ее при 10 частях на миллиард , тогда как люди могут обнаружить ее только в концентрациях выше 10 частей на миллион . В производстве продуктов питания она используется в качестве ароматизатора . [15]
У людей масляная кислота является одним из двух основных эндогенных агонистов человеческого рецептора гидроксикарбоновой кислоты 2 ( HCA 2 ), рецептора, связанного с G-белком, сопряженным с G i/o . [16] [17]
Масляная кислота присутствует в виде октилового эфира в пастернаке ( Pastinaca sativa ) [18] и в семенах дерева гинкго . [19]
В промышленности масляную кислоту получают путем гидроформилирования из пропена и синтез-газа , образуя масляный альдегид , который окисляется до конечного продукта. [7]
Его можно отделить от водных растворов путем насыщения солями, такими как хлорид кальция . Соль кальция, Ca( C4H7O2 ) 2 · H2O , менее растворима в горячей воде, чем в холодной .
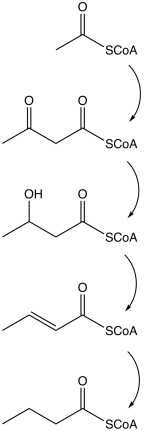
Бутират производится несколькими процессами ферментации, выполняемыми облигатными анаэробными бактериями . [20] Этот путь ферментации был открыт Луи Пастером в 1861 году. Примеры видов бактерий, продуцирующих бутират:
Путь начинается с гликолитического расщепления глюкозы до двух молекул пирувата , как это происходит в большинстве организмов. Пируват окисляется до ацетил кофермента А, катализируемого пируват: ферредоксин оксидоредуктазой . В качестве отходов образуются две молекулы углекислого газа ( CO2 ) и две молекулы водорода ( H2 ). Впоследствии на последнем этапе ферментации образуется АТФ . На каждую молекулу глюкозы образуется три молекулы АТФ, что является относительно высоким выходом. Сбалансированное уравнение для этой ферментации имеет вид
Другие пути образования бутирата включают восстановление сукцината и диспропорционирование кротоната.
Несколько видов образуют ацетон и н -бутанол в альтернативном пути, который начинается как брожение бутирата. Некоторые из этих видов:
Эти бактерии начинают с брожения бутирата, как описано выше, но когда pH падает ниже 5, они переключаются на производство бутанола и ацетона, чтобы предотвратить дальнейшее снижение pH. На каждую молекулу ацетона образуется две молекулы бутанола.
Изменение пути происходит после образования ацетоацетил-КоА. Этот промежуточный продукт затем идет по двум возможным путям:
В коммерческих целях виды Clostridium используются преимущественно для производства масляной кислоты или бутанола. Наиболее распространенным видом, используемым для пробиотиков, является Clostridium butyricum . [21]
Остатки высокоферментируемых волокон, такие как остатки резистентного крахмала , овсяных отрубей , пектина и гуара , преобразуются бактериями толстой кишки в короткоцепочечные жирные кислоты (SCFA), включая бутират, производя больше SCFA, чем менее ферментируемые волокна, такие как целлюлоза . [14] [22] Одно исследование показало, что резистентный крахмал последовательно производит больше бутирата, чем другие типы пищевых волокон . [23] Производство SCFA из волокон у жвачных животных, таких как крупный рогатый скот, отвечает за содержание бутирата в молоке и масле. [13] [24]
Фруктаны являются еще одним источником пребиотических растворимых пищевых волокон, которые могут перевариваться с образованием бутирата. [25] Они часто встречаются в растворимых волокнах продуктов с высоким содержанием серы , таких как лук и крестоцветные овощи . Источниками фруктанов являются пшеница (хотя некоторые штаммы пшеницы , такие как полба, содержат меньшее количество), [26] рожь , ячмень , лук , чеснок , топинамбур , спаржа , свекла , цикорий , листья одуванчика , лук-порей , радиккио , белая часть зеленого лука , брокколи , брюссельская капуста , белокочанная капуста , фенхель и пребиотики , такие как фруктоолигосахариды ( ФОС ), олигофруктоза и инулин . [27] [28]
Масляная кислота реагирует как типичная карбоновая кислота: она может образовывать амидные , эфирные , ангидридные и хлоридные производные. [29] Последний, бутирилхлорид , обычно используется в качестве промежуточного продукта для получения других.
Масляная кислота используется для приготовления различных эфиров бутирата. Она используется для производства ацетата бутирата целлюлозы (CAB), который используется в самых разных инструментах, красках и покрытиях и более устойчив к деградации, чем ацетат целлюлозы . [30] CAB может деградировать под воздействием тепла и влаги, выделяя масляную кислоту. [31]
Низкомолекулярные эфиры масляной кислоты, такие как метилбутират , имеют в основном приятные ароматы или вкусы. [7] Как следствие, они используются в качестве пищевых и парфюмерных добавок. Это одобренный пищевой ароматизатор в базе данных ЕС FLAVIS (номер 08.005).
Из-за своего сильного запаха он также использовался в качестве добавки к рыболовной приманке. [32] Многие из имеющихся в продаже ароматизаторов, используемых в приманках для карпа ( Cyprinus carpio ), используют масляную кислоту в качестве эфирной основы. Неясно, привлекает ли рыбу сама масляная кислота или вещества, добавленные к ней. Масляная кислота была одной из немногих органических кислот, которые, как было показано, были вкусными как для линя , так и для горчака . [33] Это вещество использовалось в качестве вонючей бомбы Обществом охраны морской фауны «Морской пастух», чтобы помешать японским китобойным командам. [34]
Масляная кислота (pK a 4,82) полностью ионизирована при физиологическом pH , поэтому ее анион является материалом, который в основном актуален в биологических системах. Это один из двух основных эндогенных агонистов человеческого рецептора гидроксикарбоновой кислоты 2 ( HCA 2 , также известного как GPR109A), G i/o - связанного рецептора, связанного с G-белком (GPCR), [16] [17]
Как и другие короткоцепочечные жирные кислоты (SCFA), бутират является агонистом рецепторов свободных жирных кислот FFAR2 и FFAR3 , которые функционируют как сенсоры питательных веществ, которые облегчают гомеостатический контроль энергетического баланса ; однако среди группы SCFA только бутират является агонистом HCA 2. [37] [38] [39] Он также является ингибитором HDAC (в частности, HDAC1, HDAC2, HDAC3 и HDAC8), [35] [ 36] препаратом, который ингибирует функцию ферментов гистондеацетилазы , тем самым способствуя ацетилированному состоянию гистонов в клетках. [39] Ацетилирование гистонов ослабляет структуру хроматина , уменьшая электростатическое притяжение между гистонами и ДНК . [39] В целом считается, что факторы транскрипции не смогут получить доступ к областям, где гистоны тесно связаны с ДНК (т. е. неацетилированным, например, гетерохроматину). [ необходима медицинская цитата ] Поэтому считается, что масляная кислота усиливает транскрипционную активность на промоторах, [39] которые обычно подавляются или подавляются из-за активности гистондеацетилазы.
Бутират, который вырабатывается в толстой кишке посредством микробной ферментации пищевых волокон, в первую очередь поглощается и метаболизируется колоноцитами и печенью [примечание 1] для генерации АТФ во время энергетического метаболизма; однако некоторая часть бутирата поглощается в дистальном отделе толстой кишки, который не соединен с воротной веной, тем самым обеспечивая системное распределение бутирата в несколько систем органов через кровеносную систему. [39] [40] Бутират, который достиг системного кровообращения, может легко пересекать гематоэнцефалический барьер с помощью монокарбоксилатных транспортеров (т. е. определенных членов группы транспортеров SLC16A ). [41] [42] Другие транспортеры, которые опосредуют прохождение бутирата через липидные мембраны, включают SLC5A8 (SMCT1), SLC27A1 (FATP1) и SLC27A4 (FATP4). [35] [42]
Масляная кислота метаболизируется различными XM-лигазами человека (ACSM1, ACSM2B, ASCM3, ACSM4, ACSM5 и ACSM6), также известными как бутират-КоА-лигаза. [43] [44] Метаболит, образующийся в результате этой реакции, представляет собой бутирил-КоА и образуется следующим образом: [43]
Как короткоцепочечная жирная кислота , бутират метаболизируется митохондриями в качестве источника энергии (т. е. аденозинтрифосфата или АТФ) посредством метаболизма жирных кислот . [39] В частности, он является важным источником энергии для клеток, выстилающих толстую кишку млекопитающих (колоноцитов). [25] Без бутиратов клетки толстой кишки подвергаются аутофагии (т. е. самоперевариванию) и погибают. [45]
У людей предшественник бутирата трибутирин , который естественным образом присутствует в сливочном масле, метаболизируется триацилглицероллипазой в дибутирин и бутират посредством реакции: [46]
Бутират оказывает многочисленные эффекты на энергетический гомеостаз и связанные с ним заболевания ( диабет и ожирение ), воспаление и иммунную функцию (например, он имеет выраженные антимикробные и антиканцерогенные эффекты) у людей. Эти эффекты происходят через его метаболизм митохондриями для генерации АТФ во время метаболизма жирных кислот или через одну или несколько его гистон-модифицирующих ферментных целей (например, гистондеацетилазы класса I ) и рецепторных целей, сопряженных с G-белком (например, FFAR2 , FFAR3 и HCA 2 ). [37] [47]
Бутират необходим для иммунного гомеостаза хозяина. [37] Хотя роль и значение бутирата в кишечнике до конца не изучены, многие исследователи утверждают, что истощение бактерий, продуцирующих бутират, у пациентов с несколькими васкулитными состояниями имеет важное значение для патогенеза этих расстройств. Истощение бутирата в кишечнике обычно вызвано отсутствием или истощением бактерий, продуцирующих бутират (БПБ). Это истощение БПБ приводит к микробному дисбактериозу . Это характеризуется общим низким биоразнообразием и истощением ключевых членов, продуцирующих бутират. Бутират является важным микробным метаболитом, играющим жизненно важную роль в качестве модулятора надлежащей иммунной функции у хозяина. Было показано, что дети, у которых отсутствует БПБ, более восприимчивы к аллергическим заболеваниям [48] и диабету 1 типа. [49] Уровень бутирата также снижается в диете с низким содержанием пищевых волокон , что может вызвать воспаление и иметь другие неблагоприятные последствия, поскольку эти короткоцепочечные жирные кислоты активируют PPAR-γ . [50]
Бутират играет ключевую роль в поддержании иммунного гомеостаза как локально (в кишечнике), так и системно (через циркулирующий бутират). Было показано, что он способствует дифференциации регуляторных Т-клеток . В частности, циркулирующий бутират стимулирует генерацию экстратимических регуляторных Т-клеток. Низкие уровни бутирата у людей могут способствовать снижению контроля, опосредованного регуляторными Т-клетками, тем самым способствуя мощному иммунопатологическому ответу Т-клеток. [51] С другой стороны, сообщалось, что кишечный бутират ингибирует местные провоспалительные цитокины. Следовательно, отсутствие или истощение этих BPB в кишечнике может быть возможным помощником в чрезмерно активной воспалительной реакции. Бутират в кишечнике также защищает целостность кишечного эпителиального барьера. Таким образом, сниженные уровни бутирата приводят к повреждению или дисфункции кишечного эпителиального барьера. [52] Снижение уровня бутирата также было связано с пролиферацией Clostridioides difficile . Напротив, диета с высоким содержанием клетчатки приводит к повышению концентрации масляной кислоты и ингибированию роста C. difficile . [53]
В исследовании 2013 года, проведенном Фурусавой и соавторами, было обнаружено, что микробный бутират необходим для индукции дифференциации регуляторных Т-клеток толстой кишки у мышей. Это имеет большое значение и, возможно, имеет отношение к патогенезу и васкулиту, связанным со многими воспалительными заболеваниями, поскольку регуляторные Т-клетки играют центральную роль в подавлении воспалительных и аллергических реакций. [54] В нескольких научных исследованиях было показано, что бутират индуцирует дифференциацию регуляторных Т-клеток in vitro и in vivo. [55] Противовоспалительная способность бутирата была тщательно проанализирована и подтверждена многими исследованиями. Было обнаружено, что продуцируемый микроорганизмами бутират ускоряет выработку регуляторных Т-клеток, хотя конкретный механизм, с помощью которого он это делает, неясен. [56] Совсем недавно было показано, что бутират играет существенную и прямую роль в модуляции экспрессии генов цитотоксических Т-клеток. [57] Бутират также оказывает противовоспалительное действие на нейтрофилы, уменьшая их миграцию в раны. Этот эффект опосредован через рецептор HCA 1 . [58]
В микробиомах кишечника, обнаруженных в классе млекопитающих, всеядные и травоядные животные имеют сообщества бактерий, продуцирующих бутират, в которых доминирует путь бутирил-КоА:ацетат-КоА-трансферазы, тогда как плотоядные имеют сообщества бактерий, продуцирующих бутират, в которых доминирует путь бутираткиназы. [59]
Запах масляной кислоты, исходящий от сальных фолликулов всех млекопитающих, действует на клеща как сигнал.
Влияние бутирата на иммунную систему опосредовано ингибированием гистондеацетилаз класса I и активацией его рецепторных мишеней, сопряженных с G-белком : HCA 2 (GPR109A), FFAR2 (GPR43) и FFAR3 (GPR41). [38] [60] Среди короткоцепочечных жирных кислот бутират является наиболее мощным стимулятором кишечных регуляторных Т-клеток in vitro и единственным среди группы, который является лигандом HCA 2. [38] Было показано, что он является критическим медиатором воспалительного ответа толстой кишки. Он обладает как профилактическим, так и терапевтическим потенциалом для противодействия язвенному колиту и колоректальному раку , вызванным воспалением .
Бутират установил антимикробные свойства у людей, которые опосредованы антимикробным пептидом LL-37 , который он индуцирует посредством ингибирования HDAC на гистоне H3. [60] [61] [62] In vitro бутират увеличивает экспрессию гена FOXP3 ( регулятора транскрипции для Tregs ) и стимулирует регуляторные Т-клетки толстой кишки (Tregs) посредством ингибирования гистондеацетилаз класса I ; [38] [60] посредством этих действий он увеличивает экспрессию интерлейкина 10 , противовоспалительного цитокина . [60] [38] Бутират также подавляет воспаление толстой кишки, ингибируя сигнальные пути IFN-γ – STAT1 , что частично опосредовано посредством ингибирования гистондеацетилазы . В то время как временная сигнализация IFN-γ обычно связана с нормальным иммунным ответом хозяина , хроническая сигнализация IFN-γ часто связана с хроническим воспалением. Было показано, что бутират ингибирует активность HDAC1, связанного с промотором гена Fas в Т-клетках, что приводит к гиперацетилированию промотора Fas и повышению регуляции рецептора Fas на поверхности Т-клеток. [63]
Подобно другим изученным агонистам HCA 2 , бутират также оказывает выраженное противовоспалительное действие на различные ткани, включая мозг, желудочно-кишечный тракт, кожу и сосудистую ткань . [64] [65] [66] Связывание бутирата с FFAR3 вызывает высвобождение нейропептида Y и способствует функциональному гомеостазу слизистой оболочки толстой кишки и энтеральной иммунной системы. [67]
Было показано, что бутират является критическим медиатором воспалительной реакции толстой кишки. Он отвечает за около 70% энергии из колоноцитов, являясь критическим SCFA в гомеостазе толстой кишки . [68] Бутират обладает как профилактическим, так и терапевтическим потенциалом для противодействия опосредованному воспалением язвенному колиту (ЯК) и колоректальному раку . [69] Он оказывает разное действие на здоровые и раковые клетки: это известно как «парадокс бутирата». В частности, бутират ингибирует клетки опухоли толстой кишки и стимулирует пролиферацию здоровых эпителиальных клеток толстой кишки. [70] [71] Объяснением того, почему бутират является источником энергии для нормальных колоноцитов и вызывает апоптоз в клетках рака толстой кишки , является эффект Варбурга в раковых клетках, который приводит к тому, что бутират не метаболизируется должным образом. Это явление приводит к накоплению бутирата в ядре, действуя как ингибитор гистондеацетилазы (HDAC). [72] Одним из механизмов, лежащих в основе функции бутирата в подавлении воспаления толстой кишки, является ингибирование сигнальных путей IFN-γ / STAT1 . Было показано, что бутират ингибирует активность HDAC1 , которая связана с промотором гена Fas в Т-клетках , что приводит к гиперацетилированию промотора Fas и повышению регуляции рецептора Fas на поверхности Т-клеток. Таким образом, предполагается, что бутират усиливает апоптоз Т-клеток в ткани толстой кишки и тем самым устраняет источник воспаления (продукцию IFN-γ). [73] Бутират ингибирует ангиогенез , инактивируя активность фактора транскрипции Sp1 и снижая экспрессию гена фактора роста эндотелия сосудов . [74]
Подводя итог, можно сказать, что производство летучих жирных кислот , таких как бутират, из ферментируемых волокон может способствовать роли пищевых волокон в раке толстой кишки. Короткоцепочечные жирные кислоты , включая масляную кислоту, вырабатываются полезными бактериями толстой кишки ( пробиотиками ), которые питаются или ферментируют пребиотики, представляющие собой растительные продукты, содержащие пищевые волокна. Эти короткоцепочечные жирные кислоты приносят пользу колоноцитам, увеличивая выработку энергии, и могут защищать от рака толстой кишки, подавляя пролиферацию клеток. [22]
Напротив, некоторые исследователи пытались исключить бутират и считали его потенциальным фактором, способствующим развитию рака. [75] Исследования на мышах показывают, что он стимулирует трансформацию эпителиальных клеток толстой кишки с дефицитом MSH2 . [76]
В связи с важностью бутирата как регулятора воспаления и фактора, способствующего иммунной системе, истощение бутирата может быть ключевым фактором, влияющим на патогенез многих васкулитных состояний. Таким образом, крайне важно поддерживать здоровый уровень бутирата в кишечнике. Трансплантация фекальной микробиоты (для восстановления BPB и симбиоза в кишечнике) может быть эффективной за счет восполнения уровня бутирата. При этом лечении здоровый человек сдает свой стул для трансплантации человеку с дисбактериозом. Менее инвазивным вариантом лечения является введение бутирата — в виде пероральных добавок или клизм — которое, как было показано, очень эффективно для прекращения симптомов воспаления с минимальными побочными эффектами или без них. В исследовании, где пациентов с язвенным колитом лечили клизмами с бутиратом, воспаление значительно уменьшилось, а кровотечение полностью прекратилось после введения бутирата. [77]
Масляная кислота является HDACИнгибитор, селективный для HDAC класса I у людей. [35] HDAC — это ферменты, модифицирующие гистоны , которые могут вызывать деацетилирование гистонов и подавление экспрессии генов. HDAC — важные регуляторы синаптического образования, синаптической пластичности и формирования долговременной памяти . Известно, что HDAC класса I участвуют в опосредовании развития зависимости . [ 78] [79] [80] Масляная кислота и другие ингибиторы HDAC использовались в доклинических исследованиях для оценки транскрипционных, нейронных и поведенческих эффектов ингибирования HDAC у животных, зависимых от наркотиков. [80] [81] [82]
Бутират или бутаноат- ион , C 3 H 7 C O O − , является сопряженным основанием масляной кислоты. Это форма, встречающаяся в биологических системах при физиологическом pH . Масляное (или бутановое) соединение представляет собой карбоксилатную соль или эфир масляной кислоты.
В этой статье использован текст из публикации, которая сейчас находится в общественном достоянии : Chisholm, Hugh , ed. (1911). «Масляная кислота». Encyclopaedia Britannica (11-е изд.). Cambridge University Press.
Короткоцепочечные жирные кислоты (SCFA), такие как ацетат, бутират и пропионат, которые вырабатываются при микробной ферментации пищевых волокон в кишечнике, признаются основными источниками энергии хозяина и действуют как молекулы передачи сигнала через рецепторы, сопряженные с G-белком (FFAR2, FFAR3, OLFR78, GPR109A), а также как эпигенетические регуляторы экспрессии генов путем ингибирования гистондеацетилазы (HDAC). Последние данные свидетельствуют о том, что пищевые волокна и короткоцепочечные жирные кислоты, полученные из кишечной микрофлоры, оказывают множественное благотворное воздействие на энергетический обмен организма хозяина не только за счет улучшения кишечной среды, но и за счет прямого воздействия на различные периферические ткани организма хозяина.
средняя и нижняя ректальные вены дренируют нижнюю часть прямой кишки, а венозная кровь возвращается в нижнюю полую вену. Поэтому препараты, абсорбированные в последней системе, будут доставляться преимущественно в системный кровоток, минуя печень и избегая метаболизма первого прохода
Другие исследования in vivo в наших лабораториях показали, что несколько соединений, включая ацетат, пропионат, бутират, бензойную кислоту, салициловую кислоту, никотиновую кислоту и некоторые β-лактамные антибиотики, могут транспортироваться MCT через ГЭБ.
21
... Поглощение вальпроевой кислоты снижалось в присутствии жирных кислот со средней длиной цепи, таких как гексаноат, октаноат и деканоат, но не пропионата или бутирата, что указывает на то, что вальпроевая кислота поступает в мозг через транспортную систему для жирных кислот со средней длиной цепи, а не для жирных кислот с короткой цепью.
связаны с транспортом короткоцепочечных жирных кислот, таких как ацетат и формиат, которые затем метаболизируются в астроцитах [78]. ... SLC5A8 экспрессируется в нормальной ткани толстой кишки и функционирует как супрессор опухолей в толстой кишке человека, при этом подавление этого гена происходит при карциноме толстой кишки. Этот транспортер участвует в концентрированном поглощении бутирата и пирувата, образующихся в результате ферментации кишечными бактериями.
{{cite encyclopedia}}: |website=проигнорировано ( помощь )