Нейротрансмиттер — это сигнальная молекула, выделяемая нейроном для воздействия на другую клетку через синапс . Клетка, получающая сигнал, или целевая клетка, может быть другим нейроном, но также может быть железистой или мышечной клеткой . [1]
Нейротрансмиттеры высвобождаются из синаптических пузырьков в синаптическую щель , где они могут взаимодействовать с рецепторами нейротрансмиттеров на целевой клетке. Эффект нейротрансмиттера на целевую клетку определяется рецептором, с которым он связывается. Многие нейротрансмиттеры синтезируются из простых и многочисленных предшественников, таких как аминокислоты , которые легко доступны и часто требуют небольшого количества биосинтетических стадий для преобразования.
Нейротрансмиттеры необходимы для функционирования сложных нейронных систем. Точное количество уникальных нейротрансмиттеров у людей неизвестно, но их идентифицировано более 100. [2] К распространенным нейротрансмиттерам относятся глутамат , ГАМК , ацетилхолин , глицин и норадреналин .
Нейротрансмиттеры обычно синтезируются в нейронах и состоят из молекул-предшественников, которые в изобилии встречаются в клетке, или получены из них. Классы нейротрансмиттеров включают аминокислоты , моноамины и пептиды . Моноамины синтезируются путем изменения одной аминокислоты. Например, предшественником серотонина является аминокислота триптофан. Пептидные трансмиттеры, или нейропептиды, являются белковыми трансмиттерами, которые часто высвобождаются вместе с другими трансмиттерами, чтобы иметь модулирующий эффект. [3] Пуриновые нейротрансмиттеры, такие как АТФ, происходят из нуклеиновых кислот. Другие нейротрансмиттеры состоят из продуктов метаболизма, таких как оксид азота и оксид углерода . [ требуется ссылка ]

Нейротрансмиттеры обычно хранятся в синаптических пузырьках , сгруппированных близко к клеточной мембране на аксонном окончании пресинаптического нейрона. Однако некоторые нейротрансмиттеры, такие как метаболические газы оксид углерода и оксид азота, синтезируются и высвобождаются сразу после потенциала действия, не хранясь в пузырьках. [4]
Обычно нейротрансмиттер высвобождается в пресинаптическом окончании в ответ на электрический сигнал, называемый потенциалом действия в пресинаптическом нейроне. Однако низкий уровень «базового» высвобождения также происходит без электрической стимуляции. Нейротрансмиттеры высвобождаются в синаптическую щель и диффундируют через нее , где они связываются со специфическими рецепторами на мембране постсинаптического нейрона. [5]
После высвобождения в синаптическую щель нейротрансмиттеры диффундируют через синапс, где они могут взаимодействовать с рецепторами на целевой клетке. Эффект нейротрансмиттера зависит от идентичности рецепторов целевой клетки, присутствующих в синапсе. В зависимости от рецептора связывание нейротрансмиттеров может вызывать возбуждение , торможение или модуляцию постсинаптического нейрона. Более подробную информацию см. ниже. [ необходима цитата ]
Чтобы избежать постоянной активации рецепторов на постсинаптической или целевой клетке, нейротрансмиттеры должны быть удалены из синаптической щели. [6] Нейротрансмиттеры удаляются посредством одного из трех механизмов:
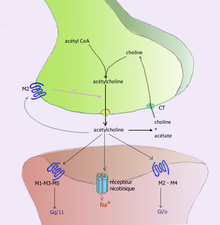
Например, ацетилхолин устраняется путем расщепления его ацетильной группы ферментом ацетилхолинэстеразой ; оставшийся холин затем принимается и перерабатывается пресинаптическим нейроном для синтеза большего количества ацетилхолина . [9] Другие нейротрансмиттеры способны диффундировать из целевых синаптических соединений и выводятся из организма через почки или разрушаются в печени. Каждый нейротрансмиттер имеет очень специфические пути деградации в регуляторных точках, которые могут быть нацелены регуляторной системой организма или лекарствами. Кокаин блокирует транспортер дофамина, ответственный за обратный захват дофамина. Без транспортера дофамин диффундирует из синаптической щели гораздо медленнее и продолжает активировать рецепторы дофамина на целевой клетке. [10]
До начала 20 века ученые предполагали, что большая часть синаптической коммуникации в мозге является электрической. Однако в ходе гистологических исследований Рамона-и-Кахаля был обнаружен зазор между нейронами размером от 20 до 40 нм, известный сегодня как синаптическая щель . Наличие такого зазора предполагало связь посредством химических посредников, пересекающих синаптическую щель, и в 1921 году немецкий фармаколог Отто Леви подтвердил, что нейроны могут общаться, выделяя химические вещества. Благодаря серии экспериментов с блуждающими нервами лягушек Леви смог вручную замедлить частоту сердечных сокращений лягушек, контролируя количество физиологического раствора, присутствующего вокруг блуждающего нерва. По завершении этого эксперимента Леви утверждал, что симпатическая регуляция сердечной функции может быть опосредована посредством изменения химических концентраций. Кроме того, Отто Леви приписывают открытие ацетилхолина (АХ) — первого известного нейромедиатора. [11]
Для идентификации нейротрансмиттеров обычно учитывают следующие критерии:
Однако, учитывая достижения фармакологии , генетики и химической нейроанатомии , термин «нейромедиатор» можно применять к химическим веществам, которые:
Анатомическая локализация нейротрансмиттеров обычно определяется с помощью иммуноцитохимических методов, которые идентифицируют местоположение либо самих веществ-трансмиттеров, либо ферментов, которые участвуют в их синтезе. Иммуноцитохимические методы также выявили, что многие трансмиттеры, особенно нейропептиды , локализованы совместно, то есть нейрон может высвобождать более одного трансмиттера из своего синаптического окончания . [13] Различные методы и эксперименты, такие как окрашивание , стимуляция и сбор, могут использоваться для идентификации нейротрансмиттеров по всей центральной нервной системе . [14]
Нейроны общаются друг с другом через синапсы , специализированные точки контакта, где нейротрансмиттеры передают сигналы. Когда потенциал действия достигает пресинаптического окончания , потенциал действия может вызвать высвобождение нейротрансмиттеров в синаптическую щель. Затем эти нейротрансмиттеры связываются с рецепторами на постсинаптической мембране, влияя на принимающий нейрон либо ингибирующим , либо возбуждающим образом. Если общие возбуждающие влияния перевешивают ингибирующие влияния, принимающий нейрон может генерировать свой собственный потенциал действия, продолжая передачу информации следующему нейрону в сети. Этот процесс обеспечивает поток информации и формирование сложных нейронных сетей. [15]
Нейротрансмиттер может оказывать возбуждающее, тормозящее или модулирующее действие на целевую клетку. Эффект определяется рецепторами, с которыми нейротрансмиттер взаимодействует на постсинаптической мембране. Нейротрансмиттер влияет на трансмембранный поток ионов, увеличивая (возбуждающий) или уменьшая (тормозящий) вероятность того, что клетка, с которой он контактирует, произведет потенциал действия. Синапсы, содержащие рецепторы с возбуждающим действием, называются синапсами типа I, в то время как синапсы типа II содержат рецепторы с тормозящим действием. [16] Таким образом, несмотря на большое разнообразие синапсов, все они передают сообщения только этих двух типов. Эти два типа имеют разный внешний вид и в основном расположены на разных участках нейронов, находящихся под их влиянием. [17] Рецепторы с модулирующим действием распространены по всем синаптическим мембранам, и связывание нейротрансмиттеров запускает сигнальные каскады, которые помогают клетке регулировать ее функцию. [18] Связывание нейротрансмиттеров с рецепторами с модуляторными эффектами может иметь много результатов. Например, это может привести к увеличению или уменьшению чувствительности к будущему стимулу путем привлечения большего или меньшего количества рецепторов к синаптической мембране.
Синапсы типа I (возбуждающие) обычно располагаются на валах или шипиках дендритов, тогда как синапсы типа II (тормозящие) обычно располагаются на теле клетки. Кроме того, синапсы типа I имеют круглые синаптические пузырьки, тогда как пузырьки синапсов типа II уплощенные. Материал на пресинаптических и постсинаптических мембранах более плотный в синапсе типа I, чем в синапсе типа II, а синаптическая щель типа I шире. Наконец, активная зона в синапсе типа I больше, чем в синапсе типа II.
Различное расположение синапсов типа I и типа II делит нейрон на две зоны: возбуждающее дендритное дерево и тормозное тело клетки. С тормозной точки зрения возбуждение поступает по дендритам и распространяется на аксонный холмик , чтобы вызвать потенциал действия . Если сообщение должно быть остановлено, лучше всего остановить его, применив торможение к телу клетки, близкому к аксонному холмику, где возникает потенциал действия. Другой способ концептуализации возбуждающе-тормозного взаимодействия — представить себе, как возбуждение преодолевает торможение. Если тело клетки обычно находится в тормозном состоянии, единственный способ сгенерировать потенциал действия на аксонном холмике — это уменьшить торможение тела клетки. В этой стратегии «открыть ворота» возбуждающее сообщение похоже на скаковую лошадь, готовую бежать по трассе, но сначала необходимо удалить тормозные стартовые ворота. [19]
Как объяснялось выше, единственным прямым действием нейротрансмиттера является активация рецептора. Поэтому эффекты нейротрансмиттерной системы зависят от связей нейронов, использующих трансмиттер, и химических свойств рецепторов.
Существует много различных способов классификации нейротрансмиттеров. Разделение их на аминокислоты , пептиды и моноамины достаточно для некоторых целей классификации. [27]
Основные нейромедиаторы:
Кроме того, было обнаружено более 100 нейроактивных пептидов , и регулярно обнаруживаются новые. [30] [31] Многие из них высвобождаются совместно с низкомолекулярным передатчиком. Тем не менее, в некоторых случаях пептид является основным передатчиком в синапсе. Бета-эндорфин является относительно известным примером пептидного нейротрансмиттера, поскольку он участвует в высокоспецифичных взаимодействиях с опиоидными рецепторами в центральной нервной системе .
Отдельные ионы (например, синаптически высвобождаемый цинк ) также считаются некоторыми нейротрансмиттерами [32] , а также некоторые газообразные молекулы, такие как оксид азота (NO), оксид углерода (CO) и сероводород (H 2 S). [33] Газы вырабатываются в нейронной цитоплазме и немедленно диффундируют через клеточную мембрану во внеклеточную жидкость и в близлежащие клетки, стимулируя выработку вторичных мессенджеров. Растворимые газообразные нейротрансмиттеры трудно изучать, поскольку они действуют быстро и немедленно разрушаются, существуя всего несколько секунд.
Наиболее распространенным передатчиком является глутамат , который является возбуждающим в более чем 90% синапсов в человеческом мозге. [28] Следующим по распространенности является гамма-аминомасляная кислота, или ГАМК, которая является ингибирующей в более чем 90% синапсов, которые не используют глутамат. Хотя другие передатчики используются в меньшем количестве синапсах, они могут быть очень важны функционально: подавляющее большинство психоактивных препаратов оказывают свое действие, изменяя действие некоторых нейротрансмиттерных систем, часто действуя через передатчики, отличные от глутамата или ГАМК. Наркотики, вызывающие зависимость, оказывают свое действие в первую очередь на дофаминовую систему. Наркотики, вызывающие зависимость, оказывают свое действие в первую очередь как функциональные аналоги опиоидных пептидов , которые, в свою очередь, регулируют уровень дофамина.
Нейроны, экспрессирующие определенные типы нейротрансмиттеров, иногда образуют отдельные системы, где активация системы влияет на большие объемы мозга, что называется объемной передачей . Основные нейротрансмиттерные системы включают норадреналиновую (норэпинефриновую) систему, дофаминовую систему, серотониновую систему и холинергическую систему, среди прочих. Следовые амины оказывают модулирующее действие на нейротрансмиссию в моноаминовых путях (т. е. дофаминовых, норадреналиновых и серотониновых путях) по всему мозгу посредством сигнализации через рецептор 1, ассоциированный со следовыми аминами . [37] [38] Ниже приведено краткое сравнение этих систем:
Понимание влияния лекарств на нейротрансмиттеры составляет значительную часть исследовательских инициатив в области нейронауки . Большинство нейробиологов, занимающихся этой областью исследований, считают, что такие усилия могут еще больше продвинуть наше понимание цепей, ответственных за различные неврологические заболевания и расстройства, а также способов эффективного лечения и когда-нибудь, возможно, предотвращения или излечения таких заболеваний. [55] [ необходима медицинская цитата ]
Лекарства могут влиять на поведение, изменяя активность нейротрансмиттеров. Например, лекарства могут снижать скорость синтеза нейротрансмиттеров, влияя на синтетический фермент(ы) для этого нейротрансмиттера. Когда синтез нейротрансмиттеров блокируется, количество нейротрансмиттеров, доступных для высвобождения, становится существенно ниже, что приводит к снижению активности нейротрансмиттеров. Некоторые лекарства блокируют или стимулируют высвобождение определенных нейротрансмиттеров. В качестве альтернативы лекарства могут предотвращать хранение нейротрансмиттеров в синаптических пузырьках, вызывая утечку мембран синаптических пузырьков. Лекарства, которые предотвращают связывание нейротрансмиттера с его рецептором, называются антагонистами рецепторов . Например, препараты, используемые для лечения пациентов с шизофренией, такие как галоперидол, хлорпромазин и клозапин, являются антагонистами рецепторов дофамина в мозге. Другие лекарства действуют, связываясь с рецептором и имитируя нормальный нейротрансмиттер. Такие лекарства называются агонистами рецепторов . Примером агониста рецептора является морфин , опиат, который имитирует эффекты эндогенного нейротрансмиттера β-эндорфина для облегчения боли. Другие препараты мешают дезактивации нейротрансмиттера после его высвобождения, тем самым продлевая действие нейротрансмиттера. Это может быть достигнуто путем блокирования обратного захвата или ингибирования деградирующих ферментов. Наконец, препараты также могут предотвращать возникновение потенциала действия, блокируя нейронную активность по всей центральной и периферической нервной системе . Такие препараты, как тетродотоксин , которые блокируют нейронную активность, обычно смертельны.
Препараты, воздействующие на нейротрансмиттер основных систем, влияют на всю систему, что может объяснить сложность действия некоторых препаратов. Например, кокаин блокирует обратный захват дофамина в пресинаптический нейрон, оставляя молекулы нейротрансмиттера в синаптической щели на длительный период времени. Поскольку дофамин остается в синапсе дольше, нейротрансмиттер продолжает связываться с рецепторами на постсинаптическом нейроне, вызывая приятную эмоциональную реакцию. Физическая зависимость от кокаина может быть результатом длительного воздействия избыточного дофамина в синапсах, что приводит к снижению регуляции некоторых постсинаптических рецепторов. После того, как действие препарата проходит, человек может впасть в депрессию из-за снижения вероятности связывания нейротрансмиттера с рецептором. Флуоксетин — селективный ингибитор обратного захвата серотонина (СИОЗС), который блокирует обратный захват серотонина пресинаптической клеткой, что увеличивает количество серотонина, присутствующего в синапсе, и, кроме того, позволяет ему оставаться там дольше, обеспечивая потенциал для эффекта естественно высвобождаемого серотонина. [56] АМПТ предотвращает превращение тирозина в L-ДОФА , предшественника дофамина; резерпин предотвращает накопление дофамина внутри везикул ; а депренил ингибирует моноаминоксидазу (МАО)-B и, таким образом, увеличивает уровень дофамина.
Агонист — это химическое вещество, способное связываться с рецептором, например, рецептором нейротрансмиттера, и инициировать ту же реакцию, которая обычно вызывается связыванием эндогенного вещества. [60] Таким образом, агонист нейротрансмиттера будет инициировать ту же реакцию рецептора, что и трансмиттер. В нейронах препарат-агонист может активировать рецепторы нейротрансмиттера либо напрямую, либо косвенно. Агонисты прямого связывания можно далее охарактеризовать как полные агонисты , частичные агонисты , обратные агонисты . [61] [62]
Direct agonists act similar to a neurotransmitter by binding directly to its associated receptor site(s), which may be located on the presynaptic neuron or postsynaptic neuron, or both.[63] Typically, neurotransmitter receptors are located on the postsynaptic neuron, while neurotransmitter autoreceptors are located on the presynaptic neuron, as is the case for monoamine neurotransmitters;[37] in some cases, a neurotransmitter utilizes retrograde neurotransmission, a type of feedback signaling in neurons where the neurotransmitter is released postsynaptically and binds to target receptors located on the presynaptic neuron.[64][note 1] Nicotine, a compound found in tobacco, is a direct agonist of most nicotinic acetylcholine receptors, mainly located in cholinergic neurons.[59] Opiates, such as morphine, heroin, hydrocodone, oxycodone, codeine, and methadone, are μ-opioid receptor agonists; this action mediates their euphoriant and pain relieving properties.[59]
Indirect agonists increase the binding of neurotransmitters at their target receptors by stimulating the release or preventing the reuptake of neurotransmitters.[63] Some indirect agonists trigger neurotransmitter release and prevent neurotransmitter reuptake. Amphetamine, for example, is an indirect agonist of postsynaptic dopamine, norepinephrine, and serotonin receptors in each their respective neurons;[37][38] it produces both neurotransmitter release into the presynaptic neuron and subsequently the synaptic cleft and prevents their reuptake from the synaptic cleft by activating TAAR1, a presynaptic G protein-coupled receptor, and binding to a site on VMAT2, a type of monoamine transporter located on synaptic vesicles within monoamine neurons.[37][38]
An antagonist is a chemical that acts within the body to reduce the physiological activity of another chemical substance (such as an opiate); especially one that opposes the action on the nervous system of a drug or a substance occurring naturally in the body by combining with and blocking its nervous receptor.[65]
There are two main types of antagonist: direct-acting Antagonist and indirect-acting Antagonists:
An antagonist drug is one that attaches (or binds) to a site called a receptor without activating that receptor to produce a biological response. It is therefore said to have no intrinsic activity. An antagonist may also be called a receptor "blocker" because they block the effect of an agonist at the site. The pharmacological effects of an antagonist, therefore, result in preventing the corresponding receptor site's agonists (e.g., drugs, hormones, neurotransmitters) from binding to and activating it. Antagonists may be "competitive" or "irreversible".
A competitive antagonist competes with an agonist for binding to the receptor. As the concentration of antagonist increases, the binding of the agonist is progressively inhibited, resulting in a decrease in the physiological response. High concentration of an antagonist can completely inhibit the response. This inhibition can be reversed, however, by an increase of the concentration of the agonist, since the agonist and antagonist compete for binding to the receptor. Competitive antagonists, therefore, can be characterized as shifting the dose–response relationship for the agonist to the right. In the presence of a competitive antagonist, it takes an increased concentration of the agonist to produce the same response observed in the absence of the antagonist.
An irreversible antagonist binds so strongly to the receptor as to render the receptor unavailable for binding to the agonist. Irreversible antagonists may even form covalent chemical bonds with the receptor. In either case, if the concentration of the irreversible antagonist is high enough, the number of unbound receptors remaining for agonist binding may be so low that even high concentrations of the agonist do not produce the maximum biological response.[66]
While intake of neurotransmitter precursors does increase neurotransmitter synthesis, evidence is mixed as to whether neurotransmitter release and postsynaptic receptor firing is increased. Even with increased neurotransmitter release, it is unclear whether this will result in a long-term increase in neurotransmitter signal strength, since the nervous system can adapt to changes such as increased neurotransmitter synthesis and may therefore maintain constant firing.[70][unreliable medical source?] Some neurotransmitters may have a role in depression and there is some evidence to suggest that intake of precursors of these neurotransmitters may be useful in the treatment of mild and moderate depression.[70][unreliable medical source?][71]
L-DOPA, a precursor of dopamine that crosses the blood–brain barrier, is used in the treatment of Parkinson's disease. For depressed patients where low activity of the neurotransmitter norepinephrine is implicated, there is only little evidence for benefit of neurotransmitter precursor administration. L-phenylalanine and L-tyrosine are both precursors for dopamine, norepinephrine, and epinephrine. These conversions require vitamin B6, vitamin C, and S-adenosylmethionine. A few studies suggest potential antidepressant effects of L-phenylalanine and L-tyrosine, but there is much room for further research in this area.[70][unreliable medical source?]
Administration of L-tryptophan, a precursor for serotonin, is seen to double the production of serotonin in the brain. It is significantly more effective than a placebo in the treatment of mild and moderate depression.[70][unreliable medical source?] This conversion requires vitamin C.[25] 5-hydroxytryptophan (5-HTP), also a precursor for serotonin, is more effective than a placebo.[70][unreliable medical source?]
Diseases and disorders may also affect specific neurotransmitter systems. The following are disorders involved in either an increase, decrease, or imbalance of certain neurotransmitters.
Dopamine:
For example, problems in producing dopamine (mainly in the substantia nigra) can result in Parkinson's disease, a disorder that affects a person's ability to move as they want to, resulting in stiffness, tremors or shaking, and other symptoms. Some studies suggest that having too little or too much dopamine or problems using dopamine in the thinking and feeling regions of the brain may play a role in disorders like schizophrenia or attention deficit hyperactivity disorder (ADHD). Dopamine is also involved in addiction and drug use, as most recreational drugs cause an influx of dopamine in the brain (especially opioid and methamphetamines) that produces a pleasurable feeling, which is why users constantly crave drugs.
Serotonin:
Similarly, after some research suggested that drugs that block the recycling, or reuptake, of serotonin seemed to help some people diagnosed with depression, it was theorized that people with depression might have lower-than-normal serotonin levels. Though widely popularized, this theory was not borne out in subsequent research.[72] Therefore, selective serotonin reuptake inhibitors (SSRIs) are used to increase the amounts of serotonin in synapses.
Glutamate:
Furthermore, problems with producing or using glutamate have been suggestively and tentatively linked to many mental disorders, including autism, obsessive–compulsive disorder (OCD), schizophrenia, and depression.[73] Having too much glutamate has been linked to neurological diseases such as Parkinson's disease, multiple sclerosis, Alzheimer's disease, stroke, and ALS (amyotrophic lateral sclerosis).[74]

Generally, there are no scientifically established "norms" for appropriate levels or "balances" of different neurotransmitters. It is in most cases pragmatically impossible to even measure levels of neurotransmitters in a brain or body at any distinct moments in time. Neurotransmitters regulate each other's release, and weak consistent imbalances in this mutual regulation were linked to temperament in healthy people.[75][76][77][78][79] Strong imbalances or disruptions to neurotransmitter systems have been associated with many diseases and mental disorders. These include Parkinson's, depression, insomnia, Attention Deficit Hyperactivity Disorder (ADHD), anxiety, memory loss, dramatic changes in weight and addictions. Chronic physical or emotional stress can be a contributor to neurotransmitter system changes. Genetics also plays a role in neurotransmitter activities.
Apart from recreational use, medications that directly and indirectly interact with one or more transmitter or its receptor are commonly prescribed for psychiatric and psychological issues. Notably, drugs interacting with serotonin and norepinephrine are prescribed to patients with problems such as depression and anxiety—though the notion that there is much solid medical evidence to support such interventions has been widely criticized.[80] Studies shown that dopamine imbalance has an influence on multiple sclerosis and other neurological disorders.[81]
{{cite book}}: CS1 maint: location missing publisher (link)see pages 13 & 14 of Guide Book
TAAR1 is a high-affinity receptor for METH/AMPH and DA
VMAT2 is the CNS vesicular transporter for not only the biogenic amines DA, NE, EPI, 5-HT, and HIS, but likely also for the trace amines TYR, PEA, and thyronamine (THYR) ... [Trace aminergic] neurons in mammalian CNS would be identifiable as neurons expressing VMAT2 for storage, and the biosynthetic enzyme aromatic amino acid decarboxylase (AADC).
Different subregions of the VTA receive glutamatergic inputs from the prefrontal cortex, orexinergic inputs from the lateral hypothalamus, cholinergic and also glutamatergic and GABAergic inputs from the laterodorsal tegmental nucleus and pedunculopontine nucleus, noradrenergic inputs from the locus ceruleus, serotonergic inputs from the raphe nuclei, and GABAergic inputs from the nucleus accumbens and ventral pallidum.
Descending NE fibers modulate afferent pain signals. ... The locus ceruleus (LC), which is located on the floor of the fourth ventricle in the rostral pons, contains more than 50% of all noradrenergic neurons in the brain; it innervates both the forebrain (eg, it provides virtually all the NE to the cerebral cortex) and regions of the brainstem and spinal cord. ... The other noradrenergic neurons in the brain occur in loose collections of cells in the brainstem, including the lateral tegmental regions. These neurons project largely within the brainstem and spinal cord. NE, along with 5HT, ACh, histamine, and orexin, is a critical regulator of the sleep-wake cycle and of levels of arousal. ... LC firing may also increase anxiety ...Stimulation of β-adrenergic receptors in the amygdala results in enhanced memory for stimuli encoded under strong negative emotion ... Epinephrine occurs in only a small number of central neurons, all located in the medulla. Epinephrine is involved in visceral functions, such as control of respiration.
The ascending reticular activating system (ARAS) is responsible for a sustained wakefulness state. ... The thalamic projection is dominated by cholinergic neurons originating from the pedunculopontine tegmental nucleus of pons and midbrain (PPT) and laterodorsal tegmental nucleus of pons and midbrain (LDT) nuclei [17, 18]. The hypothalamic projection involves noradrenergic neurons of the locus coeruleus (LC) and serotoninergic neurons of the dorsal and median raphe nuclei (DR), which pass through the lateral hypothalamus and reach axons of the histaminergic tubero-mamillary nucleus (TMN), together forming a pathway extending into the forebrain, cortex and hippocampus. Cortical arousal also takes advantage of dopaminergic neurons of the substantia nigra (SN), ventral tegmenti area (VTA) and the periaqueductal grey area (PAG). Fewer cholinergic neurons of the pons and midbrain send projections to the forebrain along the ventral pathway, bypassing the thalamus [19, 20].
The ARAS is a complex structure consisting of several different circuits including the four monoaminergic pathways ... The norepinephrine pathway originates from the locus ceruleus (LC) and related brainstem nuclei; the serotonergic neurons originate from the raphe nuclei within the brainstem as well; the dopaminergic neurons originate in ventral tegmental area (VTA); and the histaminergic pathway originates from neurons in the tuberomammillary nucleus (TMN) of the posterior hypothalamus. As discussed in Chapter 6, these neurons project widely throughout the brain from restricted collections of cell bodies. Norepinephrine, serotonin, dopamine, and histamine have complex modulatory functions and, in general, promote wakefulness. The PT in the brain stem is also an important component of the ARAS. Activity of PT cholinergic neurons (REM-on cells) promotes REM sleep. During waking, REM-on cells are inhibited by a subset of ARAS norepinephrine and serotonin neurons called REM-off cells.
Neurons from the SNc densely innervate the dorsal striatum where they play a critical role in the learning and execution of motor programs. Neurons from the VTA innervate the ventral striatum (nucleus accumbens), olfactory bulb, amygdala, hippocampus, orbital and medial prefrontal cortex, and cingulate cortex. VTA DA neurons play a critical role in motivation, reward-related behavior, attention, and multiple forms of memory. ... Thus, acting in diverse terminal fields, dopamine confers motivational salience ("wanting") on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). ... DA has multiple actions in the prefrontal cortex. It promotes the "cognitive control" of behavior: the selection and successful monitoring of behavior to facilitate attainment of chosen goals. Aspects of cognitive control in which DA plays a role include working memory, the ability to hold information "on line" in order to guide actions, suppression of prepotent behaviors that compete with goal-directed actions, and control of attention and thus the ability to overcome distractions. ... Noradrenergic projections from the LC thus interact with dopaminergic projections from the VTA to regulate cognitive control. ...
Previous work has demonstrated that optogenetically stimulating D1 MSNs promotes reward, whereas stimulating D2 MSNs produces aversion.
Recent studies on intracranial self-administration of neurochemicals (drugs) found that rats learn to self-administer various drugs into the mesolimbic dopamine structures–the posterior ventral tegmental area, medial shell nucleus accumbens and medial olfactory tubercle. ... In the 1970s it was recognized that the olfactory tubercle contains a striatal component, which is filled with GABAergic medium spiny neurons receiving glutamatergic inputs form cortical regions and dopaminergic inputs from the VTA and projecting to the ventral pallidum just like the nucleus accumbens
Within the brain, histamine is synthesized exclusively by neurons with their cell bodies in the tuberomammillary nucleus (TMN) that lies within the posterior hypothalamus. There are approximately 64000 histaminergic neurons per side in humans. These cells project throughout the brain and spinal cord. Areas that receive especially dense projections include the cerebral cortex, hippocampus, neostriatum, nucleus accumbens, amygdala, and hypothalamus. ... While the best characterized function of the histamine system in the brain is regulation of sleep and arousal, histamine is also involved in learning and memory ...It also appears that histamine is involved in the regulation of feeding and energy balance.
[The] dorsal raphe preferentially innervates the cerebral cortex, thalamus, striatal regions (caudate-putamen and nucleus accumbens), and dopaminergic nuclei of the midbrain (eg, the substantia nigra and ventral tegmental area), while the median raphe innervates the hippocampus, septum, and other structures of the limbic forebrain. ... it is clear that 5HT influences sleep, arousal, attention, processing of sensory information in the cerebral cortex, and important aspects of emotion (likely including aggression) and mood regulation. ...The rostral nuclei, which include the nucleus linearis, dorsal raphe, medial raphe, and raphe pontis, innervate most of the brain, including the cerebellum. The caudal nuclei, which comprise the raphe magnus, raphe pallidus, and raphe obscuris, have more limited projections that terminate in the cerebellum, brainstem, and spinal cord.
The dorsal raphe is the primary site of serotonergic neurons in the brain, which, like noradrenergic neurons, pervasively modulate brain function to regulate the state of activation and mood of the organism.
The basal forebrain cholinergic nuclei are comprised the medial septal nucleus (Ch1), the vertical nucleus of the diagonal band (Ch2), the horizontal limb of the diagonal band (Ch3), and the nucleus basalis of Meynert (Ch4). Brainstem cholinergic nuclei include the pedunculopontine nucleus (Ch5), the laterodorsal tegmental nucleus (Ch6), the medial habenula (Ch7), and the parabigeminal nucleus (Ch8).
{{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help)