В многоклеточных организмах стволовые клетки представляют собой недифференцированные или частично дифференцированные клетки , которые могут превращаться в различные типы клеток и бесконечно размножаться , производя больше одних и тех же стволовых клеток. Это самый ранний тип клеток в клеточной линии . [1] Они встречаются как в эмбриональных , так и во взрослых организмах, но в каждом из них они имеют несколько разные свойства. Их обычно отличают от клеток-предшественников , которые не могут делиться бесконечно, и клеток-предшественников или бластных клеток, которые обычно склонны дифференцироваться в один тип клеток.
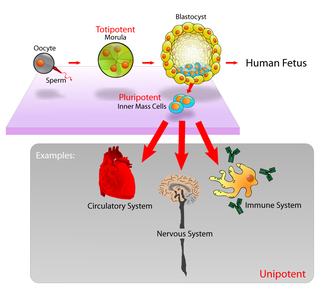
У млекопитающих примерно 50–150 клеток составляют внутреннюю клеточную массу на стадии бластоцисты эмбрионального развития , примерно на 5–14 день. Они обладают способностью использовать стволовые клетки. In vivo они в конечном итоге дифференцируются во все типы клеток организма (что делает их плюрипотентными ). Этот процесс начинается с дифференцировки на три зародышевых листка – эктодерму , мезодерму и энтодерму – на стадии гаструляции . Однако когда их выделяют и культивируют in vitro , их можно сохранять на стадии стволовых клеток, и они известны как эмбриональные стволовые клетки (ЭСК).
Взрослые стволовые клетки обнаруживаются в нескольких избранных местах тела, известных как ниши , например, в костном мозге или половых железах . Они существуют для восполнения быстро утраченных типов клеток и являются мультипотентными или унипотентными, то есть дифференцируются только в несколько типов клеток или в один тип клеток. У млекопитающих они включают, среди прочего, гемопоэтические стволовые клетки , которые пополняют кровь и иммунные клетки, базальные клетки , которые поддерживают эпителий кожи , и мезенхимальные стволовые клетки , которые поддерживают костные, хрящевые , мышечные и жировые клетки. Взрослые стволовые клетки представляют собой небольшое меньшинство клеток; их численность значительно превосходит по численности клетки-предшественники и терминально дифференцированные клетки, в которые они дифференцируются. [1]
Исследования стволовых клеток стали результатом открытий канадских биологов Эрнеста Маккалока , Джеймса Тилла и Эндрю Дж. Беккера из Университета Торонто и Института рака Онтарио в 1960-х годах. [2] [3] По состоянию на 2016 год [обновлять]единственным признанным методом лечения с использованием стволовых клеток является трансплантация гемопоэтических стволовых клеток , [4] впервые проведенная в 1958 году французским онкологом Жоржем Мате . Однако с 1998 года стало возможным культивировать и дифференцировать эмбриональные стволовые клетки человека (в линии стволовых клеток ). Процесс выделения этих клеток вызывает споры , поскольку обычно он приводит к разрушению эмбриона. Источники для выделения ЭСК были ограничены в некоторых европейских странах и Канаде, но другие, такие как Великобритания и Китай, способствовали исследованиям. [5] Перенос ядра соматической клетки — это метод клонирования , который можно использовать для создания клонированного эмбриона для использования его эмбриональных стволовых клеток в терапии стволовыми клетками. [6] В 2006 году японская группа под руководством Синья Яманака открыла метод преобразования зрелых клеток организма обратно в стволовые клетки. Их назвали индуцированными плюрипотентными стволовыми клетками (ИПСК). [7]
Термин «стволовая клетка» был придуман Теодором Бовери и Валентином Хеккером в конце 19 века. [8] Пионерские работы в теории стволовых клеток крови были проведены в начале 20 века Артуром Паппенгеймом , Александром Максимовым , Францем Эрнстом Христианом Нейманом . [8]
Ключевые свойства стволовых клеток были впервые определены Эрнестом Маккалоком и Джеймсом Тиллом в Университете Торонто и Институте рака Онтарио в начале 1960-х годов. В ходе своей новаторской работы на мышах они открыли кроветворную стволовую клетку, гемопоэтическую стволовую клетку (ГСК). Маккалок и Тилл начали серию экспериментов, в которых клетки костного мозга вводили облученным мышам. Они наблюдали образования в селезенке мышей, которые были линейно пропорциональны количеству введенных клеток костного мозга. Они предположили, что каждый комок (колония) представляет собой клон, возникший из одной клетки костного мозга (стволовой клетки). В последующей работе Маккалок и Тилль, к которым присоединились аспирант Эндрю Джон Беккер и старший научный сотрудник Луи Симинович , подтвердили, что каждый комок на самом деле возник из одной клетки. Их результаты были опубликованы в журнале Nature в 1963 году. В том же году Симинович был ведущим исследователем исследований, которые обнаружили, что колониеобразующие клетки способны к самообновлению, что является ключевым определяющим свойством стволовых клеток, которое теоретизировали Тилль и МакКаллох. [9]
Первой терапией с использованием стволовых клеток была трансплантация костного мозга , проведенная французским онкологом Жоржем Мате в 1958 году пяти работникам Ядерного института Винча в Югославии , пострадавшим в результате аварии, вызванной критичностью . Все рабочие выжили. [10]
В 1981 году британские биологи Мартин Эванс и Мэтью Кауфман впервые выделили и успешно культивировали эмбриональные стволовые (ЭС) клетки с использованием бластоцист мыши . Это позволило создать мышиные генетические модели — систему, в которой гены мышей удаляются или изменяются с целью изучения их функции при патологии. К 1998 году американские эмбриональные стволовые клетки были впервые выделены американским биологом Джеймсом Томсоном , что позволило использовать новые методы трансплантации или различные типы клеток для тестирования новых методов лечения. В 2006 году команда Синья Яманаки в Киото (Япония) превратила фибробласты в плюрипотентные стволовые клетки, изменив экспрессию только четырех генов. Этот подвиг представляет собой происхождение индуцированных плюрипотентных стволовых клеток, известных как iPS-клетки. [7]
В 2011 году самка гривистого волка , сбитая грузовиком, прошла лечение стволовыми клетками в зоопарке Бразилиа, и это был первый зарегистрированный случай использования стволовых клеток для лечения травм у дикого животного. [11] [12]
Классическое определение стволовой клетки требует, чтобы она обладала двумя свойствами:
Два механизма обеспечивают поддержание популяции стволовых клеток (не уменьшение ее размера):
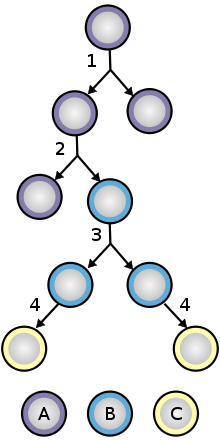
1. Асимметричное деление клеток : стволовая клетка делится на одну материнскую клетку, идентичную исходной стволовой клетке, и другую дочернюю клетку, которая дифференцируется.
Когда стволовая клетка самообновляется, она делится и не нарушает недифференцированное состояние. Это самообновление требует контроля клеточного цикла, а также поддержания мультипотентности или плюрипотентности, что все зависит от стволовой клетки. [13]
2. Стохастическая дифференцировка: когда одна стволовая клетка растет и делится на две дифференцированные дочерние клетки, другая стволовая клетка подвергается митозу и производит две стволовые клетки, идентичные исходной.
Стволовые клетки используют теломеразу , белок, который восстанавливает теломеры , чтобы защитить свою ДНК и расширить предел деления клеток ( предел Хейфлика ). [14]

Потенциал определяет потенциал дифференцировки (возможность дифференцироваться в разные типы клеток) стволовых клеток. [15]
На практике стволовые клетки идентифицируются по тому, могут ли они регенерировать ткани. Например, определяющим тестом на костный мозг или гемопоэтические стволовые клетки (ЗСК) является способность трансплантировать клетки и спасти человека без ЗСК. Это демонстрирует, что клетки могут производить новые клетки крови в течение длительного времени. Также должно быть возможно изолировать стволовые клетки от трансплантированного человека, которые сами могут быть трансплантированы другому человеку без ЗКП, демонстрируя, что стволовые клетки способны самообновляться.
Свойства стволовых клеток можно проиллюстрировать in vitro , используя такие методы, как клоногенные анализы , в которых отдельные клетки оцениваются на предмет их способности дифференцироваться и самообновляться. [18] [19] Стволовые клетки также можно выделить благодаря наличию у них особого набора маркеров клеточной поверхности. Однако условия культивирования in vitro могут изменить поведение клеток, из-за чего неясно, будут ли клетки вести себя аналогичным образом in vivo . Ведутся серьезные споры о том, действительно ли некоторые предложенные популяции взрослых клеток являются стволовыми клетками. [20]
Эмбриональные стволовые клетки ( ЭСК ) — это клетки внутренней клеточной массы бластоцисты , образующиеся до имплантации в матку. [21] В эмбриональном развитии человека стадия бластоцисты достигается через 4–5 дней после оплодотворения , когда она состоит из 50–150 клеток. ЭСК плюрипотентны и в процессе развития дают начало всем производным трех зародышевых листков : эктодермы , энтодермы и мезодермы . Другими словами, они могут развиваться в каждый из более чем 200 типов клеток взрослого организма при достаточной и необходимой стимуляции определенного типа клеток. Они не участвуют во внеэмбриональных оболочках или плаценте .
В ходе эмбрионального развития клетки внутренней клеточной массы непрерывно делятся и становятся более специализированными. Например, часть эктодермы в дорсальной части эмбриона специализируется как « нейректодерма », которая станет будущей центральной нервной системой . [22] На более позднем этапе развития нейруляция заставляет нейроэктодерму формировать нервную трубку . На стадии нервной трубки передняя часть подвергается энцефализации , образуя или «образуя» базовую форму мозга. На этой стадии развития основным типом клеток ЦНС считаются нервные стволовые клетки .
Нейральные стволовые клетки самообновляются и в какой-то момент превращаются в радиальные глиальные клетки-предшественники (RGP). Раннее сформированные RGP самообновляются путем симметричного деления с образованием резервуарной группы клеток-предшественников . Эти клетки переходят в нейрогенное состояние и начинают асимметрично делиться , образуя большое разнообразие различных типов нейронов, каждый из которых обладает уникальной экспрессией генов, морфологическими и функциональными характеристиками. Процесс образования нейронов из радиальных глиальных клеток называется нейрогенезом . Радиальная глиальная клетка имеет характерную биполярную морфологию с сильно удлиненными отростками, охватывающими толщину стенки нервной трубки. Он имеет некоторые общие глиальные характеристики, в первую очередь экспрессию глиального фибриллярного кислого белка (GFAP). [23] [24] Радиальная глиальная клетка является первичной нейральной стволовой клеткой развивающейся ЦНС позвоночных , а ее клеточное тело находится в желудочковой зоне , прилегающей к развивающейся желудочковой системе . Нейральные стволовые клетки привязаны к нейрональным линиям ( нейронам , астроцитам и олигодендроцитам ), и, таким образом, их эффективность ограничена. [22]
Почти во всех исследованиях на сегодняшний день использовались эмбриональные стволовые клетки мыши (mES) или эмбриональные стволовые клетки человека (hES) , полученные из ранней внутренней клеточной массы. Оба имеют основные характеристики стволовых клеток, однако им требуется совершенно разная среда для поддержания недифференцированного состояния. Мышиные ES-клетки выращивают на слое желатина в качестве внеклеточного матрикса (для поддержки) и требуют присутствия фактора ингибирования лейкемии (LIF) в сывороточной среде. Также было показано , что коктейль лекарств, содержащий ингибиторы GSK3B и пути MAPK/ERK , называемый 2i, поддерживает плюрипотентность в культуре стволовых клеток. [25] ЭСК человека выращиваются на питающем слое эмбриональных фибробластов мыши и требуют присутствия основного фактора роста фибробластов (bFGF или FGF-2). [26] Без оптимальных условий культивирования или генетических манипуляций [27] эмбриональные стволовые клетки будут быстро дифференцироваться.
Эмбриональные стволовые клетки человека также характеризуются экспрессией нескольких факторов транскрипции и белков клеточной поверхности. Факторы транскрипции Oct-4 , Nanog и Sox2 образуют основную регуляторную сеть, обеспечивающую подавление генов, которые приводят к дифференцировке и поддержанию плюрипотентности. [28] Антигенами клеточной поверхности, наиболее часто используемыми для идентификации клеток hES, являются гликолипидные стадийно-специфические эмбриональные антигены 3 и 4, а также кератансульфатные антигены Tra-1-60 и Tra-1-81. Молекулярное определение стволовой клетки включает в себя гораздо больше белков и продолжает оставаться темой исследований. [29]
Используя эмбриональные стволовые клетки человека для производства в лаборатории специализированных клеток, таких как нервные клетки или клетки сердца, ученые могут получить доступ к клеткам взрослого человека, не забирая ткани у пациентов. Затем они смогут детально изучить эти специализированные взрослые клетки, чтобы попытаться выявить осложнения заболеваний или изучить реакции клеток на предлагаемые новые лекарства.
Из-за их комбинированной способности к неограниченному расширению и плюрипотентности эмбриональные стволовые клетки теоретически остаются потенциальным источником для регенеративной медицины и замены тканей после травм или заболеваний. [30] однако в настоящее время не существует одобренных методов лечения с использованием ES-клеток. Первое испытание на людях было одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в январе 2009 года. [31] Однако испытания на людях не были начаты до 13 октября 2010 года в Атланте для исследования травм спинного мозга . 14 ноября 2011 года компания, проводившая исследование ( Geron Corporation ), объявила о прекращении дальнейшего развития своих программ стволовых клеток. [32] Дифференциация ES-клеток в пригодные для использования клетки, избегая при этом отторжения трансплантата, — это лишь некоторые из препятствий, с которыми все еще сталкиваются исследователи эмбриональных стволовых клеток. [33] Эмбриональные стволовые клетки, будучи плюрипотентными, требуют специфических сигналов для правильной дифференцировки – если их вводить непосредственно в другой организм, ES-клетки будут дифференцироваться во множество различных типов клеток, вызывая тератому . Этические соображения относительно использования тканей нерожденного человека являются еще одной причиной отсутствия одобренных методов лечения с использованием эмбриональных стволовых клеток. Во многих странах в настоящее время действуют моратории или ограничения либо на исследования человеческих ES-клеток, либо на производство новых линий ES-клеток человека.

Мезенхимальные стволовые клетки (МСК) или мезенхимальные стромальные клетки, также известные как лекарственные сигнальные клетки, известны как мультипотентные, которые можно обнаружить во взрослых тканях, например, в мышцах, печени, костном мозге и жировой ткани. Мезенхимальные стволовые клетки обычно выполняют функцию структурной поддержки в различных органах, как упоминалось выше, и контролируют движение веществ. МСК могут дифференцироваться в многочисленные категории клеток, например адипоциты, остеоциты и хондроциты, происходящие из мезодермального слоя. [34] Когда слой мезодермы обеспечивает увеличение элементов скелета тела, таких как хрящ или кость. Термин «мезо» означает «средний», происходит от греческого «infusion», означая, что мезенхимальные клетки способны перемещаться и перемещаться на ранних стадиях эмбрионального роста между эктодермальными и энтодермальными слоями. Этот механизм помогает заполнять пространство, что является ключом к заживлению ран у взрослых организмов, связанных с мезенхимальными клетками дермы (кожи), костей или мышц. [35]
Известно, что мезенхимальные стволовые клетки необходимы для регенеративной медицины. Они широко изучаются в клинических испытаниях . Поскольку их легко изолировать и получить высокий выход, они обладают высокой пластичностью, что позволяет облегчить воспаление и стимулировать рост клеток, дифференцировку клеток и восстановление тканей, полученных в результате иммуномодуляции и иммуносупрессии. МСК происходят из костного мозга, что требует агрессивной процедуры, когда дело доходит до выделения количества и качества изолированных клеток, и это зависит от возраста донора. При сравнении количества МСК в аспиратах костного мозга и строме костного мозга можно отметить тенденцию к более низкому содержанию МСК в аспиратах, чем в строме. Известно, что МСК гетерогенны и экспрессируют высокий уровень плюрипотентных маркеров по сравнению с другими типами стволовых клеток, такими как эмбриональные стволовые клетки. [34] Инъекция МСК приводит к заживлению ран, главным образом, за счет стимуляции ангиогенеза. [36]
Эмбриональные стволовые клетки (ЭСК) обладают способностью делиться бесконечно, сохраняя при этом свою плюрипотентность , что становится возможным благодаря специализированным механизмам контроля клеточного цикла . [37] По сравнению с пролиферирующими соматическими клетками , ЭСК обладают уникальными характеристиками клеточного цикла, такими как быстрое деление клеток, вызванное укороченной фазой G1 , отсутствием фазы G0 и модификациями контрольных точек клеточного цикла , что в любой момент времени оставляет клетки в основном в S-фазе. . [37] [38] О быстром делении ЭСК свидетельствует их короткое время удвоения, которое колеблется от 8 до 10 часов, тогда как время удвоения соматических клеток составляет примерно 20 часов или дольше. [39] По мере дифференциации клеток эти свойства изменяются: фазы G1 и G2 удлиняются, что приводит к более длительным циклам деления клеток. Это предполагает, что специфическая структура клеточного цикла может способствовать установлению плюрипотентности. [37]
В частности, поскольку фаза G1 — это фаза, в которой клетки обладают повышенной чувствительностью к дифференцировке, укороченная фаза G1 является одной из ключевых характеристик ЭСК и играет важную роль в поддержании недифференцированного фенотипа . Хотя точный молекулярный механизм остается лишь частично понятным, несколько исследований показали, как ЭСК так быстро проходят через G1 – и, возможно, через другие фазы. [38]
Клеточный цикл регулируется сложной сетью циклинов , циклин-зависимых киназ (Cdk), ингибиторов циклин-зависимых киназ (Cdkn), карманных белков семейства ретинобластомы (Rb) и других вспомогательных факторов. [39] Фундаментальное понимание особенностей регуляции клеточного цикла ЭСК было получено в ходе исследований на ЭСК мыши (мЭСК). [38] мЭСК показали клеточный цикл с сильно сокращенной фазой G1, что позволило клеткам быстро чередовать M-фазу и S-фазу. В соматическом клеточном цикле при последовательном действии наблюдается колебательная активность комплексов циклин-Cdk, которая контролирует важнейшие регуляторы клеточного цикла, вызывая однонаправленные переходы между фазами: циклин D и Cdk4/6 активны в фазе G1, тогда как циклин E и Cdk2 активны во время поздней фазы G1 и фазы S; и циклин A и Cdk2 активны в фазе S и G2, тогда как циклин B и Cdk1 активны в фазе G2 и M. [39] Однако в мЭСК эта типично упорядоченная и колебательная активность комплексов циклин-Cdk отсутствует. Скорее, комплекс Cyclin E/Cdk2 конститутивно активен на протяжении всего цикла, сохраняя белок ретинобластомы (pRb) гиперфосфорилированным и, следовательно, неактивным. Это обеспечивает прямой переход от фазы M к поздней фазе G1, что приводит к отсутствию циклинов D-типа и, следовательно, к укороченной фазе G1. [38] Активность Cdk2 имеет решающее значение как для регуляции клеточного цикла, так и для принятия решений о судьбе клеток в mESCs; Снижение активности Cdk2 продлевает прогрессирование фазы G1, устанавливает клеточный цикл, подобный соматическим клеткам, и индуцирует экспрессию маркеров дифференцировки. [40]
В ЭСК человека (чЭСК) продолжительность G1 резко сокращается. Это объясняется высокими уровнями мРНК G1-связанных генов циклина D2 и Cdk4 и низкими уровнями регуляторных белков клеточного цикла, которые ингибируют прогрессирование клеточного цикла в G1, таких как p21 CipP1 , p27 Kip1 и p57 Kip2 . [37] [41] Кроме того, регуляторы активности Cdk4 и Cdk6, такие как члены семейства ингибиторов Ink (p15, p16, p18 и p19), экспрессируются на низких уровнях или не экспрессируются вообще. Таким образом, как и мЭСК, чЭСК проявляют высокую активность Cdk, при этом Cdk2 проявляет самую высокую киназную активность. Также подобно мЭСК, чЭСК демонстрируют важность Cdk2 в регуляции фазы G1, показывая, что переход от G1 к S задерживается, когда активность Cdk2 ингибируется, и G1 останавливается, когда Cdk2 сбивается. [37] Однако в отличие от мЭСК, чЭСК имеют функциональную фазу G1. ЭСК показывают, что активность комплексов циклин E/Cdk2 и циклин A/Cdk2 зависит от клеточного цикла, а контрольная точка Rb в G1 является функциональной. [39]
ЭСК также характеризуются нефункциональностью контрольной точки G1, хотя контрольная точка G1 имеет решающее значение для поддержания стабильности генома. В ответ на повреждение ДНК ЭСК не останавливаются в G1 для восстановления повреждений ДНК, а вместо этого зависят от контрольных точек S и G2/M или подвергаются апоптозу. Отсутствие контрольной точки G1 в ЭСК позволяет удалять клетки с поврежденной ДНК и, следовательно, избегать потенциальных мутаций из-за неточной репарации ДНК. [37] В соответствии с этой идеей, ЭСК сверхчувствительны к повреждениям ДНК, что позволяет свести к минимуму мутации, передаваемые следующему поколению. [39]
Примитивные стволовые клетки, расположенные в органах плода , называются фетальными стволовыми клетками. [42]
Существует два типа фетальных стволовых клеток:
Взрослые стволовые клетки, также называемые соматическими (от греческого σωματικóς, «тела») стволовыми клетками, представляют собой стволовые клетки, которые поддерживают и восстанавливают ткани, в которых они находятся. [44] Их можно обнаружить как у детей, так и у взрослых. [45]
Существует три известных доступных источника аутологичных взрослых стволовых клеток у человека:
Стволовые клетки также можно получить из пуповинной крови сразу после рождения. Из всех типов стволовых клеток сбор аутологичных клеток сопряжен с наименьшим риском. По определению, аутологичные клетки получают из собственного тела точно так же, как можно хранить собственную кровь для плановых хирургических процедур. [ нужна цитата ]
Плюрипотентные взрослые стволовые клетки редки и, как правило, в небольшом количестве, но их можно обнаружить в пуповинной крови и других тканях. [49] Костный мозг является богатым источником взрослых стволовых клеток, [50] которые используются при лечении ряда заболеваний, включая цирроз печени, [51] хроническую ишемию конечностей [52] и терминальную сердечную недостаточность. [53] Количество стволовых клеток костного мозга снижается с возрастом и в репродуктивном возрасте у мужчин больше, чем у женщин. [54] Многие исследования стволовых клеток взрослых на сегодняшний день направлены на то, чтобы охарактеризовать их эффективность и способность к самообновлению. [55] Повреждения ДНК накапливаются с возрастом как в стволовых клетках, так и в клетках, составляющих среду стволовых клеток. Считается, что это накопление ответственно, по крайней мере частично, за усиление дисфункции стволовых клеток с возрастом (см. Теорию старения, связанную с повреждением ДНК ). [56]
Большинство взрослых стволовых клеток ограничены по линии ( мультипотентны ) и обычно называются по их тканевому происхождению ( мезенхимальные стволовые клетки , стволовые клетки жировой ткани, эндотелиальные стволовые клетки , стволовые клетки пульпы зуба и т. д.). [57] [58] Клетки-музы (многолинейные дифференцирующиеся стрессоустойчивые клетки) представляют собой недавно обнаруженный тип плюрипотентных стволовых клеток, обнаруженный во многих тканях взрослых, включая жировую ткань, дермальные фибробласты и костный мозг. Хотя клетки-музы встречаются редко, их можно идентифицировать по экспрессии SSEA-3 , маркера недифференцированных стволовых клеток, а также общих маркеров мезенхимальных стволовых клеток, таких как CD90, CD105 . При воздействии культуры суспензии отдельных клеток клетки будут генерировать кластеры, сходные с эмбриоидными тельцами по морфологии, а также по экспрессии генов, включая канонические маркеры плюрипотентности Oct4 , Sox2 и Nanog . [59]
Лечение стволовыми клетками взрослых успешно используется в течение многих лет для лечения лейкемии и связанных с ней видов рака костей/крови посредством трансплантации костного мозга. [60] Взрослые стволовые клетки также используются в ветеринарии для лечения травм сухожилий и связок у лошадей. [61]
Использование взрослых стволовых клеток в исследованиях и терапии не является столь спорным , как использование эмбриональных стволовых клеток , поскольку производство взрослых стволовых клеток не требует разрушения эмбриона . Кроме того, в тех случаях, когда взрослые стволовые клетки получены от предполагаемого реципиента (аутотрансплантата ) , риск отторжения практически отсутствует. Следовательно, правительство США выделяет больше финансирования на исследования стволовых клеток взрослых. [62]
С растущей потребностью в стволовых клетках взрослого человека как для исследовательских, так и для клинических целей (обычно для одного лечения требуется 1–5 миллионов клеток на кг массы тела) становится крайне важно преодолеть разрыв между необходимостью размножения клеток in vitro. и способность использовать факторы, лежащие в основе репликативного старения. Известно, что взрослые стволовые клетки имеют ограниченную продолжительность жизни in vitro и практически незаметно вступают в репликативное старение после начала культивирования in vitro. [63]
Гемопоэтические стволовые клетки (ГСК) уязвимы к повреждениям ДНК и мутациям , которые усиливаются с возрастом. [64] Эта уязвимость может объяснить повышенный риск медленно растущего рака крови (миелоидных опухолей) у пожилых людей. [64] По-видимому, на старение ГСК влияют несколько факторов, включая реакцию на выработку активных форм кислорода , которые могут вызывать повреждение ДНК и генетические мутации, а также изменение эпигенетического профиля. [65]
Эти мультипотентные стволовые клетки, также называемые перинатальными стволовыми клетками, обнаруживаются в околоплодных водах и пуповинной крови. Эти стволовые клетки очень активны, экстенсивно размножаются без питающих клеток и не являются канцерогенными. Амниотические стволовые клетки мультипотентны и могут дифференцироваться в клетки адипогенной, остеогенной, миогенной, эндотелиальной, печеночной, а также нейрональной линий. [66] Амниотические стволовые клетки являются предметом активных исследований.
Использование стволовых клеток из амниотической жидкости преодолевает этические возражения против использования человеческих эмбрионов в качестве источника клеток. Римско-католическое учение запрещает использование эмбриональных стволовых клеток в экспериментах; соответственно, ватиканская газета « Osservatore Romano » назвала амниотические стволовые клетки «будущим медицины». [67]
Можно собирать амниотические стволовые клетки для доноров или для аутологичного использования: первый банк амниотических стволовых клеток в США [68] [69] был открыт в 2009 году в Медфорде, штат Массачусетс, корпорацией Biocell Center Corporation [70] [71] [72] и сотрудничает с различными больницами и университетами по всему миру. [73]
Взрослые стволовые клетки имеют ограничения по своей эффективности; в отличие от эмбриональных стволовых клеток (ЭСК), они не способны дифференцироваться в клетки всех трех зародышевых листков . Таким образом, они считаются мультипотентными .
Однако перепрограммирование позволяет создавать из взрослых клеток плюрипотентные клетки, индуцированные плюрипотентные стволовые клетки (ИПСК). Это не взрослые стволовые клетки, а соматические клетки (например, эпителиальные клетки), перепрограммированные, чтобы дать начало клеткам с плюрипотентными способностями. Используя генетическое перепрограммирование с помощью белковых факторов транскрипции , были получены плюрипотентные стволовые клетки с возможностями, подобными ЭСК. [74] [75] [76] Первая демонстрация индуцированных плюрипотентных стволовых клеток была проведена Шинья Яманака и его коллегами из Киотского университета . [77] Они использовали факторы транскрипции Oct3/4 , Sox2 , c-Myc и Klf4 для перепрограммирования клеток фибробластов мыши в плюрипотентные клетки. [74] [78] Последующие работы использовали эти факторы для индукции плюрипотентности в клетках фибробластов человека. [79] Джуньин Ю , Джеймс Томсон и их коллеги из Университета Висконсин-Мэдисон использовали другой набор факторов, Oct4, Sox2, Nanog и Lin28, и провели свои эксперименты с использованием клеток крайней плоти человека . [74] [80] Однако им удалось повторить открытие Яманаки о том, что индуцирование плюрипотентности в клетках человека возможно.
Индуцированные плюрипотентные стволовые клетки отличаются от эмбриональных стволовых клеток. Они имеют много сходных свойств, таких как плюрипотентность и потенциал дифференцировки, экспрессия генов плюрипотентности , эпигенетические паттерны, образование эмбриональных тел и тератом , а также образование жизнеспособных химер [77] [78] , но внутри этих свойств существует много различий. Хроматин ИПСК оказывается более «закрытым» или метилированным, чем у ЭСК. [77] [78] Аналогичным образом, характер экспрессии генов между ЭСК и ИПСК или даже ИПСК разного происхождения. [77] Таким образом, возникают вопросы о «полноте» перепрограммирования и соматической памяти индуцированных плюрипотентных стволовых клеток. Несмотря на это, индуцирование плюрипотентности соматических клеток представляется жизнеспособным.
В результате успеха этих экспериментов Ян Уилмут , который помог создать первое клонированное животное, овцу Долли , объявил, что он откажется от переноса ядра соматической клетки как направления исследований. [81]
IPSC значительно помогли области медицины, найдя множество способов лечения болезней. Поскольку IPSCc человека дал преимущество в создании моделей in vitro для изучения токсинов и патогенеза. [82]
Более того, индуцированные плюрипотентные стволовые клетки обладают рядом терапевтических преимуществ. Как и ЭСК, они плюрипотентны . Таким образом, они обладают огромным потенциалом дифференциации; теоретически они могли бы производить любую клетку человеческого тела (если перепрограммирование на плюрипотентность было «полным»). [77] Более того, в отличие от ЭСК, они потенциально могут позволить врачам создавать линию плюрипотентных стволовых клеток для каждого отдельного пациента. [83] Замороженные образцы крови можно использовать в качестве ценного источника индуцированных плюрипотентных стволовых клеток. [84] Специфические для пациента стволовые клетки позволяют проводить скрининг побочных эффектов перед лечением лекарствами, а также снижают риск отторжения трансплантата. [83] Несмотря на ограниченное в настоящее время терапевтическое применение, ИПСК имеют большой потенциал для будущего использования в лечении и исследованиях.
Ключевые факторы, контролирующие клеточный цикл, также регулируют плюрипотентность . Таким образом, манипуляция соответствующими генами может поддерживать плюрипотентность и перепрограммировать соматические клетки в индуцированное плюрипотентное состояние. [39] Однако перепрограммирование соматических клеток часто имеет низкую эффективность и считается стохастическим . [85]
Идея о том, что более быстрый клеточный цикл является ключевым компонентом плюрипотентности, позволяет повысить эффективность перепрограммирования. Методы улучшения плюрипотентности посредством манипулирования регуляторами клеточного цикла включают: сверхэкспрессию циклина D/Cdk4, фосфорилирование Sox2 по S39 и S253, сверхэкспрессию циклина A и циклина E, нокдаун Rb и нокдаун членов семейства Cip/Kip или Семья Инков. [39] Более того, эффективность перепрограммирования коррелирует с количеством клеточных делений, произошедших во время стохастической фазы, о чем свидетельствует растущая неэффективность перепрограммирования старых или медленно ныряющих клеток. [86]
Происхождение — важная процедура для анализа развивающихся эмбрионов. Поскольку клеточные линии показывают взаимоотношения между клетками при каждом делении. Это помогает в анализе линий стволовых клеток, что помогает распознать эффективность стволовых клеток, продолжительность их жизни и другие факторы. С помощью метода клеточного происхождения мутантные гены можно анализировать в клонах стволовых клеток, что может помочь в генетических путях. Эти пути могут регулировать работу стволовых клеток. [87]
Чтобы обеспечить самообновление, стволовые клетки подвергаются двум типам клеточного деления (см. Диаграмму деления и дифференцировки стволовых клеток ). Симметричное деление дает начало двум идентичным дочерним клеткам, обе наделенным свойствами стволовых клеток. Асимметричное деление, с другой стороны, приводит к образованию только одной стволовой клетки и клетки-предшественника с ограниченным потенциалом самообновления. Предшественники могут пройти несколько раундов клеточного деления, прежде чем окончательно дифференцироваться в зрелую клетку. Возможно, что молекулярное различие между симметричными и асимметричными делениями заключается в дифференциальной сегрегации белков клеточных мембран (таких как рецепторы ) между дочерними клетками. [88]
Альтернативная теория состоит в том, что стволовые клетки остаются недифференцированными из-за сигналов окружающей среды в их конкретной нише . Стволовые клетки дифференцируются, когда покидают эту нишу или больше не получают эти сигналы. Исследования на гермарии дрозофилы выявили сигналы декапентаплегических и слипчивых соединений, которые предотвращают дифференцировку стволовых клеток гермария. [89] [90]
В Соединенных Штатах Исполнительный указ 13505 установил, что федеральные деньги могут использоваться для исследований, в которых используются одобренные линии эмбриональных стволовых клеток человека (чЭСК), но не могут быть использованы для получения новых линий. [91] Рекомендации Национального института здравоохранения (NIH) по исследованию стволовых клеток человека, вступившие в силу 7 июля 2009 года, реализовали Исполнительный указ 13505, устанавливая критерии, которым должны соответствовать линии hESC, чтобы быть одобренными для финансирования. [92] Доступ к реестру эмбриональных стволовых клеток человека Национального института здравоохранения (NIH) доступен онлайн. В нем содержится обновленная информация о клеточных линиях, имеющих право на финансирование NIH. [93] По состоянию на январь 2022 года утверждено 486 линий. [94]
Терапия стволовыми клетками — это использование стволовых клеток для лечения или предотвращения заболевания или состояния. Трансплантация костного мозга — это форма терапии стволовыми клетками, которая используется уже много лет, поскольку ее эффективность доказана в клинических испытаниях. [95] [96] Имплантация стволовых клеток может помочь укрепить левый желудочек сердца, а также сохранить сердечную ткань пациентам, перенесшим в прошлом сердечные приступы. [97]
Уже более 90 лет трансплантация гемопоэтических стволовых клеток (ТГСК) используется для лечения людей с такими заболеваниями, как лейкемия и лимфома ; это единственная широко практикуемая форма терапии стволовыми клетками. [95] [98] [99] По состоянию на 2016 год [обновлять]единственной признанной терапией с использованием стволовых клеток является трансплантация гемопоэтических стволовых клеток . [100] Обычно это происходит в форме трансплантации костного мозга , но клетки также могут быть получены из пуповинной крови . В настоящее время проводятся исследования по разработке различных источников стволовых клеток, а также по применению методов лечения нейродегенеративных заболеваний [101] [102] [103] и таких состояний, как диабет и болезни сердца .
Лечение стволовыми клетками может снизить симптомы заболевания или состояния, которое лечат. Уменьшение симптомов может позволить пациентам снизить прием лекарств в связи с заболеванием или состоянием. Лечение стволовыми клетками также может предоставить обществу знания для дальнейшего понимания стволовых клеток и будущих методов лечения. [104] Кредо врачей – не причинять вреда, а стволовые клетки делают это проще, чем когда-либо прежде. Хирургические процессы по своему характеру вредны. Для достижения успешного результата необходимо отказаться от ткани. Предотвратить опасность хирургических вмешательств можно с помощью стволовых клеток. Кроме того, существует вероятность заболевания, и в случае неудачи процедуры может потребоваться дополнительная операция. Риски, связанные с анестезией, также можно устранить с помощью стволовых клеток. [105] Кроме того, стволовые клетки были собраны из тела пациента и перераспределены там, где они нужны. Поскольку они происходят из собственного тела пациента, это называется аутологичным лечением. Аутологичные препараты считаются самыми безопасными, поскольку вероятность отторжения донорского вещества, скорее всего, равна нулю.
Лечение стволовыми клетками может потребовать иммуносупрессии из-за необходимости облучения перед трансплантацией для удаления предыдущих клеток человека или потому, что иммунная система пациента может нацеливаться на стволовые клетки. Один из способов избежать второй возможности — использовать стволовые клетки того же пациента, которого лечат.
Плюрипотентность некоторых стволовых клеток также может затруднить получение определенного типа клеток. Также сложно получить точный тип необходимых клеток, поскольку не все клетки в популяции дифференцируются равномерно. Недифференцированные клетки могут создавать ткани нежелательного типа. [106]
Некоторые стволовые клетки после трансплантации образуют опухоли; [107] Плюрипотентность связана с образованием опухолей, особенно в эмбриональных стволовых клетках, собственных стволовых клетках плода, индуцированных плюрипотентных стволовых клетках. Собственные стволовые клетки плода образуют опухоли, несмотря на мультипотентность. [108]
Этические проблемы также возникают в отношении практики использования или исследования эмбриональных стволовых клеток. Сбор клеток из бластоцисты приводит к гибели бластоцисты. Вопрос заключается в том, следует ли рассматривать бластоцисты как человеческую жизнь. [109] Дебаты по этому вопросу носят в основном философский, а не научный характер.
Туризм со стволовыми клетками — это часть индустрии медицинского туризма , в рамках которой пациенты путешествуют для получения процедур со стволовыми клетками. [110]
В Соединенных Штатах произошел взрыв «клиник стволовых клеток». [111] Процедуры со стволовыми клетками очень выгодны для клиник. Реклама звучит авторитетно, но эффективность и безопасность процедур не доказана. Иногда у пациентов возникают осложнения, такие как опухоли позвоночника [112] и смерть. Высокий расход также может привести к финансовым проблемам. [112] По мнению исследователей, необходимо просвещать общественность, пациентов и врачей по этому вопросу. [113]
По данным Международного общества исследований стволовых клеток , крупнейшей академической организации, которая выступает за исследования стволовых клеток, терапия стволовыми клетками находится в стадии разработки и пока нельзя сказать, что она доказана. [114] [115] Врачи должны информировать пациентов о том, что клинические испытания продолжают выяснять, являются ли эти методы лечения безопасными и эффективными, но неэтичные клиники представляют их как доказанные. [116]
Некоторые из фундаментальных патентов , касающихся эмбриональных стволовых клеток человека, принадлежат Исследовательскому фонду выпускников штата Висконсин (WARF) — это патенты 5 843 780, 6 200 806 и 7 029 913, изобретенные Джеймсом А. Томсоном . WARF не применяет эти патенты против академических ученых, но применяет их против компаний. [117]
В 2006 году Государственный патентный фонд подал запрос в Ведомство США по патентам и товарным знакам (USPTO) на повторную экспертизу трех патентов от имени своего клиента, некоммерческой группы по надзору за патентами Consumer Watchdog (бывший Фонд защиты прав потребителей). Налогоплательщики и права потребителей). [117] В процессе повторной экспертизы, который включает в себя несколько раундов обсуждения между ВПТЗ США и сторонами, ВПТЗ США первоначально согласилось с Consumer Watchdog и отклонило все претензии во всех трех патентах, [118] однако в ответ WARF внесла поправки в формулы всех трех патентов, чтобы сделать их более узкими, а в 2008 году USPTO признало измененные формулы всех трех патентов патентоспособными. Решение по одному из патентов (7 029 913) подлежало обжалованию, а по двум другим — нет. [119] [120] Consumer Watchdog подала апелляцию по поводу выдачи патента '913 в Совет по патентным апелляциям и вмешательствам ВПТЗ США (BPAI), который удовлетворил апелляцию, а в 2010 году BPAI решило, что измененные претензии к патенту '913 не были патентоспособный. [121] Однако WARF смог возобновить судебное преследование по делу и сделал это, снова внося поправки в требования патента '913, чтобы сделать их более узкими, и в январе 2013 года измененные требования были разрешены. [122]
В июле 2013 года Consumer Watchdog объявила, что подаст апелляцию на решение о разрешении претензий по патенту 913 в Апелляционный суд Федерального округа США (CAFC), федеральный апелляционный суд, который рассматривает патентные дела. [123] На слушаниях в декабре 2013 года CAFC поднял вопрос о том, имеет ли Consumer Watchdog законное право на подачу апелляции; дело не могло быть продолжено до тех пор, пока этот вопрос не был решен. [124]

Заболевания и состояния, при которых исследуется лечение стволовыми клетками, включают:
В настоящее время ведутся исследования по разработке различных источников стволовых клеток и применению методов лечения стволовыми клетками нейродегенеративных заболеваний и состояний, диабета , болезней сердца и других состояний. [145] Также ведутся исследования по созданию органоидов с использованием стволовых клеток, что позволит лучше понять развитие человека, органогенез и моделирование заболеваний человека. [146]
В последние годы, благодаря способности ученых изолировать и культивировать эмбриональные стволовые клетки , а также растущей способности ученых создавать стволовые клетки с использованием переноса ядер соматических клеток и методов создания индуцированных плюрипотентных стволовых клеток , закрались противоречия , связанные как с политика абортов и клонирование человека .
Гепатотоксичность и повреждение печени, вызванное лекарственными средствами, являются причиной значительного числа неудач новых лекарств в разработке и выводе их с рынка, что подчеркивает необходимость скрининговых анализов, таких как гепатоцитоподобные клетки, полученные из стволовых клеток, которые способны обнаруживать токсичность на ранних этапах разработки препарата . процесс развития . [147]
В августе 2021 года исследователи из Онкологического центра принцессы Маргарет Университетской сети здравоохранения опубликовали свое открытие механизма покоя в ключевых стволовых клетках, который может помочь в разработке методов лечения рака в будущем. [148]