Как лекарство , инсулин — это любой фармацевтический препарат белкового гормона инсулина , который используется для лечения высокого уровня глюкозы в крови . [6] К таким состояниям относятся диабет 1 типа , диабет 2 типа , гестационный диабет и осложнения диабета , такие как диабетический кетоацидоз и гиперосмолярные гипергликемические состояния . [6] Инсулин также используется вместе с глюкозой для лечения гиперкалиемии (высокого уровня калия в крови). [7] Обычно его вводят путем инъекции под кожу , но некоторые формы также могут использоваться путем инъекции в вену или мышцу . [6] Существуют различные типы инсулина, подходящие для различных промежутков времени. Все типы часто называют инсулином в широком смысле , хотя в более точном смысле инсулин идентичен естественной молекуле, тогда как аналоги инсулина имеют немного другие молекулы, которые позволяют изменять время действия. Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [8] В 2021 году это было 179-е наиболее часто назначаемое лекарство в Соединенных Штатах, с более чем 2 миллионами рецептов. [9] [10]
Инсулин может быть получен из поджелудочной железы свиней или коров. [11] Человеческие версии могут быть получены либо путем модификации свиных версий, либо с помощью рекомбинантной технологии [11] с использованием в основном E. coli или Saccharomyces cerevisiae . [12] Он бывает трех основных типов: короткого действия (например, обычный инсулин ), среднего действия (например, нейтральный протаминовый инсулин Хагедорна (НПХ)) и длительного действия (например, инсулин гларгин ). [11]
Инсулин был впервые использован в качестве лекарственного средства в Канаде Чарльзом Бестом и Фредериком Бантингом в 1922 году. [13] [14]
Это хронология ключевых вех в истории медицинского использования инсулина. Более подробную информацию об открытии, извлечении, очистке, клиническом использовании и синтезе инсулина см. в разделе Инсулин



Инсулин используется для лечения ряда заболеваний, включая диабет и его острые осложнения, такие как диабетический кетоацидоз и гиперосмолярные гипергликемические состояния . Он также используется вместе с глюкозой для лечения высокого уровня калия в крови . Использование во время беременности относительно безопасно для ребенка. [6] Инсулин ранее использовался в психиатрическом лечении, называемом инсулиновой шоковой терапией . [22]
Некоторые побочные эффекты включают гипогликемию (низкий уровень сахара в крови), гипокалиемию (низкий уровень калия в крови) и аллергические реакции . [6] Аллергия на инсулин затронула около 2% людей, из которых большинство реакций вызвано не самим инсулином, а консервантами, добавляемыми в инсулин, такими как цинк, протамин и метакрезол . Большинство реакций являются реакциями гиперчувствительности I типа и редко вызывают анафилаксию . Подозрение на аллергию на инсулин может быть подтверждено с помощью кожных проб с уколом , патч-тестов и иногда биопсии кожи . Терапия первой линии против реакций гиперчувствительности на инсулин включает симптоматическую терапию антигистаминными препаратами. Затем пострадавших переводят на препарат, не содержащий конкретного агента, на который они реагируют, или проводят десенсибилизацию . [23]
Кожные побочные эффекты
Другие побочные эффекты могут включать боль или изменения кожи в местах инъекций. Повторные подкожные инъекции без ротации мест могут привести к липогипертрофии и амилоидомам, которые проявляются в виде твердых пальпируемых узелков под кожей. [24]
Раннее начало инсулинотерапии для долгосрочного лечения таких заболеваний, как диабет 2 типа, предполагает, что использование инсулина имеет уникальные преимущества, однако при инсулинотерапии необходимо постепенно увеличивать дозу и усложнять схему, а также существует вероятность развития тяжелой гипогликемии, поэтому многие люди и их врачи не решаются начинать инсулинотерапию на ранней стадии лечения заболевания. [25] Многие препятствия, связанные со здоровьем, также мешают людям с сахарным диабетом 2 типа начинать или усиливать лечение инсулином, включая отсутствие мотивации, отсутствие знакомства или опыта лечения, а также ограничения по времени, из-за которых люди имеют высокие гликемические нагрузки в течение длительных периодов времени до начала инсулинотерапии. Вот почему управление побочными эффектами, связанными с длительным ранним рутинным использованием инсулина при сахарном диабете 2 типа, может оказаться терапевтической и поведенческой проблемой. [26]
Инсулин — это эндогенный гормон , который вырабатывается поджелудочной железой . [29] Инсулиновый белок был высококонсервативным на протяжении эволюционного времени и присутствует как у млекопитающих , так и у беспозвоночных . Сигнальный путь инсулина/ инсулиноподобного фактора роста (ИИС) был тщательно изучен у таких видов, как нематоды (например, C. elegans ), мухи ( Drosophila melanogaster ) и мыши ( Mus musculus ). Его механизмы действия очень похожи у разных видов. [30]
Как диабет 1-го типа, так и диабет 2-го типа характеризуются потерей функции поджелудочной железы, хотя и в разной степени. [29] Людей, страдающих диабетом, называют диабетиками. Многим диабетикам требуется экзогенный источник инсулина, чтобы поддерживать уровень сахара в крови в безопасном диапазоне. [31] [32] [33]
В 1916 году Николае К. Паулеску (1869–1931) удалось разработать водный экстракт поджелудочной железы, который нормализовал состояние собаки, страдающей диабетом. В 1921 году он опубликовал 4 статьи в Обществе биологии в Париже, посвященные успешному воздействию экстракта поджелудочной железы на собак, страдающих диабетом. Исследование Паулеску о роли поджелудочной железы в усвоении пищи было опубликовано в августе 1921 года в Архиве Internationales de Physiologie, Льеж, Бельгия. Первоначально единственным способом получения инсулина для клинического использования было извлечение его из поджелудочной железы другого существа. Железы животных можно было получить как отходы мясоперерабатывающей промышленности. Инсулин получали в основном от коров ( Eli Lilly and Company ) и свиней ( Nordisk Insulinlaboratorium ). Для производства восьми унций очищенного инсулина могло потребоваться до двух тонн частей свинины. [34] [35] [36] Инсулин из этих источников эффективен для людей, поскольку он очень похож на человеческий инсулин (разница в три аминокислоты в бычьем инсулине, разница в одну аминокислоту в свином). [36] Первоначально более низкая чистота препарата приводила к аллергическим реакциям на присутствие неинсулиновых веществ. Чистота неуклонно улучшалась с 1920-х годов, в конечном итоге достигнув чистоты 99% к середине 1970-х годов благодаря методам высокоэффективной жидкостной хроматографии (ВЭЖХ). Незначительные аллергические реакции все еще иногда случаются, даже на синтетические разновидности «человеческого» инсулина. [36]
Начиная с 1982 года, биосинтетический «человеческий» инсулин производился для клинического использования с помощью методов генной инженерии с использованием технологии рекомбинантной ДНК . Genentech разработала технологию, используемую для производства первого такого инсулина, Хумулина, но сама не продавала этот продукт на рынке. Eli Lilly выпустила Хумулин на рынок в 1982 году. [37] Хумулин был первым лекарством, произведенным с использованием современных методов генной инженерии, в которых фактическая человеческая ДНК вставляется в клетку-хозяина ( в данном случае E. coli ). Затем клеткам-хозяевам позволяют расти и размножаться нормально, и благодаря вставленной человеческой ДНК они производят синтетическую версию человеческого инсулина. Производители утверждают, что это снижает наличие многих примесей. Однако клинические препараты, приготовленные из таких инсулинов, отличаются от эндогенного человеческого инсулина в нескольких важных отношениях; примером является отсутствие С-пептида, который в последние годы, как было показано, сам по себе имеет системные эффекты. Novo Nordisk также разработала генно-инженерный инсулин независимо с использованием дрожжевого процесса. [38] [39]
Согласно исследованию, проведенному Международной федерацией диабета в 2002 году по вопросу доступности и наличия инсулина в странах-членах, примерно 70% инсулина, который в настоящее время продается в мире, является рекомбинантным, биосинтетическим «человеческим» инсулином. [40] Большая часть инсулина, используемого в клинической практике сегодня, производится таким образом, хотя клинический опыт предоставил противоречивые данные о том, являются ли эти инсулины менее склонными вызывать аллергическую реакцию. Были зарегистрированы побочные реакции; к ним относятся потеря предупреждающих признаков того, что пациенты могут впасть в кому из-за гипогликемии , судороги, провалы в памяти и потеря концентрации. [41] Однако в заявлении о позиции Международной федерации диабета от 2005 года очень четко указано, что «НЕ существует неопровержимых доказательств предпочтения одного вида инсулина другому» и «[современные, высокоочищенные] животные инсулины остаются вполне приемлемой альтернативой». [42]
С января 2006 года все инсулины, распространяемые в США и некоторых других странах, являются синтетическими «человеческими» инсулинами или их аналогами. Для получения бычьего или свиного инсулина для использования в США требуется специальный процесс импорта FDA, [43] хотя могут быть некоторые оставшиеся запасы свиного инсулина, произведенного Lilly в 2005 году или ранее, а свиной инсулин ленте также продается и продвигается под торговой маркой Vetsulin(SM) в США для ветеринарного использования при лечении домашних животных с диабетом. [44]
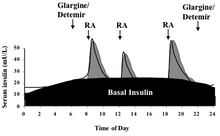
При диабете 1 типа выработка инсулина крайне низкая, и поэтому организму требуется экзогенный инсулин. Некоторым людям с диабетом 2 типа, особенно с очень высокими показателями гемоглобина A1c , может также потребоваться базовая норма инсулина, поскольку их организм десенсибилизирован к уровню вырабатываемого инсулина. Базальный инсулин регулирует уровень глюкозы в крови организма между приемами пищи, а также в течение ночи. Эта базальная норма действия инсулина обычно достигается с помощью использования инсулина средней продолжительности действия (например, НПХ) или аналога инсулина длительного действия. У больных диабетом 1 типа она также может быть достигнута с помощью непрерывной инфузии быстродействующего инсулина с помощью инсулиновой помпы . Примерно половина суточной потребности человека в инсулине вводится в виде базального инсулина, обычно вводимого один раз в день на ночь. [45]
Когда человек ест пищу, содержащую углеводы и глюкозу, инсулин помогает регулировать метаболизм пищи в организме. Прандиальный инсулин, также называемый инсулином во время еды или болюсным инсулином, разработан как болюсная доза инсулина перед едой для регулирования скачка уровня глюкозы в крови, который происходит после еды. Доза прандиального инсулина может быть статической или может быть рассчитана пациентом с использованием либо текущего уровня сахара в крови, либо запланированного потребления углеводов, либо и того, и другого. Этот расчет также может быть выполнен инсулиновой помпой у пациентов, использующих помпу. Режимы инсулинотерапии, которые состоят из доз, рассчитанных таким образом, считаются интенсивными режимами инсулинотерапии . [46] Прандиальный инсулин обычно вводят не более чем за 15–30 минут до еды с использованием быстродействующего инсулина или обычного инсулина. У некоторых пациентов может использоваться комбинированный инсулин, который содержит как инсулин НПХ (длительного действия), так и быстродействующий/обычный инсулин для обеспечения как базального инсулина, так и прандиального инсулина. [45]
Использование инсулина в качестве клинического лечения диабета сопряжено с рядом проблем: [47]
Медицинские препараты инсулина никогда не являются просто инсулином в воде (без ничего другого). Клинические инсулины представляют собой смеси инсулина и других веществ, включая консерванты. Они предотвращают слишком быструю порчу или денатурацию белка , задерживают всасывание инсулина, регулируют pH раствора для снижения реакций в месте инъекции и т. д. [48]
Небольшие вариации молекулы человеческого инсулина называются аналогами инсулина (технически « лигандами инсулиновых рецепторов »), так названными потому, что технически они не являются инсулином, а являются аналогами, которые сохраняют функциональность гормона по управлению глюкозой. Они обладают характеристиками абсорбции и активности, которые в настоящее время невозможны при подкожном введении инсулина. Они либо быстро всасываются в попытке имитировать настоящий инсулин бета-клеток (как в случае с инсулином лизпро , инсулином аспарт и инсулином глулизином ), либо стабильно всасываются после инъекции вместо того, чтобы иметь «пик», за которым следует более или менее быстрое снижение действия инсулина (как в случае с инсулином детемир и инсулином гларгином ), при этом сохраняя действие инсулина по снижению уровня глюкозы в организме человека. Однако ряд метаанализов , включая проведенные Cochrane Collaboration в 2005 году [49], Институтом Германии по качеству и экономической эффективности в секторе здравоохранения [IQWiG], опубликованный в 2007 году [50], и Канадским агентством по лекарственным средствам и технологиям в здравоохранении (CADTH) [51], также опубликованный в 2007 году, не показали однозначных преимуществ клинического использования аналогов инсулина по сравнению с более традиционными типами инсулина. [50] [51]
Обычно используются следующие типы инсулина. [29]
Включает аналоги инсулина аспарт , лизпро и глулизин . Они начинают действовать в течение 5–15 минут и активны в течение 3–4 часов. Большинство инсулинов образуют гексамеры , которые задерживают поступление в кровь в активной форме; эти аналоговые инсулины не обладают, но обладают нормальной инсулиновой активностью. Новые разновидности сейчас ожидают одобрения регулирующих органов в США, которые разработаны для быстрой работы, но сохраняют ту же генетическую структуру, что и обычный человеческий инсулин . [52] [53]
Включает обычный инсулин , который начинает действовать в течение 30 минут и активен примерно от 5 до 8 часов. [54]
Включает инсулин НПХ , который начинает действовать через 1–3 часа и активен в течение 16–24 часов. [55]
Включает аналоги гларгин U100 и детемир , каждый из которых начинает действовать в течение 1–2 часов и продолжает быть активным, без значительных пиков или спадов, в течение примерно 24 часов, хотя это варьируется у многих людей. [56] [57]
Включает аналоги инсулина гларгин U300 и деглудек , которые начинают действовать в течение 30–90 минут и продолжают действовать более 24 часов. [28]
Включает комбинацию быстродействующего или короткодействующего инсулина с инсулином длительного действия, как правило, инсулином НПХ . Комбинированные продукты начинают работать с инсулином более короткого действия (5–15 минут для быстродействующего и 30 минут для короткодействующего) и остаются активными в течение 16–24 часов. Существует несколько вариаций с различными пропорциями смешанных инсулинов (например, Novolog Mix 70/30 содержит 70% аспартамина [родственного НПХ] и 30% аспарта.) [58]

В отличие от многих лекарств, инсулин в настоящее время нельзя принимать внутрь. Как и почти все другие белки, вводимые в желудочно-кишечный тракт , он распадается на фрагменты (компоненты из отдельных аминокислот), после чего вся активность теряется. Были проведены некоторые исследования способов защиты инсулина от желудочно-кишечного тракта, чтобы его можно было вводить в таблетках. Пока это полностью экспериментально. [59]
Инсулин обычно вводят подкожно с помощью одноразовых шприцов с иглами , инсулиновой помпы или многоразовых инсулиновых ручек с иглами. Люди, желающие уменьшить количество повторных проколов кожи при инъекциях инсулина, часто используют инъекционный порт в сочетании со шприцами. [60]
Использование подкожных инъекций инсулина предназначено для имитации естественного физиологического цикла секреции инсулина, при этом принимая во внимание различные свойства используемых формул, такие как период полувыведения, начало действия и продолжительность действия. У многих людей как быстродействующий или короткодействующий инсулиновый продукт, так и продукт промежуточного или длительного действия используются для уменьшения количества инъекций в день. У некоторых инъекции инсулина могут сочетаться с другой инъекционной терапией, такой как агонисты рецепторов GLP-1 . Очищение места инъекции и техника инъекции необходимы для обеспечения эффективной инсулиновой терапии. [45]
Инсулиновые помпы являются разумным решением для некоторых. Преимущества для человека — лучший контроль фоновой или базальной дозировки инсулина, дозы болюса, рассчитанные до долей единицы, и калькуляторы в помпе, которые могут помочь с определением дозировки инфузии болюса . Ограничения — стоимость, потенциальные гипогликемические и гипергликемические эпизоды, проблемы с катетером и отсутствие «замкнутого цикла» средств контроля подачи инсулина на основе текущего уровня глюкозы в крови. [ необходима цитата ]
Инсулиновые помпы могут быть похожи на «электрические инжекторы», прикрепленные к временно имплантированному катетеру или канюле . Некоторые, кто не может достичь адекватного контроля глюкозы с помощью обычной (или струйной) инъекции, могут сделать это с помощью соответствующей помпы. [61]
Постоянные катетеры представляют риск инфекции и язвы, а у некоторых людей может также развиться липодистрофия из-за инфузионных наборов. Эти риски часто можно свести к минимуму, если поддерживать чистоту мест инфузий. Инсулиновые помпы требуют ухода и усилий для правильного использования. [61]
Одна международная единица инсулина (1 МЕ) определяется как «биологический эквивалент» 34,7 мкг чистого кристаллического инсулина. [ необходима ссылка ]
Первым определением единицы инсулина было количество, необходимое для того, чтобы вызвать гипогликемию у кролика. Это было установлено Джеймсом Коллипом в Университете Торонто в 1922 году. Конечно, это зависело от размера и рациона кроликов. Единица инсулина была установлена комитетом по инсулину в Университете Торонто. [62] Единица в конечном итоге эволюционировала в старую единицу инсулина USP , где одна единица (U) инсулина была установлена равной количеству инсулина, необходимого для снижения концентрации глюкозы в крови у голодающего кролика до 45 мкг / дл (2,5 м моль / л ). После того, как химическая структура и масса инсулина стали известны, единица инсулина была определена массой чистого кристаллического инсулина, необходимого для получения единицы USP. [ необходима цитата ]
Единица измерения, используемая в инсулиновой терапии, не является частью Международной системы единиц (сокращенно СИ), которая является современной формой метрической системы . Вместо этого Комитет экспертов ВОЗ по биологической стандартизации определяет фармакологическую международную единицу (МЕ) . [63]
Основной проблемой для тех, кому требуется внешний инсулин, является выбор правильной дозы инсулина и правильного времени его введения.
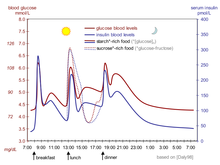
Физиологическая регуляция уровня глюкозы в крови, как у недиабетиков, была бы лучшей. Повышение уровня глюкозы в крови после еды является стимулом для быстрого высвобождения инсулина из поджелудочной железы. Повышение уровня инсулина вызывает всасывание и хранение глюкозы в клетках, снижает превращение гликогена в глюкозу, снижая уровень глюкозы в крови и, таким образом, уменьшая высвобождение инсулина. Результатом является то, что уровень глюкозы в крови несколько повышается после еды и в течение часа или около того возвращается к нормальному «голодному» уровню. Даже лучшее лечение диабета синтетическим человеческим инсулином или даже аналогами инсулина, как бы они ни применялись, далеко не достигает нормального контроля глюкозы у недиабетиков. [64]
Усложняет ситуацию то, что состав потребляемой пищи (см. гликемический индекс ) влияет на скорость всасывания в кишечнике. Глюкоза из некоторых продуктов всасывается быстрее (или медленнее), чем такое же количество глюкозы из других продуктов. Кроме того, жиры и белки вызывают задержки всасывания глюкозы из углеводов, потребляемых в то же время. Кроме того, физические упражнения снижают потребность в инсулине, даже когда все остальные факторы остаются прежними, поскольку работающие мышцы обладают некоторой способностью впитывать глюкозу без помощи инсулина. [65]
Из-за сложных и взаимодействующих факторов, в принципе, невозможно знать наверняка, сколько инсулина (и какой тип) необходимо для «покрытия» конкретного приема пищи, чтобы достичь разумного уровня глюкозы в крови в течение часа или двух после еды. Бета-клетки недиабетиков регулярно и автоматически управляют этим путем постоянного мониторинга уровня глюкозы и высвобождения инсулина. Все такие решения диабетика должны основываться на опыте и обучении (то есть по указанию врача, помощника врача или в некоторых местах специалиста-инструктора по диабету) и, кроме того, конкретно на индивидуальном опыте человека. Но это не так просто и никогда не должно делаться по привычке или по распорядку. Однако с некоторой осторожностью это можно делать достаточно хорошо в клинической практике. Например, некоторым людям с диабетом требуется больше инсулина после употребления обезжиренного молока , чем после приема эквивалентного количества жира, белка, углеводов и жидкости в какой-либо другой форме. Их особая реакция на обезжиренное молоко отличается от реакции других людей с диабетом, но то же количество цельного молока, вероятно, вызовет еще и другую реакцию даже у этого человека. Цельное молоко содержит значительное количество жира, тогда как обезжиренное молоко содержит гораздо меньше. Это постоянный балансирующий акт для всех людей с диабетом, особенно для тех, кто принимает инсулин. [ необходима цитата ]
Людям с инсулинозависимым диабетом обычно требуется некоторый базовый уровень инсулина (базальный инсулин), а также короткодействующий инсулин для покрытия приемов пищи (болюс, также известный как инсулин во время еды или прандиальный инсулин). Поддержание базальной скорости и скорости болюса — это непрерывный балансирующий акт, который люди с инсулинозависимым диабетом должны контролировать каждый день. Обычно это достигается с помощью регулярных анализов крови, хотя в настоящее время становится доступным оборудование для непрерывного измерения уровня сахара в крови ( мониторы непрерывного измерения уровня глюкозы или CGM), которое может помочь усовершенствовать этот балансирующий акт, как только его повсеместное использование станет общепринятым. [ необходима цитата ]
Длительно действующий инсулин используется для приближения к базальной секреции инсулина поджелудочной железой, которая меняется в течение дня. [66] Для этой цели можно использовать НПХ/изофан, ленте, ультраленте, гларгин и детемир. Преимуществом НПХ является его низкая стоимость, тот факт, что вы можете смешивать его с короткодействующими формами инсулина, тем самым минимизируя количество инъекций, которые необходимо сделать, и что активность НПХ достигнет пика через 4–6 часов после введения, что позволяет дозе перед сном уравновесить тенденцию глюкозы к повышению с рассветом , а также меньшей утренней дозой уравновесить более низкую дневную базальную потребность и, возможно, дневной дозой покрыть вечернюю потребность. Недостатком НПХ перед сном является то, что если его не принять достаточно поздно (около полуночи), чтобы пик пришелся незадолго до рассвета, он может вызвать гипогликемию. Одним из теоретических преимуществ гларгина и детемира является то, что их нужно вводить только один раз в день, хотя на практике многие люди обнаруживают, что ни один из них не действует полные 24 часа. Их можно вводить в любое время дня, при условии, что они вводятся в одно и то же время каждый день. Еще одним преимуществом инсулинов длительного действия является то, что базальный компонент инсулинового режима (обеспечивающий минимальный уровень инсулина в течение дня) может быть отделен от прандиального или болюсного компонента (обеспечивающего покрытие во время еды с помощью инсулинов ультракороткого действия), в то время как режимы с использованием НПХ и обычного инсулина имеют тот недостаток, что любая корректировка дозы влияет как на базальный, так и на прандиальный охват. Гларгин и детемир значительно дороже, чем НПХ, ленте и ультраленте, и их нельзя смешивать с другими формами инсулина. [ необходима цитата ]
Короткодействующий инсулин используется для имитации эндогенного выброса инсулина, производимого в ожидании еды. Для этой цели можно использовать обычный инсулин, лизпро, аспарт и глулизин. Обычный инсулин следует вводить примерно за 30 минут до еды, чтобы он был максимально эффективным и минимизировал возможность гипогликемии. Лизпро, аспарт и глулизин одобрены для дозировки с первым укусом еды и могут быть даже эффективными, если вводить их после завершения еды. Короткодействующий инсулин также используется для коррекции гипергликемии. [67]
Впервые описанный в 1934 году [68], то, что врачи обычно называют инсулином со скользящей шкалой (SSI), представляет собой быстродействующий инсулин, вводимый подкожно, как правило, во время еды, а иногда и перед сном, [69], но только когда уровень глюкозы в крови превышает пороговое значение (например, 10 ммоль/л, 180 мг/дл). [70] Так называемый метод «скользящей шкалы» широко преподается, хотя и подвергается резкой критике. [71] [72] [73] [74] Инсулин со скользящей шкалой (SSI) не является эффективным способом лечения долгосрочного диабета у лиц, проживающих в домах престарелых. [69] [75] Инсулин со скользящей шкалой приводит к большему дискомфорту и увеличению времени ухода. [75]
Пример схемы лечения с использованием инсулина гларгина и инсулина лизпро:
Во время беременности может развиться спонтанная гипергликемия, которая приведет к гестационному сахарному диабету (ГСД) — частому осложнению беременности. Гестационный сахарный диабет (ГСД) с распространенностью 6–20 % среди беременных женщин во всем мире определяется как любая степень непереносимости глюкозы, развивающаяся или изначально распознаваемая во время беременности. [76] Нейтральный протаминовый инсулин Хагедорна (НПХ) является краеугольным камнем инсулинотерапии во время беременности, вводимый от двух до четырех раз в день. Женщины с ГСД и беременные женщины с сахарным диабетом I типа, которые часто проверяют уровень глюкозы в крови и используют для этого оборудование для мониторинга глюкозы, используют непрерывную инфузию инсулина быстродействующего аналога инсулина, такого как лизпро и аспарт. Однако при выборе режима введения инсулина пациентам необходимо учитывать ряд соображений. При ведении ГСД у беременных женщин эти рекомендации имеют решающее значение и могут варьироваться в зависимости от определенных физиологических и, что интересно, социокультурных условий. Текущие перинатальные рекомендации рекомендуют низкую суточную дозу инсулина и учитывают физиологические особенности женщины и частоту самоконтроля. Подчеркивается важность использования специализированного планирования инсулинотерапии на основе параметров, подобных указанным выше, а не широкого подхода. [77]
Женщины с уже имеющимся диабетом имеют самые высокие уровни чувствительности к инсулину на ранней стадии беременности. Требуется тщательный мониторинг глюкозы для предотвращения гипогликемии, которая может потенциально привести к изменению сознания, судорогам и материнскому ущербу. [78] Низкий вес новорожденных при рождении также может быть результатом гипогликемии, особенно у пациентов с диабетом 1 типа, потому что они часто более чувствительны к инсулину, чем люди с диабетом 2 типа, и с большей вероятностью не знают о своем гипогликемическом состоянии. Тщательный мониторинг глюкозы необходим, потому что после 16 недель беременности женщины с уже имеющимся диабетом становятся более резистентными к инсулину, и их потребность в инсулине может колебаться еженедельно. Потребность в инсулине может увеличиваться от одной беременности к другой. Поэтому вполне реалистично ожидать более высоких потребностей в контроле глюкозы при последующих беременностях у многорожавших женщин. [78]
Возможность использования инсулина в попытке улучшить спортивные результаты была предложена еще на зимних Олимпийских играх 1998 года в Нагано, Япония , о чем сообщил Питер Сёнксен в июльском выпуске журнала Journal of Endocrinology за 2001 год . Вопрос о том, могут ли спортсмены, не страдающие диабетом, легально использовать инсулин, был поднят российским медицинским работником. [79] [80] Неясно, действительно ли инсулин улучшает спортивные результаты, но опасения по поводу его использования привели к тому, что Международный олимпийский комитет запретил использование гормона спортсменами, не страдающими диабетом, в 1998 году. [81]
В книге «Игра теней » (2001) репортеров Марка Файнару-Вада и Лэнса Уильямса содержались утверждения о том, что бейсболист Барри Бондс использовал инсулин (а также другие препараты), очевидно, полагая, что это повысит эффективность гормона роста, который он якобы принимал. [82] В конечном итоге Бондс дал показания перед федеральным большим жюри в рамках правительственного расследования BALCO . [83]
В частности, утверждается, что бодибилдеры используют экзогенный инсулин и другие препараты, полагая, что они увеличат мышечную массу. Бодибилдеры, как было описано, вводят до 10 МЕ обычного синтетического инсулина перед употреблением сладкой пищи. [81] В отчете 2008 года предполагалось, что инсулин иногда используется в сочетании с анаболическими стероидами и гормоном роста (ГР), и что «спортсмены подвергают себя потенциальному вреду, самостоятельно вводя большие дозы ГР, ИФР-I и инсулина». [84] [85] Злоупотребление инсулином упоминалось как возможный фактор смерти бодибилдеров Гента Уэйкфилда и Рича Пианы . [86]
Инсулин, гормон роста человека (ГРЧ) и инсулиноподобный фактор роста 1 (ИФР-1) вводятся самостоятельно теми, кто хочет увеличить мышечную массу за пределами возможностей, предлагаемых одними анаболическими стероидами. Их обоснование заключается в том, что поскольку инсулин и ГРЧ действуют синергически, способствуя росту, и поскольку ИФР-1 является основным медиатором роста опорно-двигательного аппарата, «наложение» инсулина, ГРЧ и ИФР-1 должно обеспечивать синергетический эффект роста скелетных мышц. Эта теория была поддержана в последние годы бодибилдерами высшего уровня, чей соревновательный вес превышает 50 фунтов (23 кг) мышц, больше, чем у участников соревнований в прошлом, и с еще более низким уровнем жира в организме. [ необходима цитата ]
Экзогенный инсулин значительно повышает скорость метаболизма глюкозы у тренирующихся спортсменов, а также существенно увеличивает пиковый V̇O2 . [87] Считается, что инсулин повышает производительность за счет увеличения синтеза белка, снижения катаболизма белка и облегчения переноса определенных аминокислот в скелетные мышцы человека. Спортсмены, принимающие инсулин, считаются имеющими мышечную массу, поскольку физиологическая гиперинсулинемия в скелетных мышцах человека улучшает активность транспорта аминокислот, что, в свою очередь, способствует синтезу белка. [87] Инсулин стимулирует транспорт аминокислот в клетки, а также контролирует метаболизм глюкозы. Он снижает липолиз и увеличивает липогенез, поэтому бодибилдеры и спортсмены используют рчГР в сочетании с ним, чтобы компенсировать этот негативный эффект, одновременно максимизируя синтез белка. Спортсмены экстраполировали физиологию пациента с диабетом на спортивную арену, поскольку они заинтересованы в подавлении протеолиза. Установлено, что введение инсулина является анаболическим для белка в состоянии резистентности к инсулину хронической почечной недостаточности. [88] Он ингибирует протеолиз и при введении вместе с аминокислотами усиливает чистый синтез белка. Экзогенная инъекция инсулина создает in vivo гиперинсулинемический зажим, повышая мышечный гликоген до и во время фаз восстановления интенсивных упражнений. Ожидается, что в результате увеличится мощность, сила и выносливость, и это также может ускорить процесс заживления после интенсивной физической активности. Во-вторых, ожидается, что инсулин увеличит мышечную массу, предотвращая распад мышечного белка при потреблении вместе с высокоуглеводной диетой. Хотя ограниченное количество исследований действительно предполагает, что инсулиновые препараты можно использовать в качестве фармакологического лечения для повышения силы и производительности у молодых здоровых людей или спортсменов, недавняя оценка исследования утверждает, что это применимо только к небольшой группе «наивных по отношению к лекарствам» людей. [87]
Злоупотребление экзогенным инсулином несет с собой сопутствующий риск гипогликемической комы и смерти, когда используемое количество превышает необходимое для обработки потребляемых углеводов. Острые риски включают повреждение мозга , паралич и смерть . Симптомы могут включать головокружение, слабость, дрожь, сердцебиение , судороги, спутанность сознания, головную боль, сонливость, кому, потоотделение и тошноту . Все лица с передозировкой должны быть направлены на медицинское обследование и лечение, которое может длиться часами или днями. [89]
Данные Национальной системы данных о ядах США (2013) показывают, что 89,3% случаев употребления инсулина, зарегистрированных в токсикологических центрах, являются непреднамеренными, в результате терапевтической ошибки. Еще 10% случаев являются преднамеренными и могут отражать попытку самоубийства, злоупотребление, преступные намерения, вторичную выгоду или другие неизвестные причины. [89] Гипогликемия, вызванная экзогенным инсулином, может быть обнаружена химическим путем путем исследования соотношения инсулина к С-пептиду в периферическом кровообращении. [90] Было высказано предположение, что этот тип подхода может быть использован для обнаружения злоупотребления экзогенным инсулином спортсменами. [91]
Инсулин часто измеряется в сыворотке, плазме или крови для мониторинга терапии у людей, страдающих диабетом, подтверждения диагноза отравления у госпитализированных лиц или оказания помощи в судебно-медицинском расследовании подозрительной смерти. Интерпретация полученных концентраций инсулина сложна, учитывая многочисленные типы доступного инсулина, различные пути введения, наличие антиинсулиновых антител у инсулинозависимых диабетиков и нестабильность препарата ex vivo . Другие потенциальные факторы, затрудняющие результаты, включают широкомасштабную перекрестную реактивность коммерческих иммуноанализов инсулина для биосинтетических аналогов инсулина, использование высокодозного внутривенного инсулина в качестве антидота к передозировке антигипертензивных препаратов и посмертное перераспределение инсулина в организме. Использование хроматографического метода для анализа инсулина может быть предпочтительнее иммуноанализа в некоторых обстоятельствах, чтобы избежать проблемы перекрестной реактивности, влияющей на количественный результат, а также для помощи в идентификации конкретного типа инсулина в образце. [92]
Комбинированная терапия инсулином и другими противодиабетическими препаратами, по-видимому, наиболее полезна для людей, страдающих диабетом, у которых все еще сохраняется остаточная способность секретировать инсулин. [93] Комбинация инсулиновой терапии и сульфонилмочевины более эффективна, чем один инсулин, при лечении людей с диабетом 2 типа после вторичной неэффективности пероральных препаратов, что приводит к улучшению профилей глюкозы и/или снижению потребности в инсулине. [93]
В Соединенных Штатах цена за единицу инсулина неуклонно росла с 1991 по 2019 год. [94] [95] Она выросла в три раза с 2002 по 2013 год. [96] Расходы могут достигать 900 долларов США в месяц. [96] В 2016 году были высказаны опасения относительно того, что фармацевтические компании работают сообща, чтобы повысить цены. [96] В январе 2019 года законодатели из Палаты представителей Соединенных Штатов направили письма производителям инсулина Eli Lilly and Company , Sanofi и Novo Nordisk с просьбой объяснить быстрое повышение цен на инсулин. Годовая стоимость инсулина для людей с диабетом 1 типа в США почти удвоилась с 2900 до 5700 долларов США за период с 2012 по 2016 год. [97]
По данным Международной федерации планов здравоохранения, в 2019 году жители США платили за рецептурные лекарства известных марок в два-шесть раз больше, чем жители остального мира. [98]
В июле 2022 года Калифорния утвердила бюджет, выделяющий штату 100 миллионов долларов на создание собственного инсулина по цене, близкой к себестоимости. [99]
Канада, как и многие другие промышленно развитые страны, имеет ценовой контроль над стоимостью фармацевтических препаратов. Совет по контролю цен на запатентованные лекарства гарантирует, что цена запатентованных лекарств, продаваемых в Канаде, «не является чрезмерной» и остается «сопоставимой с ценами в других странах». [98]
Инсулин и все другие лекарства предоставляются бесплатно людям, которые используют их для лечения диабета, Национальной службой здравоохранения стран Соединенного Королевства. [100]
В марте 2020 года FDA изменило регулирующий путь для одобрения новых продуктов инсулина. [101] Инсулин регулируется как биологический препарат, а не как лекарственный препарат. [101] Измененный статус дает FDA больше гибкости для одобрения и маркировки. [102] В июле 2021 года FDA одобрило инсулин гларгин-YFGN (Semglee), биоподобный продукт, который содержит аналог инсулина длительного действия гларгин. [103] Инсулин гларгин-YFGN является взаимозаменяемым и менее дорогим, чем референтный продукт, инсулин гларгин (Лантус), который был одобрен в 2000 году. [104] FDA требует, чтобы новые продукты инсулина не уступали существующим продуктам инсулина в отношении снижения гемоглобина A1c. [105]
В 2006 году Управление по контролю за продуктами и лекарствами США (FDA) одобрило использование препарата Exubera , первого ингаляционного инсулина . [106] Он был отозван с рынка его производителем в третьем квартале 2007 года из-за отсутствия одобрения. [ необходима цитата ]
Ингаляционный инсулин, как утверждается, имеет схожую эффективность с инъекционным инсулином, как с точки зрения контроля уровня глюкозы, так и периода полувыведения из крови. В настоящее время ингаляционный инсулин является короткодействующим и обычно принимается перед едой; инъекция инсулина длительного действия ночью часто все еще требуется. [107] Когда людей переводили с инъекционного на ингаляционный инсулин, не наблюдалось значительной разницы в уровнях Hb A1c в течение трех месяцев. Точное дозирование было особой проблемой, хотя люди не показали значительного увеличения веса или снижения функции легких в течение всего испытания по сравнению с исходным уровнем. [108]
После его коммерческого запуска в 2005 году в Соединенном Королевстве, он не был (по состоянию на июль 2006 года) рекомендован Национальным институтом здравоохранения и клинического мастерства для рутинного использования, за исключением случаев, когда имеется «подтвержденная фобия инъекций, диагностированная психиатром или психологом». [107]
В январе 2008 года крупнейший в мире производитель инсулина Novo Nordisk также объявил, что компания прекращает дальнейшую разработку собственной версии ингаляционного инсулина, известной как ингаляционная инсулиновая система AERx iDMS. [109] Аналогичным образом Eli Lilly and Company прекратила свои усилия по разработке своего ингаляционного инсулина Air в марте 2008 года. [110] Препарат Afrezza , разработанный Mannkind , был одобрен FDA в июне 2014 года для использования у взрослых с диабетом 1-го и 2-го типа, с ограничением на этикетке, ограничивающим его использование только теми, кто также страдает астмой , активным раком легких или хронической обструктивной болезнью легких (ХОБЛ). [111] Быстродействующий ингаляционный инсулин является компонентом комбинированного раствора лекарственного средства и устройства, который используется в начале каждого приема пищи. Он использует технологию technosphere, которая, по-видимому, имеет более практичный способ доставки и большую гибкость дозирования, а также новую формулу ингаляционного инсулина (2,5 м). Для доставки ингаляционного инсулина используется ингалятор размером с большой палец с улучшенной гибкостью дозировки. Он включает в себя растворенный в порошке рекомбинантный человеческий инсулин (фумарилдикетопиперазин). Инсулин Technosphere быстро всасывается поверхностью легких после ингаляции. В течение 12 часов после ингаляции оба вещества — инсулин и порошок (фумарилдикетопиперазин) — фактически выводятся из легких здоровых людей. По сравнению с Exubera (8–9%), всего 0,3% вдыхаемого инсулина все еще присутствовали в легких через 12 часов. Однако, поскольку сообщалось о повышении уровня сывороточных антител без существенных клинических изменений, а также об остром бронхоспазме у пациентов с астмой и ХОБЛ, а также о значительном снижении диффузионной способности легких по оксиду углерода по сравнению с подкожным инсулином, при его использовании Afrezza получил одобрение FDA с предупреждением (Стратегия оценки и смягчения рисков). [112] [111]
Существует несколько методов трансдермальной доставки инсулина. Пульсирующий инсулин использует микроструи для импульсной подачи инсулина в человека, имитируя физиологическую секрецию инсулина поджелудочной железой. [113] Струйная инъекция имела разные пики и продолжительность подачи инсулина по сравнению с инъекцией иглой. Некоторые диабетики могут предпочесть струйные инъекторы подкожным инъекциям. [114] Было обнаружено, что как электричество с использованием ионофореза [115], так и ультразвук делают кожу временно пористой. Аспект введения инсулина остается экспериментальным, но аспект теста на уровень глюкозы в крови «запястных приспособлений» доступен в продаже Исследователи создали похожее на часы устройство, которое проверяет уровень глюкозы в крови через кожу и вводит корректирующие дозы инсулина через поры в коже. Аналогичное устройство, но основанное на проникающих через кожу «микроиглах», находилось на стадии испытаний на животных в 2015 году. [116] За последние пару лет использование химических усилителей, электрических устройств и устройств с микроиглами показало огромные перспективы для улучшения проникновения инсулина по сравнению с пассивным транспортом через кожу. Трансдермальная доставка инсулина демонстрирует более удобный для пациента и минимально инвазивный подход к ежедневному лечению диабета, чем обычная подкожная инъекция. Однако необходимы дополнительные исследования для решения таких вопросов, как долгосрочное использование, эффективность и надежность доставки, а также побочные эффекты, связанные с воспалением и раздражением. [117]
Инсулин может быть доставлен в центральную нервную систему через интраназальный (IN) путь с небольшим или нулевым системным поглощением или связанными с ним периферическими побочными эффектами. Было показано, что интраназально доставленный инсулин быстро накапливается в спинномозговой жидкости, что указывает на эффективный транспорт в мозг. Считается, что это накопление происходит вдоль обонятельных и близлежащих путей. Хотя многочисленные исследования опубликовали обнадеживающие результаты, все еще проводятся дальнейшие исследования, чтобы понять его долгосрочные последствия, чтобы начать успешное клиническое применение. [118]
Основная привлекательность гипогликемических средств для приема внутрь заключается в том, что большинство людей предпочли бы таблетку или оральную жидкость инъекции. Однако инсулин — это пептидный гормон , который переваривается в желудке и кишечнике и для того, чтобы эффективно контролировать уровень сахара в крови, его нельзя принимать внутрь в его нынешней форме. [ необходима цитата ]
Предполагается, что потенциальный рынок для пероральной формы инсулина огромен, поэтому многие лаборатории пытались разработать способы перемещения достаточного количества интактного инсулина из кишечника в воротную вену, чтобы оказать измеримое влияние на уровень сахара в крови. [119]
В настоящее время разрабатывается ряд стратегий дериватизации и формулирования в попытке разработать перорально доступный инсулин. [120] Многие из этих подходов используют системы доставки наночастиц [121] [122] [123] , а некоторые из них проходят клинические испытания . [124] [125] [126]
Другим улучшением была бы трансплантация поджелудочной железы или бета-клеток, чтобы избежать периодического введения инсулина. Это привело бы к саморегулирующемуся источнику инсулина. Трансплантация всей поджелудочной железы (как отдельного органа ) сложна и относительно редка. Часто она выполняется в сочетании с пересадкой печени или почек , хотя может быть сделана сама по себе. Также возможно провести трансплантацию только бета-клеток поджелудочной железы. Однако трансплантация островков была в значительной степени экспериментальной в течение многих лет, но некоторые исследователи в Альберте, Канада , разработали методы с высоким начальным уровнем успеха (около 90% в одной группе). Почти половина тех, кому была сделана трансплантация островковых клеток, не принимали инсулин в течение года после операции; к концу второго года это число снижается примерно до одного из семи. Однако исследователи из Иллинойсского университета в Чикаго (UIC) немного изменили процедуру Эдмонтонского протокола для трансплантации островковых клеток и добились инсулинонезависимости у людей с диабетом, с меньшим количеством, но лучше функционирующих островковых клеток поджелудочной железы. [127]
Трансплантация бета-клеток может стать практичной в ближайшем будущем. Кроме того, некоторые исследователи изучили возможность трансплантации генетически модифицированных не-бета-клеток для секреции инсулина. [128]
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка )Если вы используете инсулин или лекарства для лечения диабета, ... вы не платите ни за один прописанный вам препарат.