Репарация ДНК — это совокупность процессов, с помощью которых клетка идентифицирует и исправляет повреждения молекул ДНК , кодирующих ее геном . [1] В клетках человека как нормальная метаболическая активность, так и факторы окружающей среды, такие как радиация , могут вызвать повреждение ДНК, что приводит к десяткам тысяч отдельных молекулярных повреждений на клетку в день. [2] Многие из этих повреждений вызывают структурные повреждения молекулы ДНК и могут изменить или устранить способность клетки транскрибировать ген , который кодирует пораженная ДНК. Другие поражения вызывают потенциально вредные мутации в геноме клетки, которые влияют на выживаемость дочерних клеток после митоза . Как следствие, процесс репарации ДНК постоянно активен, поскольку он реагирует на повреждение структуры ДНК. Когда нормальные процессы восстановления терпят неудачу и когда не происходит клеточного апоптоза , может произойти непоправимое повреждение ДНК. В конечном итоге это может привести к злокачественным опухолям или раку согласно гипотезе двух ударов .
Скорость репарации ДНК зависит от многих факторов, включая тип клеток, возраст клетки и внеклеточную среду. Клетка, накопившая большое количество повреждений ДНК или клетка, которая больше не может эффективно восстанавливать повреждения, нанесенные ее ДНК, может войти в одно из трех возможных состояний:
Способность клетки восстанавливать ДНК жизненно важна для целостности ее генома и, следовательно, для нормального функционирования организма. Многие гены, влияние которых первоначально было показано на продолжительность жизни , оказались вовлеченными в восстановление и защиту повреждений ДНК. [3]
Нобелевская премия по химии 2015 года была присуждена Томасу Линдалю , Полу Модричу и Азизу Санкару за работу над молекулярными механизмами процессов репарации ДНК. [4] [5]
Повреждение ДНК, вызванное факторами окружающей среды и нормальными метаболическими процессами внутри клетки, происходит со скоростью от 10 000 до 1 000 000 молекулярных повреждений на клетку в день. [2] Хотя это составляет не более 0,0003125% от примерно 3,2 миллиардов оснований генома человека, невосстановленные повреждения критических генов (таких как гены-супрессоры опухолей ) могут препятствовать способности клетки выполнять свои функции и значительно увеличивать вероятность образования опухоли . и способствуют гетерогенности опухоли .
Подавляющее большинство повреждений ДНК затрагивает первичную структуру двойной спирали; то есть сами основания химически модифицированы. Эти модификации, в свою очередь, могут нарушить регулярную спиральную структуру молекул за счет введения неродных химических связей или объемных аддуктов , которые не вписываются в стандартную двойную спираль. В отличие от белков и РНК , ДНК обычно не имеет третичной структуры , поэтому на этом уровне не происходит повреждений или нарушений. Однако ДНК сверхспиральна и намотана вокруг «упаковочных» белков, называемых гистонами (у эукариот), и обе суперструктуры уязвимы к последствиям повреждения ДНК.
Повреждения ДНК можно разделить на два основных типа:
Репликация поврежденной ДНК до деления клетки может привести к включению неправильных оснований напротив поврежденных. Дочерние клетки, наследующие эти неправильные основания, несут мутации, из-за которых исходную последовательность ДНК невозможно восстановить (за исключением редких случаев обратной мутации , например, посредством конверсии гена ).
Существует несколько типов повреждений ДНК, обусловленных эндогенными клеточными процессами:
Повреждения, вызванные экзогенными агентами, проявляются во многих формах. Некоторые примеры:
УФ-повреждение, алкилирование/метилирование, рентгеновское повреждение и окислительное повреждение являются примерами индуцированного повреждения. Спонтанное повреждение может включать потерю основания, дезаминирование, сморщивание сахарного кольца и таутомерный сдвиг. Конститутивные (спонтанные) повреждения ДНК, вызванные эндогенными оксидантами, можно обнаружить по низкому уровню фосфорилирования гистона H2AX в необработанных клетках. [9]
В клетках человека и эукариотических клетках в целом ДНК находится в двух клеточных местах — внутри ядра и внутри митохондрий . Ядерная ДНК (н-ДНК) существует в виде хроматина на нерепликативных стадиях клеточного цикла и конденсируется в агрегатные структуры, известные как хромосомы , во время деления клеток . В любом из этих состояний ДНК сильно уплотнена и свернута вокруг белков, похожих на шарики, называемых гистонами . Всякий раз, когда клетке необходимо выразить генетическую информацию, закодированную в ее н-ДНК, требуемая хромосомная область раскрывается, расположенные в ней гены экспрессируются, а затем область конденсируется обратно в свою конформацию покоя. Митохондриальная ДНК (мтДНК) расположена внутри митохондриальных органелл , существует в нескольких копиях, а также тесно связана с рядом белков, образуя комплекс, известный как нуклеоид. Внутри митохондрий активные формы кислорода (АФК) или свободные радикалы , побочные продукты постоянного производства аденозинтрифосфата (АТФ) посредством окислительного фосфорилирования , создают высокоокислительную среду, которая, как известно, повреждает мтДНК. Важнейшим ферментом в противодействии токсичности этих видов является супероксиддисмутаза , которая присутствует как в митохондриях, так и в цитоплазме эукариотических клеток.
Старение, необратимый процесс, при котором клетка больше не делится , является защитной реакцией на укорочение концов хромосом, называемых теломерами . Теломеры представляют собой длинные участки повторяющейся некодирующей ДНК , которые покрывают хромосомы и подвергаются частичной деградации каждый раз, когда клетка подвергается делению (см. предел Хейфлика ). [10] Напротив, покой — это обратимое состояние клеточного покоя, не связанное с повреждением генома (см. клеточный цикл ). Старение клеток может служить функциональной альтернативой апоптозу в тех случаях, когда физическое присутствие клетки по пространственным причинам требуется организму [11] , что служит механизмом «последнего средства», предотвращающим репликацию клетки с поврежденной ДНК. неуместно в отсутствие передачи сигналов, способствующих росту клеток . Нерегулируемое деление клеток может привести к образованию опухоли (см. рак ), потенциально смертельной для организма. Поэтому индукция старения и апоптоза считается частью стратегии защиты от рака. [12]
Важно различать повреждение ДНК и мутацию — два основных типа ошибок в ДНК. Повреждение ДНК и мутация принципиально различны. Повреждения приводят к физическим аномалиям в ДНК, таким как одно- и двухцепочечные разрывы, остатки 8-гидроксидезоксигуанозина и аддукты полициклических ароматических углеводородов. Повреждение ДНК может быть распознано ферментами и, таким образом, может быть правильно восстановлено, если для копирования доступна избыточная информация, такая как неповрежденная последовательность в комплементарной цепи ДНК или в гомологичной хромосоме. Если в клетке сохраняется повреждение ДНК, транскрипция гена может быть предотвращена, и, таким образом, трансляция в белок также будет заблокирована. Репликация также может быть заблокирована или клетка может погибнуть.
В отличие от повреждения ДНК, мутация представляет собой изменение базовой последовательности ДНК. Мутация не может быть распознана ферментами, если изменение оснований присутствует в обеих цепях ДНК, и, следовательно, мутация не может быть исправлена. На клеточном уровне мутации могут вызывать изменения в функции и регуляции белков. Мутации реплицируются при репликации клетки. В популяции клеток частота появления мутантных клеток будет увеличиваться или уменьшаться в зависимости от влияния мутации на способность клетки выживать и размножаться.
Хотя повреждения ДНК и мутации явно отличаются друг от друга, они связаны между собой, поскольку повреждение ДНК часто вызывает ошибки синтеза ДНК во время репликации или репарации; эти ошибки являются основным источником мутаций.
Учитывая эти свойства повреждений и мутаций ДНК, можно видеть, что повреждение ДНК представляет собой особую проблему в неделящихся или медленно делящихся клетках, где неустраненные повреждения имеют тенденцию накапливаться с течением времени. С другой стороны, в быстро делящихся клетках невосстановленные повреждения ДНК, которые не убивают клетку путем блокирования репликации, будут иметь тенденцию вызывать ошибки репликации и, следовательно, мутацию. Подавляющее большинство мутаций, которые не являются нейтральными по своему эффекту, вредны для выживания клетки. Таким образом, в популяции клеток, составляющей ткань с реплицирующими клетками, мутантные клетки будут иметь тенденцию к потере. Однако нечастые мутации, обеспечивающие преимущество в выживании, будут иметь тенденцию к клональной экспансии за счет соседних клеток в ткани. Это преимущество для клетки невыгодно для всего организма, поскольку такие мутантные клетки могут вызывать рак. Таким образом, повреждение ДНК в часто делящихся клетках, поскольку оно приводит к мутациям, является основной причиной рака. Напротив, повреждение ДНК в редко делящихся клетках, вероятно, является основной причиной старения. [13]
Клетки не могут функционировать, если повреждение ДНК нарушает целостность и доступность важной информации в геноме (но клетки остаются поверхностно функциональными, когда несущественные гены отсутствуют или повреждены). В зависимости от типа повреждения двойной спиральной структуры ДНК были разработаны различные стратегии восстановления потерянной информации. Если возможно, клетки используют немодифицированную комплементарную цепь ДНК или сестринскую хроматиду в качестве матрицы для восстановления исходной информации. Без доступа к шаблону клетки в крайнем случае используют подверженный ошибкам механизм восстановления, известный как трансочаговый синтез.
Повреждение ДНК изменяет пространственную конфигурацию спирали, и такие изменения могут быть обнаружены клеткой. Как только повреждение локализовано, определенные молекулы восстановления ДНК связываются в месте повреждения или рядом с ним, побуждая другие молекулы связываться и образовывать комплекс, который позволяет осуществить фактическое восстановление.
Известно, что клетки устраняют три типа повреждений своей ДНК, химически обращая их. Эти механизмы не требуют шаблона, поскольку типы повреждений, которым они противодействуют, могут возникать только на одной из четырех баз. Такие механизмы прямого обращения специфичны для типа нанесенного повреждения и не связаны с разрушением фосфодиэфирного остова. Образование димеров пиримидина при облучении УФ-светом приводит к образованию аномальной ковалентной связи между соседними пиримидиновыми основаниями. Процесс фотореактивации напрямую устраняет это повреждение под действием фермента фотолиазы , активация которого обязательно зависит от энергии, поглощаемой синим/УФ-светом ( длина волны 300–500 нм ) для стимулирования катализа. [14] Фотолиаза, старый фермент, присутствующий в бактериях , грибах и большинстве животных , больше не функционирует у людей, [15] которые вместо этого используют эксцизионную репарацию нуклеотидов для устранения повреждений, вызванных УФ-облучением. Другой тип повреждения, метилирование оснований гуанина, напрямую устраняется ферментом метилгуанинметилтрансферазой (MGMT), бактериальный эквивалент которого называется ogt . Это дорогостоящий процесс, поскольку каждую молекулу MGMT можно использовать только один раз; то есть реакция является стехиометрической , а не каталитической . [16] Обобщенный ответ бактерий на метилирующие агенты известен как адаптивный ответ и обеспечивает определенный уровень устойчивости к алкилирующим агентам при длительном воздействии за счет активации ферментов восстановления алкилирования. [17] Третий тип повреждения ДНК, обратимый клетками, — это определенное метилирование оснований цитозина и аденина.

Когда только одна из двух нитей двойной спирали имеет дефект, другую нить можно использовать в качестве шаблона для коррекции поврежденной нити. Чтобы восстановить повреждение одной из двух парных молекул ДНК, существует ряд механизмов эксцизионной репарации , которые удаляют поврежденный нуклеотид и заменяют его неповрежденным нуклеотидом, комплементарным нуклеотиду, обнаруженному в неповрежденной цепи ДНК. [16]
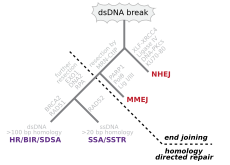
Двухцепочечные разрывы, при которых обе цепи двойной спирали разрываются, особенно опасны для клетки, поскольку могут привести к перестройкам генома . Фактически, когда двухцепочечный разрыв сопровождается поперечной связью, соединяющей две цепи в одной и той же точке, ни одна цепь не может использоваться в качестве матрицы для механизмов репарации, так что клетка не сможет завершить митоз, когда Затем он делится и либо умирает, либо, в редких случаях, подвергается мутации. [22] [23] Существуют три механизма восстановления двухцепочечных разрывов (DSB): негомологическое соединение концов (NHEJ), микрогомологическое соединение концов (MMEJ) и гомологичная рекомбинация (HR): [16] [24]

В системе in vitro MMEJ возникал в клетках млекопитающих на уровне 10–20% от HR, когда также были доступны механизмы HR и NHEJ. [32]
Экстремофил Deinococcus radiodurans обладает замечательной способностью выдерживать повреждения ДНК, вызванные ионизирующим излучением и другими источниками. По крайней мере две копии генома со случайными разрывами ДНК могут образовывать фрагменты ДНК посредством отжига . Частично перекрывающиеся фрагменты затем используются для синтеза гомологичных областей посредством движущейся D-петли , которая может продолжать удлинение до тех пор, пока не будут найдены комплементарные партнерские цепи. На заключительном этапе происходит кроссинговер посредством RecA -зависимой гомологичной рекомбинации . [35]
Топоизомеразы вносят как одно-, так и двухцепочечные разрывы в ходе изменения состояния суперспирализации ДНК , что особенно часто встречается в областях вблизи открытой репликационной вилки. Такие разрывы не считаются повреждением ДНК, поскольку они являются естественным промежуточным продуктом биохимического механизма топоизомеразы и немедленно восстанавливаются создавшими их ферментами.
Другой тип двухцепочечных разрывов ДНК происходит из термочувствительных или термолабильных участков ДНК. Эти сайты ДНК не являются исходными DSB. Однако после обработки повышенной температурой они превращаются в ДСБ. Ионизирующее облучение может вызвать очень сложную форму повреждения ДНК в виде кластерного повреждения. Он состоит из различных типов повреждений ДНК в различных местах спирали ДНК. Некоторые из этих близко расположенных поражений, вероятно, могут превратиться в DSB под воздействием высоких температур. Но точная природа этих поражений и их взаимодействие пока не известны [36].
Синтез транслезий (TLS) — это процесс толерантности к повреждениям ДНК, который позволяет механизму репликации ДНК реплицировать прошлые повреждения ДНК, такие как димеры тимина или AP-сайты . [37] Он включает в себя замену обычных ДНК-полимераз специализированными полимеразами трансповреждения (т.е. ДНК-полимеразами IV или V из семейства Y-полимераз), часто с более крупными активными сайтами, которые могут облегчить вставку оснований напротив поврежденных нуклеотидов. Считается, что переключение полимеразы опосредовано, среди других факторов, посттрансляционной модификацией фактора процессивности репликации PCNA . Полимеразы транслезионного синтеза часто имеют низкую точность (высокую склонность к вставке неправильных оснований) на неповрежденных матрицах по сравнению с обычными полимеразами. Тем не менее, многие из них чрезвычайно эффективны при вставке правильных баз против конкретных типов повреждений. Например, Pol η обеспечивает безошибочное обход поражений, вызванных УФ-облучением , тогда как Pol ι вызывает мутации в этих сайтах. Известно, что Pol η добавляет первый аденин к фотодимеру T^T с использованием пары оснований Уотсона-Крика , а второй аденин будет добавлен в его син-конформации с использованием пары оснований Хугстина . С клеточной точки зрения риск введения точечных мутаций во время синтеза транслейкоза может быть предпочтительнее, чем прибегать к более радикальным механизмам репарации ДНК, которые могут вызвать грубые хромосомные аберрации или гибель клеток. Короче говоря, в этом процессе участвуют специализированные полимеразы, которые либо обходят, либо восстанавливают повреждения в местах остановки репликации ДНК. Например, ДНК-полимераза человека эта может обходить сложные повреждения ДНК, такие как внутрицепочечная сшивка гуанин-тимина, G[8,5-Me]T, хотя она может вызывать целевые и полуцелевые мутации. [38] Паромита Райчаудхури и Ашис Басу [39] изучали токсичность и мутагенез того же поражения в Escherichia coli путем репликации G[8,5-Me]T-модифицированной плазмиды в E. coli со специфическими нокаутами ДНК-полимеразы. Жизнеспособность была очень низкой у штамма, лишенного pol II, pol IV и pol V, трех SOS-индуцируемых ДНК-полимераз, что указывает на то, что синтез транслейкоза осуществляется в основном этими специализированными ДНК-полимеразами. Обходную платформу для этих полимераз обеспечивает ядерный антиген пролиферирующих клеток (PCNA). В нормальных условиях PCNA, связанная с полимеразами, реплицирует ДНК. В месте повреждения PCNA убиквитинируется или модифицируется белками RAD6/ RAD18 . предоставить платформу для специализированных полимераз, позволяющих обойти повреждение и возобновить репликацию ДНК. [40] [41] После синтеза транслезии требуется расширение. Это расширение может быть осуществлено с помощью репликативной полимеразы, если TLS не содержит ошибок, как в случае Pol η, но если TLS приводит к несоответствию, для его расширения необходима специализированная полимераза; Пол ζ . Pol ζ уникален тем, что может расширять терминальные несоответствия, тогда как более процессивные полимеразы не могут этого сделать. Таким образом, при обнаружении повреждения репликационная вилка останавливается, PCNA переключается с процессивной полимеразы на TLS-полимеразу, такую как Pol ι, чтобы исправить повреждение, затем PCNA может переключиться на Pol ζ, чтобы расширить несоответствие, и последняя PCNA переключится. процессивной полимеразе для продолжения репликации.
Клетки, подвергающиеся воздействию ионизирующего излучения , ультрафиолетового света или химических веществ, склонны к образованию множественных участков объемных повреждений ДНК и двухцепочечных разрывов. Более того, агенты, повреждающие ДНК, могут повредить другие биомолекулы , такие как белки , углеводы , липиды и РНК . Накопление повреждений, а именно двухцепочечные разрывы или аддукты, останавливающие репликативные вилки , относятся к числу известных сигналов стимуляции глобального ответа на повреждение ДНК. [42] Глобальный ответ на повреждение представляет собой действие, направленное на сохранение клеток и запускающее множество путей восстановления макромолекул, обхода повреждений, толерантности или апоптоза . Общими чертами глобального ответа являются индукция множества генов , остановка клеточного цикла и ингибирование клеточного деления .
Упаковка эукариотической ДНК в хроматин представляет собой барьер для всех процессов, основанных на ДНК, которые требуют привлечения ферментов к местам их действия. Чтобы обеспечить восстановление ДНК, хроматин должен быть ремоделирован . У эукариот АТФ - зависимые комплексы ремоделирования хроматина и ферменты, модифицирующие гистоны, являются двумя преобладающими факторами, используемыми для осуществления этого процесса ремоделирования. [43]
Релаксация хроматина быстро происходит в месте повреждения ДНК. [44] [45] На одном из самых ранних этапов активируемая стрессом протеинкиназа, N-концевая киназа c-Jun (JNK) , фосфорилирует SIRT6 по серину 10 в ответ на двухцепочечные разрывы или другие повреждения ДНК. [46] Эта посттрансляционная модификация облегчает мобилизацию SIRT6 к сайтам повреждения ДНК и необходима для эффективного рекрутирования поли(ADP-рибозо)полимеразы 1 (PARP1) к сайтам разрыва ДНК и для эффективного восстановления DSB. [46] Белок PARP1 начинает появляться в местах повреждения ДНК менее чем за секунду, с полумаксимальным накоплением в течение 1,6 секунды после возникновения повреждения. [47] PARP1 синтезирует полимерные цепи аденозиндифосфатрибозы (поли (АДФ-рибоза) или PAR) на себе. Затем ремодератор хроматина ALC1 быстро присоединяется к продукту действия PARP1, рибозной цепи поли-АДФ, и ALC1 завершает прибытие к повреждению ДНК в течение 10 секунд после возникновения повреждения. [45] Около половины максимальной релаксации хроматина, предположительно за счет действия ALC1, происходит к 10 секундам. [45] Это позволяет активировать фермент репарации ДНК MRE11 , чтобы инициировать репарацию ДНК в течение 13 секунд. [47]
γH2AX, фосфорилированная форма H2AX , также участвует в ранних стадиях, приводящих к деконденсации хроматина после двухцепочечных разрывов ДНК. Вариант гистонов H2AX составляет около 10% гистонов H2A в хроматине человека. [48] γH2AX (H2AX, фосфорилированный по серину 139) можно обнаружить уже через 20 секунд после облучения клеток (с образованием двухцепочечного разрыва ДНК), а накопление γH2AX на половину максимального уровня происходит за одну минуту. [48] Размер хроматина с фосфорилированным γH2AX составляет около двух миллионов пар оснований в месте двухцепочечного разрыва ДНК. [48] γH2AX сам по себе не вызывает деконденсацию хроматина, но в течение 30 секунд после облучения можно обнаружить белок RNF8 в ассоциации с γH2AX. [49] RNF8 опосредует обширную деконденсацию хроматина посредством его последующего взаимодействия с CHD4 , [50] компонентом ремоделирования нуклеосом и деацетилазного комплекса NuRD .
DDB2 встречается в гетеродимерном комплексе с DDB1 . Этот комплекс далее образует комплексы с белком убиквитинлигазы CUL4A [51] и PARP1 . [52] Этот более крупный комплекс быстро связывается с УФ-индуцированным повреждением хроматина, при этом ассоциация на половине максимума завершается за 40 секунд. [51] Белок PARP1, прикрепленный как к DDB1, так и к DDB2, затем PARилирует (создает рибозную цепь поли-АДФ) на DDB2, что привлекает белок ремоделирования ДНК ALC1 . [52] Действие ALC1 расслабляет хроматин в месте повреждения ДНК УФ-излучением. Это расслабление позволяет другим белкам пути эксцизионной репарации нуклеотидов проникать в хроматин и восстанавливать вызванные УФ-излучением повреждения димера циклобутан-пиримидина .
После быстрого ремоделирования хроматина активируются контрольные точки клеточного цикла , позволяющие восстановить ДНК до того, как клеточный цикл продолжится. Во-первых, две киназы , ATM и ATR , активируются в течение 5 или 6 минут после повреждения ДНК. За этим следует фосфорилирование белка контрольной точки клеточного цикла Chk1 , запускающего его функцию, примерно через 10 минут после повреждения ДНК. [53]
После повреждения ДНК активируются контрольные точки клеточного цикла . Активация контрольной точки приостанавливает клеточный цикл и дает клетке время восстановить повреждения, прежде чем продолжить деление. Контрольные точки повреждения ДНК возникают на границах G1 / S и G2 / M . Также существует контрольная точка внутри S. Активация контрольной точки контролируется двумя мастер- киназами , ATM и ATR . ATM реагирует на двухцепочечные разрывы ДНК и нарушения структуры хроматина [54] , тогда как ATR в первую очередь реагирует на остановку вилок репликации . Эти киназы фосфорилируют нижестоящие мишени в каскаде сигнальной трансдукции , что в конечном итоге приводит к остановке клеточного цикла. Также был идентифицирован класс белков-медиаторов контрольных точек, включая BRCA1 , MDC1 и 53BP1 . [55] Эти белки, по-видимому, необходимы для передачи сигнала активации контрольной точки нижестоящим белкам.
Контрольная точка повреждения ДНК — это путь передачи сигнала , который блокирует развитие клеточного цикла в G1, G2 и метафазе и замедляет скорость прогрессирования S-фазы при повреждении ДНК . Это приводит к паузе в клеточном цикле, давая клеткам время восстановить повреждения, прежде чем продолжить деление.
Белки контрольной точки можно разделить на четыре группы: фосфатидилинозитол-3-киназа (PI3K)-подобная протеинкиназа , группа, подобная ядерному антигену пролиферирующих клеток (PCNA), две серин/треонин (S/T) киназы и их адаптеры. Центральное место во всех реакциях контрольных точек, вызванных повреждением ДНК, занимает пара крупных протеинкиназ, принадлежащих к первой группе PI3K-подобных протеинкиназ - киназы ATM ( мутированная атаксия телеангиэктазии ) и ATR (атаксия- и Rad-связанная) киназы, последовательность и функции которых хорошо сохранились в эволюции. Любой ответ на повреждение ДНК требует либо ATM, либо ATR, поскольку они обладают способностью связываться с хромосомами в месте повреждения ДНК вместе с дополнительными белками, которые являются платформами, на которых могут быть собраны компоненты ответа на повреждение ДНК и комплексы репарации ДНК.
Важной последующей мишенью ATM и ATR является р53 , поскольку он необходим для индукции апоптоза после повреждения ДНК. [56] Ингибитор циклин-зависимой киназы p21 индуцируется как p53-зависимым, так и p53-независимым механизмом и может останавливать клеточный цикл в контрольных точках G1/S и G2/M путем деактивации комплексов циклин / циклин-зависимая киназа . [57]
SOS -ответ — это изменения экспрессии генов у Escherichia coli и других бактерий в ответ на обширное повреждение ДНК. SOS -система прокариот регулируется двумя ключевыми белками: LexA и RecA . Годимер LexA представляет собой репрессор транскрипции , который связывается с операторными последовательностями, обычно называемыми SOS-боксами. Известно, что у Escherichia coli LexA регулирует транскрипцию примерно 48 генов, включая гены lexA и RecA. [58] Известно, что SOS-ответ широко распространен в домене бактерий, но он в основном отсутствует в некоторых бактериальных типах, таких как спирохеты . [59] Наиболее распространенными клеточными сигналами, активирующими SOS-ответ, являются участки одноцепочечной ДНК (оцДНК), возникающие в результате остановки вилок репликации или двухцепочечных разрывов, которые обрабатываются ДНК-хеликазой для разделения двух цепей ДНК. [42] На этапе инициации белок RecA связывается с оцДНК в реакции, управляемой гидролизом АТФ, создавая нити RecA-оцДНК. Нити RecA-оцДНК активируют активность аутопротеазы LexA , что в конечном итоге приводит к расщеплению димера LexA и последующей деградации LexA. Утрата репрессора LexA индуцирует транскрипцию генов SOS и обеспечивает дальнейшую индукцию сигнала, ингибирование деления клеток и увеличение уровней белков, ответственных за обработку повреждений.
У Escherichia coli SOS-боксы представляют собой последовательности длиной 20 нуклеотидов вблизи промоторов с палиндромной структурой и высокой степенью консервативности последовательности. В других классах и типах последовательность SOS-боксов значительно различается, имеет разную длину и состав, но всегда высококонсервативна и является одним из самых сильных коротких сигналов в геноме. [59] Высокая информативность SOS-боксов позволяет дифференциально связывать LexA с разными промоторами и позволяет определять время SOS-ответа. Гены восстановления повреждений индуцируются в начале SOS-ответа. Подверженные ошибкам полимеразы трансфекции, например, UmuCD'2 (также называемая ДНК-полимеразой V), индуцируются позже, в крайнем случае. [60] Как только повреждение ДНК восстанавливается или обходится с помощью полимераз или посредством рекомбинации, количество одноцепочечной ДНК в клетках уменьшается, уменьшение количества нитей RecA снижает активность расщепления гомодимера LexA, который затем связывается с SOS-боксами вблизи промоторы и восстанавливает нормальную экспрессию генов.
Эукариотические клетки, подвергшиеся воздействию агентов, повреждающих ДНК, также активируют важные защитные пути, индуцируя множество белков, участвующих в репарации ДНК, контроле контрольных точек клеточного цикла , транспортировке и деградации белков. Такой полногеномный транскрипционный ответ очень сложен и жестко регулируется, что позволяет скоординировать глобальный ответ на повреждение. Воздействие на дрожжи Saccharomyces cerevisiae агентов, повреждающих ДНК, приводит к перекрывающимся, но различным профилям транскрипции. Сходство с реакцией на экологический шок указывает на то, что общий глобальный путь реакции на стресс существует на уровне активации транскрипции. Напротив, разные типы клеток человека по-разному реагируют на повреждения, что указывает на отсутствие общего глобального ответа. Вероятное объяснение этой разницы между клетками дрожжей и человека может заключаться в гетерогенности клеток млекопитающих . У животного разные типы клеток распределены по разным органам, которые развили разную чувствительность к повреждению ДНК. [61]
В целом глобальный ответ на повреждение ДНК включает экспрессию множества генов, ответственных за пострепликационное восстановление , гомологичную рекомбинацию, эксцизионную репарацию нуклеотидов, контрольную точку повреждения ДНК , глобальную активацию транскрипции, гены, контролирующие распад мРНК, и многие другие. Большой объем повреждений клетки ставит ее перед важным решением: подвергнуться апоптозу и умереть или выжить ценой жизни с измененным геномом. Увеличение толерантности к повреждениям может привести к увеличению выживаемости, что приведет к большему накоплению мутаций. Дрожжевые Rev1 и полимераза человека η являются членами семейства Y-трансформальных ДНК- полимераз , присутствующих во время глобального ответа на повреждение ДНК и ответственных за усиленный мутагенез во время глобального ответа на повреждение ДНК у эукариот. [42]
Экспериментальные животные с генетическими нарушениями репарации ДНК часто демонстрируют снижение продолжительности жизни и увеличение заболеваемости раком. [13] Например, мыши с дефицитом доминантного пути NHEJ и механизмов поддержания теломер чаще заболевают лимфомой и инфекциями и, как следствие, имеют более короткую продолжительность жизни, чем мыши дикого типа. [62] Аналогичным образом, у мышей с дефицитом ключевого белка репарации и транскрипции, который раскручивает спирали ДНК, преждевременно возникают заболевания, связанные со старением, и, как следствие, сокращается продолжительность жизни. [63] Однако не каждый дефицит репарации ДНК приводит к именно предсказанным эффектам; у мышей с дефицитом пути NER наблюдалось сокращение продолжительности жизни без соответствующего более высокого уровня мутаций. [64]
Максимальная продолжительность жизни мышей , голых землекопов и человека составляет соответственно ~3, ~30 и ~129 лет . [65] Из них самый короткоживущий вид, мышь, экспрессирует гены репарации ДНК, включая основные гены в нескольких путях репарации ДНК, на более низком уровне, чем люди и голые землекопы. [65] Кроме того, несколько путей восстановления ДНК у людей и голых землекопов активируются по сравнению с мышами. Эти наблюдения позволяют предположить, что повышенная репарация ДНК способствует увеличению продолжительности жизни . [65]
Если скорость повреждения ДНК превышает способность клетки восстанавливать ее, накопление ошибок может перегрузить клетку и привести к раннему старению, апоптозу или раку. Наследственные заболевания, связанные с нарушением функции репарации ДНК, приводят к преждевременному старению, [13] повышению чувствительности к канцерогенам и, соответственно, увеличению риска развития рака (см. ниже). С другой стороны, организмы с улучшенными системами репарации ДНК, такие как Deinococcus radiodurans , наиболее устойчивый к радиации известный организм, демонстрируют замечательную устойчивость к эффектам радиоактивности , вызывающим двухцепочечный разрыв , вероятно, из-за повышенной эффективности репарации ДНК и особенно НХЭЖ. [66]
Было обнаружено, что ряд отдельных генов влияют на вариации продолжительности жизни внутри популяции организмов. Эффекты этих генов сильно зависят от окружающей среды, в частности, от питания организма. Ограничение калорий воспроизводимо приводит к увеличению продолжительности жизни у различных организмов, вероятно, за счет путей восприятия питательных веществ и снижения скорости метаболизма . Молекулярные механизмы, с помощью которых такое ограничение приводит к увеличению продолжительности жизни, пока неясны (см. обсуждение в [67] ); однако поведение многих генов, которые, как известно, участвуют в репарации ДНК, изменяется в условиях ограничения калорий. Было показано, что несколько агентов, обладающих антивозрастными свойствами, снижают конститутивный уровень передачи сигналов mTOR , что свидетельствует о снижении метаболической активности , и одновременно снижают конститутивный уровень повреждения ДНК , вызванного эндогенно генерируемыми активными формами кислорода. [68]
Например, увеличение дозировки гена SIR-2, который регулирует упаковку ДНК у нематодного червя Caenorhabditis elegans , может значительно продлить продолжительность жизни. [69] Известно, что гомолог SIR-2 млекопитающих индуцирует нижестоящие факторы репарации ДНК, участвующие в NHEJ, активность, которая особенно усиливается в условиях ограничения калорий. [70] Ограничение калорий было тесно связано со скоростью эксцизионной репарации оснований в ядерной ДНК грызунов, [71] хотя аналогичные эффекты не наблюдались в митохондриальной ДНК. [72]
Ген AGE-1 C. elegans , вышестоящий эффектор путей восстановления ДНК, обеспечивает резкое увеличение продолжительности жизни в условиях свободного кормления, но приводит к снижению репродуктивной способности в условиях ограничения калорий. [73] Это наблюдение подтверждает плейотропную теорию биологических причин старения , которая предполагает, что гены, дающие большое преимущество в выживании в раннем возрасте, будут отбираться, даже если они несут соответствующий недостаток в позднем возрасте.
Дефекты в механизме NER ответственны за несколько генетических нарушений, в том числе:
Умственная отсталость часто сопровождает два последних расстройства, что указывает на повышенную уязвимость нейронов развития.
Другие нарушения репарации ДНК включают:
Все вышеперечисленные заболевания часто называют «сегментарными прогериями » (« болезнями ускоренного старения »), поскольку заболевшие выглядят пожилыми и испытывают возрастные заболевания в аномально молодом возрасте, при этом не проявляя всех симптомов старости.
Другие заболевания, связанные со снижением функции восстановления ДНК, включают анемию Фанкони , наследственный рак молочной железы и наследственный рак толстой кишки .
Из-за присущих механизмам восстановления ДНК ограничений, если бы люди жили достаточно долго, у всех них в конечном итоге развился бы рак. [74] [75] Существует по меньшей мере 34 наследственных мутации гена репарации ДНК человека, которые увеличивают риск рака . Многие из этих мутаций приводят к тому, что восстановление ДНК становится менее эффективным, чем обычно. В частности, наследственный неполипозный колоректальный рак (HNPCC) тесно связан со специфическими мутациями в пути восстановления несоответствия ДНК. BRCA1 и BRCA2 , два важных гена, мутации которых приводят к значительному увеличению риска рака молочной железы у носителей, [76] оба связаны с большим количеством путей репарации ДНК, особенно NHEJ и гомологичной рекомбинации.
Процедуры лечения рака, такие как химиотерапия и лучевая терапия, подавляют способность клеток восстанавливать повреждения ДНК, что приводит к их гибели. Предпочтительно поражаются клетки, которые делятся наиболее быстро – чаще всего раковые клетки. Побочным эффектом является то, что поражаются и другие нераковые, но быстро делящиеся клетки, такие как клетки-предшественники в кишечнике, коже и кроветворной системе. Современные методы лечения рака пытаются локализовать повреждение ДНК в клетках и тканях, связанных только с раком, либо физическими средствами (концентрация терапевтического агента в области опухоли), либо биохимическими средствами (используя особенность, уникальную для раковых клеток в организме). . В контексте терапии, нацеленной на гены, отвечающие за повреждение ДНК, последний подход получил название «синтетическая летальность». [77]
Вероятно, наиболее известным из этих «синтетических летальных» препаратов является ингибитор поли(АДФ-рибозы) полимеразы 1 ( PARP1 ) олапариб , который был одобрен Управлением по контролю за продуктами и лекарствами в 2015 году для лечения женщин с дефектом яичников по BRCA. рак. Опухолевые клетки с частичной утратой реакции на повреждение ДНК (в частности, репарации гомологичной рекомбинации ) зависят от другого механизма – репарации одноцепочечных разрывов, который частично состоит из продукта гена PARP1. [78] Олапариб комбинируется с химиотерапевтическими средствами для ингибирования восстановления одноцепочечных разрывов, вызванных повреждением ДНК, вызванным одновременным применением химиотерапии. Опухолевые клетки, опирающиеся на этот механизм репарации остаточной ДНК, не способны восстанавливать повреждения и, следовательно, не способны выживать и пролиферировать, тогда как нормальные клетки могут восстанавливать повреждения с помощью функционирующего механизма гомологичной рекомбинации.
В настоящее время исследуются многие другие препараты для использования против других остаточных механизмов репарации ДНК, обычно встречающихся при раке. Однако синтетические подходы к лечению летальности были поставлены под сомнение из-за появляющихся доказательств приобретенной устойчивости, достигаемой за счет перестройки путей ответа на повреждение ДНК и реверсии ранее подавленных дефектов. [79]
За последние несколько лет стало очевидно, что реакция на повреждение ДНК действует как барьер на пути злокачественной трансформации предопухолевых клеток. [80] Предыдущие исследования показали повышенную реакцию на повреждение ДНК в моделях клеточных культур с активацией онкогена [81] и предопухолевыми аденомами толстой кишки. [82] Механизмы ответа на повреждение ДНК запускают остановку клеточного цикла и пытаются восстановить повреждения ДНК или способствуют гибели/старению клеток, если восстановление невозможно. Стресс репликации наблюдается в предопухолевых клетках из-за усиления сигналов пролиферации от онкогенных мутаций. Репликативный стресс характеризуется: повышенным запуском инициации/оригинации репликации; усиление транскрипции и столкновение комплексов транскрипции-репликации; дефицит нуклеотидов; увеличение активных форм кислорода (АФК). [83]
Репликативный стресс, наряду с отбором инактивирующих мутаций в генах реакции на повреждение ДНК в ходе эволюции опухоли, [84] приводит к подавлению и/или потере некоторых механизмов реакции на повреждение ДНК и, следовательно, к потере репарации ДНК и/или старению. запрограммированная гибель клеток. В экспериментальных моделях на мышах потеря клеточного старения, опосредованного реакцией на повреждение ДНК, наблюдалась после использования короткой шпилечной РНК (shRNA) для ингибирования киназы реакции двухцепочечного разрыва атаксии телеангиэктазии ( ATM ), что приводило к увеличению размера опухоли и ее инвазивности. [82] Люди, рожденные с наследственными дефектами механизмов репарации ДНК (например, синдром Ли-Фраумени ), имеют более высокий риск развития рака. [85]
Распространенность мутаций в ответ на повреждение ДНК различается в зависимости от типа рака; например, 30% инвазивных карцином молочной железы имеют мутации в генах, участвующих в гомологичной рекомбинации. [80] При раке снижение регуляции наблюдается во всех механизмах ответа на повреждение ДНК (восстановление эксцизионного основания (BER), эксцизионное восстановление нуклеотидов (NER), восстановление несоответствия ДНК (MMR), репарация гомологичной рекомбинации (HR), негомологическое соединение концов (80). NHEJ) и синтез ДНК при транслейкции (TLS). [86] Помимо мутаций в генах восстановления повреждений ДНК, мутации также возникают в генах, ответственных за остановку клеточного цикла , чтобы дать достаточно времени для восстановления ДНК, при этом в этом участвуют некоторые гены. как в восстановлении повреждений ДНК, так и в контроле контрольных точек клеточного цикла, например, ATM и киназа контрольной точки 2 (CHEK2) – супрессор опухоли, который часто отсутствует или снижается при немелкоклеточном раке легких [87] .
Классически рак рассматривался как совокупность заболеваний, вызванных прогрессирующими генетическими аномалиями, включающими мутации в генах-супрессорах опухолей и онкогенах, а также хромосомные аберрации. Однако стало очевидно, что рак также обусловлен эпигенетическими изменениями . [88]
Эпигенетические изменения относятся к функционально значимым модификациям генома, которые не связаны с изменением нуклеотидной последовательности. Примерами таких модификаций являются изменения метилирования ДНК (гиперметилирование и гипометилирование) и модификации гистонов , [89] изменения в хромосомной архитектуре (вызванные несоответствующей экспрессией белков, таких как HMGA2 или HMGA1 ) [90] и изменения, вызванные микроРНК . Каждое из этих эпигенетических изменений служит для регуляции экспрессии генов без изменения базовой последовательности ДНК . Эти изменения обычно сохраняются в результате деления клеток , длятся несколько поколений клеток и могут рассматриваться как эпимутации (эквивалентные мутациям).
Хотя при раке обнаруживается большое количество эпигенетических изменений, эпигенетические изменения в генах репарации ДНК, вызывающие снижение экспрессии белков репарации ДНК, кажутся особенно важными. Считается, что такие изменения происходят на ранних стадиях развития рака и являются вероятной причиной генетической нестабильности , характерной для рака. [91] [92] [93]
Снижение экспрессии генов репарации ДНК приводит к недостаточной репарации ДНК. Когда репарация ДНК недостаточна, повреждения ДНК остаются в клетках на более высоком, чем обычно, уровне, и эти избыточные повреждения вызывают повышенную частоту мутаций или эпимутаций. Частота мутаций существенно увеличивается в клетках, дефектных в репарации несоответствия ДНК [94] [95] или в гомологичной рекомбинационной репарации (HRR). [96] Хромосомные перестройки и анеуплоидия также увеличиваются в HRR-дефектных клетках. [97]
Более высокие уровни повреждения ДНК не только вызывают усиление мутаций, но и усиление эпимутации. Во время репарации двухцепочечных разрывов ДНК или других повреждений ДНК не полностью очищенные участки репарации могут вызывать эпигенетическое молчание генов. [98] [99]
Недостаточная экспрессия белков репарации ДНК из-за наследственной мутации может вызвать повышенный риск развития рака. Лица с унаследованным нарушением любого из 34 генов репарации ДНК (см. статью « Расстройство, связанное с дефицитом репарации ДНК ») имеют повышенный риск развития рака, при этом некоторые дефекты вызывают до 100% вероятность возникновения рака на протяжении всей жизни (например, мутации p53). [100] Однако такие мутации зародышевой линии (которые вызывают синдромы высокопроникающего рака) являются причиной лишь около 1 процента случаев рака. [101]
Дефицит ферментов репарации ДНК иногда вызван вновь возникающей соматической мутацией в гене репарации ДНК, но гораздо чаще вызван эпигенетическими изменениями, которые снижают или подавляют экспрессию генов репарации ДНК. Например, когда последовательно исследовали 113 случаев колоректального рака, только четыре имели миссенс-мутацию в гене репарации ДНК MGMT , в то время как у большинства наблюдалось снижение экспрессии MGMT из-за метилирования области промотора MGMT (эпигенетическое изменение). [102] Пять различных исследований показали, что от 40% до 90% случаев колоректального рака снижают экспрессию MGMT из-за метилирования области промотора MGMT. [103] [104] [105] [106] [107]
Аналогичным образом, из 119 случаев колоректального рака с дефицитом репарации ошибочного спаривания, при котором отсутствовала экспрессия гена репарации ДНК PMS2 , PMS2 был дефицитным в 6 из-за мутаций в гене PMS2, тогда как в 103 случаях экспрессия PMS2 была недостаточной, потому что его партнер по спариванию MLH1 был подавлен из-за метилированию промотора (белок PMS2 нестабильен в отсутствие MLH1). [108] В остальных 10 случаях потеря экспрессии PMS2, вероятно, была связана с эпигенетической сверхэкспрессией микроРНК , miR -155 , которая подавляет MLH1. [109]
В следующем примере эпигенетические дефекты были обнаружены при различных видах рака (например, рака молочной железы, яичников, колоректального рака, а также рака головы и шеи). Два или три дефицита экспрессии ERCC1 , XPF или PMS2 встречаются одновременно в большинстве из 49 случаев рака толстой кишки, оцененных Facista et al. [110]
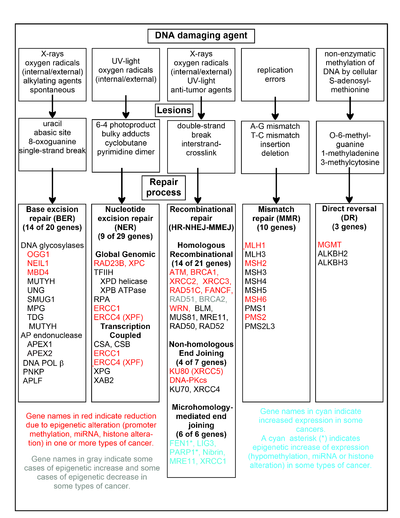
В таблице в этом разделе показаны некоторые часто встречающиеся агенты, повреждающие ДНК, примеры повреждений ДНК, которые они вызывают, и пути, которые устраняют эти повреждения ДНК. По крайней мере 169 ферментов либо непосредственно участвуют в репарации ДНК, либо влияют на процессы репарации ДНК. [111] Из них 83 непосредственно задействованы в восстановлении 5 типов повреждений ДНК, показанных на диаграмме. [ нужна цитата ]
Некоторые из наиболее хорошо изученных генов, играющих центральную роль в процессах восстановления, показаны на диаграмме. Обозначения генов, выделенные красным, серым или голубым цветом, указывают на гены, которые часто эпигенетически изменяются при различных типах рака. Статьи в Википедии о каждом из генов, выделенных красным, серым или голубым, описывают эпигенетические изменения и рак, при которых обнаруживаются эти эпимутации. Обзорные статьи [112] и обширные экспериментальные обзорные статьи [113] [114] также документируют большинство этих нарушений эпигенетической репарации ДНК при раке.
Гены, выделенные красным, часто редуцируются или подавляются эпигенетическими механизмами при различных видах рака. Когда экспрессия этих генов низкая или отсутствует, повреждения ДНК могут накапливаться. Ошибки репликации, выходящие за пределы этих повреждений (см. Синтез транслезий), могут привести к увеличению количества мутаций и, в конечном итоге, к раку. Эпигенетическая репрессия генов репарации ДНК в точных путях репарации ДНК, по-видимому, играет центральную роль в канцерогенезе .
Два выделенных серым гена RAD51 и BRCA2 необходимы для гомологичной рекомбинационной репарации. Иногда они эпигенетически сверхэкспрессируются, а иногда и недостаточно экспрессируются при некоторых видах рака. Как указано в статьях Википедии о RAD51 и BRCA2 , такие виды рака обычно имеют эпигенетический дефицит других генов репарации ДНК. Эти недостатки репарации, вероятно, приведут к увеличению невосстановленных повреждений ДНК. Сверхэкспрессия RAD51 и BRCA2 , наблюдаемая при этих видах рака, может отражать селективное давление на компенсаторную сверхэкспрессию RAD51 или BRCA2 и усиление гомологичной рекомбинационной репарации, чтобы хотя бы частично справиться с такими избыточными повреждениями ДНК. В тех случаях, когда RAD51 или BRCA2 недостаточно экспрессируются, это само по себе может привести к увеличению невосстановленных повреждений ДНК. Ошибки репликации, выходящие за рамки этих повреждений (см. Синтез транслезий), могут вызвать увеличение числа мутаций и рак, так что недостаточная экспрессия RAD51 или BRCA2 сама по себе будет канцерогенной.
Гены, выделенные голубым цветом, участвуют в пути соединения концов, опосредованном микрогомологией (MMEJ), и их активация повышается при раке. MMEJ — это дополнительный, подверженный ошибкам и неточный путь восстановления двухцепочечных разрывов. При репарации двухцепочечного разрыва MMEJ гомология 5–25 комплементарных пар оснований между обеими парными цепями достаточна для выравнивания цепей, но обычно присутствуют несовпадающие концы (лоскуты). MMEJ удаляет лишние нуклеотиды (лоскуты) в местах соединения цепей, а затем лигирует нити, чтобы создать неповрежденную двойную спираль ДНК. MMEJ почти всегда включает хотя бы небольшую делецию, так что это мутагенный путь. [24] FEN1 , эндонуклеаза лоскута в MMEJ, эпигенетически увеличивается за счет гипометилирования промотора и сверхэкспрессируется в большинстве случаев рака молочной железы, [115] простаты, [116] желудка, [117] [118] нейробластом, [24] 119] поджелудочная железа, [120] и легкие. [121] PARP1 также сверхэкспрессируется, когда сайт ETS его промоторной области эпигенетически гипометилирован, и это способствует прогрессированию рака эндометрия [122] и серозного рака яичников с мутацией BRCA. [123] Другие гены пути MMEJ также сверхэкспрессируются при ряде видов рака (краткое описание см. в MMEJ ) и также показаны голубым цветом.
Дифференциальная активность путей репарации ДНК в различных областях генома человека приводит к тому, что мутации распределяются внутри опухолевых геномов очень неравномерно. [124] [125] В частности, богатые генами и рано реплицирующиеся области человеческого генома демонстрируют более низкую частоту мутаций, чем бедный генами и поздно реплицирующийся гетерохроматин . Один из механизмов, лежащих в основе этого, включает модификацию гистонов H3K36me3 , которая может рекрутировать белки репарации ошибочных спариваний , [126] тем самым снижая частоту мутаций в H3K36me3 -маркированных областях. [127] Другой важный механизм касается эксцизионной репарации нуклеотидов , которая может быть задействована с помощью транскрипционного аппарата, снижая частоту соматических мутаций в активных генах [125] и других открытых областях хроматина. [128]
Повреждения ДНК очень распространены и постоянно восстанавливаются. Эпигенетические изменения могут сопровождать восстановление ДНК в результате окислительного повреждения или двухцепочечных разрывов. В клетках человека окислительное повреждение ДНК происходит примерно 10 000 раз в день, а двухцепочечные разрывы ДНК происходят примерно от 10 до 50 раз за клеточный цикл в соматических реплицирующихся клетках (см. Повреждение ДНК (естественное) ). Избирательное преимущество репарации ДНК заключается в том, что она позволяет клетке выжить даже после повреждения ДНК. Избирательное преимущество эпигенетических изменений, возникающих при репарации ДНК, неясно. [ нужна цитата ]
В устойчивом состоянии (при возникновении и восстановлении эндогенных повреждений) в средней ДНК клеток млекопитающих имеется около 2400 окислительно поврежденных гуанинов, которые образуют 8-оксо-2'-дезоксигуанозин (8-OHdG). [129] 8-OHdG составляет около 5% окислительных повреждений, обычно присутствующих в ДНК. [130] Окисленные гуанины не встречаются случайно среди всех гуанинов в ДНК. Существует предпочтение последовательности гуанина в метилированном сайте CpG (за цитозином следует гуанин в направлении 5' → 3' и там, где цитозин метилирован (5-mCpG)). [131] Сайт 5-mCpG имеет самый низкий потенциал ионизации для окисления гуанина.

Окисленный гуанин обладает потенциалом неправильного спаривания и является мутагенным. [133] Оксогуанингликозилаза (OGG1) является основным ферментом, ответственным за удаление окисленного гуанина во время репарации ДНК. OGG1 находит 8-OHdG и связывается с ним в течение нескольких секунд. [134] Однако OGG1 не удаляет 8-OHdG немедленно. В клетках HeLa половина максимального удаления 8-OHdG происходит за 30 минут [135] , а у облученных мышей 8-OHdG, индуцированные в печени мышей, удаляются с периодом полураспада 11 минут. [130]
Когда OGG1 присутствует в окисленном гуанине в метилированном сайте CpG, он привлекает TET1 к повреждению 8-OHdG (см. Рисунок). Это позволяет TET1 деметилировать соседний метилированный цитозин. Деметилирование цитозина является эпигенетическим изменением. [ нужна цитата ]
Например, когда эпителиальные клетки молочной железы человека обрабатывались H 2 O 2 в течение шести часов, содержание 8-OHdG в ДНК увеличивалось примерно в 3,5 раза, что вызывало примерно 80% деметилирование 5-метилцитозинов в геноме. [132] Деметилирование CpG в промоторе гена под действием активности фермента ТЕТ увеличивает транскрипцию гена в информационную РНК. [136] В клетках, обработанных H 2 O 2 , исследовали один конкретный ген, BACE1 . [132] Уровень метилирования CpG-островка BACE1 был снижен (эпигенетическое изменение), что позволило примерно в 6,5 раз увеличить экспрессию информационной РНК BACE1 . [ нужна цитата ]
В то время как шестичасовая инкубация с H 2 O 2 вызывает значительное деметилирование сайтов 5-mCpG, более короткое время инкубации с H 2 O 2 , по-видимому, способствует другим эпигенетическим изменениям. Обработка клеток H 2 O 2 в течение 30 минут приводит к тому, что гетеродимер белка репарации несоответствия MSH2-MSH6 рекрутирует ДНК-метилтрансферазу 1 (DNMT1) в места некоторых видов окислительного повреждения ДНК. [137] Это может вызвать повышенное метилирование цитозинов (эпигенетические изменения) в этих местах.
Цзян и др. [138] обрабатывали клетки HEK 293 агентами, вызывающими окислительное повреждение ДНК ( бромат калия (KBrO3) или хромат калия (K2CrO4)). Базовая эксцизионная репарация (BER) окислительного повреждения происходила с помощью фермента репарации ДНК- полимеразы бета , локализующегося на окисленных гуанинах. Полимераза бета является основной полимеразой человека при коротком BER окислительного повреждения ДНК. Цзян и др. [138] также обнаружили, что полимераза бета рекрутирует белок ДНК-метилтрансферазы DNMT3b в сайты репарации BER. Затем они оценили характер метилирования на уровне одного нуклеотида в небольшой области ДНК, включая область промотора и область ранней транскрипции гена BRCA1 . Окислительное повреждение ДНК броматом модулировало характер метилирования ДНК (вызывая эпигенетические изменения) в сайтах CpG в исследуемой области ДНК. В необработанных клетках CpG, расположенные в местах -189, -134, -29, -19, +16 и +19 гена BRCA1, имели метилированные цитозины (где нумерация ведется от места начала транскрипции информационной РНК , а отрицательные числа указывают на нуклеотиды в вышележащая промоторная область). Окисление, вызванное обработкой броматом, привело к потере метилирования цитозина в точках -189, -134, +16 и +19, а также привело к образованию нового метилирования в CpG, расположенных в точках -80, -55, -21 и +8 после Репарация ДНК была разрешена. [ нужна цитата ]
По крайней мере в четырех статьях сообщается о привлечении ДНК-метилтрансферазы 1 (DNMT1) к участкам двухцепочечных разрывов ДНК. [139] [140] [98] [141] Во время гомологичной рекомбинационной репарации (HR) двухцепочечного разрыва участие DNMT1 приводит к тому, что две восстановленные цепи ДНК имеют разные уровни метилированных цитозинов. Одна цепь часто метилируется примерно в 21 сайте CpG ниже восстановленного двухцепочечного разрыва. Другая цепь ДНК теряет метилирование примерно в шести сайтах CpG, которые ранее были метилированы после двухцепочечного разрыва, а также теряет метилирование примерно в пяти сайтах CpG, которые ранее были метилированы перед двухцепочечным разрывом. Когда хромосома реплицируется, это приводит к появлению одной дочерней хромосомы, которая сильно метилирована ниже предыдущего сайта разрыва, и одной, которая неметилирована в области как выше, так и ниже предыдущего сайта разрыва. Что касается гена, который был сломан в результате двухцепочечного разрыва, половина клеток-потомков экспрессирует этот ген на высоком уровне, а в другой половине клеток-потомков экспрессия этого гена подавляется. Когда клоны этих клеток хранились в течение трех лет, новые закономерности метилирования сохранялись в течение этого периода времени. [142]
У мышей с CRISPR-опосредованной вставкой рекомбинации, направленной на гомологию, в их геноме наблюдалось большое количество повышенного метилирования сайтов CpG внутри вставки, связанной с двухцепочечным разрывом. [143]
Восстановление двухцепочечного разрыва с помощью негомологичного соединения концов (NHEJ) может вызвать небольшое количество деметилирований ранее существовавших метилирований цитозиновой ДНК ниже восстановленного двухцепочечного разрыва. [140] Дальнейшая работа Аллена и др. [144] показали, что NHEJ двухцепочечного разрыва ДНК в клетке может давать начало некоторым потомкам клеток, имеющих репрессированную экспрессию гена, несущего первоначальный двухцепочечный разрыв, и некоторым потомкам, имеющим высокую экспрессию этого гена из-за эпигенетических изменений, связанных с с ремонтом NHEJ. Частота эпигенетических изменений, вызывающих репрессию гена после репарации NHEJ двухцепочечного разрыва ДНК в этом гене, может составлять около 0,9%. [98]
Основные процессы репарации ДНК высоко консервативны как у прокариот , так и у эукариот и даже у бактериофагов ( вирусов , поражающих бактерии ); однако более сложные организмы с более сложными геномами имеют соответственно более сложные механизмы восстановления. [145] Способность большого количества структурных мотивов белков катализировать соответствующие химические реакции сыграла значительную роль в разработке механизмов репарации в ходе эволюции. Чрезвычайно подробный обзор гипотез, касающихся эволюции репарации ДНК, см. [146]
Летопись окаменелостей указывает на то, что одноклеточная жизнь начала распространяться на планете в какой-то момент в докембрийский период, хотя точно неясно, когда именно возникла современная жизнь. Нуклеиновые кислоты стали единственным и универсальным средством кодирования генетической информации, требующим механизмов репарации ДНК, которые в своей основной форме были унаследованы всеми существующими формами жизни от их общего предка. Появление на Земле богатой кислородом атмосферы (известной как « кислородная катастрофа ») из-за фотосинтезирующих организмов, а также наличие потенциально повреждающих свободных радикалов в клетке из-за окислительного фосфорилирования , вызвало необходимость эволюции механизмов репарации ДНК, действующих специфическим образом. для противодействия типам повреждений, вызванных окислительным стрессом . Однако механизм, благодаря которому это произошло, неясен. [ нужна цитата ]
В некоторых случаях повреждение ДНК не восстанавливается или восстанавливается с помощью механизма, подверженного ошибкам, что приводит к изменению исходной последовательности. Когда это происходит, мутации могут распространиться на геномы потомства клетки. Если такое событие произойдет в клетке зародышевой линии , которая в конечном итоге продуцирует гамету , мутация может быть передана потомству организма. Скорость эволюции конкретного вида (или конкретного гена) является функцией скорости мутаций. Как следствие, скорость и точность механизмов репарации ДНК оказывают влияние на процесс эволюционных изменений. [147] Защита и восстановление повреждений ДНК не влияют на скорость адаптации за счет регуляции генов, а также за счет рекомбинации и отбора аллелей. С другой стороны, восстановление и защита повреждений ДНК действительно влияет на скорость накопления непоправимых, полезных, расширяющих код наследственных мутаций и замедляет эволюционный механизм расширения генома организмов с новыми функциональными возможностями. Противоречие между эволюционируемостью и восстановлением и защитой мутаций требует дальнейшего изучения. [ нужна цитата ]
В 2012 году была открыта технология, названная кластеризованными короткими палиндромными повторами с регулярными промежутками (сокращенно CRISPR -Cas9). Новая технология позволяет любому человеку, имеющему образование в области молекулярной биологии, с точностью изменять гены любого вида, вызывая повреждение ДНК в определенной точке, а затем изменение механизмов репарации ДНК для вставки новых генов. [148] Это дешевле, эффективнее и точнее, чем другие технологии. С помощью CRISPR-Cas9 ученые могут редактировать части генома, удаляя, добавляя или изменяя части последовательности ДНК. [ нужна цитата ]
Если бы мы жили достаточно долго, рано или поздно мы все заболели бы раком.
Определенную неснижаемую фоновую заболеваемость раком следует ожидать независимо от обстоятельств: мутаций никогда нельзя полностью избежать, поскольку они являются неизбежным следствием фундаментальных ограничений точности репликации ДНК, как обсуждалось в главе 5. Если бы человек мог жить долго более того, неизбежно, что по крайней мере одна из его или ее клеток в конечном итоге накопит набор мутаций, достаточный для развития рака.