Болезнь Гентингтона ( БГ ), также известная как хорея Гентингтона , является неизлечимым нейродегенеративным заболеванием [7] , которое в основном передается по наследству . [8] Самыми ранними симптомами часто являются едва заметные проблемы с настроением или умственными/психическими способностями. [9] [1] Часто следуют общее отсутствие координации и неустойчивая походка . [2] Это также заболевание базальных ганглиев, вызывающее гиперкинетическое двигательное расстройство, известное как хорея . [10] [11] По мере прогрессирования болезни нескоординированные, непроизвольные движения тела при хорее становятся более очевидными. [1] Физические способности постепенно ухудшаются, пока координированные движения не станут затруднительными, и человек не сможет говорить. [1] [2] Умственные способности обычно снижаются до слабоумия , депрессии, апатии и временами импульсивности. [9] [12] [3] Конкретные симптомы несколько различаются у разных людей. [1] Симптомы обычно проявляются в возрасте от 30 до 50 лет и могут проявиться в любом возрасте, но обычно проявляются около 40 лет. [12] [9] [3] [4] Заболевание может развиваться раньше в каждом последующем поколении . [1] Около восьми процентов случаев начинаются до 20 лет и известны как ювенильная болезнь Паркинсона , которая обычно проявляется симптомами замедления движений, характерными для болезни Паркинсона, а не для хореи. [3]
HD обычно наследуется от пораженного родителя , который несет мутацию в гене хантингтина ( HTT ). [4] Однако до 10% случаев обусловлены новой мутацией. [1] Ген хантингтина обеспечивает генетическую информацию для белка хантингтина (Htt). [1] Расширение CAG-повторов цитозина - аденина - гуанина (известное как расширение тринуклеотидного повтора ) в гене, кодирующем белок хантингтина, приводит к образованию аномального мутантного белка (mHtt), который постепенно повреждает клетки мозга посредством ряда возможных механизмов. [8] [13] Мутантный белок является доминантным , поэтому наличие одного из родителей, являющегося носителем признака, достаточно для того, чтобы вызвать заболевание у их детей. Диагностика проводится с помощью генетического тестирования , которое может быть проведено в любое время, независимо от наличия симптомов. [5] Этот факт поднимает несколько этических споров: возраст, в котором человек считается достаточно зрелым, чтобы выбрать тестирование; имеют ли родители право проводить тестирование своих детей; и управление конфиденциальностью и раскрытием результатов испытаний. [2]
Неизвестно лекарство от HD, и на поздних стадиях требуется постоянный уход. [2] Лечение может облегчить некоторые симптомы, а в некоторых случаях улучшить качество жизни . [3] Лучшим доказательством эффективности лечения проблем с движением является тетрабеназин . [3] HD поражает около 4–15 из 100 000 человек европейского происхождения. [1] [3] Это редкое заболевание среди финнов и японцев, в то время как частота его возникновения в Африке неизвестна. [3] Заболевание поражает мужчин и женщин в равной степени. [3] Осложнения, такие как пневмония , болезни сердца и физические травмы от падений, сокращают продолжительность жизни; хотя фатальная аспирационная пневмония обычно упоминается как конечная причина смерти для людей с этим заболеванием. [14] [12] [3] Самоубийство является причиной смерти примерно в 9% случаев. [3] Смерть обычно наступает через 15–20 лет с момента первого обнаружения заболевания. [4]
Самое раннее известное описание заболевания было сделано в 1841 году американским врачом Чарльзом Оскаром Уотерсом. [15] Состояние было подробно описано в 1872 году американским врачом Джорджем Хантингтоном . [15] Генетическая основа была обнаружена в 1993 году в результате международного сотрудничества под руководством Фонда наследственных заболеваний . [16] [17] Научно-исследовательские и вспомогательные организации начали формироваться в конце 1960-х годов для повышения осведомленности общественности, оказания поддержки отдельным лицам и их семьям и содействия исследованиям. [17] [18] Направления исследований включают определение точного механизма заболевания, улучшение моделей животных для помощи в исследованиях, тестирование лекарств и их доставку для лечения симптомов или замедления прогрессирования заболевания, а также изучение таких процедур, как терапия стволовыми клетками с целью замены поврежденных или утраченных нейронов. [16]
Признаки и симптомы болезни Гентингтона чаще всего становятся заметными в возрасте от 30 до 50 лет, но они могут начаться в любом возрасте [4] и проявляться в виде триады двигательных, когнитивных и психиатрических симптомов. [19] При развитии на ранней стадии это известно как ювенильная болезнь Гентингтона. [20] В 50% случаев сначала появляются психиатрические симптомы. [19] Их прогрессирование часто описывается на ранних стадиях, средних стадиях и поздних стадиях с более ранней продромальной фазой. [2] На ранних стадиях возникают едва заметные изменения личности, проблемы с познанием и физическими навыками, раздражительность и перепады настроения, все из которых могут остаться незамеченными, [21] [22] и они обычно предшествуют двигательным симптомам. [23] Почти у всех с HD в конечном итоге проявляются схожие физические симптомы, но начало, прогрессирование и степень когнитивных и поведенческих симптомов значительно различаются у разных людей. [24] [25]
Наиболее характерными начальными физическими симптомами являются судорожные, случайные и неконтролируемые движения, называемые хореей . [10] Многие люди не осознают своих непроизвольных движений или затрудняются ими. [1] Хорея может изначально проявляться как общее беспокойство, небольшие непреднамеренно инициированные или незавершенные движения, отсутствие координации или замедленные саккадические движения глаз . [26] Эти незначительные двигательные нарушения обычно предшествуют более очевидным признакам двигательной дисфункции по крайней мере на три года. [27] Явное проявление симптомов, таких как ригидность, извивающиеся движения или ненормальное положение тела , появляется по мере прогрессирования расстройства. [26] Это признаки того, что система мозга, отвечающая за движение, была затронута. [28] Психомоторные функции становятся все более нарушенными, так что любое действие, требующее мышечного контроля, нарушается. Когда нарушается мышечный контроль, такой как ригидность или мышечная контрактура, это известно как дистония . Дистония — это неврологическое гиперкинетическое двигательное расстройство, которое приводит к скручивающим или повторяющимся движениям, которые могут напоминать тремор. Распространенными последствиями являются физическая нестабильность, ненормальное выражение лица и трудности с жеванием, глотанием и речью . [26] Нарушения сна и потеря веса также являются сопутствующими симптомами. [29] Трудности с приемом пищи обычно вызывают потерю веса и могут привести к недоеданию. [30] [31] Потеря веса распространена у людей с болезнью Хантингтона и прогрессирует вместе с болезнью. Ювенильная болезнь Хантингтона обычно прогрессирует более быстрыми темпами с более выраженным снижением когнитивных способностей, а хорея проявляется ненадолго, если вообще проявляется; вариант Вестфаля с замедленностью движений , ригидностью и тремором более типичен для ювенильной болезни Хантингтона, как и судороги . [26] [29]
Когнитивные способности постепенно ухудшаются и, как правило, переходят в слабоумие . [3] Особенно страдают исполнительные функции , которые включают планирование, когнитивную гибкость, абстрактное мышление , усвоение правил, инициирование соответствующих действий и торможение ненадлежащих действий. Различные когнитивные нарушения включают трудности с концентрацией внимания на задачах, отсутствие гибкости, отсутствие импульса, отсутствие осознания собственного поведения и способностей и трудности с обучением или обработкой новой информации. По мере прогрессирования заболевания, как правило, появляются дефициты памяти . Сообщаемые нарушения варьируются от дефицита кратковременной памяти до трудностей с долговременной памятью , включая дефицит эпизодической (память о своей жизни), процедурной (память тела о том, как выполнять действие) и рабочей памяти . [28]
Сообщаемые нейропсихиатрические признаки включают тревогу , депрессию , сниженное проявление эмоций , эгоцентризм , агрессию и компульсивное поведение , а также галлюцинации и бред . [32] Другие распространенные психиатрические расстройства могут включать обсессивно-компульсивное расстройство , манию , бессонницу и биполярное расстройство . Также наблюдались трудности с распознаванием негативных выражений других людей. [ 28] Распространенность этих симптомов сильно различается между исследованиями, при этом предполагаемые показатели распространенности психических расстройств в течение жизни составляют от 33 до 76%. [32] Для многих больных и их семей эти симптомы являются одними из самых тревожных аспектов заболевания, часто влияющими на повседневное функционирование и являющимися причиной для помещения в лечебницу . [32] Ранние поведенческие изменения при HD приводят к повышенному риску самоубийства. [10] Часто у людей снижается осведомленность о хорее, когнитивных и эмоциональных нарушениях. [33]
Мутантный хантингтин экспрессируется по всему телу и связан с аномалиями в периферических тканях, которые напрямую вызваны такой экспрессией вне мозга. Эти аномалии включают атрофию мышц , сердечную недостаточность , нарушение толерантности к глюкозе , потерю веса , остеопороз и атрофию яичек . [34]
У каждого человека есть две копии гена хантингтина ( HTT ), который кодирует белок хантингтина (Htt). HTT также называют геном HD и геном IT15 (интересный транскрипт 15). Часть этого гена представляет собой повторяющийся участок, называемый расширением тринуклеотидного повтора – короткий повтор , длина которого варьируется у разных людей и может изменяться между поколениями. Если повтор присутствует в здоровом гене, динамическая мутация может увеличить количество повторов и привести к дефектному гену. Когда длина этого повторяющегося участка достигает определенного порога, он производит измененную форму белка, называемую мутантным белком хантингтина (mHtt). Различные функции этих белков являются причиной патологических изменений, которые, в свою очередь, вызывают симптомы заболевания. Мутация болезни Хантингтона является генетически доминантной и почти полностью пенетрантной ; мутация любого из аллелей HTT человека вызывает заболевание. Оно наследуется не по полу, а по длине повторяющегося участка гена; следовательно, на его тяжесть может влиять пол пораженного родителя. [26]
HD является одним из нескольких нарушений тринуклеотидных повторов , которые вызваны длиной повторяющегося участка гена, превышающей нормальный диапазон. [26] Ген HTT расположен на коротком плече хромосомы 4 [26] в 4p16.3. HTT содержит последовательность из трех оснований ДНК — цитозин-аденин-гуанин (CAG), — повторяющуюся многократно (т. е. ... CAGCAGCAG ...), известную как тринуклеотидный повтор. [26] CAG — это трехбуквенный генетический код ( кодон ) для аминокислоты глутамина , поэтому их серия приводит к образованию цепи глутамина, известной как полиглутаминовый тракт (или тракт полиQ), и повторяющейся части гена, области полиQ . [35]
.jpg/440px-Huntington's_disease_(5880985560).jpg)
Обычно у людей в области полиQ имеется менее 36 повторяющихся глутаминов, что приводит к образованию цитоплазматического белка хантингтина. [26] Однако последовательность из 36 или более глутаминов приводит к образованию белка с другими характеристиками. [26] Эта измененная форма, называемая мутантным хантингтином (mHtt), увеличивает скорость распада определенных типов нейронов . Области мозга имеют разное количество и зависимость от этих типов нейронов и соответственно страдают. [26] Как правило, количество повторов CAG связано с тем, насколько сильно затронут этот процесс, и составляет около 60% вариации возраста появления симптомов. Оставшаяся вариация приписывается окружающей среде и другим генам, которые изменяют механизм HD. [26] Около 36–39 повторов приводят к форме заболевания со сниженной пенетрантностью, с гораздо более поздним началом и более медленным прогрессированием симптомов. В некоторых случаях начало может быть настолько поздним, что симптомы никогда не замечаются. [26] При очень большом количестве повторов (более 60) начало HD может произойти в возрасте до 20 лет, известном как ювенильная HD. Ювенильная HD обычно относится к варианту Вестфаля, который характеризуется замедленностью движений, ригидностью и тремором. Это составляет около 7% носителей HD. [36] [37]

Болезнь Хантингтона имеет аутосомно-доминантный тип наследования, что означает, что пораженный человек обычно наследует одну копию гена с расширенным тринуклеотидным повтором (мутантный аллель ) от пораженного родителя. [26] Поскольку пенетрантность мутации очень высока, те, у кого есть мутировавшая копия гена, будут иметь заболевание. При этом типе наследования каждый потомок пораженного человека имеет 50% риск унаследовать мутантный аллель, поэтому они поражены расстройством (см. рисунок). Эта вероятность не зависит от пола. [38] Гены, зависящие от пола или сцепленные с полом, представляют собой признаки, которые находятся на X- или Y-хромосомах. [39]
Тринуклеотидные CAG-повторы, насчитывающие более 28, нестабильны во время репликации , и эта нестабильность увеличивается с числом присутствующих повторов. [26] Обычно это приводит к новым расширениям по мере смены поколений ( динамические мутации ) вместо воспроизведения точной копии тринуклеотидного повтора. [26] Это приводит к изменению числа повторов в последовательных поколениях, так что непораженный родитель с «промежуточным» числом повторов (28–35) или «пониженной пенетрантностью» (36–40) может передать копию гена с увеличенным числом повторов, что приводит к полностью пенетрантному HD. [26] Более ранний возраст начала и большая тяжесть заболевания в последовательных поколениях из-за увеличения числа повторов известны как генетическое антиципирование . [1] Нестабильность сильнее в сперматогенезе , чем в оогенезе ; [26] аллели, унаследованные по материнской линии, обычно имеют одинаковую длину повторов, тогда как аллели, унаследованные по отцовской линии, имеют более высокую вероятность увеличения длины. [26] [40] Редко болезнь Гентингтона вызывается новой мутацией , когда ни у одного из родителей нет более 36 повторов CAG. [41]
В редких случаях, когда у обоих родителей есть расширенный ген HD, риск увеличивается до 75%, а когда у одного из родителей есть две расширенные копии, риск составляет 100% (все дети будут поражены). Люди с обоими пораженными генами встречаются редко. Некоторое время HD считалось единственным заболеванием, при котором наличие второго мутировавшего гена не влияет на симптомы и прогрессирование, [42], но с тех пор было обнаружено, что это может влиять на фенотип и скорость прогрессирования. [26] [43]
Белок Хантингтин взаимодействует с более чем 100 другими белками и, по-видимому, имеет множество функций. [44] Поведение мутировавшего белка (mHtt) не полностью изучено, но он токсичен для определенных типов клеток, особенно клеток мозга . Раннее повреждение наиболее очевидно в подкорковых базальных ганглиях , первоначально в полосатом теле , но по мере прогрессирования заболевания поражаются и другие области мозга, включая области коры головного мозга . Ранние симптомы связаны с функциями полосатого тела и его корковых связей, а именно с контролем движения, настроения и высшей когнитивной функции. [26] Метилирование ДНК также, по-видимому, изменяется при HD. [45]
Htt экспрессируется во всех клетках, причем самые высокие концентрации обнаружены в мозге и яичках , а умеренные количества — в печени , сердце и легких . Его функции неясны, но он взаимодействует с белками, участвующими в транскрипции , клеточной сигнализации и внутриклеточной транспортировке . [46] У животных, генетически модифицированных для проявления HD, было выявлено несколько функций Htt. [47] У этих животных Htt важен для эмбрионального развития, поскольку его отсутствие связано с эмбриональной смертью. Считается, что каспаза , фермент, который играет роль в катализе апоптоза , активируется мутировавшим геном посредством повреждения системы убиквитин-протеаза. Он также действует как антиапоптотический агент, предотвращая запрограммированную гибель клеток , и контролирует выработку нейротрофического фактора, полученного из мозга , белка, который защищает нейроны и регулирует их создание во время нейрогенеза . Htt также облегчает синаптическую везикулярную транспортировку и синаптическую передачу , а также контролирует транскрипцию нейронных генов. [47] Если экспрессия Htt увеличивается, выживаемость клеток мозга улучшается, а эффекты mHtt уменьшаются, тогда как когда экспрессия Htt уменьшается, полученные характеристики больше похожи на те, которые наблюдаются при наличии mHtt. [47] Соответственно, считается, что заболевание вызвано не недостаточным производством Htt, а токсическим усилением функции mHtt в организме. [26]

Токсическое действие mHtt может проявляться и вызывать патологию HD посредством множественных клеточных изменений. [48] [49] В своей мутантной (полиглутаминовой) форме белок более склонен к расщеплению, что создает более короткие фрагменты, содержащие полиглутаминовую экспансию. [48] Эти белковые фрагменты имеют склонность подвергаться неправильному сворачиванию и агрегации, образуя фибриллярные агрегаты, в которых ненативные полиглутаминовые β-нити из нескольких белков связаны вместе водородными связями. [13] Эти агрегаты имеют ту же фундаментальную перекрестную бета- амилоидную архитектуру, что и при других заболеваниях отложения белков . [50] Со временем агрегаты накапливаются, образуя тельца включения внутри клеток, в конечном итоге нарушая функцию нейронов. [13] [48] Тельца включения были обнаружены как в ядре клетки , так и в цитоплазме . [48] Тельца включения в клетках мозга являются одним из самых ранних патологических изменений, и некоторые эксперименты показали, что они могут быть токсичными для клетки, но другие эксперименты показали, что они могут образовываться как часть защитного механизма организма и помогать защищать клетки. [48]
Было выявлено несколько путей, посредством которых mHtt может вызывать гибель клеток. К ним относятся воздействие на белки-шапероны , которые помогают сворачивать белки и удалять неправильно свернутые; взаимодействие с каспазами , которые играют роль в процессе удаления клеток ; токсическое воздействие глутамина на нервные клетки ; нарушение выработки энергии внутри клеток; и воздействие на экспрессию генов. [13] [51]
Было обнаружено, что мутантный белок хантингтин играет ключевую роль в дисфункции митохондрий . [46] Нарушение митохондриального транспорта электронов может привести к более высоким уровням окислительного стресса и высвобождению активных форм кислорода . [52]
Известно, что глутамин является эксайтотоксичным , когда присутствует в больших количествах, что может вызвать повреждение многочисленных клеточных структур. Избыток глутамина не обнаруживается при HD, но взаимодействие измененного белка хантингтина с многочисленными белками в нейронах приводит к повышенной уязвимости к глутамину. Считается, что повышенная уязвимость приводит к эксайтотоксичным эффектам от нормальных уровней глутамина. [13]

Первоначально повреждение мозга является регионально-специфическим, при этом в первую очередь поражается дорсальный стриатум в подкорковых базальных ганглиях , а затем вовлекается кора во всех областях. [53] [54] Другие пораженные области базальных ганглиев включают черную субстанцию ; вовлечение коры включает корковые слои 3, 5 и 6 ; также очевидно вовлечение гиппокампа , клеток Пуркинье в мозжечке , латеральных туберальных ядер гипоталамуса и частей таламуса . [ 26] Эти области поражаются в соответствии с их структурой и типами нейронов, которые они содержат, уменьшаясь в размере по мере потери клеток. [26] Наиболее уязвимы средние шиповатые нейроны полосатого тела , особенно те, которые имеют проекции к внешнему бледному шару , при этом интернейроны и шиповатые клетки, проецирующиеся к внутреннему бледному шару , поражаются меньше. [26] [55] HD также вызывает аномальное увеличение астроцитов и активацию иммунных клеток мозга, микроглии . [56]
Базальные ганглии играют ключевую роль в контроле движений и поведения. Их функции до конца не изучены, но теории предполагают, что они являются частью когнитивной исполнительной системы [28] и двигательного контура. [57] Базальные ганглии обычно подавляют большое количество контуров, которые генерируют определенные движения. Чтобы инициировать определенное движение, кора головного мозга посылает сигнал в базальные ганглии, который вызывает снятие торможения. Повреждение базальных ганглиев может привести к тому, что снятие или восстановление торможения будет беспорядочным и неконтролируемым, что приводит к неловкому началу движения или движениям, которые непреднамеренно инициируются или к остановке движения до или после его предполагаемого завершения. Накапливающееся повреждение этой области вызывает характерные беспорядочные движения, связанные с HD, известные как хорея, дискинезия . [ 57] Из-за неспособности базальных ганглиев подавлять движения, люди, страдающие от нее, неизбежно испытывают снижение способности производить речь и глотать пищу и жидкости (дисфагия). [58]
CREB-связывающий белок (CBP), транскрипционный корегулятор, необходим для функционирования клеток, поскольку, выступая в качестве коактиватора значительного числа промоторов, он активирует транскрипцию генов для путей выживания. [51] CBP содержит домен ацетилтрансферазы , с которым HTT связывается через свой домен, содержащий полиглутамин. [59] В аутопсийном мозге тех, кто страдал болезнью Гентингтона, также было обнаружено невероятно сниженное количество CBP. [60] Кроме того, когда CBP сверхэкспрессируется, снижается гибель, вызванная полиглутамином, что еще раз доказывает, что CBP играет важную роль в болезни Гентингтона и нейронах в целом. [51]
Диагностика начала HD может быть сделана после появления физических симптомов, характерных для этого заболевания. [26] Генетическое тестирование может быть использовано для подтверждения физического диагноза, если семейный анамнез HD отсутствует. Даже до появления симптомов генетическое тестирование может подтвердить, несет ли человек или эмбрион расширенную копию тринуклеотидного повтора (CAG) в гене HTT , который вызывает заболевание. Генетическое консультирование доступно для предоставления советов и рекомендаций на протяжении всей процедуры тестирования и относительно последствий подтвержденного диагноза. Эти последствия включают влияние на психологию человека, карьеру, решения по планированию семьи, родственников и отношения. Несмотря на доступность предсимптоматического тестирования, только 5% из тех, кто подвержен риску наследования HD, решают сделать это. [26]

Физическое обследование , иногда в сочетании с психологическим обследованием , может определить, началось ли начало заболевания. [26] Чрезмерные непреднамеренные движения любой части тела часто являются причиной обращения за медицинской консультацией. Если они резкие и имеют случайное время и распределение, они предполагают диагноз HD. Когнитивные или поведенческие симптомы редко являются первыми диагностируемыми симптомами; они обычно распознаются только задним числом или при дальнейшем развитии. Насколько далеко продвинулось заболевание, можно измерить с помощью унифицированной шкалы оценки болезни Хантингтона, которая предоставляет общую систему оценок, основанную на двигательных, поведенческих, когнитивных и функциональных оценках. [62] [63] Медицинская визуализация , такая как КТ или МРТ , может показать атрофию хвостатых ядер на ранней стадии заболевания, как показано на иллюстрации справа, но эти изменения сами по себе не являются диагностическими для HD. Церебральная атрофия может наблюдаться на поздних стадиях заболевания. Методы функциональной нейровизуализации , такие как функциональная магнитно-резонансная томография (фМРТ) и позитронно-эмиссионная томография (ПЭТ), могут показать изменения в активности мозга до появления физических симптомов, но они являются экспериментальными инструментами и не используются в клинической практике. [26]
Поскольку HD наследуется по аутосомно-доминантному типу, у людей, которые подвержены риску наследования этого заболевания, существует сильная мотивация обратиться за диагностикой. Генетический тест на HD состоит из анализа крови, который подсчитывает количество повторов CAG в каждом из аллелей HTT . [64] Пороговые значения указаны следующим образом:
Тестирование до появления симптомов — это событие, которое меняет жизнь, и очень личное решение. [26] Основной причиной, по которой выбирают тест на болезнь Хантингтона, является помощь в принятии решений, касающихся карьеры и семьи. [26] Прогностическое тестирование на болезнь Хантингтона стало доступно с помощью анализа сцепления (который требует тестирования нескольких членов семьи) с 1986 года и с помощью прямого анализа мутаций с 1993 года. [66] В то время опросы показали, что 50–70% людей из группы риска были бы заинтересованы в прохождении тестирования, но с тех пор, как было предложено прогностическое тестирование, гораздо меньше людей решили пройти тестирование. [67] Более 95% людей из группы риска по наследованию болезни Хантингтона не продолжают тестирование, в основном потому, что оно не поддается лечению. [26] Ключевой проблемой является беспокойство, которое человек испытывает из-за того, что не знает, разовьется ли у него в конечном итоге болезнь Хантингтона, по сравнению с влиянием положительного результата. [26] Независимо от результата, уровень стресса ниже через два года после тестирования, но риск самоубийства увеличивается после положительного результата теста. [26] Лица, у которых не было выявлено наследственного заболевания, могут испытывать чувство вины выжившего по отношению к членам семьи, которые были затронуты. [26] Другие факторы, принимаемые во внимание при рассмотрении вопроса о тестировании, включают возможность дискриминации и последствия положительного результата, что обычно означает, что у родителя есть пораженный ген, и что братья и сестры этого человека будут подвержены риску унаследовать его. [26] В одном исследовании генетическая дискриминация была обнаружена у 46% лиц, подверженных риску болезни Хантингтона. Она встречалась чаще в личных отношениях, чем в сфере медицинского страхования или трудовых отношений. [68] Генетическое консультирование при болезни Хантингтона может предоставить информацию, советы и поддержку для первоначального принятия решения, а затем, если выбрано, на всех этапах процесса тестирования. [69] Из-за последствий этого теста пациенты, желающие пройти тестирование, должны пройти три сеанса консультирования, на которых предоставляется информация о болезни Хантингтона. [70]
Консультации и рекомендации по использованию генетического тестирования на HD стали моделями для других генетических заболеваний, таких как аутосомно-доминантная мозжечковая атаксия . [26] [71] [72] Пресимптоматическое тестирование на HD также повлияло на тестирование на другие заболевания с генетическими вариантами, такими как поликистозная болезнь почек, семейная болезнь Альцгеймера и рак молочной железы . [71] Европейская сеть качества молекулярной генетики опубликовала ежегодную внешнюю схему оценки качества для молекулярно-генетического тестирования на это заболевание и разработала рекомендации по передовой практике для генетического тестирования на HD, чтобы помочь в тестировании и сообщении результатов. [73]
Эмбрионы, полученные с помощью экстракорпорального оплодотворения , могут быть генетически протестированы на HD с помощью предимплантационной генетической диагностики . Этот метод, при котором одна или две клетки извлекаются из эмбриона, как правило, из 4-8-клеточного, а затем тестируются на генетическую аномалию, может затем использоваться для гарантии того, что эмбрионы, пораженные генами HD, не будут имплантированы, поэтому ни одно потомство не унаследует заболевание. Некоторые формы предимплантационной генетической диагностики — тестирование с неразглашением или исключение — позволяют людям из группы риска иметь потомство без HD, не раскрывая свой собственный родительский генотип, не давая никакой информации о том, суждено ли им самим развить HD. При тестировании с исключением ДНК эмбриона сравнивается с ДНК родителей и бабушек и дедушек, чтобы избежать наследования хромосомной области, содержащей ген HD, от пораженного бабушки или дедушки. При тестировании с неразглашением в матку помещаются только эмбрионы без заболеваний, в то время как родительский генотип и, следовательно, родительский риск HD никогда не раскрываются. [74] [75]
Также возможно проведение пренатальной диагностики эмбриона или плода в утробе матери с использованием генетического материала плода, полученного с помощью биопсии ворсин хориона . Амниоцентез может быть выполнен, если беременность на более позднем сроке, в пределах 14–18 недель. Эта процедура исследует амниотическую жидкость, окружающую ребенка, на наличие признаков мутации HD. [76] Это также может сочетаться с исключающим тестированием, чтобы избежать раскрытия родительского генотипа. Пренатальное тестирование может быть проведено, когда родителям был поставлен диагноз HD, когда у них было генетическое тестирование, показывающее расширение гена HTT , или когда у них есть 50% вероятность унаследовать заболевание. Родителей можно проконсультировать об их вариантах, которые включают прерывание беременности , и о трудностях ребенка с идентифицированным геном. [77] [78]
Кроме того, при беременностях с высоким риском из-за партнера-мужчины неинвазивная пренатальная диагностика может быть проведена путем анализа бесклеточной ДНК плода в образце крови, взятом у матери (путем венепункции ) между 6 и 12 неделями беременности. [65] Она не имеет риска выкидыша, связанного с процедурой. [65]
Около 99% диагнозов HD, основанных на типичных симптомах и семейном анамнезе заболевания, подтверждаются генетическим тестированием на наличие расширенного тринуклеотидного повтора, который вызывает HD. Большинство оставшихся называются HD-подобными (HDL) синдромами . [26] [79] Причина большинства заболеваний HDL неизвестна, но те, причины которых известны, обусловлены мутациями в гене прионного белка (HDL1), гене юнктофилина 3 (HDL2), рецессивно наследуемом неизвестном гене (HDL3 — обнаружен только в двух семьях и плохо изучен), и гене, кодирующем белок, связывающий ТАТА-бокс ( SCA17, иногда называемый HDL4 ). Другие аутосомно-доминантные заболевания, которые могут быть ошибочно диагностированы как HD, — это дентаторубро-паллидолуизианская атрофия и нейроферритинопатия . Кроме того, некоторые аутосомно-рецессивные расстройства напоминают спорадические случаи HD. К ним относятся хорея-акантоцитоз и пантотенаткиназа-ассоциированная нейродегенерация . Одним из таких заболеваний, сцепленных с Х- хромосомой, является синдром Маклеода . [79]
.pdf/page1-440px-Report_(IA_report00comm_6).pdf.jpg)
Существуют методы лечения, позволяющие уменьшить тяжесть некоторых симптомов HD. [80] Для многих из этих методов лечения доказательства, подтверждающие их эффективность в лечении симптомов HD, являются неполными. [26] [81] По мере прогрессирования заболевания способность заботиться о себе снижается, и тщательно контролируемый многопрофильный уход становится все более необходимым. [26] Хотя относительно небольшое количество исследований упражнений и методов лечения показали свою полезность для реабилитации когнитивных симптомов HD, некоторые данные показывают полезность физиотерапии , трудотерапии и логопедии . [26]
Потеря веса и проблемы с приемом пищи из-за дисфагии и других мышечных нарушений являются обычным явлением, что делает управление питанием все более важным по мере прогрессирования заболевания. [26] Загустители могут быть добавлены в жидкости, так как более густые жидкости легче и безопаснее глотать. [26] Напоминание больному человеку о необходимости есть медленно и брать в рот более мелкие кусочки пищи также может быть полезным для предотвращения удушья. [26] Если прием пищи становится слишком опасным или неудобным, доступна возможность использования чрескожной эндоскопической гастростомии . Эта зонд для кормления, постоянно прикрепленный через живот в желудок , снижает риск аспирации пищи и обеспечивает лучшее управление питанием. [82] Рекомендуется оценка и управление логопедами с опытом работы с болезнью Гентингтона. [26]
Люди с болезнью Хантингтона могут обратиться к физиотерапевту для неинвазивных и немедикаментозных способов управления физическими симптомами. Физиотерапевты могут проводить оценку и профилактику риска падения, а также укрепляющие, растягивающие и сердечно-сосудистые упражнения. При необходимости могут быть назначены вспомогательные средства для ходьбы . Физиотерапевты также назначают дыхательные упражнения и методы очистки дыхательных путей при развитии респираторных проблем. [83] Европейская сеть HD разработала консенсусные рекомендации по физиотерапии при болезни Хантингтона. [83] Целями ранних реабилитационных вмешательств являются профилактика потери функции. Участие в программах реабилитации на ранней и средней стадиях заболевания может быть полезным, поскольку оно приводит к долгосрочному поддержанию двигательной и функциональной работоспособности. Реабилитация на поздней стадии направлена на компенсацию двигательных и функциональных потерь. [84] Для долгосрочного независимого лечения терапевт может разработать программы домашних упражнений для соответствующих людей. [85]
Кроме того, все больше людей с болезнью Гентингтона обращаются за паллиативной помощью , которая направлена на улучшение качества жизни посредством лечения симптомов и стресса, вызванных серьезным заболеванием, в дополнение к другим видам лечения. [86]
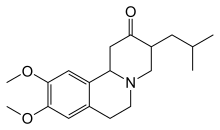
Тетрабеназин был одобрен в 2000 году для лечения хореи при болезни Гентингтона в ЕС и в 2008 году в США. [87] Хотя другие препараты использовались « не по назначению », тетрабеназин был первым одобренным средством для лечения болезни Гентингтона в США. Это соединение известно с 1950-х годов. Альтернативой тетрабеназину является амантадин , но имеются ограниченные доказательства его безопасности и эффективности. [88]
Другие препараты, помогающие уменьшить хорею, включают антипсихотики и бензодиазепины . [22] Гипокинезию и ригидность, особенно в ювенильных случаях, можно лечить противопаркинсоническими препаратами, а миоклонический гиперкинез можно лечить вальпроевой кислотой . [22] Предварительные данные показали, что этилэйкозапентаеновая кислота улучшает двигательные симптомы в течение одного года. [89] В 2017 году FDA одобрило деутетрабеназин , более тяжелую форму тетрабеназина для лечения хореи при HD. [90] Он продается как Austedo.
Психиатрические симптомы можно лечить с помощью лекарств, аналогичных тем, которые используются для населения в целом. [26] [81] Селективные ингибиторы обратного захвата серотонина и миртазапин рекомендуются при депрессии, в то время как атипичные антипсихотики рекомендуются при психозе и поведенческих проблемах. [81] Рекомендуется участие специалиста-нейропсихиатра, поскольку людям может потребоваться длительное лечение с использованием нескольких лекарств в комбинации. [26]
В аюрведической медицине экспериментировало множество альтернативных методов лечения с использованием растительных продуктов, хотя ни один из них не предоставил убедительных доказательств эффективности. Недавнее исследование показало, что стромальная процессинговая пептидаза (SPP), синтетический фермент, обнаруженный в растительных хлоропластах , предотвращает агрегацию белков, связанных с болезнью Хантингтона. [91] Однако для подтверждения ее истинного терапевтического потенциала необходимы повторные исследования и клиническая проверка.
Семьи людей и общество в целом, которые унаследовали или подвержены риску унаследовать болезнь Гентингтона, имеют поколения опыта болезни Гентингтона, но могут не знать о недавних прорывах в понимании болезни и о доступности генетического тестирования. Генетическое консультирование приносит пользу этим людям, обновляя их знания, стремясь развеять любые необоснованные убеждения, которые у них могут быть, и помогая им рассмотреть свои будущие варианты и планы. Программа обучения пациентов по болезни Гентингтона была создана, чтобы помочь обучать членов семьи, лиц, осуществляющих уход, и тех, у кого диагностирована болезнь Гентингтона. [92] Также рассматривается информация о вариантах планирования семьи, управлении уходом и других соображениях. [26] [93]
Длина тринуклеотидного повтора составляет 60% вариации возраста появления симптомов и скорости их прогрессирования. Более длинный повтор приводит к более раннему возрасту появления и более быстрому прогрессированию симптомов. [26] [94] У людей с более чем шестьюдесятью повторами заболевание часто развивается до 20 лет, в то время как у тех, у кого менее 40 повторов, симптомы могут оставаться бессимптомными. [95] Оставшаяся вариация обусловлена факторами окружающей среды и другими генами, которые влияют на механизм заболевания. [26]
Ожидаемая продолжительность жизни при HD обычно составляет около 10–30 лет после появления видимых симптомов. [26] При болезни Хантингтона у юношей продолжительность жизни составляет 10 лет после появления видимых симптомов. Большинство опасных для жизни осложнений возникают из-за мышечной координации и, в меньшей степени, из-за поведенческих изменений, вызванных снижением когнитивной функции. Наибольший риск представляет собой пневмония , которая приводит к смерти трети людей с HD. Поскольку способность синхронизировать движения ухудшается, трудности с очисткой легких и повышенный риск аспирации пищи или питья увеличивают риск заражения пневмонией . Вторым по величине риском является болезнь сердца , которая является причиной почти четверти смертельных случаев у людей с HD. [96] Самоубийство является третьей по значимости причиной смертельных случаев, при этом 7,3% людей с HD кончают жизнь самоубийством, а до 27% пытаются это сделать. Неясно, в какой степени суицидальные мысли зависят от поведенческих симптомов, поскольку они означают желание избежать более поздних стадий заболевания. [97] [98] [99] Самоубийство является самым большим риском этого заболевания до постановки диагноза и на средних стадиях развития в течение болезни. Другие сопутствующие риски включают удушье; из-за неспособности глотать, физические травмы от падений и недоедания. [96] [20]
Позднее начало болезни Хантингтона означает, что она обычно не влияет на репродуктивную функцию. [26] Распространенность болезни Хантингтона во всем мире составляет 5–10 случаев на 100 000 человек, [100] [101], но сильно варьируется географически в результате этнической принадлежности, местной миграции и прошлых иммиграционных схем. [26] Распространенность одинакова для мужчин и женщин. Частота возникновения самая высокая у людей западноевропейского происхождения, в среднем около семи на 100 000 человек, и ниже в остальном мире; например, один на миллион человек азиатского и африканского происхождения. Эпидемиологическое исследование распространенности болезни Хантингтона в Великобритании, проведенное в 2013 году в период с 1990 по 2010 год, показало, что средняя распространенность для Великобритании составила 12,3 на 100 000. [26] [102] Кроме того, в некоторых локализованных районах распространенность намного выше, чем в среднем по региону. [26] Один из самых высоких показателей заболеваемости наблюдается в изолированных популяциях региона озера Маракайбо в Венесуэле , где HD поражает до 700 человек на 100 000 человек. [26] [103] Другие области высокой локализации были обнаружены в Тасмании и определенных регионах Шотландии , Уэльса и Швеции . [99] Повышенная распространенность в некоторых случаях происходит из-за локального эффекта основателя , исторической миграции носителей в область географической изоляции . [99] [104] Некоторые из этих носителей были прослежены на сотни лет назад с помощью генеалогических исследований. [99] Генетические гаплотипы также могут дать подсказки для географических вариаций распространенности. [99] [105] Исландия , напротив, имеет довольно низкую распространенность - 1 на 100 000, несмотря на то, что исландцы как народ произошли от ранних германских племен Скандинавии, которые также дали начало шведам ; все случаи, за исключением одного, который датируется почти двумя столетиями ранее и произошел от потомства пары, жившей в начале 19 века. [106] В Финляндии также наблюдается низкий уровень заболеваемости — всего 2,2 на 100 000 человек. [107]
До открытия генетического теста статистика могла включать только клинический диагноз, основанный на физических симптомах и семейной истории HD, исключая тех, кто умер от других причин до постановки диагноза. Эти случаи теперь могут быть включены в статистику; и, поскольку тест становится более доступным, оценки распространенности и заболеваемости расстройством, вероятно, возрастут. [99] [108]

В прошлые века различные виды хореи порой называли такими именами, как пляска святого Витта , при этом в каждом случае причины или типа хореи были мало изучены или вообще не изучены.
Первое определенное упоминание о БХ было в письме Чарльза Оскара Уотерса (1816–1892), опубликованном в первом издании « Практики медицины» Робли Данглисона в 1842 году. [110] Уотерс описал «форму хореи, в просторечии называемую магрумс», включая точные описания хореи, ее прогрессирования и сильной наследственности заболевания. [111] В 1846 году Чарльз Роллин Горман (1817–1879) наблюдал, как более высокая распространенность, по-видимому, наблюдалась в локализованных регионах. [112] [111] Независимо от Гормана и Уотерса, студентов Данглисона в Медицинском колледже Джефферсона в Филадельфии, [113] Йохан Кристиан Лунд (1830–1906) также создал раннее описание в 1860 году. [111] Он особо отметил, что в Сетесдалене , уединенной горной долине в Норвегии , высокая распространенность деменции была связана с моделью расстройств судорожных движений, которые передавались по наследству. [114]
Первое подробное описание заболевания было дано Джорджем Хантингтоном в 1872 году. Изучая объединенную историю болезни нескольких поколений семьи, проявляющих схожие симптомы, он понял, что их состояния должны быть связаны; он представил свое подробное и точное определение заболевания в своей первой статье. Хантингтон описал точную схему наследования аутосомно-доминантного заболевания за годы до повторного открытия учеными менделевского наследования .
Наследственной природы. Когда один или оба родителя проявляют проявления болезни... один или несколько потомков почти всегда страдают от этой болезни... Но если по какой-либо случайности эти дети пройдут через жизнь без нее, нить прерывается, и внуки и правнуки первоначальных шейкеров могут быть уверены, что они свободны от этой болезни. [109] [115]
Сэр Уильям Ослер интересовался расстройством и хореей в целом и был впечатлен статьей Хантингтона, в которой говорилось: «В истории медицины мало случаев, когда болезнь была описана более точно, более наглядно или более кратко». [116] [111] [117] Постоянный интерес Ослера к HD, в сочетании с его влиянием в области медицины, помог быстро распространить осведомленность и знания об этом расстройстве во всем медицинском сообществе. [111] Большой интерес проявили ученые в Европе, включая Луи Теофиля Жозефа Ландузи , Дезире-Маглуара Бурневиля , Камилло Гольджи и Жозефа Жюля Дежерина , и до конца века большая часть исследований HD была европейского происхождения. [111] К концу 19 века исследования и отчеты о HD были опубликованы во многих странах, и болезнь была признана всемирным заболеванием. [111]
Во время повторного открытия менделевского наследования на рубеже 20-го века болезнь HD использовалась в качестве примера аутосомно-доминантного наследования. [111] Английский биолог Уильям Бейтсон использовал родословные затронутых семей, чтобы установить, что болезнь HD имеет аутосомно-доминантный тип наследования. [118] [113] Сильный тип наследования побудил нескольких исследователей, включая Смита Эли Джеллиффа , попытаться отследить и связать членов семей предыдущих исследований. [111] Джеллифф собрал информацию по всему Нью-Йорку и опубликовал несколько статей, касающихся генеалогии болезни HD в Новой Англии . [119] Исследования Джеллиффа вызвали интерес его друга по колледжу Чарльза Дэвенпорта , который поручил Элизабет Манси провести первое полевое исследование семей с болезнью HD на Восточном побережье Соединенных Штатов и составить их родословные. [120] Дэвенпорт использовал эту информацию, чтобы задокументировать различный возраст начала и диапазон симптомов болезни HD; он утверждал, что большинство случаев HD в США можно проследить до нескольких человек. [120] Это исследование было дополнительно приукрашено в 1932 году П. Р. Весси, который популяризировал идею о том, что три брата, покинувшие Англию в 1630 году и направлявшиеся в Бостон, были прародителями HD в США. [121] Утверждение о том, что самые ранние прародители были установлены, и евгеническая предвзятость работы Манси, Дэвенпорта и Весси способствовали недопониманию и предрассудкам относительно HD. [113] Манси и Дэвенпорт также популяризировали идею о том, что в прошлом некоторые люди с HD могли считаться одержимыми духами или жертвами колдовства , и иногда избегались или изгонялись обществом. [122] [123] Эта идея не была доказана. Исследователи нашли противоположные доказательства; например, сообщество семьи, изученное Джорджем Хантингтоном, открыто принимало тех, у кого проявлялись симптомы HD. [113] [122]
Поиски причины этого состояния значительно активизировались в 1968 году, когда Милтон Векслер , психоаналитик из Лос-Анджелеса , штат Калифорния , создал Фонд наследственных заболеваний (HDF) , жена которого Леонора Сабин в начале того же года получила диагноз болезни Гентингтона. [124] У трех братьев жены Векслера также была эта болезнь.
Фонд участвовал в наборе более 100 ученых в совместный проект США и Венесуэлы по болезни Хантингтона, который в течение 10 лет с 1979 года работал над определением генетической причины. [125] Это было достигнуто в 1983 году, когда был приблизительно определен причинный ген, [104] а в 1993 году ген был точно локализован на хромосоме 4 (4p16.3). [126] Исследование было сосредоточено на населении двух изолированных венесуэльских деревень, Барранкитас и Лагунетас, где наблюдалась необычно высокая распространенность HD, и охватило более 18 000 человек, в основном из одной большой семьи, и привело к тому, что HD стал первым аутосомным локусом заболевания, обнаруженным с помощью анализа генетического сцепления . [126] [127] Среди других инноваций проект разработал методы маркировки ДНК , которые стали важным шагом на пути к реализации проекта «Геном человека» . [125]
В то же время были сделаны ключевые открытия, касающиеся механизмов этого расстройства, включая выводы исследовательской группы Аниты Хардинг о влиянии длины гена. [128]
Моделирование заболевания на различных типах животных, таких как трансгенная мышь, созданная в 1996 году, позволило проводить более масштабные эксперименты. Поскольку у этих животных более быстрый метаболизм и гораздо более короткая продолжительность жизни, чем у людей, результаты экспериментов поступают раньше, что ускоряет исследования. Открытие в 1997 году того, что фрагменты mHtt неправильно сворачиваются, привело к открытию ядерных включений, которые они вызывают. Эти достижения привели к все более обширным исследованиям белков, связанных с заболеванием, потенциальных лекарственных средств, методов ухода и самого гена. [111] [129]
Сети ухода и поддержки, которые были созданы в Венесуэле и Колумбии во время исследовательских проектов там в 1970-х - 2000-х годах, в конечном итоге были подорваны различными силами, такими как продолжающийся кризис в Венесуэле и смерть ведущего исследователя в Колумбии (Хорхе Даса Баррига). [130] Врачи работают над возрождением этих сетей, потому что люди, которые внесли вклад в науку о болезни Гентингтона, участвуя в этих исследованиях, заслуживают адекватного последующего ухода; общества в других частях мира, которые получают выгоду от научных достижений, достигнутых таким образом, обязаны по крайней мере этим тем, кто участвовал в исследовании. [130]
Ранее это состояние называлось хореей Гентингтона, но этот термин был заменен на болезнь Гентингтона, поскольку не у всех пациентов развивается хорея, а также из-за важности когнитивных и поведенческих проблем. [131]
Генетическое тестирование на болезнь Хантингтона подняло несколько этических проблем. Проблемы генетического тестирования включают определение того, насколько зрелым должен быть человек, прежде чем его будут считать подходящим для тестирования, обеспечение конфиденциальности результатов и следует ли разрешать компаниям использовать результаты теста для принятия решений о трудоустройстве, страховании жизни или других финансовых вопросах. Возникли разногласия, когда Чарльз Дэвенпорт в 1910 году предложил использовать обязательную стерилизацию и иммиграционный контроль для людей с определенными заболеваниями, включая болезнь Хантингтона, в рамках евгенического движения. [132] Экстракорпоральное оплодотворение имеет некоторые проблемы, связанные с использованием эмбрионов. Некоторые исследования болезни Хантингтона имеют этические проблемы из-за использования испытаний на животных и эмбриональных стволовых клеток . [133] [134]
Разработка точного диагностического теста на болезнь Хантингтона вызвала социальные, правовые и этические опасения по поводу доступа к результатам человека и их использования. [135] [136] Многие руководства и процедуры тестирования имеют строгие процедуры раскрытия и конфиденциальности, чтобы позволить людям решать, когда и как получать свои результаты, а также кому они будут предоставлены. [26] Страховые компании и предприятия сталкиваются с вопросом, использовать ли результаты генетических тестов при оценке человека, например, для страхования жизни или трудоустройства. Страховые компании Соединенного Королевства договорились с Департаментом здравоохранения и социального обеспечения , что до 2017 года клиентам не нужно будет раскрывать им результаты предиктивных генетических тестов, но это соглашение явно исключало одобренный правительством тест на болезнь Хантингтона при оформлении полисов на сумму более 500 000 фунтов стерлингов . [137] [138] Как и в случае с другими неизлечимыми генетическими заболеваниями с более поздним началом, этически сомнительно проводить предсимптоматическое тестирование у ребенка или подростка, поскольку это не принесет никакой медицинской пользы для этого человека. Существует консенсус относительно тестирования только тех лиц, которые считаются когнитивно зрелыми, хотя есть контраргумент, что родители имеют право принимать решение от имени своего ребенка. При отсутствии эффективного лечения тестирование человека, не достигшего совершеннолетия , который не считается дееспособным, в большинстве случаев считается неэтичным. [49] [139] [140]
Существуют этические проблемы, связанные с пренатальным генетическим тестированием или преимплантационной генетической диагностикой, чтобы гарантировать, что ребенок не родится с данным заболеванием. [141] Например, пренатальное тестирование поднимает вопрос селективного аборта, выбор, который некоторые считают неприемлемым. [141] Поскольку это доминирующее заболевание, существуют трудности в ситуациях, когда родитель не хочет знать свой собственный диагноз. Это потребовало бы сохранения частей процесса в тайне от родителя. [141]

В 1968 году, столкнувшись с болезнью HD в семье своей жены, доктор Милтон Векслер был вдохновлен идеей создания Фонда наследственных заболеваний (HDF) с целью лечения генетических заболеваний путем координации и поддержки исследований. [17] Фонд и дочь Векслера, Нэнси Векслер , были ключевыми участниками исследовательской группы в Венесуэле, которая открыла ген HD. [17]
Примерно в то же время, когда был сформирован HDF, Марджори Гатри помогла основать комитет по борьбе с болезнью Хантингтона (ныне Американское общество борьбы с болезнью Хантингтона ), после того как ее муж, фолк-певец и автор песен Вуди Гатри , умер от осложнений болезни Хантингтона. [18]
С тех пор во многих странах мира сформировались организации поддержки и исследования, которые помогли повысить осведомленность общественности о HD. Некоторые из них сотрудничают в зонтичных организациях, таких как Международная ассоциация Хантингтона и Европейская сеть HD. [142] Многие организации поддержки проводят ежегодные мероприятия по повышению осведомленности о HD, некоторые из которых были одобрены их соответствующими правительствами. Например, 6 июня объявлено Сенатом США «Национальным днем осведомленности о болезни Хантингтона» . [143] Существует множество организаций, поддерживающих и информирующих людей, страдающих HD, включая Ассоциацию по болезни Хантингтона в Великобритании. Крупнейшим спонсором исследований является Фонд инициативы по лечению болезни Хантингтона (CHDI). [144]
Исследования механизма HD сосредоточены на выявлении функционирования Htt, того, как mHtt отличается или мешает ему, и патологии мозга, которую вызывает заболевание. [145] Исследования проводятся с использованием методов in vitro , генетически модифицированных животных (также называемых трансгенными животными-моделями ) и людей-добровольцев. Животные модели имеют решающее значение для понимания фундаментальных механизмов, вызывающих заболевание, и для поддержки ранних стадий разработки лекарств . [129] Идентификация причинного гена позволила разработать множество генетически модифицированных организмов, включая нематод (круглых червей), плодовых мушек Drosophila и генетически модифицированных млекопитающих, включая мышей, крыс, овец, свиней и обезьян, которые экспрессируют мутантный гентингтин и развивают прогрессирующую нейродегенерацию и симптомы, подобные HD. [129]
Исследования проводятся с использованием многих подходов, чтобы либо предотвратить болезнь Хантингтона, либо замедлить ее прогрессирование. [145] Стратегии модификации болезни можно в целом сгруппировать в три категории: снижение уровня мутантного белка хантингтина (включая сплайсинг генов и подавление генов ); подходы, направленные на улучшение выживания нейронов путем снижения вреда, наносимого белком определенным клеточным путям и механизмам (включая гомеостаз белков и ингибирование гистондеацетилазы ); и стратегии замены потерянных нейронов. Кроме того, разрабатываются новые методы лечения для улучшения функционирования мозга; они стремятся производить симптоматическую, а не модифицирующую болезнь терапию и включают ингибиторы фосфодиэстеразы . [146] [147]
Фонд CHDI финансирует множество исследовательских инициатив, предоставляя множество публикаций. [148] Фонд CHDI является крупнейшим спонсором исследований болезни Гентингтона во всем мире и ставит своей целью поиск и разработку препаратов, которые замедлят прогрессирование HD. [144] [149] Ранее CHDI был известен как High Q Foundation. В 2006 году он потратил 50 миллионов долларов на исследования болезни Гентингтона. [144] CHDI сотрудничает со многими академическими и коммерческими лабораториями по всему миру и занимается надзором и управлением исследовательскими проектами, а также финансированием. [150]
Подавление генов направлено на снижение выработки мутантного белка, поскольку HD вызывается одним доминирующим геном, кодирующим токсичный белок. Эксперименты по подавлению генов на моделях мышей показали, что при снижении экспрессии mHtt симптомы улучшаются. [151] Безопасность методов РНК-интерференции и аллель-специфических олигонуклеотидных (ASO) подавления генов была продемонстрирована на мышах и мозге более крупных приматов-макак. [152] [153] Аллель-специфическое подавление пытается подавить мутантный htt, оставляя Htt дикого типа нетронутым. Одним из способов достижения этого является выявление полиморфизмов, присутствующих только в одном аллеле, и создание препаратов для подавления генов, которые нацелены на полиморфизмы только в мутантном аллеле. [154] Первое испытание подавления генов с участием людей с HD началось в 2015 году, проверяя безопасность IONIS-HTTRx, производимого Ionis Pharmaceuticals и возглавляемого Институтом неврологии UCL . [155] [156] Мутантный хантингтин был впервые обнаружен и количественно определен в спинномозговой жидкости у носителей мутации болезни Хантингтона в 2015 году с использованием нового иммуноанализа с «подсчетом отдельных молекул» , [157] обеспечивающего прямой способ оценки того, достигают ли методы лечения, снижающие уровень хантингтина, желаемого эффекта. [158] [159] Испытание фазы 3 этого соединения, переименованного в томинерсен и спонсируемого Roche Pharmaceuticals , началось в 2019 году, но было остановлено в 2021 году после того, как совет по мониторингу безопасности пришел к выводу, что баланс риска и пользы был неблагоприятным. [160] Испытание генной терапии, снижающей уровень хантингтина, проводимое Uniqure, началось в 2019 году, и было объявлено о нескольких испытаниях перорально вводимых соединений-модуляторов сплайсинга, снижающих уровень хантингтина. [161] Методы сплайсинга генов изучаются, чтобы попытаться восстановить геном с ошибочным геном, который вызывает HD, используя такие инструменты, как CRISPR/Cas9 . [147] PTC Therapeutics оценивает малые молекулы, которые вызывают включение ядовитого экзона в транскрипт HTT , в качестве терапевтической стратегии для снижения экспрессии HTT . [162] [163]
Другая стратегия снижения уровня мутантного хантингтина заключается в увеличении скорости, с которой клетки способны его очищать. [164] Поскольку mHtt (и многие другие белковые агрегаты ) разрушаются аутофагией , увеличение скорости аутофагии имеет потенциал для снижения уровня mHtt и, таким образом, улучшения течения болезни. [165] Фармакологические и генетические индукторы аутофагии были протестированы на различных моделях болезни Хантингтона; было показано, что многие из них снижают уровень mHtt и уменьшают токсичность. [164]
Среди подходов, направленных на улучшение выживаемости клеток в присутствии мутантного хантингтина, можно назвать коррекцию транскрипционной регуляции с использованием ингибиторов гистондеацетилазы , модуляцию агрегации хантингтина, улучшение метаболизма и функции митохондрий и восстановление функции синапсов . [151]
Терапия стволовыми клетками используется для замены поврежденных нейронов путем трансплантации стволовых клеток в пораженные области мозга. Эксперименты на животных моделях (только крысы и мыши) дали положительные результаты. [166]
Каким бы ни был их будущий терапевтический потенциал, стволовые клетки уже сейчас являются ценным инструментом для изучения болезни Гентингтона в лабораторных условиях. [167]
Ферроптоз — это форма регулируемой гибели клеток, характеризующаяся железозависимым накоплением гидроперекисей липидов до летальных уровней. Ферроптоз, опосредованный ALOX5, действует как путь гибели клеток при окислительном стрессе при болезни Хантингтона. [168] Ингибиторы ферроптоза оказывают защитное действие в моделях дегенеративных заболеваний мозга, включая болезни Паркинсона, Хантингтона и Альцгеймера. [168]
В 2020 году было проведено 197 клинических испытаний, связанных с различными методами лечения и биомаркерами болезни Гентингтона, которые были указаны как текущие, набирающие участников или недавно завершенные. [169] Испытанные соединения , которые не смогли предотвратить или замедлить прогрессирование болезни Гентингтона, включают ремацемид , коэнзим Q10 , рилузол , креатин , миноциклин , этил-ЭПК , фенилбутират и димебон . [170]
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка )