Изотопы — это различные ядерные виды (или нуклиды ) одного и того же химического элемента . Они имеют одинаковый атомный номер (число протонов в их ядрах ) и положение в периодической таблице (и, следовательно, принадлежат к одному и тому же химическому элементу), но разные нуклонные числа ( массовые числа ) из-за разного числа нейтронов в их ядрах. Хотя все изотопы данного элемента имеют схожие химические свойства, они имеют разные атомные массы и физические свойства. [1]
Термин «изотоп» происходит от греческих корней isos (ἴσος «равный») и topos (τόπος «место»), что означает «одно и то же место»; таким образом, смысл названия заключается в том, что различные изотопы одного элемента занимают одно и то же положение в периодической таблице . [2] Он был придуман шотландским врачом и писательницей Маргарет Тодд в 1913 году в предложении британскому химику Фредерику Содди , который популяризировал этот термин. [3]
Число протонов в ядре атома называется его атомным числом и равно числу электронов в нейтральном (неионизированном) атоме. Каждое атомное число идентифицирует определенный элемент, но не изотоп; атом данного элемента может иметь широкий диапазон числа нейтронов . Число нуклонов (как протонов, так и нейтронов) в ядре является массовым числом атома , и каждый изотоп данного элемента имеет различное массовое число.
Например, углерод-12 , углерод-13 и углерод-14 — это три изотопа элемента углерода с массовыми числами 12, 13 и 14 соответственно. Атомный номер углерода равен 6, что означает, что каждый атом углерода имеет 6 протонов, так что нейтронные числа этих изотопов равны 6, 7 и 8 соответственно.
Нуклид — это разновидность атома с определенным числом протонов и нейтронов в ядре, например, углерод-13 с 6 протонами и 7 нейтронами. Концепция нуклида (относящаяся к отдельным ядерным видам) подчеркивает ядерные свойства по сравнению с химическими свойствами, тогда как концепция изотопа (группировка всех атомов каждого элемента) подчеркивает химические свойства по сравнению с ядерными. Число нейтронов сильно влияет на ядерные свойства, но его влияние на химические свойства незначительно для большинства элементов. Даже для самых легких элементов, чье отношение числа нейтронов к атомному номеру больше всего варьируется между изотопами, оно обычно оказывает лишь небольшое влияние, хотя в некоторых обстоятельствах имеет значение (для водорода, самого легкого элемента, изотопный эффект достаточно велик, чтобы сильно влиять на биологию). Термин изотопы (первоначально также изотопные элементы [4] , теперь иногда изотопные нуклиды [5] ) подразумевает сравнение (как синонимы или изомеры ). Например, нуклиды12
6С
,13
6С
,14
6С
являются изотопами (нуклидами с одинаковым атомным номером, но разными массовыми числами [6] ), но40
18Ар
,40
19К
,40
20Ca
являются изобарами (нуклидами с одинаковым массовым числом [7] ). Однако изотоп — более старый термин, поэтому он более известен, чем нуклид , и иногда используется в контекстах, в которых термин нуклид может быть более подходящим, например, в ядерной технологии и ядерной медицине .
Изотоп и/или нуклид указывается по названию конкретного элемента (это указывает атомный номер), за которым следует дефис и массовое число (например, гелий-3 , гелий-4 , углерод-12 , углерод-14 , уран-235 и уран-239 ). [8] Когда используется химический символ , например, «C» для углерода, стандартная нотация (теперь известная как «нотация AZE», поскольку A — это массовое число , Z — атомный номер , а E — элемент ) должна указывать массовое число (число нуклонов) с помощью надстрочного индекса в левом верхнем углу химического символа и указывать атомный номер с помощью подстрочного индекса в левом нижнем углу (например,3
2Он
,4
2Он
,12
6С
,14
6С
,235
92У
, и239
92У
). [9] Поскольку атомный номер задается символом элемента, обычно в верхнем индексе указывают только массовое число, а нижний индекс атомного номера опускают (например,3
Он
,4
Он
,12
С
,14
С
,235
У
, и239
У
). Буква m (от metastable — метастабильный) иногда добавляется после массового числа, чтобы указать на ядерный изомер , метастабильное или энергетически возбужденное состояние ядра (в отличие от основного состояния с самой низкой энергией ), например180м
73Та
( тантал-180м ).
Общепринятое произношение обозначения AZE отличается от его написания:4
2Он
обычно произносится как гелий-четыре вместо четыре-два-гелий, и235
92У
как уран два-тридцать пять (американский английский) или уран-два-три-пять (британский) вместо 235-92-уран.
Некоторые изотопы/нуклиды радиоактивны и поэтому называются радиоизотопами или радионуклидами , тогда как другие никогда не наблюдались в радиоактивном распаде и называются стабильными изотопами или стабильными нуклидами . Например,14
С
является радиоактивной формой углерода, тогда как12
С
и13
С
являются стабильными изотопами. На Земле существует около 339 естественных нуклидов, [10] из которых 286 являются первичными нуклидами , что означает, что они существовали с момента образования Солнечной системы .
Первичные нуклиды включают 35 нуклидов с очень длительным периодом полураспада (более 100 миллионов лет) и 251, которые формально считаются « стабильными нуклидами » [10] , поскольку их распад не наблюдался. В большинстве случаев, по очевидным причинам, если элемент имеет стабильные изотопы, эти изотопы преобладают в элементарном изотопе, обнаруженном на Земле и в Солнечной системе. Однако в случае трех элементов ( теллур , индий и рений ) наиболее распространенным изотопом, обнаруженным в природе, на самом деле является один (или два) чрезвычайно долгоживущих радиоизотопа(ов) элемента, несмотря на то, что эти элементы имеют один или несколько стабильных изотопов.
Теория предсказывает, что многие, по-видимому, «стабильные» нуклиды являются радиоактивными, с чрезвычайно долгим периодом полураспада (исключая возможность распада протона , который сделал бы все нуклиды в конечном итоге нестабильными). Некоторые стабильные нуклиды в теории энергетически восприимчивы к другим известным формам распада, таким как альфа-распад или двойной бета-распад, но продукты распада пока не наблюдались, и поэтому эти изотопы считаются «наблюдательно стабильными». Предсказанные периоды полураспада для этих нуклидов часто значительно превышают предполагаемый возраст Вселенной, и на самом деле, также известно 31 радионуклид (см. первичный нуклид ) с периодом полураспада, превышающим возраст Вселенной.
Если добавить радиоактивные нуклиды, созданные искусственно, то в настоящее время известно 3339 нуклидов . [11] Среди них 905 нуклидов, которые либо стабильны, либо имеют период полураспада более 60 минут. Подробности см. в списке нуклидов .
Существование изотопов было впервые предположено в 1913 году радиохимиком Фредериком Содди на основе исследований цепочек радиоактивного распада , которые выявили около 40 различных видов, называемых радиоэлементами (т.е. радиоактивными элементами) между ураном и свинцом, хотя периодическая таблица допускала только 11 элементов между свинцом и ураном включительно. [12] [13] [14]
Несколько попыток разделить эти новые радиоэлементы химическим путем потерпели неудачу. [15] Например, в 1910 году Содди показал, что мезоторий (позже было показано, что это 228 Ra), радий ( 226 Ra, самый долгоживущий изотоп) и торий X ( 224 Ra) невозможно разделить. [16] Попытки разместить радиоэлементы в периодической таблице привели Содди и Казимежа Фаянса независимо друг от друга к предложению в 1913 году закона радиоактивного смещения , согласно которому альфа-распад производит элемент, расположенный на две позиции левее в периодической таблице, тогда как испускание бета-распада производит элемент, расположенный на одну позицию правее. [17] [18] [19] [20] Содди осознал, что испускание альфа-частицы, за которым следуют две бета-частицы, приводит к образованию элемента, химически идентичного исходному элементу, но с массой на четыре единицы легче и с другими радиоактивными свойствами.
Содди предположил, что несколько типов атомов (различающихся по радиоактивным свойствам) могут занимать одно и то же место в таблице. [14] Например, альфа-распад урана-235 образует торий-231, тогда как бета-распад актиния-230 образует торий-230. [15] Термин «изотоп», по-гречески означающий «в том же месте», [14] был предложен Содди Маргарет Тодд , шотландским врачом и другом семьи, во время разговора, в котором он объяснял ей свои идеи. [16] [21] [22] [23] [24] [25] Он получил Нобелевскую премию по химии 1921 года отчасти за свою работу по изотопам. [26]

В 1914 году Т. У. Ричардс обнаружил различия в атомном весе свинца из разных минеральных источников, которые можно объяснить различиями в изотопном составе из-за различного радиоактивного происхождения. [15] [26]
Первое доказательство существования множественных изотопов стабильного (нерадиоактивного) элемента было обнаружено Дж. Дж. Томсоном в 1912 году в ходе его исследования состава канальных лучей (положительных ионов). [27] Томсон направлял потоки ионов неона через параллельные магнитные и электрические поля, измерял их отклонение, помещая на их пути фотографическую пластину, и вычислял их отношение массы к заряду с помощью метода, который стал известен как метод параболы Томсона. Каждый поток создавал светящееся пятно на пластине в точке, куда он попадал. Томсон наблюдал два отдельных параболических пятна света на фотографической пластине (см. изображение), что предполагало два вида ядер с различными отношениями массы к заряду. Он писал: «Поэтому, я думаю, не может быть никаких сомнений в том, что то, что было названо неоном, является не простым газом, а смесью двух газов, один из которых имеет атомный вес около 20, а другой около 22. Парабола, обусловленная более тяжелым газом, всегда намного слабее, чем парабола, обусловленная более легким, так что, вероятно, более тяжелый газ составляет лишь небольшой процент смеси». [28]
FW Aston впоследствии открыл несколько стабильных изотопов для многочисленных элементов с помощью масс-спектрографа . В 1919 году Aston изучил неон с достаточным разрешением, чтобы показать, что две изотопные массы очень близки к целым числам 20 и 22, и что ни одна из них не равна известной молярной массе (20,2) неонового газа. Это пример правила целых чисел Астона для изотопных масс, которое гласит, что большие отклонения элементарных молярных масс от целых чисел в первую очередь обусловлены тем фактом, что элемент представляет собой смесь изотопов. Aston аналогичным образом показал в 1920 году, что молярная масса хлора (35,45) является средневзвешенным значением почти интегральных масс для двух изотопов 35 Cl и 37 Cl. [29] [30]
После открытия нейтрона Джеймсом Чедвиком в 1932 году [31] была выяснена первопричина существования изотопов, а именно, что ядра различных изотопов одного и того же элемента имеют разное количество нейтронов, хотя и одинаковое количество протонов.
Нейтральный атом имеет одинаковое количество электронов и протонов. Таким образом, различные изотопы данного элемента имеют одинаковое количество электронов и имеют схожую электронную структуру. Поскольку химическое поведение атома в значительной степени определяется его электронной структурой, различные изотопы демонстрируют почти одинаковое химическое поведение.
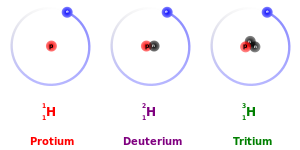
Главным исключением из этого является кинетический изотопный эффект : из-за их большей массы более тяжелые изотопы имеют тенденцию реагировать несколько медленнее, чем более легкие изотопы того же элемента. Это наиболее выражено для протия (1
ЧАС
), дейтерий (2
ЧАС
) и тритий (3
ЧАС
), поскольку дейтерий имеет вдвое большую массу, чем протий, а тритий имеет в три раза большую массу, чем протий. [32] Эти различия в массе также влияют на поведение их соответствующих химических связей, изменяя центр тяжести ( приведенную массу ) атомных систем. Однако для более тяжелых элементов относительная разница в массе между изотопами намного меньше, так что эффекты разницы в массе на химию обычно пренебрежимо малы. (Тяжелые элементы также имеют относительно больше нейтронов, чем более легкие элементы, поэтому отношение ядерной массы к коллективной электронной массе немного больше.) Существует также равновесный изотопный эффект .

Аналогично, две молекулы , которые отличаются только изотопами своих атомов ( изотопологи ), имеют идентичные электронные структуры и, следовательно, почти неразличимые физические и химические свойства (опять же, за исключением дейтерия и трития, являющихся основными исключениями). Колебательные моды молекулы определяются ее формой и массами ее составляющих атомов; поэтому разные изотопологи имеют разные наборы колебательных мод. Поскольку колебательные моды позволяют молекуле поглощать фотоны соответствующих энергий, изотопологи имеют разные оптические свойства в инфракрасном диапазоне.
Атомные ядра состоят из протонов и нейтронов, связанных вместе остаточной сильной силой . Поскольку протоны заряжены положительно, они отталкиваются друг от друга. Нейтроны, которые электрически нейтральны, стабилизируют ядро двумя способами. Их совместное присутствие слегка отталкивает протоны, уменьшая электростатическое отталкивание между протонами, и они оказывают притягивающую ядерную силу друг на друга и на протоны. По этой причине для связывания двух или более протонов в ядро необходим один или несколько нейтронов. По мере увеличения числа протонов увеличивается и соотношение нейтронов к протонам, необходимое для обеспечения стабильности ядра (см. график справа). Например, хотя соотношение нейтронов и протонов3
2Он
составляет 1:2, соотношение нейтронов и протонов238
92У
больше 3:2. Ряд более легких элементов имеют стабильные нуклиды с соотношением 1:1 ( Z = N ). Нуклид40
20Ca
(кальций-40) является наблюдаемо самым тяжелым стабильным нуклидом с одинаковым числом нейтронов и протонов. Все стабильные нуклиды тяжелее кальция-40 содержат больше нейтронов, чем протонов.
Из 80 элементов со стабильным изотопом наибольшее число стабильных изотопов, наблюдаемых для любого элемента, составляет десять (для элемента олово ). Ни один элемент не имеет девять или восемь стабильных изотопов. Пять элементов имеют семь стабильных изотопов, восемь имеют шесть стабильных изотопов, десять имеют пять стабильных изотопов, девять имеют четыре стабильных изотопа, пять имеют три стабильных изотопа, 16 имеют два стабильных изотопа (считая180м
73Та
как стабильные), и 26 элементов имеют только один стабильный изотоп (из них 19 являются так называемыми мононуклидными элементами , имеющими один первичный стабильный изотоп, который доминирует и фиксирует атомный вес природного элемента с высокой точностью; также встречаются 3 радиоактивных мононуклидных элемента). [33] Всего существует 251 нуклид, распад которых не наблюдался. Для 80 элементов, имеющих один или несколько стабильных изотопов, среднее число стабильных изотопов составляет 251/80 ≈ 3,14 изотопов на элемент.
Соотношение протонов и нейтронов не является единственным фактором, влияющим на стабильность ядра. Оно также зависит от четности или нечетности его атомного числа Z , числа нейтронов N и, следовательно, их суммы, массового числа A. Нечетность как Z , так и N имеет тенденцию к снижению энергии ядерной связи , делая нечетные ядра, как правило, менее стабильными. Эта примечательная разница в энергии ядерной связи между соседними ядрами, особенно нечетных изобар A , имеет важные последствия: нестабильные изотопы с неоптимальным числом нейтронов или протонов распадаются путем бета-распада (включая испускание позитронов ), электронного захвата или других менее распространенных режимов распада, таких как спонтанное деление и кластерный распад .
Большинство стабильных нуклидов — это четно-протонно-четно-нейтронные, где все числа Z , N и A четные. Нечетно -A стабильные нуклиды делятся (примерно поровну) на нечетно-протонно-четно-нейтронные и четно-протонно-нечетно-нейтронные нуклиды. Стабильные нечетно-протонно-нечетно-нейтронные нуклиды встречаются реже всего.
146 четно-протонных, четно-нейтронных (EE) нуклидов составляют ~58% всех стабильных нуклидов и все имеют спин 0 из-за спаривания. Также существует 24 первичных долгоживущих четно-четных нуклида. В результате каждый из 41 четных элементов от 2 до 82 имеет по крайней мере один стабильный изотоп , и большинство этих элементов имеют несколько первичных изотопов. Половина этих четных элементов имеет шесть или более стабильных изотопов. Чрезвычайная стабильность гелия-4 из-за двойного спаривания 2 протонов и 2 нейтронов предотвращает образование любых нуклидов, содержащих пять (5
2Он
,5
3Ли
) или восемь (8
4Быть
) нуклонов, которые существуют достаточно долго, чтобы служить платформами для накопления более тяжелых элементов посредством ядерного синтеза в звездах (см. тройной альфа-процесс ).
Только пять стабильных нуклидов содержат как нечетное число протонов , так и нечетное число нейтронов. Первые четыре "нечетных-нечетных" нуклида встречаются в нуклидах с низкой массой, для которых замена протона на нейтрон или наоборот приведет к очень неравномерному соотношению протонов и нейтронов (2
1ЧАС
,6
3Ли
,10
5Б
, и14
7Н
; спины 1, 1, 3, 1). Единственный другой полностью «стабильный» нечетно-нечетный нуклид,180м
73Та
(спин 9) считается самым редким из 251 стабильных нуклидов и единственным первичным ядерным изомером , распад которого до сих пор не наблюдался, несмотря на экспериментальные попытки. [34]
Известно много нечетно-нечетных радионуклидов (например, основное состояние тантала-180) со сравнительно короткими периодами полураспада. Обычно они бета-распадаются до своих близких четно-четных изобар , которые имеют спаренные протоны и спаренные нейтроны. Из девяти первичных нечетно-нечетных нуклидов (пять стабильных и четыре радиоактивных с длительными периодами полураспада) только14
7Н
является наиболее распространенным изотопом распространенного элемента. Это так, потому что он является частью цикла CNO . Нуклиды6
3Ли
и10
5Б
являются миноритарными изотопами элементов, которые сами по себе редки по сравнению с другими легкими элементами, тогда как остальные шесть изотопов составляют лишь незначительный процент от естественной распространенности своих элементов.
53 стабильных нуклида имеют четное число протонов и нечетное число нейтронов. Они составляют меньшинство по сравнению с четно-четными изотопами, которых примерно в 3 раза больше. Среди 41 четно- Z элементов, имеющих стабильный нуклид, только два элемента (аргон и церий) не имеют четно-нечетных стабильных нуклидов. Один элемент (олово) имеет три. Существует 24 элемента, которые имеют один четно-нечетный нуклид, и 13, которые имеют два нечетно-четных нуклида. Из 35 первичных радионуклидов существует четыре четно-нечетных нуклида (см. таблицу справа), включая делящийся 235
92У
. Из-за нечетного числа нейтронов четно-нечетные нуклиды имеют тенденцию иметь большие сечения захвата нейтронов из-за энергии, которая возникает в результате эффектов нейтронного спаривания. Эти стабильные четно-протонные нечетно-нейтронные нуклиды имеют тенденцию быть необычными по распространенности в природе, в основном потому, что для образования и перехода в изначальное распространенность они должны были избежать захвата нейтронов, чтобы сформировать другие стабильные четно-четные изотопы, как во время s-процесса , так и r-процесса захвата нейтронов, во время нуклеосинтеза в звездах . По этой причине только195
78Пт
и9
4Быть
являются наиболее распространенными в природе изотопами своего элемента.
48 стабильных нечетно-протонно-четно-нейтронных нуклидов, стабилизированных их парными нейтронами, образуют большинство стабильных изотопов нечетных элементов; очень немногие нечетно-протонно-нечетно-нейтронные нуклиды составляют остальные. Существует 41 нечетный элемент с Z = 1 через 81, из которых 39 имеют стабильные изотопы ( технеций (
43Тс
) и прометий (
61ПМ
) не имеют стабильных изотопов). Из этих 39 нечетных Z- элементов 30 элементов (включая водород-1, где 0 нейтронов — четное число ) имеют один стабильный нечетно-четный изотоп, а девять элементов: хлор (
17Кл
), калий (
19К
), медь (
29Cu
), галлий (
31Га
), бром (
35Бр
), серебро (
47Аг
), сурьма (
51Сб
), иридий (
77Ир
) и таллий (
81Тл
), имеют по два нечетно-четных стабильных изотопа. Это дает в общей сложности 30 + 2(9) = 48 стабильных нечетно-четных изотопов.
Существует также пять первичных долгоживущих радиоактивных нечетно-четных изотопов,87
37Руб.
,115
49В
,187
75Повторно
,151
63Евросоюз
, и209
83Би
. Последние два элемента только недавно были обнаружены распадающимися, с периодом полураспада более 10 18 лет.
Актиниды с нечетным числом нейтронов, как правило, делятся (с тепловыми нейтронами ), тогда как актиниды с четным числом нейтронов, как правило, нет, хотя они делятся с быстрыми нейтронами . Все наблюдаемо стабильные нечетно-нечетные нуклиды имеют ненулевой целочисленный спин. Это происходит потому, что одиночный неспаренный нейтрон и неспаренный протон имеют большую ядерную силу притяжения друг к другу, если их спины выровнены (создавая общий спин не менее 1 единицы), а не анти-выровнены. См. дейтерий для простейшего случая такого ядерного поведения.
Только195
78Пт
,9
4Быть
, и14
7Н
имеют нечетное число нейтронов и являются наиболее распространенным в природе изотопом своего элемента.
Элементы состоят либо из одного нуклида ( мононуклидные элементы ), либо из более чем одного естественного изотопа. Нестабильные (радиоактивные) изотопы являются либо первичными , либо постпервичными. Первичные изотопы были продуктом звездного нуклеосинтеза или другого типа нуклеосинтеза, такого как расщепление космическими лучами , и сохранились до настоящего времени, потому что скорость их распада очень мала (например, уран-238 и калий-40 ). Постпервичные изотопы были созданы бомбардировкой космическими лучами как космогенные нуклиды (например, тритий , углерод-14 ) или путем распада радиоактивного первичного изотопа на радиоактивный радиогенный дочерний нуклид (например, уран на радий ). Некоторые изотопы естественным образом синтезируются как нуклеогенные нуклиды в результате других природных ядерных реакций , например, когда нейтроны, образующиеся при естественном делении ядра, поглощаются другим атомом.
Как обсуждалось выше, только 80 элементов имеют какие-либо стабильные изотопы, и 26 из них имеют только один стабильный изотоп. Таким образом, около двух третей стабильных элементов встречаются на Земле в природе в виде нескольких стабильных изотопов, причем наибольшее количество стабильных изотопов для элемента составляет десять, для олова (
50Сн
). На Земле в природе встречается около 94 элементов (вплоть до плутония включительно), хотя некоторые из них обнаружены только в очень малых количествах, например, плутоний-244 . Ученые подсчитали, что элементы, которые встречаются на Земле в природе (некоторые только в виде радиоизотопов), встречаются в общей сложности в виде 339 изотопов ( нуклидов ). [35] Только 251 из этих встречающихся в природе нуклидов являются стабильными, в том смысле, что их распад никогда не наблюдался по состоянию на настоящее время. Еще 35 первичных нуклидов (всего 286 первичных нуклидов) являются радиоактивными с известными периодами полураспада, но имеют периоды полураспада более 100 миллионов лет, что позволяет им существовать с самого начала Солнечной системы. Подробности см. в списке нуклидов .
Все известные стабильные нуклиды встречаются на Земле естественным образом; другие естественные нуклиды радиоактивны, но встречаются на Земле из-за их относительно длительного периода полураспада или же из-за других средств постоянного естественного производства. К ним относятся вышеупомянутые космогенные нуклиды , нуклеогенные нуклиды и любые радиогенные нуклиды, образованные постоянным распадом первичного радиоактивного нуклида, такого как радон и радий из урана.
Еще около ~3000 радиоактивных нуклидов, не встречающихся в природе, были созданы в ядерных реакторах и ускорителях частиц. Многие короткоживущие нуклиды, не встречающиеся в природе на Земле, также были обнаружены с помощью спектроскопического анализа, поскольку они естественным образом создаются в звездах или сверхновых . Примером может служить алюминий-26 , который не встречается на Земле в природе, но встречается в изобилии в астрономических масштабах.
Табличные атомные массы элементов являются средними, которые учитывают наличие нескольких изотопов с разными массами. До открытия изотопов эмпирически определенные нецелые значения атомной массы сбивали ученых с толку. Например, образец хлора содержит 75,8% хлора-35 и 24,2% хлора-37 , что дает среднюю атомную массу 35,5 атомных единиц массы .
Согласно общепринятой космологической теории , только изотопы водорода и гелия, следы некоторых изотопов лития и бериллия, и, возможно, немного бора, были созданы во время Большого взрыва , в то время как все остальные нуклиды были синтезированы позже, в звездах и сверхновых, а также во взаимодействиях между энергичными частицами, такими как космические лучи, и ранее образованными нуклидами. (См. нуклеосинтез для получения подробной информации о различных процессах, которые считаются ответственными за производство изотопов.) Соответствующее содержание изотопов на Земле является результатом количеств, образованных этими процессами, их распространения по галактике и скоростей распада нестабильных изотопов. После первоначального слияния Солнечной системы изотопы были перераспределены в соответствии с массой, и изотопный состав элементов немного различается от планеты к планете. Это иногда позволяет проследить происхождение метеоритов .
Атомная масса ( m r ) изотопа (нуклида) определяется в основном его массовым числом (т. е. числом нуклонов в его ядре). Небольшие поправки обусловлены энергией связи ядра (см. дефект массы ), небольшой разницей в массе протона и нейтрона и массой электронов, связанных с атомом, последнее связано с тем, что соотношение электрон:нуклон различается среди изотопов.
Массовое число — безразмерная величина . Атомная масса, с другой стороны, измеряется с помощью атомной единицы массы , основанной на массе атома углерода-12. Она обозначается символами «u» (единая атомная единица массы) или «Da» (дальтон ) .
Атомные массы природных изотопов элемента определяют стандартный атомный вес элемента. Когда элемент содержит N изотопов, для средней атомной массы применяется следующее выражение :
где m 1 , m 2 , ..., m N — атомные массы каждого отдельного изотопа, а x 1 , ..., x N — относительные содержания этих изотопов.
Существует несколько приложений, которые используют свойства различных изотопов данного элемента. Разделение изотопов является значительной технологической проблемой, особенно для тяжелых элементов, таких как уран или плутоний. Более легкие элементы, такие как литий, углерод, азот и кислород, обычно разделяются путем газовой диффузии их соединений, таких как CO и NO. Разделение водорода и дейтерия необычно, поскольку оно основано на химических, а не на физических свойствах, например, в сульфидном процессе Гирдлера . Изотопы урана были разделены в больших объемах путем газовой диффузии, газового центрифугирования, лазерного ионизационного разделения и (в Манхэттенском проекте ) с помощью типа производственной масс-спектрометрии .
образом, химически идентичные элементы — или изотопы, как я их впервые назвал в этом письме в Nature, поскольку они занимают одно и то же место в Периодической таблице ...
стр. 208: До 1913 года мы использовали фразу «химически неразделимые радиоэлементы», а в то время в гостиной в доме тестя Содди, сэра Джорджа
Бейлби
, было предложено слово «изотоп» .