Скелетные мышцы ( обычно называемые мышцами ) являются органами мышечной системы позвоночных и обычно прикрепляются сухожилиями к костям скелета . [1] [2] Мышечные клетки скелетных мышц намного длиннее, чем в других типах мышечной ткани , и часто называются мышечными волокнами. [3] Мышечная ткань скелетных мышц поперечно -полосатая из-за расположения саркомеров .
Скелетные мышцы являются произвольными мышцами, находящимися под контролем соматической нервной системы . Другими типами мышц являются сердечная мышца , которая также поперечно-полосатая, и гладкая мышца , которая не поперечно-полосатая; Оба этих типа мышечной ткани относят к непроизвольным, или находящимся под контролем вегетативной нервной системы . [4]
Скелетная мышца содержит множество пучков – пучков мышечных волокон. Каждое отдельное волокно и каждая мышца окружены слоем соединительной ткани типа фасции . Мышечные волокна образуются в результате слияния развивающихся миобластов в процессе, известном как миогенез, в результате которого образуются длинные многоядерные клетки. В этих клетках ядра , называемые миоядрами , расположены вдоль внутренней части клеточной мембраны . Мышечные волокна также имеют множество митохондрий для удовлетворения энергетических потребностей.
Мышечные волокна в свою очередь состоят из миофибрилл . Миофибриллы состоят из актиновых и миозиновых нитей, называемых миофиламентами , повторяющихся в единицах, называемых саркомерами, которые являются основными функциональными сократительными единицами мышечного волокна, необходимыми для мышечного сокращения . [5] Мышцы питаются преимущественно за счет окисления жиров и углеводов , но также используются анаэробные химические реакции, особенно с участием быстрых волокон. Эти химические реакции производят молекулы аденозинтрифосфата (АТФ), которые используются для движения головок миозина . [6]
Скелетные мышцы составляют около 35% массы тела человека. [7] Функции скелетных мышц включают в себя обеспечение движения, поддержание осанки тела, контроль температуры тела и стабилизацию суставов. [8] Скелетные мышцы также являются эндокринным органом . [9] [10] [11] В различных физиологических условиях в секретоме скелетных мышц обнаруживаются субпопуляции 654 различных белков, а также липидов, аминокислот, метаболитов и малых РНК . [12]
Скелетные мышцы в основном состоят из многоядерных сократительных мышечных волокон (миоцитов). Однако в скелетных мышцах также присутствует значительное количество резидентных и инфильтрирующих мононуклеаров. [13] По объему миоциты составляют подавляющее большинство скелетных мышц. Миоциты скелетных мышц обычно очень крупные: около 2–3 см в длину и 100 мкм в диаметре. [14] Для сравнения, мононуклеарные клетки в мышцах намного меньше. Некоторые из мононуклеарных клеток в мышцах [15] представляют собой эндотелиальные клетки (длиной около 50–70 мкм, шириной 10–30 мкм и толщиной 0,1–10 мкм), [16] макрофаги (диаметром 21 мкм) и нейтрофилы (12 -15 мкм в диаметре). [17] Однако с точки зрения ядер, присутствующих в скелетных мышцах, ядра миоцитов могут составлять только половину присутствующих ядер, тогда как ядра резидентных и инфильтрирующих мононуклеарных клеток составляют другую половину. [13]
Значительные исследования скелетных мышц сосредоточены на клетках мышечных волокон, миоцитах, как подробно обсуждается в первых разделах ниже. Однако в последнее время интерес также сосредоточился на различных типах мононуклеарных клеток скелетных мышц, а также на эндокринных функциях мышц, описанных ниже.
В организме человека насчитывается более 600 скелетных мышц, которые составляют около 40% массы тела здорового молодого человека. [18] [19] [20] В западных популяциях мужчины имеют в среднем примерно на 61% больше скелетных мышц, чем женщины. [21] Большинство мышц расположены парами с двух сторон и обслуживают обе стороны тела. Мышцы часто классифицируют как группы мышц , которые работают вместе, чтобы выполнить действие. В туловище имеется несколько основных групп мышц , включая грудные и брюшные мышцы ; Внутренние и внешние мышцы — подразделения мышечных групп рук , стоп , языка и экстраокулярных мышц глаза . Мышцы также сгруппированы в отдельные группы , включая четыре группы в руках и четыре группы в ногах .
Помимо сократительной части мышцы, состоящей из ее волокон, мышца содержит несократительную часть плотной волокнистой соединительной ткани, составляющую сухожилие на каждом конце. Сухожилия прикрепляют мышцы к костям, обеспечивая движение скелета. В длину мышцы входят сухожилия. Соединительная ткань присутствует во всех мышцах в виде глубокой фасции . Глубокая фасция специализируется внутри мышц, заключая в себе каждое мышечное волокно в виде эндомизия ; каждый мышечный пучок — перимизий , а каждая отдельная мышца — эпимизий . Вместе эти слои называются мизия . Глубокая фасция также разделяет группы мышц на мышечные отсеки.
В мышцах имеются два типа сенсорных рецепторов : мышечные веретена и сухожильные органы Гольджи . Мышечные веретена представляют собой рецепторы растяжения , расположенные в брюшке мышцы. Сухожильные органы Гольджи представляют собой проприорецепторы , расположенные в миотендинальном соединении , которые сообщают о напряжении мышцы .

Клетки скелетных мышц — это отдельные сократительные клетки внутри мышцы, их часто называют мышечными волокнами . [2] Одна мышца, например бицепс, у молодого взрослого мужчины содержит около 253 000 мышечных волокон. [22]
Скелетные мышечные волокна — единственные мышечные клетки, которые имеют многоядерные ядра, часто называемые миоядрами . Это происходит во время миогенеза при слиянии миобластов, каждый из которых образует ядро. [23] Слияние зависит от специфичных для мышц белков, известных как фузогены , называемые миомакер и миомергер . [24]
Клетка скелетных мышц нуждается во многих ядрах для производства большого количества белков и ферментов, необходимых для нормального функционирования клетки. Одно мышечное волокно может содержать от сотен до тысяч ядер. [25] Мышечное волокно, например, бицепса человека длиной 10 см, может иметь до 3000 ядер. [25] В отличие от немышечных клеток , где ядро расположено в центре, миоядро удлинено и расположено близко к сарколемме . Миоядра расположены вдоль волокна довольно равномерно, причем каждое ядро имеет свой собственный миоядерный домен , где оно отвечает за поддержание объема цитоплазмы в этом конкретном участке миоволокна. [24] [25]
Группа мышечных стволовых клеток , известная как миосателлитные клетки , также клетки-сателлиты обнаруживаются между базальной мембраной и сарколеммой мышечных волокон. Эти клетки обычно находятся в состоянии покоя, но могут быть активированы физическими упражнениями или патологиями, чтобы обеспечить дополнительные миоядра для роста или восстановления мышц. [26]
Мышцы прикрепляются к сухожилиям в сложной области интерфейса, известной как мышечно-сухожильное соединение , также известное как миосухожильное соединение , области, специализированной для первичной передачи силы. [27] На границе мышц и сухожилий сила передается от саркомеров в мышечных клетках к сухожилию. [5] Мышцы и сухожилия развиваются в тесной связи и после соединения в мышечно-сухожильном соединении образуют динамическую единицу передачи силы от сокращения мышц к скелетной системе. [27]

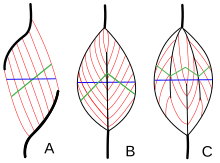
Архитектура мышц относится к расположению мышечных волокон относительно оси генерации силы , которая проходит от начала мышцы до места ее прикрепления . Обычным расположением являются типы параллельных и типы перистых мышц . В параллельных мышцах пучки проходят параллельно оси генерации силы, но пучки могут различаться по своему взаимодействию друг с другом и со своими сухожилиями. [28] Эти вариации наблюдаются в веретенообразных , ременных и сходящихся мышцах . [3] Сходящаяся мышца имеет треугольную или веерообразную форму, поскольку волокна сходятся в месте ее прикрепления и широко разветвляются в начале. [28] Менее распространенным примером параллельной мышцы является круговая мышца, такая как круговая мышца глаза , в которой волокна расположены продольно, но образуют круг от начала до места прикрепления. [29] Эти различия в архитектуре могут вызывать различия в напряжении, которое мышца может создавать между своими сухожилиями.
Волокна перистых мышц проходят под углом к оси генерации силы. [29] Этот угол перистости уменьшает эффективную силу любого отдельного волокна, поскольку оно эффективно отрывается от оси. Однако из-за этого угла в тот же объем мышцы можно упаковать больше волокон, увеличивая физиологическую площадь поперечного сечения (PCSA). Этот эффект известен как упаковка волокон, и с точки зрения генерации силы он более чем компенсирует потерю эффективности из-за внеосевой ориентации. Компромисс заключается в общей скорости сокращения мышц и общей экскурсии. Общая скорость сокращения мышц снижается по сравнению со скоростью сокращения волокон, как и общая длина сокращения. [29] Все эти эффекты масштабируются в зависимости от угла перистости; большие углы приводят к большей силе из-за увеличения упаковки волокон и PCSA, но с большими потерями в скорости сокращения и смещении. Типы перистых мышц — одноперистые , двуперистые и многоперистые . Одноперистая мышца имеет волокна под одинаковым углом, расположенные на одной стороне сухожилия. Двуперистая мышца имеет волокна по обе стороны от сухожилия. Многоперистые мышцы имеют волокна, ориентированные под разными углами вдоль оси, создающей силу, и это наиболее общая и наиболее распространенная архитектура. [29]
Мышечные волокна растут во время тренировок и сжимаются, когда они не используются. Это связано с тем, что упражнения стимулируют рост миофибрилл , которые увеличивают общий размер мышечных клеток. Хорошо тренируемые мышцы могут не только увеличиться в размерах, но и развить больше митохондрий , миоглобина , гликогена и более высокую плотность капилляров . Однако мышечные клетки не могут делиться для образования новых клеток, и в результате у взрослого человека меньше мышечных клеток, чем у новорожденного. [30]
Для обозначения мышц используется ряд терминов, в том числе относящихся к размеру, форме, действию, расположению, их ориентации и количеству головок.
В целом существует два типа мышечных волокон: тип I — медленные, и тип II — быстрые. Тип II имеет два подразделения: тип IIA (окислительный) и тип IIX (гликолитический), что дает три основных типа волокон. [33] Эти волокна имеют относительно разные метаболические, сократительные и двигательные свойства. В таблице ниже различаются эти типы свойств. Эти типы свойств — хотя они частично зависят от свойств отдельных волокон — имеют тенденцию быть актуальными и измеряться на уровне двигательной единицы, а не отдельного волокна. [34]
Медленные окислительные волокна (тип I) сокращаются относительно медленно и используют аэробное дыхание для производства АТФ. Быстрые окислительные волокна (тип IIA) имеют быстрые сокращения и в основном используют аэробное дыхание, но поскольку они могут переключаться на анаэробное дыхание (гликолиз), они могут утомляться быстрее, чем медленные окислительные волокна. Быстрые гликолитические волокна (тип IIX) имеют быстрые сокращения и в основном используют анаэробный гликолиз. Волокна FG утомляются быстрее остальных. Большинство скелетных мышц человека содержат все три типа, хотя и в разных пропорциях. [35]
Традиционно волокна классифицировали в зависимости от их разного цвета, который отражает содержание миоглобина . Волокна I типа кажутся красными из-за высокого уровня миоглобина. Красные мышечные волокна, как правило, содержат больше митохондрий и большую плотность локальных капилляров. Эти волокна больше подходят для выносливости и медленнее утомляются, поскольку используют окислительный метаболизм для выработки АТФ ( аденозинтрифосфата ). Менее окислительные волокна типа II имеют белый цвет из-за относительно низкого уровня миоглобина и зависимости от гликолитических ферментов.
Волокна также можно разделить по способности сокращаться на быстрые и медленные. Эти признаки в значительной степени, но не полностью, перекрывают классификации, основанные на цвете, АТФазе или MHC ( тяжелой цепи миозина ).
Некоторые авторы определяют быстросокращающиеся волокна как волокна, в которых миозин может очень быстро расщеплять АТФ. К ним в основном относятся волокна АТФазы типа II и MHC типа II. Однако быстросокращающиеся волокна также демонстрируют более высокую способность к электрохимической передаче потенциалов действия и быстрый уровень высвобождения и поглощения кальция саркоплазматической сетью. Быстросокращающиеся волокна опираются на хорошо развитую анаэробную , кратковременную гликолитическую систему для передачи энергии и могут сокращаться и развивать напряжение в 2–3 раза быстрее, чем медленные волокна. Быстросокращающиеся мышцы гораздо лучше создают короткие всплески силы или скорости, чем медленные мышцы, и поэтому утомляются быстрее. [36]
Медленно сокращающиеся волокна генерируют энергию для повторного синтеза АТФ посредством долгосрочной системы аэробной передачи энергии. К ним в основном относятся волокна АТФазы типа I и MHC типа I. Они, как правило, имеют низкий уровень активности АТФазы, более медленную скорость сокращения и менее развитую гликолитическую способность. [36] Волокна, которые становятся медленными, развивают большее количество митохондрий и капилляров, что делает их более пригодными для длительной работы. [37]
Отдельные мышцы, как правило, представляют собой смесь различных типов волокон, но их пропорции варьируются в зависимости от действия этой мышцы. Например, у человека четырехглавые мышцы содержат ~52% волокон типа I, а камбаловидная мышца - ~80% волокон типа I. [38] Круговая мышца глаза состоит только из ~15% волокон типа I. [38] Двигательные единицы . однако внутри мышцы различия между волокнами этой единицы минимальны. Именно этот факт делает принцип размера рекрутирования двигательных единиц жизнеспособным.
Традиционно считалось, что общее количество волокон скелетных мышц не меняется. Считается, что в распределении волокон нет половых или возрастных различий; однако пропорции типов волокон значительно варьируются от мышцы к мышце и от человека к человеку. [ нужна цитата ] Среди разных видов существуют большие различия в пропорциях типов мышечных волокон. [39]
Мужчины и женщины, ведущие малоподвижный образ жизни (а также маленькие дети), имеют 45% волокон типа II и 55% типа I. [ нужна цитата ] Люди, занимающиеся более высоким уровнем любого вида спорта, как правило, демонстрируют закономерности распределения волокон, например, спортсмены, занимающиеся выносливостью, демонстрируют более высокий уровень волокон типа I. С другой стороны, спортсменам-спринтерам требуется большое количество волокон типа IIX. Спортсмены на средних дистанциях демонстрируют примерно равное распределение двух типов. Это также часто относится к силовым спортсменам, таким как метатели и прыгуны. Было высказано предположение, что различные виды упражнений могут вызывать изменения в волокнах скелетных мышц. [40]
Считается, что при выполнении упражнений на выносливость в течение длительного периода времени некоторые волокна типа IIX трансформируются в волокна типа IIA. Однако единого мнения по этому вопросу нет. [ нужна цитата ] Вполне возможно, что волокна типа IIX демонстрируют усиление окислительной способности после высокоинтенсивных тренировок на выносливость, что выводит их на уровень, на котором они способны осуществлять окислительный метаболизм так же эффективно, как и медленно сокращающиеся волокна нетренированных субъектов. Это будет вызвано увеличением размера и количества митохондрий и соответствующими изменениями, а не изменением типа волокон.

Существует множество методов, используемых для типирования волокон, и среди неспециалистов часто возникает путаница между этими методами. Двумя часто путаемыми методами являются гистохимическое окрашивание на активность АТФазы миозина и иммуногистохимическое окрашивание на тип тяжелой цепи миозина (MHC). Активность АТФазы миозина обычно (и правильно) называют просто «типом волокна» и является результатом прямого анализа активности АТФазы в различных условиях (например, pH ). [34] Окрашивание тяжелой цепи миозина наиболее точно называют «типом волокна MHC», например «волокна MHC IIa», и является результатом определения различных изоформ MHC . [34] Эти методы тесно связаны физиологически, поскольку тип MHC является основным определяющим фактором активности АТФазы. Однако ни один из этих методов типирования не имеет прямой метаболической природы; они не влияют напрямую на окислительную или гликолитическую способность клетчатки.
Когда волокна «типа I» или «типа II» упоминаются в общем, это наиболее точно относится к сумме числовых типов волокон (I против II), оцененных по окрашиванию активности миозиновой АТФазы (например, волокна «типа II» относятся к типу IIA + тип IIAX + тип IIXA… и т. д.).
Ниже приведена таблица, показывающая взаимосвязь между этими двумя методами, ограниченная типами волокон, обнаруженными у человека. Заглавные буквы подтипов используются при типировании волокон по сравнению с типированием MHC, а некоторые типы АТФазы фактически содержат несколько типов MHC. Кроме того, ни один из методов не экспрессирует подтип B или b у людей . [41] Ранние исследователи полагали, что люди экспрессируют MHC IIb, что привело к классификации АТФазы IIB. Однако более поздние исследования показали, что человеческий MHC IIb на самом деле был IIx, [41] что указывает на то, что IIB лучше называть IIX. IIb экспрессируется у других млекопитающих, поэтому он до сих пор точно встречается (наряду с IIB) в литературе. Нечеловеческие типы волокон включают настоящие волокна IIb, IIc, IId и т. д.
Дальнейшие методы типизации волокон менее формально очерчены и существуют в более широком спектре. Они, как правило, больше внимания уделяют метаболическим и функциональным возможностям (т.е. окислительному или гликолитическому , быстрому или медленному сокращению). Как отмечалось выше, типирование волокон с помощью АТФазы или MHC напрямую не измеряет и не определяет эти параметры. Однако многие из различных методов механически связаны, тогда как другие коррелируют in vivo . [44] [45] Например, тип волокон АТФазы связан со скоростью сокращения, поскольку высокая активность АТФазы обеспечивает более быструю езду на велосипеде с поперечными мостиками . [34] Хотя активность АТФазы является лишь одним из компонентов скорости сокращения, волокна типа I являются «медленными», отчасти потому, что у них низкая скорость активности АТФазы по сравнению с волокнами типа II. Однако измерение скорости сокращения — это не то же самое, что типирование волокон АТФазы.
Движение почти всех многоклеточных животных зависит от мышц. [46] Как правило, мышечная система большинства многоклеточных животных состоит из как медленно сокращающихся, так и быстро сокращающихся мышечных волокон, хотя пропорции каждого типа волокон могут варьироваться в зависимости от организма и окружающей среды. Способность изменять пропорции фенотипических типов волокон посредством тренировки и реагирования на окружающую среду хорошо послужила организмам при их помещении в меняющуюся среду, требующую либо коротких взрывных движений (более высокая доля быстрых сокращений), либо длительной продолжительности движений (более высокая доля медленных сокращений) для выживания. [47] Бодибилдинг показал, что изменения в мышечной массе и силе могут измениться в течение нескольких месяцев. [48] Некоторые примеры этого варианта описаны ниже. [49]
Американский омар Homarus americanus имеет три типа волокон: быстросокращающиеся, медленные и медленнотонические. [50] Медленные тоники – это медленные волокна, способные выдерживать более длительные сокращения ( тоники ). [51] [52] У омаров мышцы в разных частях тела различаются по пропорциям типов мышечных волокон в зависимости от назначения группы мышц. [50]
На ранних стадиях развития эмбрионов позвоночных рост и формирование мышц происходят последовательными волнами или фазами миогенеза . Изотип тяжелой цепи миозина является основным фактором, определяющим конкретный тип волокна. У эмбрионов рыбок данио первыми формируются мышечные волокна — медленно сокращающиеся. Эти клетки будут мигрировать из своего исходного местоположения, образуя монослой медленно сокращающихся мышечных волокон. Эти мышечные волокна подвергаются дальнейшей дифференцировке по мере взросления эмбриона. [53]
У более крупных животных разные группы мышц все чаще требуют разных пропорций типов волокон в мышцах для разных целей. Черепахи , такие как Trachemys scripta elegans , имеют дополнительные мышцы на шее, которые демонстрируют потенциальную обратную тенденцию процентного соотношения типов волокон (одна мышца имеет высокий процент быстрых сокращений, в то время как дополнительная мышца будет иметь более высокий процент медленных волокон). Дополнительные мышцы черепах имели одинаковое процентное соотношение типов волокон. [51]
Мышцы шимпанзе на 67% состоят из быстросокращающихся волокон и имеют максимальную динамическую силу и выходную мощность в 1,35 раза выше, чем мышцы человека аналогичного размера. Среди млекопитающих преобладают волокна II типа, использующие гликолитический метаболизм. Из-за различий в быстросокращающихся волокнах по сравнению с людьми шимпанзе превосходят людей в тестах, связанных с мощностью. Однако люди лучше справляются с упражнениями в аэробном диапазоне, требующим больших метаболических затрат, например, при ходьбе (двуногие движения). [54]
У разных видов сохранились определенные последовательности генов, но они не всегда имеют одинаковое функциональное назначение. В эмбрионах рыбок данио ген Prdm1 подавляет образование новых медленно сокращающихся волокон посредством прямых и непрямых механизмов, таких как Sox6 (непрямой). У мышей ген Prdm1 присутствует, но не контролирует гены медленных мышц у мышей через Sox6 . [55]
Помимо генетической основы, состав типов мышечных волокон является гибким и может меняться в зависимости от ряда различных факторов окружающей среды. Эта пластичность, возможно, может быть самым сильным эволюционным преимуществом среди организмов с мышцами.
У рыб разные типы клетчатки проявляются при разной температуре воды. [53] Низкие температуры требуют более эффективного метаболизма в мышцах, и важна устойчивость к усталости. В то время как в более тропических условиях быстрые мощные движения (с более высокими пропорциями быстрых сокращений) могут оказаться более полезными в долгосрочной перспективе. [56]
У грызунов, таких как крысы, преходящий характер мышц широко распространен. Они имеют высокий процент гибридных мышечных волокон и до 60% быстро трансформирующихся в медленные мышцы. [48]
Влияние окружающей среды, такое как диета, физические упражнения и образ жизни, играют решающую роль в пропорциях типов клетчатки в организме человека. Аэробные упражнения смещают пропорции в сторону медленно сокращающихся волокон, а взрывной пауэрлифтинг и спринт – в сторону быстрых волокон. [47] У животных «тренировка упражнений» будет больше похожа на потребность в длительных движениях или коротких взрывных движениях, чтобы уйти от хищников или поймать добычу. [57]


Скелетные мышцы при рассмотрении под микроскопом демонстрируют характерный рисунок полос из-за расположения двух сократительных белков миозина и актина – двух миофиламентов в миофибриллах . Миозин образует толстые нити, а актин — тонкие нити и расположены в повторяющиеся единицы, называемые саркомерами . Взаимодействие обоих белков приводит к сокращению мышц.
Саркомер прикрепляется к другим органеллам, таким как митохондрии, промежуточными нитями цитоскелета. Костамер прикрепляет саркомер к сарколемме . [5]
Каждая органелла и макромолекула мышечного волокна устроена таким образом, чтобы гарантировать выполнение желаемых функций. Клеточная мембрана называется сарколеммой, а цитоплазма — саркоплазмой . В саркоплазме находятся миофибриллы. Миофибриллы представляют собой длинные белковые пучки диаметром около одного микрометра. К внутренней части сарколеммы прижаты необычные уплощенные миоядра. Между миофибриллами находятся митохондрии .
Хотя мышечное волокно не имеет гладких эндоплазматических цистерн, оно содержит саркоплазматический ретикулум . Саркоплазматическая сеть окружает миофибриллы и содержит запас ионов кальция , необходимых для сокращения мышц. Периодически в нем появляются расширенные концевые мешочки, известные как терминальные цистерны . Они пересекают мышечное волокно с одной стороны на другую. Между двумя терминальными цистернами находится трубчатая складка, называемая поперечным канальцем (Т-трубочка). Т-трубочки — это пути прохождения потенциалов действия, которые подают сигнал саркоплазматической сети о высвобождении кальция, вызывая мышечное сокращение. Вместе две концевые цистерны и поперечный каналец образуют триаду . [58]

Все мышцы происходят из параксиальной мезодермы . В процессе эмбрионального развития в процессе сомитогенеза параксиальная мезодерма разделяется по длине зародыша с образованием сомитов , что соответствует сегментации тела, наиболее четко выраженной в позвоночнике . [59] Каждый сомит состоит из трех отделов: склеротома (который образует позвонки ), дерматома (который образует кожу) и миотома (который образует мышцы). Миотом разделен на две части: эпимер и гипомер, которые образуют эпаксиальную и гипаксиальную мышцы соответственно. Единственными эпаксиальными мышцами у человека являются мышцы, выпрямляющие позвоночник , и малые позвоночные мышцы, которые иннервируются дорсальными ветвями спинномозговых нервов . Все остальные мышцы, в том числе конечностей, являются гипаксиальными и иннервируются вентральными ветвями спинномозговых нервов. [59]
Во время развития миобласты (клетки-предшественники мышц) либо остаются в сомитах, образуя мышцы, связанные с позвоночником, либо мигрируют в тело, образуя все остальные мышцы. Миграции миобластов предшествует образование соединительнотканных каркасов, обычно образующихся из соматической латеральной пластинки мезодермы . Миобласты следуют за химическими сигналами в соответствующие места, где сливаются в удлиненные многоядерные клетки скелетных мышц. [59]
Между десятой и восемнадцатой неделями беременности все мышечные клетки имеют быстрые тяжелые цепи миозина; У развивающегося плода выделяются два типа мышечных трубок : оба экспрессируют быстрые цепи, а один экспрессирует быстрые и медленные цепи. От 10 до 40 процентов волокон экспрессируют медленную миозиновую цепь. [60]
Типы волокон закладываются во время эмбрионального развития и реконструируются позже у взрослого человека под воздействием нервных и гормональных влияний. [39] Популяция сателлитных клеток, присутствующая под базальной пластинкой, необходима для постнатального развития мышечных клеток. [61]
Основная функция мышцы – сокращение . [2] После сокращения скелетные мышцы функционируют как эндокринный орган, секретируя миокины – широкий спектр цитокинов и других пептидов , которые действуют как сигнальные молекулы. [62] Считается, что миокины, в свою очередь, обеспечивают пользу физических упражнений для здоровья . [63] Миокины секретируются в кровоток после сокращения мышц. Интерлейкин 6 (IL-6) является наиболее изученным миокином, другие миокины, индуцированные мышечными сокращениями, включают BDNF , FGF21 и SPARC . [64]
Мышцы также функционируют для производства тепла тела. Сокращение мышц отвечает за выработку 85% тепла тела. [65] Это выделяемое тепло является побочным продуктом мышечной деятельности и в основном тратится впустую. В качестве гомеостатической реакции на сильный холод мышцам посылается сигнал о сокращении дрожи для выработки тепла. [66]



Сокращение достигается за счет структурной единицы мышцы — мышечного волокна и ее функциональной единицы — двигательной единицы . [3] Мышечные волокна — это возбудимые клетки , стимулируемые мотонейронами . Двигательная единица состоит из двигательного нейрона и множества волокон, с которыми он контактирует. Одна мышца стимулируется многими двигательными единицами. Мышечные волокна подвергаются деполяризации под действием нейромедиатора ацетилхолина , выделяемого мотонейронами в нервно-мышечных соединениях . [67]
Помимо актиновых и миозиновых миофиламентов в миофибриллах , составляющих сократительные саркомеры , есть два других важных регуляторных белка — тропонин и тропомиозин , которые делают возможным мышечное сокращение. Эти белки связаны с актином и взаимодействуют, предотвращая его взаимодействие с миозином. Как только клетка получает достаточную стимуляцию, саркоплазматический ретикулум клетки высвобождает ионный кальций (Ca 2+ ), который затем взаимодействует с регуляторным белком тропонином. Связанный с кальцием тропонин претерпевает конформационные изменения, которые приводят к перемещению тропомиозина, впоследствии обнажая миозин-связывающие сайты на актине. Это позволяет осуществлять миозин- и актин-АТФ-зависимое циклическое пересечение мостиков и укорачивать мышцы.
Соединение возбуждения-сокращения — это процесс, посредством которого мышечный потенциал действия в мышечном волокне заставляет миофибриллы сокращаться. Этот процесс основан на прямом взаимодействии между каналом высвобождения кальция RYR1 саркоплазматического ретикулума (рианодиновый рецептор 1) и потенциалзависимыми кальциевыми каналами L-типа (идентифицированными как дигидропиридиновые рецепторы, DHPR). DHPR расположены на сарколемме (которая включает поверхностную сарколемму и поперечные канальцы ), тогда как RyR находятся через мембрану SR. Тесное расположение поперечных канальцев и двух областей SR, содержащих RyRs, описывается как триада и преимущественно происходит там, где имеет место связь возбуждения-сокращения. Соединение возбуждения и сокращения происходит, когда деполяризация клеток скелетных мышц приводит к возникновению мышечного потенциала действия, который распространяется по поверхности клетки и в сеть Т-трубочек мышечного волокна , тем самым деполяризуя внутреннюю часть мышечного волокна. Деполяризация внутренних порций активирует дигидропиридиновые рецепторы в терминальных цистернах, которые расположены близко к рианодиновым рецепторам в прилежащем саркоплазматическом ретикулуме . Активированные дигидропиридиновые рецепторы физически взаимодействуют с рианодиновыми рецепторами, активируя их посредством отростков стопы (включая конформационные изменения, которые аллостерически активируют рианодиновые рецепторы). Когда рианодиновые рецепторы открываются, Ca2+
высвобождается из саркоплазматического ретикулума в местное соединительное пространство и диффундирует в основную цитоплазму, вызывая кальциевую искру . Саркоплазматический ретикулум обладает большой буферной способностью по отношению к кальцию, частично благодаря кальций-связывающему белку, называемому кальсеквестрином . Почти синхронная активация тысяч кальциевых искр потенциалом действия вызывает увеличение уровня кальция в масштабах всей клетки, вызывая подъем кальциевого переходного процесса. CA _2+
высвобождаемый в цитозоль, он связывается с тропонином С актиновыми нитями , обеспечивая циклическое пересечение мостиков, создавая силу и, в некоторых ситуациях, движение. Кальций -АТФаза сарко/эндоплазматического ретикулума (SERCA) активно перекачивает Ca.2+
обратно в саркоплазматический ретикулум. Как Ка2+
снижается до уровня покоя, сила снижается и происходит расслабление. [68]
Эфферентная часть периферической нервной системы отвечает за передачу команд мышцам и железам и, в конечном итоге, отвечает за произвольные движения . Нервы приводят в движение мышцы в ответ на произвольные и вегетативные (непроизвольные) сигналы мозга . Глубокие мышцы, поверхностные мышцы, мышцы лица и внутренние мышцы соответствуют выделенным областям первичной двигательной коры головного мозга , непосредственно перед центральной бороздой, разделяющей лобную и теменную доли.
Кроме того, мышцы реагируют на рефлекторные нервные стимулы, которые не всегда посылают сигналы в мозг. В этом случае сигнал от афферентного волокна не достигает головного мозга, а производит рефлекторное движение путем прямых связей с эфферентными нервами позвоночника . Однако большая часть мышечной активности является волевой и является результатом сложных взаимодействий между различными областями мозга.
Нервы, которые контролируют скелетные мышцы у млекопитающих , соответствуют группам нейронов первичной моторной коры коры головного мозга . Команды проходят через базальные ганглии и модифицируются входными сигналами из мозжечка , а затем передаются через пирамидный тракт в спинной мозг , а оттуда в двигательную концевую пластинку в мышцах. Попутно обратная связь, например, от экстрапирамидной системы, вносит сигналы, влияющие на мышечный тонус и реакцию.
Более глубокие мышцы, например, отвечающие за осанку , часто контролируются ядрами ствола мозга и базальных ганглиев.
В скелетных мышцах мышечные веретена передают информацию о степени длины и растяжения мышц в центральную нервную систему, чтобы помочь поддерживать осанку и положение суставов. Ощущение того , где наши тела находятся в пространстве, называется проприоцепцией , восприятием осознания тела, «бессознательным» осознанием того, где в любой момент времени расположены различные области тела. Несколько областей мозга координируют движение и положение с помощью информации обратной связи, полученной в результате проприоцепции. Мозжечок и красное ядро , в частности, постоянно проверяют положение относительно движения и вносят незначительные корректировки, чтобы обеспечить плавное движение. [ нужна цитата ]

На мышечную деятельность приходится большая часть потребления энергии организмом . Все мышечные клетки производят молекулы аденозинтрифосфата (АТФ), которые используются для движения головок миозина . Мышцы имеют кратковременный запас энергии в виде креатинфосфата , который вырабатывается из АТФ и при необходимости может регенерировать АТФ с помощью креатинкиназы . Мышцы также сохраняют запасную форму глюкозы в виде гликогена . Гликоген может быстро превращаться в глюкозу , когда для устойчивых и мощных сокращений требуется энергия. В скелетных мышцах молекула глюкозы может метаболизироваться анаэробно в процессе, называемом гликолизом, в ходе которого образуются две молекулы АТФ и две молекулы молочной кислоты (в аэробных условиях лактат не образуется; вместо этого образуется пируват , который передается через лимонную кислоту) . цикл ). Мышечные клетки также содержат шарики жира, которые используются для получения энергии во время аэробных упражнений . Аэробным энергетическим системам требуется больше времени для производства АТФ и достижения максимальной эффективности, а также требуется гораздо больше биохимических этапов, но они производят значительно больше АТФ, чем анаэробный гликолиз. С другой стороны, сердечная мышца может легко потреблять любой из трех макронутриентов (белок, глюкозу и жир) аэробно без периода «разогрева» и всегда извлекает максимальный выход АТФ из любой задействованной молекулы. Сердце, печень и эритроциты также потребляют молочную кислоту, вырабатываемую и выделяемую скелетными мышцами во время тренировки.
Скелетные мышцы используют больше калорий, чем другие органы. [69] В состоянии покоя он потребляет 54,4 кДж/кг (13,0 ккал/кг) в день. Это больше, чем у жировой ткани (18,8 кДж/кг (4,5 ккал/кг) и костной ткани (9,6 кДж/кг (2,3 ккал/кг))). [70]
Эффективность человеческих мышц оценивается (в контексте гребли и езды на велосипеде ) на уровне от 18% до 26%. Эффективность определяется как отношение объема механической работы к общим метаболическим затратам, которые можно рассчитать по потреблению кислорода. Эта низкая эффективность является результатом около 40% эффективности выработки АТФ из пищевой энергии , потерь при преобразовании энергии АТФ в механическую работу внутри мышц и механических потерь внутри тела. Последние две потери зависят от типа упражнения и типа используемых мышечных волокон (быстросокращающиеся или медленносокращающиеся). При общем КПД 20 процентов один ватт механической энергии эквивалентен 4,3 ккал в час. Например, один производитель гребного оборудования калибрует свой гребной эргометр так, чтобы подсчитывать сожженные калории как сумму, в четыре раза превышающую фактическую механическую работу плюс 300 ккал в час, что составляет около 20 процентов эффективности при механической мощности 250 Вт. Выход механической энергии при циклическом сокращении может зависеть от многих факторов, включая время активации, траекторию напряжения мышц, а также скорость нарастания и затухания силы. Их можно синтезировать экспериментально с помощью анализа рабочего цикла .
Мышечная сила является результатом трех перекрывающихся факторов: физиологической силы (размер мышцы, площадь поперечного сечения, доступные перемычки, реакция на тренировку), неврологической силы (насколько сильным или слабым является сигнал, который заставляет мышцу сокращаться) и механической силы ( угол силы мышцы на рычаге, момент, длина плеча, возможности сустава). [ нужна цитата ]
Мышцы позвоночных обычно производят примерно 25–33 Н (5,6–7,4 фунт- сила ) силы на квадратный сантиметр площади поперечного сечения мышцы в изометрическом состоянии и при оптимальной длине. [71] Некоторые мышцы беспозвоночных , например, клешни крабов, имеют гораздо более длинные саркомеры , чем позвоночные, в результате чего появляется гораздо больше мест для связывания актина и миозина и, следовательно, гораздо большая сила на квадратный сантиметр за счет гораздо более медленной скорости. Силу, создаваемую сокращением, можно измерить неинвазивно с помощью механомиографии или фономиографии , измерить in vivo с использованием растяжения сухожилия (при наличии заметного сухожилия) или измерить непосредственно с использованием более инвазивных методов.
Сила любой мышцы с точки зрения силы, действующей на скелет, зависит от длины, скорости сокращения , площади поперечного сечения, перистости , длины саркомера , изоформ миозина и нейронной активации двигательных единиц . Значительное снижение мышечной силы может указывать на основную патологию. В качестве руководства можно использовать таблицу справа.
Максимальное время удержания сокращенной мышцы зависит от запаса энергии и согласно закону Ромерта экспоненциально затухает с начала нагрузки.
Поскольку три фактора влияют на мышечную силу одновременно, а мышцы никогда не работают по отдельности, ошибочно сравнивать силу отдельных мышц и утверждать, что одна из них является «самой сильной». Но ниже приведены несколько мышц, сила которых примечательна по разным причинам.
Мышечная сила пропорциональна физиологической площади поперечного сечения (PCSA), а скорость мышц пропорциональна длине мышечных волокон. [72] Однако крутящий момент вокруг сустава определяется рядом биомеханических параметров, включая расстояние между местами прикрепления мышц и точками поворота, размером мышц и архитектурным передаточным числом . Мышцы обычно расположены противоположно, так что, когда одна группа мышц сокращается, другая группа расслабляется или удлиняется. [73] Антагонизм в передаче нервных импульсов к мышцам означает, что невозможно одновременно полностью стимулировать сокращение двух мышц-антагонистов . Во время баллистических движений, таких как бросок, мышцы-антагонисты «тормозят» мышцы-агонисты на протяжении всего сокращения, особенно в конце движения. В примере с броском грудь и передняя часть плеча (передняя дельтовидная мышца) сокращаются, чтобы вытянуть руку вперед, в то время как мышцы задней и задней части плеча (задняя дельтовидная мышца) также сокращаются и подвергаются эксцентрическому сокращению, чтобы замедлить движение. во избежание травм. Частью тренировочного процесса является умение расслаблять мышцы-антагонисты, чтобы увеличить нагрузку на грудь и переднюю часть плеча.
Сокращающиеся мышцы производят вибрацию и звук. [74] Медленно сокращающиеся волокна производят от 10 до 30 сокращений в секунду (от 10 до 30 Гц). Быстросокращающиеся волокна производят от 30 до 70 сокращений в секунду (от 30 до 70 Гц). [75] Вибрацию можно увидеть и почувствовать, сильно напрягая мышцы, например, крепко сжимая кулак. Звук можно услышать, прижав сильно напряженную мышцу к уху; хорошим примером опять же является крепкий кулак. Звук обычно описывается как грохочущий звук. Некоторые люди могут произвольно издавать этот грохочущий звук, сокращая мышцу, напрягающую барабанную перепонку среднего уха. Грохочущий звук также можно услышать, когда мышцы шеи или челюсти сильно напряжены. [ нужна цитата ]
Фенотип волокон скелетных мышц у взрослых животных регулируется несколькими независимыми сигнальными путями. К ним относятся пути, участвующие в пути Ras /митоген-активируемой протеинкиназы ( MAPK ), кальциневрина, кальций/кальмодулин-зависимой протеинкиназы IV и коактиватора 1 пролифератора пероксисом γ (PGC-1). Сигнальный путь Ras /MAPK связывает мотонейроны и сигнальные системы, связывая возбуждение и регуляцию транскрипции, способствуя нервно-зависимой индукции медленной программы регенерации мышц. Кальцинеурин , Ca 2+ / кальмодулин -активируемая фосфатаза , участвующая в зависимой от нервной активности спецификации типов волокон в скелетных мышцах, напрямую контролирует состояние фосфорилирования транскрипционного фактора NFAT , обеспечивая его транслокацию в ядро и приводя к активации медленных Мышечные белки -типа в сотрудничестве с белками фактора усиления миоцитов 2 ( MEF2 ) и другими регуляторными белками. Активность Ca2+/кальмодулин-зависимой протеинкиназы также усиливается активностью медленных мотонейронов, возможно, потому, что она усиливает ответы медленного типа, генерируемые кальциневрином, путем стимулирования трансактиваторных функций MEF2 и повышения окислительной способности посредством стимуляции митохондриального биогенеза .
Вызванные сокращением изменения во внутриклеточном кальции или активных формах кислорода подают сигналы различным путям, которые включают МАРК, кальциневрин и кальций/кальмодулин-зависимую протеинкиназу IV, чтобы активировать факторы транскрипции, которые регулируют экспрессию генов и активность ферментов в скелетных мышцах.

PGC1-α ( PPARGC1A ), транскрипционный коактиватор ядерных рецепторов, важный для регуляции ряда митохондриальных генов, участвующих в окислительном метаболизме, напрямую взаимодействует с MEF2, синергически активируя селективные гены медленных мышц (ST), а также служит мишенью для передача сигналов кальциневрина. Транскрипционный путь , опосредованный рецептором δ, активируемым пролифератором пероксисом ( PPARδ ), участвует в регуляции фенотипа волокон скелетных мышц. Мыши, несущие активированную форму PPARδ, демонстрируют фенотип «выносливости» с скоординированным увеличением окислительных ферментов и митохондриального биогенеза , а также увеличением доли ST-волокон. Таким образом, благодаря функциональной геномике кальциневрин, кальмодулин-зависимая киназа, PGC-1α и активированный PPARδ составляют основу сигнальной сети, которая контролирует трансформацию типов волокон скелетных мышц и метаболические профили, которые защищают от резистентности к инсулину и ожирения.
Переход от аэробного к анаэробному метаболизму при интенсивной работе требует быстрой активации нескольких систем, обеспечивающих постоянное снабжение АТФ работающих мышц. К ним относятся переход с жиров на углеводы, перераспределение кровотока от неработающих мышц к тренируемым, а также удаление некоторых побочных продуктов анаэробного метаболизма, таких как углекислый газ и молочная кислота. Некоторые из этих ответов регулируются транскрипционным контролем гликолитического фенотипа быстрого сокращения (FT). Например, перепрограммирование скелетных мышц с гликолитического фенотипа ST на гликолитический фенотип FT включает комплекс Six1/Eya1, состоящий из членов семейства белков Six. Более того, индуцируемый гипоксией фактор 1-α ( HIF1A ) был идентифицирован как главный регулятор экспрессии генов, участвующих в основных гипоксических реакциях, которые поддерживают уровни АТФ в клетках. Абляция HIF-1α в скелетных мышцах была связана с увеличением активности лимитирующих ферментов митохондрий, что указывает на то, что цикл лимонной кислоты и усиление окисления жирных кислот могут компенсировать снижение тока через гликолитический путь у этих животных. Однако опосредованные гипоксией ответы HIF-1α также связаны с регуляцией митохондриальной дисфункции посредством образования избыточного количества активных форм кислорода в митохондриях.
Другие пути также влияют на характер мышц взрослого человека. Например, физическая сила внутри мышечного волокна может высвободить сывороточный фактор ответа транскрипционного фактора из структурного белка тайтина, что приведет к изменению мышечного роста.

Физические упражнения часто рекомендуются как средство улучшения двигательных навыков , физической формы , силы мышц и костей, а также функции суставов. Упражнения оказывают различное воздействие на мышцы, соединительную ткань , кости и нервы, которые стимулируют мышцы. Одним из таких эффектов является мышечная гипертрофия , увеличение размера мышц за счет увеличения количества мышечных волокон или площади поперечного сечения миофибрилл. [76] Изменения мышц зависят от типа используемых упражнений.
Обычно существует два типа режимов тренировок: аэробный и анаэробный. Аэробные упражнения (например, марафоны) включают в себя деятельность низкой интенсивности, но длительной продолжительности, во время которой задействованные мышцы имеют силу сокращения ниже максимальной. Аэробная деятельность зависит от аэробного дыхания (т.е. цикла лимонной кислоты и цепи переноса электронов) для получения метаболической энергии за счет потребления жиров, белков, углеводов и кислорода. Мышцы, участвующие в аэробных упражнениях, содержат более высокий процент мышечных волокон типа I (или медленносокращающихся), которые в основном содержат митохондриальные и окислительные ферменты, связанные с аэробным дыханием. [77] [78] Напротив, анаэробные упражнения связаны с деятельностью высокой интенсивности, но короткой продолжительности, такой как спринт или поднятие тяжестей . При анаэробной деятельности преимущественно задействуются быстросокращающиеся мышечные волокна типа II. [79] Мышечные волокна типа II полагаются на глюкогенез для получения энергии во время анаэробных упражнений. [80] Во время анаэробных упражнений волокна типа II потребляют мало кислорода, белков и жиров, производят большое количество молочной кислоты и утомляются. Многие упражнения частично аэробные и анаэробные; например, футбол и скалолазание .
Присутствие молочной кислоты оказывает ингибирующее действие на выработку АТФ в мышцах. Он может даже остановить выработку АТФ, если внутриклеточная концентрация станет слишком высокой. Однако тренировки на выносливость уменьшают накопление молочной кислоты за счет увеличения капилляризации и миоглобина. [81] Это увеличивает способность выводить из мышц отходы, такие как молочная кислота, чтобы не нарушать мышечную функцию. После выхода из мышц молочная кислота может использоваться другими мышцами или тканями тела в качестве источника энергии или транспортироваться в печень, где она преобразуется обратно в пируват . Помимо повышения уровня молочной кислоты, напряженные упражнения приводят к потере ионов калия в мышцах. Это может облегчить восстановление мышечной функции, защищая от усталости. [82]
Боли в мышцах с отсроченным началом — это боль или дискомфорт, которые могут ощущаться через один-три дня после тренировки и обычно проходят через два-три дня. Когда-то считалось, что это вызвано накоплением молочной кислоты, но более поздняя теория заключается в том, что это вызвано крошечными разрывами мышечных волокон, вызванными эксцентрическим сокращением или непривычным уровнем тренировки. Поскольку молочная кислота растворяется довольно быстро, она не может объяснить боль, возникающую через несколько дней после тренировки. [83]
Заболевания скелетных мышц называются миопатиями , а заболевания нервов — нейропатиями . Оба могут повлиять на функцию мышц или вызвать мышечную боль и подпадают под категорию нервно-мышечных заболеваний . Причиной многих миопатий являются мутации в различных связанных мышечных белках. [5] [84] Некоторые воспалительные миопатии включают полимиозит и миозит с включенными тельцами.

Нервно-мышечные заболевания влияют на мышцы и их нервный контроль. В целом, проблемы с нервным контролем могут вызвать спастичность или паралич , в зависимости от локализации и характера проблемы. Ряд двигательных расстройств вызван неврологическими расстройствами , такими как болезнь Паркинсона и болезнь Хантингтона, при которых наблюдается дисфункция центральной нервной системы. [85]
Симптомы мышечных заболеваний могут включать слабость , спастичность, миоклонус и миалгию . Диагностические процедуры, которые могут выявить мышечные нарушения, включают тестирование уровня креатинкиназы в крови и электромиографию (измерение электрической активности в мышцах). В некоторых случаях для выявления миопатии может быть проведена биопсия мышц , а также генетическое тестирование для выявления аномалий ДНК , связанных со специфическими миопатиями и дистрофиями .
Методика неинвазивной эластографии , измеряющая мышечный шум, находится в стадии экспериментирования, чтобы обеспечить способ мониторинга нервно-мышечных заболеваний. Звук, издаваемый мышцей, возникает в результате укорочения актомиозиновых нитей вдоль оси мышцы. Во время сокращения мышца укорачивается по длине и расширяется по ширине, вызывая вибрации на поверхности. [86]
Независимо от показателей силы и производительности, рост мышц может быть вызван рядом факторов, в том числе гормональными сигналами, факторами развития, силовыми тренировками и болезнями. Вопреки распространенному мнению, количество мышечных волокон нельзя увеличить с помощью упражнений . Вместо этого мышцы увеличиваются в размерах за счет сочетания роста мышечных клеток по мере добавления новых белковых нитей и дополнительной массы, обеспечиваемой недифференцированными клетками-сателлитами наряду с существующими мышечными клетками. [87]
Биологические факторы, такие как возраст и уровень гормонов, могут влиять на гипертрофию мышц. В период полового созревания у мужчин гипертрофия происходит ускоренными темпами, поскольку уровень гормонов , стимулирующих рост, вырабатываемых организмом, увеличивается. Естественная гипертрофия обычно прекращается в период полного роста в подростковом возрасте. Поскольку тестостерон является одним из основных гормонов роста организма, мужчинам в среднем гораздо легче достичь гипертрофии, чем женщинам. Прием дополнительного тестостерона или других анаболических стероидов увеличит мышечную гипертрофию.
Мышечные, спинальные и нервные факторы влияют на наращивание мышечной массы. Иногда человек может заметить увеличение силы в определенной мышце, хотя упражнениям подвергалась только ее противоположная мышца, например, когда бодибилдер обнаруживает, что ее левый бицепс стал сильнее после завершения режима, ориентированного только на правый бицепс. Это явление называется перекрестным образованием . [ нужна цитата ]

Каждый день от одного до двух процентов мышц разрушается и восстанавливается. Бездеятельность , недоедание , болезни и старение могут усилить расстройство, приводящее к мышечной атрофии или саркопении . Саркопения обычно представляет собой возрастной процесс, который может вызвать слабость и ее последствия. [88] Уменьшение мышечной массы может сопровождаться меньшим количеством и размером мышечных клеток, а также меньшим содержанием белка. [89]
Известно, что полет человека в космос , включающий длительные периоды обездвиживания и невесомости, приводит к ослаблению и атрофии мышц, что приводит к потере до 30% массы некоторых мышц. [90] [91] Такие последствия также отмечаются у некоторых млекопитающих после спячки . [92]
Многие заболевания и состояния, включая рак , СПИД и сердечную недостаточность , могут вызвать потерю мышечной массы, известную как кахексия . [93]
Миопатии моделировались с использованием систем клеточных культур мышц из биопсий здоровых или больных тканей . Другим источником скелетных мышц и предшественников является направленная дифференцировка плюрипотентных стволовых клеток . [94]
В исследованиях свойств скелетных мышц используется множество методов. Электрическая стимуляция мышц используется для определения силы и скорости сокращения на разных частотах, связанных с составом типов волокон и их сочетанием в отдельной группе мышц. Тестирование мышц in vitro используется для более полной характеристики свойств мышц.
Электрическую активность, связанную с сокращением мышц, измеряют с помощью электромиографии (ЭМГ). Скелетные мышцы имеют две физиологические реакции: расслабление и сокращение. Механизмы, благодаря которым возникают эти реакции, генерируют электрическую активность, измеряемую с помощью ЭМГ. В частности, ЭМГ может измерить потенциал действия скелетных мышц, который возникает в результате гиперполяризации двигательных аксонов от нервных импульсов, посылаемых в мышцу. ЭМГ используется в исследованиях для определения того, активируется ли интересующая скелетная мышца, величины создаваемой силы и индикатора мышечной усталости . [95] Двумя типами ЭМГ являются внутримышечная ЭМГ и наиболее распространенная поверхностная ЭМГ. Сигналы ЭМГ намного сильнее, когда скелетные мышцы сокращаются, а не расслабляются. Однако для меньших и более глубоких скелетных мышц сигналы ЭМГ уменьшаются и поэтому рассматриваются как менее ценный метод измерения активации. [96] В исследованиях с использованием ЭМГ максимальное произвольное сокращение (MVC) обычно выполняется на интересующей скелетной мышце, чтобы иметь справочные данные для остальных записей ЭМГ во время основного экспериментального тестирования для той же самой скелетной мышцы. [97]
Исследования по созданию искусственных мышц включают использование электроактивных полимеров .

Ядра, присутствующие в скелетных мышцах, составляют около 50% ядер миоцитов и 50% ядер мононуклеарных клеток. [13] Мононуклеарные клетки, обнаруженные в образцах тканей скелетных мышц мышей и людей [15] [99] [98], могут быть идентифицированы с помощью транскрипции информационной РНК маркеров клеточного типа. Кэмерон и др. [98] выделили девять типов клеток. Они включают эндотелиальные клетки , выстилающие капилляры (45% клеток), фиброадипогенные предшественники (ФАП) (20%), [100] перициты (14%) и эндотелиоподобные перициты (4%). Еще 9% мононуклеаров представляют собой мышечные стволовые клетки , прилегающие к клеткам мышечных волокон. Типы лимфоидных клеток (таких как В-клетки и Т-клетки) (3%) и миелоидные клетки, такие как макрофаги (2%), составляли большую часть оставшихся мононуклеарных клеток скелетных мышц. [98] Кроме того, Кэмерон и др. [98] также идентифицировали два типа клеток миоцитов: тип I и тип II. Было обнаружено, что каждый из различных типов клеток скелетных мышц экспрессирует разные наборы генов. Среднее количество генов, экспрессируемых в каждом из девяти различных типов клеток, составило 1331 ген. Однако когда биопсия берется из мышцы бедра, она содержит все различные типы клеток. В совокупности в биопсии скелетных мышц бедра человека обнаружено от 13 026 до 13 108 генов с обнаруженной экспрессией. [101] [102]
Как указано во введении к этой статье, при различных физиологических условиях в секретоме скелетных мышц встречаются субпопуляции 654 различных белков, а также липидов, аминокислот, метаболитов и малых РНК . [12] Как описано в статье Википедии « Список эндокринных органов и действий человека », скелетные мышцы идентифицируются как эндокринные органы из-за секреции ими цитокинов и других пептидов, продуцируемых скелетными мышцами в качестве сигнальных молекул. Иизука и др. [9] указали, что скелетные мышцы являются эндокринным органом, поскольку они «синтезируют и секретируют множество факторов, и эти мышечные факторы оказывают благотворное влияние на периферические и отдаленные органы». Измененные секретомы после тренировки на выносливость или тренировки с отягощениями , а также секретом малоподвижных мышц, по-видимому, оказывают множество эффектов на отдаленные ткани.
Исследование, проведенное в Канаде, проверило влияние мышечной массы на умственные функции во время старения. Ожидалось, что в результате исследования эндокринные компоненты секретома, специфичного для скелетных мышц, смогут защитить когнитивные функции. Скелетная мышечная масса рук и ног у 8279 канадцев старше 65 лет и людей со средним здоровьем была измерена исходно и через три года. [103] Из этих лиц 1605 участников (19,4%), как считалось, имели низкую массу скелетных мышц на исходном уровне: менее 7,30 кг/м 2 для мужчин и менее 5,42 кг/м 2 для женщин (уровни, определяемые как саркопения в Канаде).
Исполнительные умственные функции , память и скорость психомоторных реакций измерялись исходно и через три года. Исполнительные умственные функции измерялись с помощью стандартных тестов, включая способность произносить последовательность 1-A, 2-B, 3-C…, называть количество животных за одну минуту, а также с помощью теста Струпа . [103] Исследование показало, что у людей с более низкой массой скелетных мышц в начале исследования снижение исполнительных умственных функций значительно более резкое, чем у людей с более высокой мышечной массой. С другой стороны, память, как и скорость психомоторики, не коррелировали с массой скелетных мышц. [103] Таким образом, большая мышечная масса и одновременно больший секретом, по-видимому, выполняют эндокринную функцию защиты исполнительной умственной функции у людей старше 65 лет.
Палух и др. [104] сравнили среднее количество шагов, пройденных в день, с риском смертности как для взрослых старше 60 лет, так и для взрослых младше 60 лет. Исследование представляло собой метаанализ 15 исследований, в которых в общей сложности оценивался 47 471 взрослый человек в течение 7 лет. Особи были разделены на примерно равные квартили. Самый низкий квартиль в среднем составлял 3553 шага в день, второй квартиль — 5801 шаг в день, третий квартиль — 7842 шага в день и четвертый квартиль — 10 901 шаг в день. Скорость ходьбы с поправкой на объем ходьбы не влияла на смертность. Однако количество шагов в день явно было связано со смертностью. Когда риск смертности для лиц старше 60 лет был установлен на уровне 1,0 для нижнего квартиля шагов в день, относительный риск смертности для второго, третьего и четвертого квартилей составлял 0,56, 0,45 и 0,35 соответственно. Для лиц моложе 60 лет результаты были менее выражены. Для лиц моложе 60 лет, при первом квартиле риска смертности, установленном на уровне 1,0, относительные риски смертности второго, третьего и четвертого квартилей составили 0,57, 0,42 и 0,53 соответственно. Таким образом, использование скелетных мышц при ходьбе оказывает большое влияние на смертность, особенно среди пожилых людей.
Уильямс и др. [102] получили биопсию скелетных мышц бедра (латеральная широкая мышца) восьми 23-летних мужчин европеоидной расы, изначально ведущих малоподвижный образ жизни. Биопсии брались как до, так и после шестинедельной программы тренировок на выносливость. Упражнение заключалось в езде на велотренажере в течение одного часа пять дней в неделю в течение шести недель.
Из 13 108 генов, экспрессия которых была обнаружена в биоптатах мышц, 641 ген активировался после тренировки на выносливость, а 176 генов снижались. Из 817 измененных генов 531 был идентифицирован как находящийся в секретоме с помощью Uniprot или Exocarta или обоих исследований, изучающих секретом мышечных клеток. Поскольку многие из генов, регулируемых физическими упражнениями, идентифицированы как секретируемые, это указывает на то, что большая часть эффекта физических упражнений имеет эндокринную, а не метаболическую функцию. [102] Установлено, что основные пути воздействия секретируемых регулируемых физическими упражнениями белков связаны с сердечной , когнитивной , почечной и тромбоцитарной функциями.
В период с 2012 по 2019 год по крайней мере 25 отчетов указывали на важную роль эпигенетических механизмов в реакции скелетных мышц на физические упражнения. [105] Эпигенетические изменения часто происходят путем добавления метильных групп к цитозинам в ДНК или удаления метильных групп из цитозинов ДНК , особенно в сайтах CpG . Метилирование цитозинов может привести к уплотнению ДНК в гетерохроматин , тем самым препятствуя доступу других молекул к ДНК. [106] Эпигенетические изменения также часто происходят посредством ацетилирования или деацетилирования гистоновых хвостов в хроматине . ДНК в ядре обычно состоит из сегментов из 146 пар оснований ДНК, обернутых вокруг восьми тесно связанных гистонов (и каждый гистон также имеет свободный хвост) в структуре, называемой нуклеосомой , и один сегмент ДНК соединен с соседним сегментом ДНК на нуклеосома с помощью линкерной ДНК . Когда гистоновые хвосты ацетилируются, они обычно вызывают ослабление ДНК вокруг нуклеосомы, что приводит к увеличению доступности ДНК.

Экспрессия генов в мышцах, как и в тканях в целом, в значительной степени регулируется регуляторными последовательностями ДНК , особенно энхансерами . Энхансеры — это некодирующие последовательности в геноме, которые активируют экспрессию отдаленных генов-мишеней [107] , зацикливаясь и взаимодействуя с промоторами своих генов-мишеней [108] (см. рисунок «Регуляция транскрипции у млекопитающих»). Как сообщили Williams et al., [102] среднее расстояние в петле между связанными энхансерами и промоторами генов составляет 239 000 нуклеотидных оснований.
Тренировка мышц на выносливость изменяет экспрессию мышечных генов за счет метилирования эпигенетической ДНК или деметилирования сайтов CpG в энхансерах. [109]
В исследовании Линдхольма и др. [109] двадцать три человека в возрасте около 27 лет, ведущие малоподвижный образ жизни, добровольно вызвались тренировать выносливость только на одной ноге в течение 3 месяцев. Другая нога использовалась как нетренированная контрольная нога. Тренировка состояла из тренировки разгибания колена на одной ноге в течение 3 месяцев (45 минут, 4 занятия в неделю). Биопсии скелетных мышц латеральной широкой мышцы бедра (мышцы бедра) были взяты как до начала тренировки, так и через 24 часа после последней тренировки с каждой ноги. Нога, тренируемая на выносливость, по сравнению с нетренированной ногой имела значительные изменения метилирования ДНК в 4919 участках генома. Сайты измененного метилирования ДНК находились преимущественно в энхансерах . Транскрипционный анализ с использованием секвенирования РНК выявил 4076 дифференциально экспрессируемых генов.
Гены с повышенной регуляцией транскрипции были связаны с энхансерами, которые значительно снижали метилирование ДНК , тогда как гены с пониженной регуляцией транскрипции были связаны с энхансерами, которые увеличивали метилирование ДНК. Повышенное метилирование в основном было связано с генами, участвующими в структурном ремоделировании мышц и метаболизме глюкозы. Энхансеры со сниженным метилированием были связаны с генами, участвующими в воспалительных или иммунологических процессах, а также в регуляции транскрипции.

Как указано выше, после тренировки эпигенетические изменения энхансеров изменяют долговременную экспрессию сотен мышечных генов. [102] Сюда входят гены, продуцирующие белки, секретируемые в системный кровоток, многие из которых могут действовать как эндокринные мессенджеры. [102] Шести малоподвижным мужчинам европеоидной расы в возрасте около 23 лет сделали биопсию латеральной широкой мышцы бедра перед тем, как приступить к программе упражнений (шесть недель 60-минутных занятий велотренажером, пять дней в неделю). Через четыре дня после завершения этой программы упражнений экспрессия многих генов постоянно эпигенно изменялась. Изменения изменили ацетилирование и деацетилирование хвостов гистонов, расположенных в энхансерах, контролирующих гены с измененной экспрессией. [102]
Гены с повышенной регуляцией были связаны с эпигенетическим ацетилированием, добавленным к гистону 3 лизина 27 (H3K27ac) нуклеосом, расположенных в их энхансерах . Гены с пониженной регуляцией были связаны с удалением эпигенетического ацетилирования H3K27 в нуклеосомах, расположенных в их энхансерах (см. Рисунок «Нуклеосома с гистоновыми хвостами , настроенными для активации транскрипции»). Биопсия латеральной широкой мышцы показала экспрессию 13 108 генов на исходном уровне перед программой тренировок. Через четыре дня после завершения программы упражнений биопсия тех же мышц показала измененную экспрессию генов: 641 ген активировался, а 176 генов снизился. [102] Уильямс и др. идентифицировали 599 взаимодействий энхансер-ген, охватывающих 491 энхансер и 268 генов (было обнаружено несколько энхансеров, связанных с некоторыми генами), где как энхансер, так и связанный с ним ген-мишень координально активировались или подавлялись после тренировки. [102]
{{cite web}}: CS1 maint: multiple names: authors list (link)