Никель — химический элемент ; он имеет символ Ni и атомный номер 28. Это серебристо-белый блестящий металл с легким золотистым оттенком. Никель – твердый и пластичный переходный металл . Чистый никель химически активен, но крупные куски медленно вступают в реакцию с воздухом при стандартных условиях, поскольку на поверхности образуется пассивирующий слой оксида никеля , который предотвращает дальнейшую коррозию. Несмотря на это, чистый самородный никель встречается в земной коре лишь в небольших количествах, обычно в ультраосновных породах [6] [7] и во внутренностях более крупных никель-железных метеоритов , которые не подвергались воздействию кислорода за пределами земной атмосферы.
Метеоритный никель встречается в сочетании с железом , что отражает происхождение этих элементов как основных конечных продуктов нуклеосинтеза сверхновых . Считается, что смесь железа и никеля составляет внешнее и внутреннее ядра Земли . [8]
Использование никеля (как природного метеоритного сплава никеля и железа) было прослежено еще в 3500 году до нашей эры. Никель был впервые выделен и классифицирован как элемент в 1751 году Акселем Фредриком Кронстедтом , который первоначально принял руду за медный минерал , в кобальтовых рудниках Лоса, Хельсингланд, Швеция . Название элемента происходит от озорного духа из немецкой шахтерской мифологии Никеля (похожего на Старого Ника ). Минералы никеля были зелеными, как медные руды, и были известны как купферникель – медь никеля – потому что они не производили меди. Экономически важным источником никеля является железная руда лимонит , в которой часто содержится 1–2% никеля. Другие важные минералы никелевой руды включают пентландит и смесь богатых никелем природных силикатов, известную как гарниерит . Основные места производства включают регион Садбери , Канада (который, как полагают, имеет метеоритное происхождение), Новую Каледонию в Тихом океане и Норильск , Россия.
Никель — один из четырех элементов (остальные — железо , кобальт и гадолиний ) [9] , которые являются ферромагнитными при температуре около комнатной. Постоянные магниты Alnico , частично основанные на никеле, имеют промежуточную силу между постоянными магнитами на основе железа и редкоземельными магнитами . Металл используется главным образом в сплавах и коррозионностойких покрытиях. Около 68% мирового производства приходится на нержавеющую сталь . Еще 10% используется для сплавов на основе никеля и меди, 9% для гальванического покрытия, 7% для легированных сталей, 3% в литейном производстве и 4% в других приложениях, таких как перезаряжаемые батареи, [10] , в том числе в электромобили (EV). [11] Никель широко используется в монетах , хотя никелированные предметы иногда вызывают аллергию на никель . Как соединение, никель имеет ряд нишевых применений в химической промышленности, таких как катализатор гидрирования , катоды для аккумуляторных батарей, пигменты и обработка поверхности металлов. [12] Никель является важным питательным веществом для некоторых микроорганизмов и растений, у которых есть ферменты с никелем в качестве активного центра . [13]

Никель — серебристо-белый металл с легким золотистым оттенком, который требует полировки. Это один из четырех элементов, которые являются ферромагнитными при комнатной температуре или около нее; остальные — железо, кобальт и гадолиний . Его температура Кюри составляет 355 ° C (671 ° F), что означает, что объемный никель немагнитен при температуре выше этой температуры. [15] [9] Элементарная ячейка никеля представляет собой гранецентрированный куб ; он имеет параметр решетки 0,352 нм, что дает атомный радиус 0,124 нм. Эта кристаллическая структура устойчива к давлению не менее 70 ГПа. Никель тверд, ковок и пластичен и имеет относительно высокую электро- и теплопроводность для переходных металлов. [16] Высокая прочность на сжатие в 34 ГПа, предсказанная для идеальных кристаллов, никогда не достигается в реальном объемном материале из-за образования и движения дислокаций . Однако это было достигнуто в наночастицах Ni . [17]
Никель имеет две атомные электронные конфигурации , [Ar] 3d 8 4s 2 и [Ar] 3d 9 4s 1 , очень близкие по энергии; [Ar] обозначает полную структуру ядра аргона . Существуют некоторые разногласия по поводу того, какая конфигурация имеет меньшую энергию. [18] В учебниках химии электронная конфигурация никеля приводится как [Ar] 4s 2 3d 8 , [19] также пишется [Ar] 3d 8 4s 2 . [20] Эта конфигурация согласуется с правилом энергетического упорядочения Маделунга , которое предсказывает, что 4s заполняется раньше 3d. Это подтверждается экспериментальным фактом, что низшим энергетическим состоянием атома никеля является энергетический уровень 3d 8 4s 2 , а именно уровень 3d 8 ( 3 F) 4s 2 3 F, J = 4. [21] [22]
Однако каждая из этих двух конфигураций распадается на несколько энергетических уровней из-за тонкой структуры , [21] [22] и два набора энергетических уровней перекрываются. Средняя энергия состояний с [Ar] 3d 9 4s 1 фактически ниже средней энергии состояний с [Ar] 3d 8 4s 2 . Поэтому в исследовательской литературе по атомным расчетам конфигурация основного состояния приводится как [Ar] 3d 9 4s 1 . [18]
Атомный вес изотопов никеля варьируется от 48 u (48
Ni ) до 82 u (82
Ни ). [5]
Природный никель состоит из пяти стабильных изотопов .58
Ни ,60
Ни ,61
Ни ,62
Ни и64
Ни , из них58
Ni является наиболее распространенным (68,077% естественного содержания ). [5]
Никель-62 имеет самую высокую энергию связи на нуклон среди всех нуклидов : 8,7946 МэВ/нуклон. [23] [24] Его энергия связи больше, чем у обоих56Фе и58Fe , более распространенные нуклиды, которые часто ошибочно называют имеющими самую высокую энергию связи. [25] Хотя это, казалось бы, предсказывает, что никель является наиболее распространенным тяжелым элементом во Вселенной, высокая скорость фотораспада никеля в недрах звезд приводит к тому, что железо является наиболее распространенным. [25]
Никель-60 — дочерний продукт вымершего радионуклида. 60Fe (период полураспада 2,6 млн лет). Из-за длительного периода полураспада60
Fe , его сохранение в материалах Солнечной системы может привести к наблюдаемым изменениям в изотопном составе60
Ни . Поэтому обилие60
Ni во внеземном материале может дать представление о происхождении Солнечной системы и ее ранней истории. [26]
Охарактеризовано не менее 26 радиоизотопов никеля; наиболее стабильными являются59
Ni с периодом полураспада 76 000 лет,63
Ни (100 лет) и56
Ни (6 дней). Все остальные радиоизотопы имеют период полураспада менее 60 часов, а у большинства из них период полураспада менее 30 секунд. Этот элемент также имеет одно метасостояние . [5]
Радиоактивный никель-56 производится в процессе сжигания кремния и позже высвобождается в больших количествах в сверхновых типа Ia . Форма кривой блеска этих сверхновых в средние и поздние времена соответствует распаду за счет электронного захвата56
Ni в кобальт -56 и, в конечном счете, в железо-56. [27] Никель-59 – долгоживущий космогенный радионуклид ; период полураспада 76 000 лет.59
Ni нашел множество применений в изотопной геологии .59
Ni использовался для определения земного возраста метеоритов и для определения содержания внеземной пыли во льду и отложениях . Период полураспада никеля-78 недавно был измерен на уровне 110 миллисекунд, и считается, что он является важным изотопом в нуклеосинтезе сверхновых элементов тяжелее железа. [28] 48 Ni, открытый в 1999 году, является самым богатым из известных изотопов тяжелых элементов. С 28 протонами и 20 нейтронами 48 Ni является « вдвойне магическим », как и 78 Ni с 28 протонами и 50 нейтронами. Поэтому оба они необычайно стабильны для ядер с таким большим протон-нейтронным дисбалансом . [5] [29]
Никель-63 — загрязнитель, обнаруженный в опорных конструкциях ядерных реакторов. Он производится путем захвата нейтронов никелем-62. Небольшие количества были также обнаружены вблизи полигонов ядерного оружия в южной части Тихого океана. [30]

На Земле никель встречается чаще всего в сочетании с серой и железом в пентландите , с серой в миллерите , с мышьяком в минерале никелин , а также с мышьяком и серой в никель- галените . [31] Никель обычно встречается в железных метеоритах в виде сплавов камасита и тэнита . Никель в метеоритах впервые обнаружил в 1799 году Жозеф-Луи Пруст , французский химик, работавший тогда в Испании. Пруст проанализировал образцы метеорита из Кампо-дель-Сьело (Аргентина), полученные в 1783 году Мигелем Рубином де Селисом, обнаружив в них наряду с железом присутствие никеля (около 10%). [32]
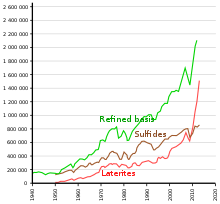
Основная часть никеля добывается из двух типов рудных месторождений. Первый — латерит , где основными рудными минеральными смесями являются никельсодержащий лимонит , (Fe,Ni)O(OH) и гарниерит (смесь различных водосодержащих никеля и богатых никелем силикатов). Второе — магматические сульфидные месторождения , где основным рудным минералом является пентландит : ( Ni,Fe) 9S8 . [33]
Индонезия и Австралия обладают крупнейшими оценочными запасами — 43,6% мировых запасов. [34]
Выявленные наземные ресурсы по всему миру со средним содержанием никеля 1% или выше включают не менее 130 миллионов тонн никеля (примерно вдвое больше известных запасов). Около 60% приходится на латериты и 40% на сульфидные месторождения. [35]
Согласно геофизическим данным, большая часть никеля на Земле находится во внешнем и внутреннем ядрах Земли . Камасит и тэнит — это встречающиеся в природе сплавы железа и никеля. Для камасита соотношение сплава обычно составляет от 90:10 до 95:5, хотя могут присутствовать примеси (например , кобальт или углерод ). Тенит содержит от 20% до 65% никеля. Камасит и тэнит встречаются также в железо-никелевых метеоритах . [36]
Наиболее распространенной степенью окисления никеля является +2, но соединения Ni 0 , Ni + и Ni 3+ хорошо известны, а экзотические степени окисления Ni 2- и Ni - были получены и изучены. [37]
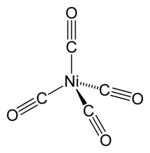
Тетракарбонил никеля (Ni(CO) 4 ), открытый Людвигом Мондом [38] , представляет собой летучую высокотоксичную жидкость при комнатной температуре. При нагревании комплекс разлагается обратно на никель и окись углерода:
Это поведение используется в процессе Монда для очистки никеля, как описано выше. Родственный комплекс никеля (0) бис (циклооктадиен) никель (0) является полезным катализатором в никельорганической химии , поскольку циклооктадиеновые (или тресковые ) лиганды легко замещаются.

Комплексы никеля(I) встречаются редко, но одним из примеров является тетраэдрический комплекс NiBr(PPh 3 ) 3 . Многие комплексы никеля(I) имеют связь Ni-Ni, например, темно-красный диамагнитный K 4 [Ni 2 (CN) 6 ] , полученный восстановлением K 2 [Ni 2 (CN) 6 ] амальгамой натрия . Это соединение окисляется в воде с выделением H 2 . [39]
Считается, что степень окисления никеля(I) важна для никельсодержащих ферментов, таких как [NiFe]-гидрогеназа , которая катализирует обратимое восстановление протонов до H 2 . [40]
_complexes_in_aqueous_solution.jpg/440px-Color_of_various_Ni(II)_complexes_in_aqueous_solution.jpg)
-sulfate-hexahydrate-sample.jpg/440px-Nickel(II)-sulfate-hexahydrate-sample.jpg)
Никель(II) образует соединения со всеми распространенными анионами, включая сульфид , сульфат , карбонат, гидроксид, карбоксилаты и галогениды. Сульфат никеля (II) производится в больших количествах путем растворения металлического никеля или оксидов в серной кислоте с образованием как гекса-, так и гептагидрата [41] , пригодного для гальваники никеля. Обыкновенные соли никеля, такие как хлорид, нитрат и сульфат, растворяются в воде с образованием зеленых растворов аквакомплекса металла [Ni(H 2 O) 6 ] 2+ . [42]
Четыре галогенида образуют соединения никеля, которые представляют собой твердые вещества с молекулами с октаэдрическими центрами Ni. Хлорид никеля (II) является наиболее распространенным, и его поведение характерно для других галогенидов. Хлорид никеля(II) получают растворением никеля или его оксида в соляной кислоте . Обычно он встречается в виде зеленого гексагидрата, формула которого обычно пишется NiCl 2 ·6H 2 O. При растворении в воде эта соль образует аквакомплекс металла [Ni(H 2 O) 6 ] 2+ . Дегидратация NiCl 2 ·6H 2 O дает желтый безводный NiCl 2 . [43]
Некоторые тетракоординированные комплексы никеля (II), например бис (трифенилфосфин) хлорид никеля , существуют как в тетраэдрической, так и в плоско-квадратной геометрии. Тетраэдрические комплексы парамагнитны ; плоские квадратные комплексы диамагнитны . Обладая свойствами магнитного равновесия и образования октаэдрических комплексов, они контрастируют с двухвалентными комплексами более тяжелых металлов 10-й группы, палладия (II) и платины (II), которые образуют только плоскоквадратную геометрию. [37]
Никелоцен известен и имеет число электронов 20. Он гораздо менее стабилен, чем ферроцен. Многие химические реакции никельоцена имеют тенденцию давать 18-электронные продукты. [44]

Известны многие соединения Ni(III). Ni(III) образует простые соли с фторид-ионами [45] или оксид- ионами. Ni(III) можно стабилизировать σ-донорными лигандами, такими как тиолы и органофосфины . [39]
Ni(III) содержится в гидроксиде оксида никеля , который используется в качестве катода во многих аккумуляторных батареях , включая никель-кадмиевые , никель-железные , никель-водородные и никель-металлогидридные , и используется некоторыми производителями в литий-ионных батареях. . [46]
Ni(IV) встречается в составе смешанного оксида BaNiO 3 . Ni(IV) остается редкой степенью окисления, и известно очень мало соединений. [47] [48] [49] [50]
Поскольку никелевые руды легко спутать с рудами серебра и меди, понимание этого металла и его использования появилось относительно недавно. Но непреднамеренное использование никеля имеет давнюю историю и может быть прослежено еще в 3500 году до нашей эры. Было обнаружено, что бронзы из территории современной Сирии содержат до 2% никеля. [51] Некоторые древние китайские рукописи предполагают, что «белая медь» ( мельхиор , известная как байтонг ) использовалась там в 1700–1400 годах до нашей эры. Эта белая медь Пактонг была экспортирована в Британию еще в 17 веке, но содержание никеля в этом сплаве было обнаружено только в 1822 году. [52] Монеты из никель-медного сплава чеканили бактрийские цари Агафокл , Евтидем II и Панталеон в II век до н. э., возможно, из китайского медно-никелевого сплава. [53]

В средневековой Германии в Рудных горах был найден металлический желтый минерал , напоминающий медную руду. Но когда горняки не смогли получить из него медь, они обвинили озорного духа немецкой мифологии Никеля (похожего на Старого Ника ) в том, что он осаждает медь. Эту руду они назвали Kupfernickel от немецкого Kupfer «медь». [54] [55] [56] [57] Эта руда теперь известна как минерал никелин (ранее никколит [58] ), арсенид никеля . В 1751 году барон Аксель Фредрик Кронстедт попытался извлечь медь из купферникеля на кобальтовой шахте в деревне Лос, Швеция , и вместо этого получил белый металл, который он назвал никелем в честь духа, давшего минералу свое название. [59] В современном немецком языке Kupfernickel или Kupfer-Nickel обозначает сплав медно-никелевого сплава . [16]
Первоначально единственным источником никеля был редкий купферникель. Начиная с 1824 года никель стали получать как побочный продукт производства синего кобальта . Первая крупномасштабная выплавка никеля началась в Норвегии в 1848 году из богатого никелем пирротина . Внедрение никеля в производство стали в 1889 г. увеличило спрос на никель; месторождения никеля в Новой Каледонии , открытые в 1865 году, обеспечивали большую часть мировых запасов в период с 1875 по 1915 год. Открытие крупных месторождений в бассейне Садбери в Канаде в 1883 году, в Норильске -Талнахе в России в 1920 году и в Меренском бассейне Риф в Южной Африке в 1924 году сделал возможным крупномасштабное производство никеля. [52]

За исключением вышеупомянутых бактрийских монет, никель не входил в состав монет до середины XIX века. [60]
Пятицентовые монеты из 99,9% никеля были отчеканены в Канаде (крупнейшем в мире производителе никеля в то время) в невоенные годы с 1922 по 1981 год; содержание металла делало эти монеты магнитными. [61] Во время войны 1942–1945 годов большая часть или весь никель был удален из канадских и американских монет, чтобы сохранить его для изготовления доспехов. [55] Канада использовала 99,9% никеля с 1968 года в своих более дорогих монетах до 2000 года. [62]
Монеты из почти чистого никеля впервые были использованы в 1881 году в Швейцарии. [63]
Бирмингем подделывал никелевые монеты в ок. 1833 г. для торговли в Малайзии. [64]
В Соединенных Штатах термин «никель» или «никель» первоначально применялся к медно-никелевому центу Flying Eagle , который заменил медь на 12% никеля в 1857–1858 годах, а затем к центу Indian Head из того же сплава с 1859 по 1864 год. Еще позже, в 1865 году, этот термин обозначал трехцентовый никель , при этом содержание никеля увеличилось до 25%. В 1866 году пятицентовый щитовой никель (25% никеля, 75% меди) получил обозначение, которое с тех пор используется для последующих монет номиналом 5 центов. Эта часть сплава не является ферромагнитной .
Никелевая монета США содержит 0,04 унции (1,1 г) никеля, который по цене апреля 2007 года стоил 6,5 цента, а также 3,75 грамма меди стоимостью около 3 центов, при общей стоимости металла более 9 центов. Поскольку номинальная стоимость никеля составляет 5 центов, это сделало его привлекательной целью для переплавки людьми, желающими продать металл с прибылью. Монетный двор США , предвидя такую практику, 14 декабря 2006 года ввел новые временные правила, подлежащие общественному обсуждению в течение 30 дней, которые установили уголовную ответственность за переплавку и экспорт центов и никелей. [65] Нарушители могут быть наказаны штрафом в размере до 10 000 долларов США и/или лишением свободы на срок до пяти лет. [66] По состоянию на 19 сентября 2013 г. стоимость расплава американского никеля (включая медь и никель) составляет 0,045 доллара США (90% от номинальной стоимости). [67]
В 21 веке высокая цена на никель привела к некоторой замене металла в монетах по всему миру. Монеты, которые до сих пор изготавливаются из никелевых сплавов, включают монеты достоинством в один и два евро , монеты США номиналом 5, 10, 25, 50 центов и 1 доллар США , [68] и британские монеты номиналом 20 пенсов, 50 пенсов, 1 фунт стерлингов и 2 фунта стерлингов . С 2012 года никелевый сплав, используемый для изготовления монет Великобритании номиналом 5 и 10 пенсов, был заменен никелированной сталью. Это вызвало общественную полемику относительно проблем людей с аллергией на никель . [63]
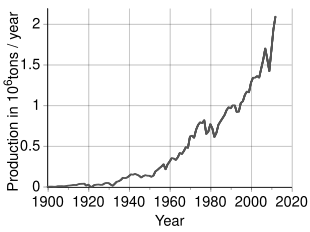

По оценкам, во всем мире добывается 3,3 миллиона тонн (т) никеля в год; Крупнейшими производителями по состоянию на 2022 год являются Индонезия (1 600 000 т), Филиппины (330 000 т), Россия (220 000 т), Новая Каледония ( Франция ) (190 000 т), Австралия (160 000 т) и Канада (130 000 т) [70]. ] Крупнейшие месторождения никеля в нероссийской Европе находятся в Финляндии и Греции . Выявленные наземные источники со средним содержанием никеля не менее 1% содержат не менее 130 миллионов тонн никеля. Около 60% приходится на латериты и 40% на сульфидные месторождения. Кроме того, обширные источники никеля обнаружены в глубинах Тихого океана , особенно в районе, называемом зоной Кларион-Клиппертона, в виде полиметаллических конкреций , усеивающих морское дно на глубине 3,5–6 км ниже уровня моря . [71] [72] Эти конкреции состоят из многочисленных редкоземельных металлов и, по оценкам, содержат 1,7% никеля. [73] Благодаря достижениям в области науки и техники , Международный орган по морскому дну в настоящее время вводит правила , гарантирующие, что сбор этих конкреций осуществляется экологически добросовестным образом и в соответствии с Целями устойчивого развития Организации Объединенных Наций . [74]
Единственное место в Соединенных Штатах, где прибыльно добывается никель, — это Риддл, штат Орегон , где расположены несколько квадратных миль никельсодержащих поверхностных месторождений гарниерита . Шахта закрылась в 1987 году. [75] [76] Проект шахты Игл — это новый никелевый рудник на Верхнем полуострове Мичигана . Строительство было завершено в 2013 году, а эксплуатация началась в третьем квартале 2014 года. [77] За первый полный год работы рудник Игл добыл 18 000 тонн. [77]
Никель получают посредством добывающей металлургии : его извлекают из руды обычными процессами обжига и восстановления, в результате которых получается металл чистотой более 75%. Во многих случаях применения нержавеющей стали можно использовать никель с чистотой 75% без дальнейшей очистки, в зависимости от примесей. [41]
Традиционно большинство сульфидных руд перерабатываются пирометаллургическими методами с получением штейна для дальнейшего рафинирования. Последние достижения в области гидрометаллургических технологий привели к получению значительно более чистого металлического никеля. Большинство сульфидных месторождений традиционно перерабатывались путем обогащения посредством процесса пенной флотации с последующей пирометаллургической экстракцией. В гидрометаллургических процессах сульфидно-никелевые руды концентрируют с помощью флотации (дифференциальная флотация, если соотношение Ni/Fe слишком низкое), а затем плавят. Никелевый штейн дополнительно обрабатывается процессом Шерритта-Гордона . Сначала медь удаляют добавлением сероводорода , оставляя концентрат кобальта и никеля. Затем экстракцией растворителем отделяют кобальт и никель, при этом конечное содержание никеля превышает 86%. [78]

Второй распространенный процесс рафинирования — это выщелачивание металлического штейна в раствор соли никеля с последующим электролитическим извлечением никеля из раствора путем нанесения его на катод в виде электролитического никеля. [79]

Самый чистый металл получают из оксида никеля по процессу Монда , который дает чистоту более 99,99%. [80] Этот процесс был запатентован Людвигом Мондом и использовался в промышленности еще до начала 20 века. В этом процессе никель реагирует с окисью углерода в присутствии серного катализатора при температуре около 40–80 ° C с образованием карбонила никеля . В аналогичной реакции с железом может образоваться пентакарбонил железа , но эта реакция протекает медленно. При необходимости никель можно отделить перегонкой. Октакарбонил дикобальта также образуется при перегонке никеля в качестве побочного продукта, но при температуре реакции он разлагается до додекакарбонила тетракобальта с образованием нелетучего твердого вещества. [81]
Никель получают из карбонила никеля одним из двух процессов. Его можно пропускать через большую камеру при высоких температурах, в которой постоянно перемешиваются десятки тысяч никелевых сфер (гранул). Карбонил разлагается и откладывает на сферы чистый никель. В альтернативном процессе карбонил никеля разлагается в камере меньшего размера при температуре 230 ° C с образованием мелкодисперсного порошка никеля. Побочный продукт оксид углерода рециркулируется и используется повторно. Продукт из никеля высокой чистоты известен как «карбонильный никель». [82]
Рыночная цена никеля росла на протяжении 2006 г. и в первые месяцы 2007 г.; по состоянию на 5 апреля 2007 г. [обновлять]металл торговался по цене 52 300 долларов США за тонну или 1,47 доллара США за унцию. [83] Позже цена резко упала; по состоянию на сентябрь 2017 года [обновлять]металл торговался по цене 11 000 долларов США за тонну, или 0,31 доллара США за унцию. [84] Во время российского вторжения в Украину в 2022 году опасения по поводу санкций в отношении экспорта российского никеля спровоцировали короткое сжатие , в результате чего цена на никель выросла в четыре раза всего за два дня, достигнув 100 000 долларов США за тонну. [85] [86] Лондонская биржа металлов расторгла контракты на сумму 3,9 миллиарда долларов и приостановила торговлю никелем более чем на неделю. [87] Аналитик Энди Хоум утверждал, что такие ценовые шоки усугубляются требованиями к чистоте, предъявляемыми рынками металлов: только металл класса I (чистота 99,8%) может использоваться в качестве товара на биржах, но большая часть мирового предложения находится либо в ферроникелевые сплавы или сплавы более низкой чистоты. [88]

В настоящее время глобальное использование никеля составляет 68% в производстве нержавеющей стали, 10% в цветных сплавах , 9% в гальванотехнике , 7% в легированной стали, 3% в литейном производстве и 4% в других отраслях (включая батареи). [10]
Никель используется во многих известных промышленных и потребительских товарах, включая нержавеющую сталь , магниты алнико , чеканку монет, аккумуляторные батареи (например, никель-железные ), струны электрогитар, микрофонные капсюли, покрытие сантехнических приборов [89] и специальные сплавы, такие как пермаллои. , элинвар и инвар . Используется для гальванического покрытия и в качестве зеленого оттенка в стекле. Никель преимущественно является легированным металлом, и его основное применение приходится на производство никелевых сталей и никелевых чугунов, где он обычно увеличивает прочность на разрыв, ударную вязкость и предел упругости. Он широко используется во многих других сплавах, включая никелевые латуни и бронзы, а также сплавы с медью, хромом, алюминием, свинцом, кобальтом, серебром и золотом ( Инконель , Инколой , Монель , Нимоник ). [79]

Поскольку никель устойчив к коррозии, его иногда использовали вместо декоративного серебра. Никель также иногда использовался в некоторых странах после 1859 года в качестве дешевого металла для чеканки монет (см. выше), но в последние годы 20-го века он был заменен более дешевыми сплавами нержавеющей стали (т.е. железа), за исключением США и США. Канада. [60]
Никель является отличным легирующим агентом для некоторых драгоценных металлов и используется в огневой пробе в качестве коллектора элементов платиновой группы (ЭПГ). Таким образом, никель может полностью собрать все шесть ЭПГ из руд и частично собрать золото. Высокопроизводительные никелевые рудники также могут производить добычу ЭПГ (в основном платины и палладия ); примерами являются Норильск, Россия и бассейн Садбери, Канада. [90]
Пенопласт никеля или никелевая сетка используются в газодиффузионных электродах щелочных топливных элементов . [91] [92]
Никель и его сплавы часто используются в качестве катализаторов реакций гидрирования . Никель Ренея , мелкодисперсный никель-алюминиевый сплав, является одной из распространенных форм, хотя также используются родственные катализаторы, в том числе катализаторы типа Ренея. [93]
Никель по природе своей магнитострикционен: в присутствии магнитного поля материал претерпевает небольшое изменение длины. [94] [95] Магнитострикция никеля составляет порядка 50 частей на миллион и является отрицательной, что указывает на то, что он сжимается . [96]
Никель используется в качестве связующего в промышленности по производству цементированного карбида вольфрама или твердых сплавов и применяется в пропорциях от 6% до 12% по весу. Никель придает карбиду вольфрама магнитность и повышает коррозионную стойкость склеенных деталей, хотя твердость у них меньше, чем у сплавов с кобальтовой связкой. [97]
63
Ni с периодом полураспада 100,1 года используется в устройствах на основе критрона в качестве эмиттера бета-частиц (высокоскоростных электронов ), чтобы сделать ионизацию с помощью поддерживающего электрода более надежной. [98] Он исследуется в качестве источника питания для бетавольтаических батарей . [99] [100]
Около 27% всего производства никеля используется в машиностроении, 10% в строительстве, 14% в трубной продукции, 20% в производстве металлических изделий, 14% в транспорте, 11% в производстве электронных товаров и 5% в других целях. [10]
Никель Ренея широко используется для гидрогенизации ненасыщенных масел с целью производства маргарина , а некондиционный маргарин и остатки масла могут содержать никель в качестве примеси . Форте и др. обнаружили, что у пациентов с диабетом 2 типа содержание Ni в крови составляет 0,89 нг/мл по сравнению с 0,77 нг/мл у контрольной группы. [101]
Никель-титан представляет собой сплав примерно равных атомных процентов входящих в его состав металлов, который демонстрирует два тесно связанных и уникальных свойства: эффект памяти формы и сверхэластичность .
Он не был признан до 1970-х годов, но известно, что никель играет важную роль в биологии некоторых растений, бактерий , архей и грибов . [102] [103] [104] Никелевые ферменты, такие как уреаза , считаются факторами вирулентности у некоторых организмов. [105] [106] Уреаза катализирует гидролиз мочевины с образованием аммиака и карбамата . [103] [102] Гидрогеназы NiFe могут катализировать окисление H 2 с образованием протонов и электронов; а также обратная реакция — восстановление протонов с образованием газообразного водорода. [103] [102] Никель-тетрапиррольный кофермент, кофактор F430 , присутствует в метилкоферменте М- редуктазе, который может катализировать образование метана или обратную реакцию у метаногенных архей (в степени окисления +1). [107] Один из ферментов дегидрогеназы монооксида углерода состоит из кластера Fe -Ni- S . [108] Другие никельсодержащие ферменты включают редкий бактериальный класс супероксиддисмутазы [109] и ферменты глиоксалазы I у бактерий и некоторых эукариотических трипаносомных паразитов [110] (у других организмов, включая дрожжи и млекопитающие, этот фермент содержит двухвалентный Zn 2+ ). [111] [112] [113] [114] [115]
Диетический никель может влиять на здоровье человека через инфекции, вызванные никель-зависимыми бактериями, но никель также может быть важным питательным веществом для бактерий, живущих в толстом кишечнике, фактически действуя как пребиотик . [116] Институт медицины США не подтвердил, что никель является важным питательным веществом для человека, поэтому не установлены ни рекомендуемая диетическая норма (RDA), ни адекватное потребление. Допустимый верхний уровень потребления никеля с пищей составляет 1 мг/день в виде растворимых солей никеля. Предполагаемое потребление с пищей составляет от 70 до 100 мкг/день; всасывается менее 10%. То, что всасывается, выводится с мочой. [117] Относительно большие количества никеля – сравнимые с указанными выше средними показателями поступления в организм – попадают в пищу, приготовленную из нержавеющей стали. Например, количество никеля, выщелоченного после 10 циклов приготовления в одну порцию томатного соуса, составляет в среднем 88 мкг. [118] [119]
Предполагается, что никель, высвобождаемый в результате извержений вулканов Сибирских траппов , способствует росту Methanosarcina , рода эвриархеотных архей, производивших метан во время пермско-триасового вымирания , крупнейшего из известных массовых вымираний . [120]
Основным источником воздействия никеля является пероральное употребление, поскольку никель необходим растениям. [122] Типичные фоновые концентрации никеля не превышают 20 нг/м 3 в воздухе, 100 мг/кг в почве, 10 мг/кг в растительности, 10 мкг/л в пресной воде и 1 мкг/л в морской воде. [123] Концентрации в окружающей среде могут увеличиваться из-за загрязнения окружающей среды человеком . Например, никелированные краны могут загрязнять воду и почву; горнодобывающая и металлургическая промышленность может сбрасывать никель в сточные воды ; Посуда из сплава никеля и стали и посуда, окрашенная никелем, могут выделять никель в пищу. Воздух может быть загрязнен в результате переработки никелевой руды и сжигания ископаемого топлива . Люди могут поглощать никель непосредственно из табачного дыма и при контакте кожи с ювелирными изделиями, шампунями , моющими средствами и монетами . Менее распространенной формой хронического воздействия является гемодиализ , поскольку следы ионов никеля могут абсорбироваться в плазму в результате хелатирующего действия альбумина . [ нужна цитата ]
Среднесуточная экспозиция не представляет угрозы для здоровья человека. Большая часть никеля, усваиваемого человеком, выводится почками и выводится из организма с мочой или выводится через желудочно-кишечный тракт, не всасываясь. Никель не является кумулятивным ядом, но большие дозы или хроническое ингаляционное воздействие могут быть токсичными, даже канцерогенными и представлять собой профессиональную опасность . [124]
Соединения никеля классифицируются как канцерогены для человека [125] [126] [127] [128] на основании повышенного риска рака дыхательных путей, наблюдаемого в эпидемиологических исследованиях среди рабочих предприятий по переработке сульфидной руды. [129] Это подтверждается положительными результатами биоанализа NTP с субсульфидом никеля и оксидом никеля на крысах и мышах. [130] [131] Данные о людях и животных неизменно указывают на отсутствие канцерогенности при пероральном пути воздействия и ограничивают канцерогенность соединений никеля в отношении опухолей дыхательных путей после вдыхания. [132] [133] Металлический никель классифицируется как подозреваемый канцероген; [125] [126] [127] существует согласованность между отсутствием повышенного риска рака органов дыхания у рабочих, преимущественно подвергающихся воздействию металлического никеля [129] и отсутствием опухолей дыхательных путей в исследовании канцерогенности при вдыхании порошка металлического никеля на крысах в течение всей жизни. [134] В исследованиях ингаляционного воздействия на грызунах различных соединений никеля и металлического никеля наблюдалось усиление воспаления легких с гиперплазией или фиброзом бронхиальных лимфатических узлов или без них. [128] [130] [134] [135] В исследованиях на крысах пероральный прием водорастворимых солей никеля может вызвать перинатальную смертность у беременных животных. [136] Неясно, имеют ли эти последствия отношение к человеку, поскольку эпидемиологические исследования работниц, подвергшихся сильному воздействию, не выявили неблагоприятных последствий токсичности для развития. [137]
Люди могут подвергнуться воздействию никеля на рабочем месте при вдыхании, проглатывании и контакте с кожей или глазами. Управление по охране труда (OSHA) установило законный предел ( допустимый предел воздействия ) для рабочего места на уровне 1 мг/м 3 за 8-часовой рабочий день, исключая карбонил никеля. Национальный институт охраны труда (NIOSH) устанавливает рекомендуемый предел воздействия (REL) на уровне 0,015 мг/м 3 за 8-часовой рабочий день. Никель в концентрации 10 мг/м 3 сразу опасен для жизни и здоровья . [138] Карбонил никеля [Ni(CO) 4 ] является чрезвычайно токсичным газом. Токсичность карбонилов металлов зависит как от токсичности металла, так и от выделения моноксида углерода из карбонильных функциональных групп; Карбонил никеля также взрывоопасен на воздухе. [139] [140]
У чувствительных людей может наблюдаться контактная аллергия на никель, известная как контактный дерматит . Люди с высокой чувствительностью также могут реагировать на продукты с высоким содержанием никеля. [141] Пациенты с помфоликсом также могут быть чувствительны к никелю. Никель является наиболее подтвержденным контактным аллергеном во всем мире, отчасти из-за его использования в украшениях для проколотых ушей . [142] Аллергия на никель, поражающая проколотые уши, часто проявляется зудом и покраснением кожи. Чтобы решить эту проблему, многие серьги в настоящее время изготавливаются без никеля или с никелем с низким выделением [143] . Количество, разрешенное в продуктах, контактирующих с кожей человека, теперь регулируется Европейским Союзом . В 2002 году исследователи обнаружили, что никель, выпущенный в монетах номиналом 1 и 2 евро, намного превышает эти стандарты. Считается, что это происходит из-за гальванической реакции. [144] В 2008 году Американское общество контактного дерматита признало никель аллергеном года . [145] В августе 2015 года Американская академия дерматологии приняла заявление о безопасности никеля: «По оценкам, контактный дерматит, включающий сенсибилизацию к никелю, обходится примерно в 1,918 миллиарда долларов и поражает почти 72,29 миллиона человек». [141]
Отчеты показывают, что как индуцированная никелем активация фактора, индуцируемого гипоксией (HIF-1), так и активация генов, индуцируемых гипоксией, вызваны истощением внутриклеточного аскорбата . Добавление аскорбата в культуральную среду увеличивало внутриклеточный уровень аскорбата и обращало вспять индуцированную металлами стабилизацию HIF-1- и HIF-1α-зависимой экспрессии генов. [146] [147]
Во второй книге страны Оз, « Чудесная страна Оз» (Л. Фрэнк Баум, опубликованная издательством Reilly & Britton , 1904 г.), Железный Дровосек утверждает, что его оловянное тело никелировано. После этого он очень осторожен, чтобы не допустить, чтобы его никелированное покрытие было поцарапано, надрезано или повреждено. [148]
В этой таблице Ni I = нейтральный атом Ni, Ni II = Ni+ и т. д.
С 1968 по 1999 год канадские четвертаки и десятицентовые монеты чеканились из 99,9% никеля, а пятицентовые монеты - из 25-99,9% никеля.
.... Этот скачок уровня никеля позволил резкому росту выбросов метаногенов.
{{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка )