
В органической химии алкан , или парафин ( историческое тривиальное название , имеющее и другие значения ), представляет собой ациклический насыщенный углеводород . Другими словами, алкан состоит из атомов водорода и углерода , расположенных в виде древовидной структуры , в которой все связи углерод-углерод одинарные . [1] Алканы имеют общую химическую формулу C n H 2 n +2 . Алканы варьируются по сложности от простейшего случая метана ( CH 4 ), где n = 1 (иногда называемого исходной молекулой), до сколь угодно больших и сложных молекул, таких как пентаконтан ( C 50 H 102 ) или 6-этил-2- метил - 5-(1-метилэтил)октан, изомер тетрадекана ( C 14 H 30 ).
Международный союз теоретической и прикладной химии (ИЮПАК) определяет алканы как «ациклические разветвленные или неразветвленные углеводороды, имеющие общую формулу C n H 2 n +2 и, следовательно, полностью состоящие из атомов водорода и насыщенных атомов углерода». Однако в некоторых источниках этот термин используется для обозначения любого насыщенного углеводорода, включая моноциклические (т.е. циклоалканы ) или полициклические , несмотря на то, что они имеют четкую общую формулу (т.е. циклоалканы представляют собой C n H 2 n ).
В алкане каждый атом углерода sp 3 -гибридизирован четырьмя сигма-связями (либо C–C, либо C–H ), а каждый атом водорода присоединен к одному из атомов углерода (по связи C–H). Самая длинная серия связанных атомов углерода в молекуле известна как ее углеродный скелет или углеродная основная цепь. Число атомов углерода можно рассматривать как размер алкана.
Одной из групп высших алканов являются воски , твердые вещества при стандартной температуре и давлении окружающей среды (SATP), у которых число атомов углерода в углеродной цепи превышает примерно 17. Благодаря повторяющимся звеньям – CH 2 алканы представляют собой гомологичные соединения. ряд органических соединений, в которых члены различаются по молекулярной массе кратной 14,03 ед . (суммарная масса каждого такого метиленомостикового звена, включающего один атом углерода массой 12,01 ед. и два атома водорода массой ~1,01 ед. каждый) .
Метан вырабатывается метаногенными бактериями , а некоторые алканы с длинной цепью действуют как феромоны у некоторых видов животных или как защитные воски у растений и грибов. Тем не менее, большинство алканов не обладают большой биологической активностью . Их можно рассматривать как молекулярные деревья, на которые можно навесить более активные/реактивные функциональные группы биологических молекул.
Алканы имеют два основных коммерческих источника: нефть (сырая нефть) и природный газ .
Алкильная группа представляет собой молекулярный фрагмент на основе алкана, который имеет одну открытую валентность для связывания . Обычно их обозначают символом любой органильной группы R, хотя Alk иногда используется для обозначения алкильной группы (в отличие от алкенильной группы или арильной группы).
Обычно расстояние одинарной связи CC составляет 1,53 ангстрема (1,53 × 10 -10 м). [2] Насыщенные углеводороды могут быть линейными, разветвленными или циклическими . Третью группу иногда называют циклоалканами . [1] Очень сложные структуры возможны при объединении линейных, разветвленных и циклических алканов.

Алканы с числом атомов углерода более трех могут располагаться различным образом, образуя структурные изомеры . Простейшим изомером алкана является тот, у которого атомы углерода расположены в одну цепь без разветвлений. Этот изомер иногда называют n -изомером ( n означает «нормальный», хотя он не обязательно является самым распространенным). Однако цепь атомов углерода также может быть разветвленной в одной или нескольких точках. Число возможных изомеров быстро увеличивается с увеличением числа атомов углерода. Например, для ациклических алканов: [3]
Разветвленные алканы могут быть хиральными . Например, 3-метилгексан и его высшие гомологи являются хиральными из-за их стереогенного центра при атоме углерода под номером 3. Приведенный выше список включает только различия в связности, а не стереохимию. Помимо изомеров алканов, цепочка атомов углерода может образовывать одно или несколько колец. Такие соединения называются циклоалканами и также исключены из приведенного выше списка, поскольку изменение количества колец меняет молекулярную формулу . Например, циклобутан и метилциклопропан являются изомерами друг друга (C 4 H 8 ), но не являются изомерами бутана (C 4 H 10 ).
Разветвленные алканы более термодинамически стабильны, чем их линейные (или менее разветвленные) изомеры. Например, сильно разветвленный 2,2,3,3-тетраметилбутан примерно на 1,9 ккал/моль более стабилен, чем его линейный изомер н -октан. [4]
Номенклатура ИЮПАК ( систематический способ обозначения соединений) алканов основана на идентификации углеводородных цепей. Неразветвленные насыщенные углеводородные цепи систематически называются с помощью греческого числового префикса, обозначающего количество атомов углерода, и суффикса «-ан». [5]
В 1866 году Август Вильгельм фон Хофманн предложил систематизировать номенклатуру, используя всю последовательность гласных a, e, i, o и u для создания суффиксов -ane, -ene, -ine (или -yne), -one, -une, для углеводороды C n H 2 n +2 , C n H 2 n , C n H 2 n -2 , C n H 2 n -4 , C n H 2 n -6 . [6] В современной номенклатуре первые три конкретно называют углеводороды с одинарными, двойными и тройными связями; [7] в то время как «-один» теперь представляет собой кетон .
Алканы с прямой цепью иногда обозначаются префиксом «n-» или « n- » (от «нормального»), если существует нелинейный изомер . Хотя это не является строго необходимым и не является частью системы наименований ИЮПАК, такое использование по-прежнему распространено в тех случаях, когда кто-то хочет подчеркнуть или провести различие между изомерами с прямой и разветвленной цепью, например, « н -бутан », а не просто «бутан», чтобы отличить его от изобутана . Альтернативные названия этой группы, используемые в нефтяной промышленности, — линейные парафины или н -парафины .
Первые восемь членов ряда (по числу атомов углерода) называются следующим образом:
Первые четыре названия произошли от метанола , эфира , пропионовой кислоты и масляной кислоты . Алканы с пятью и более атомами углерода называются путем добавления суффикса -ane к соответствующему префиксу числового множителя [8] с удалением любой концевой гласной ( -a или -o ) из основного числового термина. Следовательно, пентан , C 5 H 12 ; гексан , C 6 H 14 ; гептан , C 7 H 16 ; октан , C 8 H 18 ; и т. д. Цифровой префикс обычно греческий; однако алканы, число атомов углерода которых заканчивается на девять, например нонан , используют латинский префикс non- .
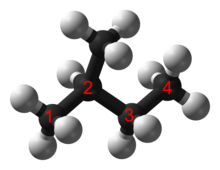
Простые разветвленные алканы часто имеют общее название с использованием префикса, чтобы отличить их от линейных алканов, например н -пентан , изопентан и неопентан .
Соглашения об именах ИЮПАК можно использовать для создания систематического названия.
Ключевые этапы в названии более сложных разветвленных алканов следующие: [9]
Хотя технически этот класс углеводородов отличается от алканов, некоторые называют его «циклическими алканами». Как следует из их описания, они содержат одно или несколько колец.
Простые циклоалканы имеют приставку «цикло-», чтобы отличить их от алканов. Циклоалканы называются в соответствии с их ациклическими аналогами в зависимости от количества атомов углерода в их основной цепи, например, циклопентан (C 5 H 10 ) представляет собой циклоалкан с 5 атомами углерода, как и пентан (C 5 H 12 ), но они соединены образовали пятичленное кольцо. Подобным образом пропан и циклопропан , бутан и циклобутан и т. д.
Замещенные циклоалканы называются так же, как и замещенные алканы: указывается циклоалкановое кольцо, а заместители располагаются в соответствии с их положением в кольце, а нумерация определяется правилами приоритета Кана-Ингольда-Прелога . [8]
Тривиальное (несистематическое ) название алканов — «парафины». Вместе алканы известны как «парафиновый ряд». Тривиальные названия соединений обычно являются историческими артефактами. Они были придуманы до появления систематических названий и сохранились благодаря привычному использованию в промышленности. Циклоалканы еще называют нафтенами. [11] [12]
Алканы с разветвленной цепью называются изопарафинами . «Парафин» является общим термином и часто не различает чистые соединения и смеси изомеров , т. е. соединения одной и той же химической формулы , например пентан и изопентан .
В системе ИЮПАК сохранены следующие тривиальные имена:
Иногда используются некоторые тривиальные имена, не относящиеся к IUPAC:
Все алканы бесцветны. [14] [15] Алканы с наименьшей молекулярной массой представляют собой газы, с промежуточной молекулярной массой — жидкости, а самые тяжелые — воскообразные твердые вещества. [16] [17]

Алканы испытывают межмолекулярные силы Ван-дер-Ваальса . Совокупное воздействие этих межмолекулярных сил приводит к повышению температуры кипения алканов. [18]
На силу сил Ван-дер-Ваальса влияют два фактора:
В стандартных условиях алканы от CH 4 до C 4 H 10 являются газообразными; от C 5 H 12 до C 17 H 36 — жидкости; а после C 18 H 38 они твердые. Поскольку температура кипения алканов в первую очередь определяется массой, неудивительно, что температура кипения имеет почти линейную зависимость от размера ( молекулярной массы ) молекулы. Как правило, температура кипения повышается на 20–30 ° C для каждого углерода, добавленного в цепь; это правило применимо и к другим гомологическим рядам. [18]
Алкан с прямой цепью будет иметь температуру кипения выше, чем алкан с разветвленной цепью, из-за большей площади контакта и, следовательно, больших сил Ван-дер-Ваальса между соседними молекулами. Например, сравните изобутан (2-метилпропан) и н-бутан (бутан), которые кипят при -12 и 0 °С, а также 2,2-диметилбутан и 2,3-диметилбутан, которые кипят при 50 и 58 °С соответственно. . [18]
С другой стороны, циклоалканы имеют тенденцию иметь более высокие температуры кипения, чем их линейные аналоги, из-за заблокированных конформаций молекул, которые образуют плоскость межмолекулярного контакта.
Точки плавления алканов имеют ту же тенденцию, что и температуры кипения , по той же причине, что изложена выше. То есть (при прочих равных условиях) чем больше молекула, тем выше температура плавления. Существует одно существенное различие между точками кипения и точками плавления. Твердые тела имеют более жесткую и фиксированную структуру, чем жидкости. Эта жесткая структура требует энергии для разрушения. Таким образом, более прочные конструкции, собранные лучше, потребуют больше энергии для разрушения. Для алканов это видно из графика выше (т.е. синей линии). Алканы с нечетными номерами имеют более низкую температуру плавления, чем алканы с четными номерами. Это связано с тем, что алканы с четными номерами хорошо упаковываются в твердую фазу, образуя хорошо организованную структуру, для распада которой требуется больше энергии. Алканы с нечетными номерами упаковываются хуже, и поэтому «более рыхлая» организованная твердая структура упаковки требует меньше энергии для разрушения. [19] Визуализацию кристаллических структур см. [20]
Температуры плавления алканов с разветвленной цепью могут быть как выше, так и ниже, чем у соответствующих алканов с прямой цепью, опять же в зависимости от способности рассматриваемого алкана хорошо упаковываться в твердой фазе.
Алканы никоим образом не проводят электричество и существенно не поляризуются электрическим полем . По этой причине они не образуют водородных связей и нерастворимы в полярных растворителях, таких как вода. Поскольку водородные связи между отдельными молекулами воды направлены в сторону от молекулы алкана, сосуществование алкана и воды приводит к увеличению молекулярного порядка (уменьшению энтропии ) . Поскольку между молекулами воды и молекулами алканов нет значительной связи, второй закон термодинамики предполагает, что это снижение энтропии следует свести к минимуму за счет минимизации контакта между алканом и водой: алканы считаются гидрофобными, поскольку они нерастворимы в воде.
Их растворимость в неполярных растворителях относительно высока, это свойство называется липофильностью . Алканы, например, смешиваются между собой во всех пропорциях.
Плотность алканов обычно увеличивается с увеличением числа атомов углерода, но остается меньше, чем у воды. Следовательно, алканы образуют верхний слой в смеси алканов и воды. [21]
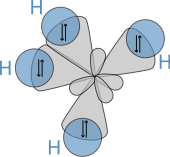
Молекулярная структура алканов напрямую влияет на их физические и химические характеристики. Он получен из электронной конфигурации углерода , который имеет четыре валентных электрона . Атомы углерода в алканах описываются как sp3 - гибриды; то есть, в хорошем приближении, валентные электроны находятся на орбиталях, направленных к углам тетраэдра, которые образуются в результате комбинации 2s-орбитали и трех 2p-орбиталей. Геометрически угол между связями равен cos −1 (−1/3) ≈ 109,47°. Это точно в случае метана, в то время как более крупные алканы, содержащие комбинацию связей C–H и C–C, обычно имеют связи, которые находятся в пределах нескольких градусов от этого идеализированного значения.

Алкан имеет только одинарные связи C–H и C–C. Первые являются результатом перекрытия sp3- орбитали углерода с 1s-орбиталью водорода; последнее - перекрытием двух sp 3 -орбиталей соседних атомов углерода. Длины связей составляют 1,09×10–10 м для связи C–H и 1,54×10–10 м для связи C–C.
Пространственное расположение связей аналогично расположению четырех sp 3 -орбиталей — они расположены тетраэдрически с углом между ними 109,47°. Структурные формулы, которые представляют связи под прямым углом друг к другу, хотя и распространены, и полезны, но не точно отражают геометрию.


Пространственное расположение связей CC и CH описывается торсионными углами молекулы и называется ее конформацией . В этане , простейшем случае изучения конформации алканов, существует почти свободное вращение вокруг одинарной связи углерод-углерод. Важны две предельные конформации: затменная конформация и шахматная конформация . Ступенчатая конформация на 12,6 кДж/моль (3,0 ккал/моль) ниже по энергии (более стабильна), чем затменная конформация (наименее стабильная). В сильно разветвленных алканах валентный угол может отличаться от оптимального значения (109,5°) для размещения объемных групп. Такие искажения создают напряжение в молекуле, известное как стерические препятствия или деформация. Деформация существенно увеличивает реакционную способность. [22]
Спектроскопические признаки алканов можно получить с помощью основных методов определения характеристик. [23]
Режим растяжения C-H дает сильное поглощение между 2850 и 2960 см -1 , а более слабые полосы для режима растяжения CC поглощают между 800 и 1300 см -1 . Моды изгиба углерода и водорода зависят от природы группы: у метильных групп наблюдаются полосы при 1450 см -1 и 1375 см -1 , а у метиленовых групп - полосы при 1465 см- 1 и 1450 см -1 . [24] Углеродные цепочки с более чем четырьмя атомами углерода демонстрируют слабое поглощение при частоте около 725 см -1 .
Протонные резонансы алканов обычно находятся при δ H = 0,5–1,5. Резонансы углерода-13 зависят от числа атомов водорода, присоединенных к углероду: δ C = 8–30 (первичные, метиловые, –CH 3 ), 15–55 (вторичные, метиленовые, –CH 2 –), 20–60 (третичный, метин, C–H) и четвертичный. Резонанс углерода-13 четвертичных атомов углерода характерно слабый из-за отсутствия ядерного эффекта Оверхаузера и большого времени релаксации и может быть пропущен в слабых образцах или образцах, которые не подвергались испытаниям в течение достаточно длительного времени.
Поскольку алканы имеют высокие энергии ионизации , их масс-спектры электронного удара показывают слабые токи для их молекулярных ионов. Характер фрагментации может быть трудно интерпретировать, но в случае алканов с разветвленной цепью углеродная цепь преимущественно расщепляется по третичным или четвертичным атомам углерода из-за относительной стабильности образующихся свободных радикалов . Масс-спектры алканов с прямой цепью иллюстрирует масс-спектр додекана : фрагмент, образующийся в результате потери одной метильной группы ( М - 15), отсутствует, фрагменты более интенсивны, чем молекулярный ион, и расположены между собой с интервалом 14 масс. ед., что соответствует потере групп CH 2 . [25]
Алканы слабо реагируют с большинством химических соединений. Они реагируют только с самыми сильными электрофильными реагентами благодаря своим сильным связям C–H (~ 100 ккал/моль) и связям C–C (~ 90 ккал/моль). Они также относительно не реагируют на свободные радикалы. Эта инертность является источником термина « парафины » (здесь это означает «недостаток сродства»). В сырой нефти молекулы алканов остаются химически неизменными на протяжении миллионов лет.
Значения констант кислотной диссоциации (p K a ) всех алканов оцениваются в пределах от 50 до 70 в зависимости от метода экстраполяции, следовательно, это чрезвычайно слабые кислоты, практически инертные к основаниям (см.: Углеродные кислоты ). Они также являются чрезвычайно слабыми основаниями, не подвергаясь заметному протонированию в чистой серной кислоте ( H 0 ~ -12), хотя известно, что суперкислоты , которые по крайней мере в миллионы раз сильнее, протонируют их с образованием гиперкоординированных ионов алкания (см.: ион метана ). . Так, смесь пентафторида сурьмы (SbF 5 ) и фторсульфоновой кислоты (HSO 3 F), называемая волшебной кислотой , способна протонировать алканы. [26]
Все алканы реагируют с кислородом в реакции горения , хотя с увеличением числа атомов углерода их становится все труднее воспламенить. Общее уравнение полного сгорания:
При отсутствии достаточного количества кислорода может образоваться окись углерода или даже сажа , как показано ниже:
Например, метан :
Подробные данные см. в таблице теплоты образования алканов . Стандартное изменение энтальпии сгорания Δc H ⊖ для алканов увеличивается примерно на 650 кДж/моль на группу CH 2 . Алканы с разветвленной цепью имеют более низкие значения Δ c H ⊖ , чем алканы с прямой цепью с тем же количеством атомов углерода, и поэтому можно считать, что они несколько более стабильны.
Некоторые организмы способны метаболизировать алканы. [27] [ 28] Метанмонооксигеназы превращают метан в метанол . Что касается высших алканов, цитохром P450 превращает алканы в спирты, которые затем подвержены разложению.
Свободные радикалы – молекулы с неспаренными электронами – играют большую роль в большинстве реакций алканов. С галогенами происходят свободнорадикальные реакции галогенирования, приводящие к образованию галогеналканов . Атомы водорода алкана постепенно заменяются атомами галогена. Реакция алканов и фтора сильно экзотермична и может привести к взрыву. [29] Эти реакции являются важным промышленным путем получения галогенированных углеводородов. Есть три шага:
Эксперименты показали, что любое галогенирование дает смесь всех возможных изомеров, что указывает на то, что все атомы водорода восприимчивы к реакции. Однако полученная смесь не является статистической: вторичные и третичные атомы водорода преимущественно заменяются из-за большей стабильности вторичных и третичных свободных радикалов. Пример можно увидеть при монобромировании пропана: [18]

В реакции Рида диоксид серы и хлор под действием света превращают углеводороды в сульфонилхлориды .
При некоторых условиях алканы подвергаются нитрованию .
Некоторые комплексы переходных металлов способствуют нерадикальным реакциям с алканами, что приводит к реакциям активации связи C–H . [30]
Крекинг разбивает более крупные молекулы на более мелкие. Эта реакция требует тепла и катализаторов. Процесс термического крекинга протекает по гомолитическому механизму с образованием свободных радикалов . Процесс каталитического крекинга предполагает присутствие кислотных катализаторов (обычно твердых кислот, таких как алюмосиликат и цеолиты ), которые способствуют гетеролитическому (асимметричному) разрыву связей с образованием пар ионов с противоположными зарядами, обычно карбокатиона . Свободные радикалы и катионы, локализованные в углероде, очень нестабильны и подвергаются процессам перегруппировки цепей, разрыву C–C в бета- положении (т.е. крекингу), а также внутри- и межмолекулярному переносу водорода или гидридному переносу. В обоих типах процессов соответствующие реакционноспособные интермедиаты (радикалы, ионы) постоянно регенерируются, и поэтому они протекают по самораспространяющемуся цепному механизму. Цепочка реакций в конечном итоге обрывается радикальной или ионной рекомбинацией. [ нужна цитата ]
Драган и его коллега первыми сообщили об изомеризации алканов. [31] Изомеризация и реформация — это процессы, в которых алканы с прямой цепью нагреваются в присутствии платинового катализатора. При изомеризации алканы превращаются в изомеры с разветвленной цепью. Другими словами, он не теряет ни углерода, ни водорода, сохраняя ту же молекулярную массу. [31] В процессе реформации алканы превращаются в циклоалканы или ароматические углеводороды , выделяя водород в качестве побочного продукта. Оба эти процесса повышают октановое число вещества. Бутан — наиболее распространенный алкан, подвергающийся процессу изомеризации, поскольку из него образуется множество разветвленных алканов с высокими октановыми числами. [31]
При паровом риформинге алканы реагируют с водяным паром в присутствии никелевого катализатора с образованием водорода и монооксида углерода.


Алканы составляют небольшую часть атмосфер внешних газовых планет, таких как Юпитер (0,1% метана, 2 ppm этана), Сатурн (0,2% метана, 5 ppm этана), Уран (1,99% метана, 2,5 ppm этана) и Нептун ( 1,5% метана, 1,5 ppm этана). Титан (1,6% метана), спутник Сатурна, был исследован зондом « Гюйгенс» , который показал, что атмосфера Титана периодически выбрасывает жидкий метан на поверхность Луны. [32] Также на Титане миссия Кассини запечатлела сезонные метан/этановые озера вблизи полярных регионов Титана. Метан и этан также были обнаружены в хвосте кометы Хякутакэ . Химический анализ показал, что содержание этана и метана было примерно равным, что, как полагают, означает, что его льды образовались в межзвездном пространстве, вдали от Солнца, где эти летучие молекулы испарились бы. [33] Алканы также были обнаружены в метеоритах , таких как углистые хондриты .
Следы газообразного метана (около 0,0002% или 1745 частей на миллиард) встречаются в атмосфере Земли, вырабатываемого в основном метаногенными микроорганизмами, такими как археи, в кишечнике жвачных животных. [34]
Важнейшими коммерческими источниками алканов являются природный газ и нефть . [18] Природный газ содержит в основном метан и этан, а также некоторое количество пропана и бутана : нефть представляет собой смесь жидких алканов и других углеводородов . Эти углеводороды образовались, когда морские животные и растения (зоопланктон и фитопланктон) погибли и опустились на дно древних морей, были покрыты осадками в бескислородной среде и за многие миллионы лет при высоких температурах и высоком давлении превратились в свою современную форму. Природный газ образуется, например, в результате следующей реакции:
Эти залежи углеводородов, собранные в пористых породах, запертых под непроницаемыми покрышками, составляют коммерческие нефтяные месторождения . Они формировались на протяжении миллионов лет, и однажды исчерпанные, их невозможно легко заменить. Истощение этих запасов углеводородов является основой того, что известно как энергетический кризис .
Алканы плохо растворяются в воде, поэтому их содержание в Мировом океане незначительно; однако при высоких давлениях и низких температурах (например, на дне океанов) метан может кристаллизоваться вместе с водой с образованием твердого клатрата метана (гидрата метана). Хотя в настоящее время это не может быть использовано в коммерческих целях, количество горючей энергии известных месторождений клатрата метана превышает энергосодержание всех месторождений природного газа и нефти, вместе взятых. Таким образом, метан, извлеченный из клатрата метана, является кандидатом на будущее топливо.

Помимо нефти и природного газа, алканы в природе встречаются в основном только в виде метана, который вырабатывается некоторыми архей в процессе метаногенеза . Эти организмы обнаружены в кишечнике термитов [35] и коров. [36] Метан производится из углекислого газа или других органических соединений. Энергия выделяется при окислении водорода :
Вполне вероятно, что наши нынешние месторождения природного газа образовались аналогичным образом. [37]
RCH2\sCH3}} (R = алкил )
Другой путь получения алканов — гидрогенолиз , который влечет за собой расщепление связей C-гетероатом с использованием водорода. В промышленности основными субстратами являются азоторганические и сероорганические примеси, т.е. гетероатомы – N и S. Специфические процессы называются гидроденитрификацией и гидродесульфурацией :
Гидрогенолиз можно применять для превращения практически любой функциональной группы в углеводороды. Субстраты включают галогеналканы, спирты, альдегиды, кетоны, карбоновые кислоты и т. д. На нефтеперерабатывающих заводах практикуются как гидрогенолиз, так и гидрирование. Этого можно добиться с помощью литийалюминийгидрида , восстановления Клемменсона и других специализированных способов.
Уголь является более традиционным предшественником алканов. Широкий спектр технологий интенсивно практиковался на протяжении веков. [38] Простое нагревание угля дает алканы, оставляя после себя кокс . Соответствующие технологии включают процесс Бергиуса и сжижение угля . Частичное сгорание угля и связанных с ним твердых органических соединений приводит к образованию угарного газа , который можно гидрировать с помощью процесса Фишера-Тропша . Эта технология позволяет синтезировать жидкие углеводороды, в том числе алканы. Этот метод используется для получения заменителей нефтяных дистиллятов .
Редко возникает интерес к синтезу алканов, поскольку они обычно коммерчески доступны и менее ценны, чем практически любой предшественник. Самый известный метод — гидрирование алкенов . Многие связи CX можно преобразовать в связи CH с использованием алюмогидрида лития , восстановления Клемменсона и других специализированных способов. [39] Гидролиз алкильных реагентов Гриньяра и соединений алкиллития дает алканы. [40]
Алканы преимущественно используются в качестве топлива. Пропан и бутан , легко сжижаемые газы, широко известны как сжиженный нефтяной газ (СНГ). [41] От пентана до октана алканы представляют собой легколетучие жидкости. Их используют в качестве топлива в двигателях внутреннего сгорания , так как они легко испаряются при попадании в камеру сгорания, не образуя капель, что ухудшало бы равномерность сгорания. Предпочтительны алканы с разветвленной цепью, поскольку они гораздо менее склонны к преждевременному возгоранию, вызывающему детонацию , чем их гомологи с прямой цепью. Эта склонность к преждевременному воспламенению измеряется октановым числом топлива, где 2,2,4-триметилпентан ( изооктан ) имеет произвольное значение 100, а гептан — нулевое значение. Помимо использования в качестве топлива, средние алканы также являются хорошими растворителями неполярных веществ. Алканы от нонана до, например, гексадекана (алкана с шестнадцатью атомами углерода) представляют собой жидкости более высокой вязкости , все менее пригодные для использования в бензине. Вместо этого они составляют большую часть дизельного и авиационного топлива . Дизельное топливо характеризуется цетановым числом , причем цетан — старое название гексадекана. Однако более высокие температуры плавления этих алканов могут вызвать проблемы при низких температурах и в полярных регионах, где топливо становится слишком густым и не может течь правильно.
В процессе крекинга алканы могут превращаться в алкены . Простые алкены являются предшественниками полимеров, таких как полиэтилен и полипропилен . Когда крекинг доходит до крайности, алканы могут превращаться в технический углерод , который является важным компонентом шин.
Хлорирование метана дает хлорметаны, которые используются в качестве растворителей и строительных блоков для сложных соединений. Аналогичным образом обработка метана серой дает сероуглерод . Другие химические вещества получают путем реакции с триоксидом серы и оксидом азота.
Некоторые легкие углеводороды используются в виде аэрозольных распылителей .
Алканы от гексадекана и выше образуют важнейшие компоненты мазута и смазочного масла . В последней функции они действуют одновременно как антикоррозионные средства, поскольку их гидрофобная природа означает, что вода не может достичь поверхности металла. Многие твердые алканы находят применение в качестве парафина , например, в свечах . Однако его не следует путать с настоящим воском , который состоит в основном из сложных эфиров .
Алканы с длиной цепи примерно 35 и более атомов углерода встречаются в битумах , используемых, например, при дорожном покрытии. Однако высшие алканы имеют небольшую ценность и обычно расщепляются на низшие алканы путем крекинга .
Алканы легко воспламеняются, но обладают низкой токсичностью. Метан «токсикологически практически инертен». Алканы могут оказывать удушающее и наркотическое действие. [38]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )