Колоректальный рак ( КРР ), также известный как рак кишечника , рак толстой кишки или рак прямой кишки , представляет собой развитие рака из толстой или прямой кишки (части толстой кишки ). [5] Признаки и симптомы могут включать кровь в стуле , изменение дефекации , потерю веса, боли в животе и усталость. [9] Большинство случаев колоректального рака обусловлены факторами образа жизни и генетическими нарушениями. [2] [3] Факторы риска включают диету, ожирение , курение и отсутствие физической активности . [2] Диетические факторы, которые увеличивают риск, включают красное мясо , обработанное мясо и алкоголь . [2] [4] Другим фактором риска является воспалительное заболевание кишечника , которое включает болезнь Крона и язвенный колит . [2] Некоторые из наследственных генетических нарушений, которые могут вызвать колоректальный рак, включают семейный аденоматозный полипоз и наследственный неполипозный рак толстой кишки ; однако они составляют менее 5% случаев. [2] [3] Обычно это начинается как доброкачественная опухоль , часто в форме полипа , которая со временем становится раковой . [2]
Колоректальный рак может быть диагностирован путем получения образца толстой кишки во время сигмоидоскопии или колоноскопии . [1] Затем следует медицинская визуализация , чтобы определить, распространилось ли заболевание. [5] Скрининг эффективен для предотвращения и снижения смертности от колоректального рака. [10] Скрининг одним из ряда методов рекомендуется начинать с возраста 45–75 лет. Его рекомендовали начинать с 50 лет, но из-за увеличения количества случаев рака толстой кишки его изменили на 45 лет. [10] [11] Во время колоноскопии небольшие полипы могут быть удалены, если они обнаружены. [2] Если обнаружен большой полип или опухоль, может быть проведена биопсия , чтобы проверить, являются ли они раковыми. Аспирин и другие нестероидные противовоспалительные препараты снижают риск боли во время удаления полипа. [2] [12] Однако их общее использование для этой цели не рекомендуется из-за побочных эффектов. [13]
Лечение, используемое для колоректального рака, может включать некоторую комбинацию хирургии, лучевой терапии , химиотерапии и таргетной терапии . [5] Рак, ограниченный стенкой толстой кишки, может быть излечен хирургическим путем, в то время как рак, который широко распространился, обычно неизлечим, при этом лечение направлено на улучшение качества жизни и симптомов. [5] Пятилетняя выживаемость в Соединенных Штатах составляла около 65% в 2014 году. [6] Индивидуальная вероятность выживания зависит от того, насколько запущен рак, можно ли удалить всю опухоль хирургическим путем, и от общего состояния здоровья человека. [1] Во всем мире колоректальный рак является третьим по распространенности типом рака, составляя около 10% всех случаев. [14] В 2018 году было зарегистрировано 1,09 миллиона новых случаев и 551 000 смертей от этого заболевания. [8] Он чаще встречается в развитых странах , где обнаруживается более 65% случаев. [2] Он реже встречается у женщин, чем у мужчин. [2]
Признаки и симптомы колоректального рака зависят от расположения опухоли в кишечнике и от того, распространилась ли она в другие части тела ( метастазы ). Классические предупреждающие признаки включают: ухудшение запора , кровь в стуле , уменьшение калибра (густоты) стула, потерю аппетита, потерю веса и тошноту или рвоту у людей старше 50 лет. [15] Около 50% людей, больных колоректальным раком, не сообщают о каких-либо симптомах. [16]
Ректальное кровотечение или анемия являются симптомами высокого риска у людей старше 50 лет. [17] Потеря веса и изменения в работе кишечника человека обычно вызывают беспокойство только в том случае, если они связаны с ректальным кровотечением. [17] [18]
75–95% случаев колоректального рака возникают у людей с небольшим или нулевым генетическим риском. [19] [20] Факторы риска включают пожилой возраст, мужской пол, [20] высокое потребление жиров, сахара , алкоголя , красного мяса , обработанных мясных продуктов , ожирение , курение и отсутствие физических упражнений . [19] [21] Калькулятор выживаемости при раке прямой кишки, разработанный онкологическим центром им. М. Д. Андерсона, дополнительно рассматривает расу как фактор риска; однако существуют вопросы справедливости относительно того, может ли это привести к неравенству в принятии клинических решений. [22] [23] Примерно 10% случаев связаны с недостаточной активностью. [24] Риск от алкоголя, по-видимому, увеличивается при употреблении более одного напитка в день. [25] Употребление пяти стаканов воды в день связано со снижением риска колоректального рака и аденоматозных полипов. [26] Streptococcus gallolyticus связан с колоректальным раком. [27] Некоторые штаммы комплекса Streptococcus bovis/Streptococcus equinus ежедневно употребляются миллионами людей и, таким образом, могут быть безопасными. [28] У 25–80 % людей с бактериемией Streptococcus bovis/gallolyticus имеются сопутствующие колоректальные опухоли. [29] Серопревалентность Streptococcus bovis/gallolyticus рассматривается как возможный практический маркер для раннего прогнозирования основного поражения кишечника у группы высокого риска. [29] Было высказано предположение, что наличие антител к антигенам Streptococcus bovis/gallolyticus или самих антигенов в кровотоке может служить маркерами канцерогенеза в толстой кишке. [29]
Патогенная кишечная палочка может повышать риск развития колоректального рака , вырабатывая генотоксичный метаболит колибактин . [30]
Люди с воспалительными заболеваниями кишечника ( язвенный колит и болезнь Крона ) подвержены повышенному риску рака толстой кишки. [31] [32] Риск увеличивается с увеличением продолжительности заболевания и тяжести воспаления. [33] В этих группах высокого риска рекомендуется как профилактика с помощью аспирина , так и регулярные колоноскопии . [34] Эндоскопическое наблюдение в этой группе высокого риска может снизить развитие колоректального рака за счет ранней диагностики, а также может снизить вероятность смерти от рака толстой кишки. [34] На людей с воспалительными заболеваниями кишечника приходится менее 2% случаев рака толстой кишки в год. [33] У людей с болезнью Крона 2% заболевают колоректальным раком через 10 лет, 8% — через 20 лет и 18% — через 30 лет. [33] У людей с язвенным колитом примерно у 16% развивается либо предшественник рака , либо рак толстой кишки в течение 30 лет. [33]
Те, у кого в семейном анамнезе двое или более родственников первой степени родства (например, родители или братья и сестры), имеют в два-три раза больший риск заболевания, и эта группа составляет около 20% всех случаев. Ряд генетических синдромов также связаны с более высокими показателями колоректального рака. Наиболее распространенным из них является наследственный неполипозный колоректальный рак (HNPCC или синдром Линча), который присутствует примерно у 3% людей с колоректальным раком. [20] Другие синдромы, которые тесно связаны с колоректальным раком, включают синдром Гарднера и семейный аденоматозный полипоз (FAP). [35] У людей с этими синдромами рак возникает почти всегда и составляет 1% случаев рака. [36] Полная проктоколэктомия может быть рекомендована для людей с FAP в качестве профилактической меры из-за высокого риска злокачественности. Колэктомия, удаление толстой кишки, может быть недостаточной в качестве профилактической меры из-за высокого риска рака прямой кишки, если прямая кишка останется. [37] Наиболее распространенным синдромом полипоза, поражающим толстую кишку, является синдром зубчатого полипоза , [38] который связан с 25–40% риском колоректального рака. [39]
Мутации в паре генов ( POLE и POLD1 ) связаны с семейным раком толстой кишки. [40]
Большинство смертей от рака толстой кишки связаны с метастатическим заболеванием. Был выделен ген, который, по-видимому, способствует потенциалу метастатического заболевания, метастазированию, связанному с раком толстой кишки 1 ( MACC1 ). [41] Это транскрипционный фактор, который влияет на экспрессию фактора роста гепатоцитов . Этот ген связан с пролиферацией, инвазией и рассеиванием клеток рака толстой кишки в клеточной культуре , а также ростом опухоли и метастазированием у мышей. MACC1 может быть потенциальной целью для вмешательства в рак, но эта возможность должна быть подтверждена клиническими исследованиями. [42]
Эпигенетические факторы, такие как аномальное метилирование ДНК промоутеров супрессоров опухолей , играют роль в развитии колоректального рака. [43]
У евреев-ашкенази риск развития аденомы , а затем рака толстой кишки на 6% выше из-за более распространенных мутаций в гене APC . [44]
Колоректальный рак — это заболевание, возникающее из эпителиальных клеток, выстилающих толстую или прямую кишку желудочно-кишечного тракта , чаще всего в результате генетических мутаций в сигнальном пути Wnt , который увеличивает сигнальную активность. [45] Сигнальный путь Wnt обычно играет важную роль для нормального функционирования этих клеток, включая поддержание этой выстилки. Мутации могут быть унаследованными или приобретенными и, скорее всего, происходят в стволовой клетке кишечной крипты . [46] [47] [48] Наиболее часто мутирующий ген при всех видах колоректального рака — это ген APC , который продуцирует белок APC. [45] Белок APC предотвращает накопление белка β-катенина . Без APC β-катенин накапливается до высоких уровней и транслоцируется (перемещается) в ядро , связывается с ДНК и активирует транскрипцию протоонкогенов . Эти гены обычно важны для обновления и дифференцировки стволовых клеток, но при ненадлежащей экспрессии на высоких уровнях они могут вызвать рак. [45] В то время как APC мутирует при большинстве видов рака толстой кишки, некоторые виды рака имеют повышенный уровень β-катенина из-за мутаций в β-катенине (CTNNB1), которые блокируют его собственный распад, или имеют мутации в других генах с функцией, аналогичной APC, таких как AXIN1 , AXIN2 , TCF7L2 или NKD1 . [49]
Помимо дефектов в сигнальном пути Wnt , для того, чтобы клетка стала раковой, должны произойти другие мутации. Белок p53 , вырабатываемый геном TP53 , обычно контролирует деление клеток и вызывает их запрограммированную смерть, если у них есть дефекты пути Wnt. В конце концов, клеточная линия приобретает мутацию в гене TP53 и трансформирует ткань из доброкачественной эпителиальной опухоли в инвазивный рак эпителиальных клеток . Иногда ген, кодирующий p53, не мутирует, но вместо этого мутирует другой защитный белок, называемый BAX . [49]
Другие белки, ответственные за запрограммированную гибель клеток, которые обычно дезактивируются при колоректальном раке, — это TGF-β и DCC ( удалён при колоректальном раке ). TGF-β имеет дезактивирующую мутацию по крайней мере в половине случаев колоректального рака. Иногда TGF-β не дезактивируется, но дезактивируется нижестоящий белок, называемый SMAD . [49] DCC обычно имеет удалённый сегмент хромосомы при колоректальном раке. [50]
Приблизительно 70% всех человеческих генов экспрессируются при колоректальном раке, причем чуть более 1% имеют повышенную экспрессию при колоректальном раке по сравнению с другими формами рака. [51] Некоторые гены являются онкогенами : они сверхэкспрессируются при колоректальном раке. Например, гены, кодирующие белки KRAS , RAF и PI3K , которые обычно стимулируют деление клеток в ответ на факторы роста, могут приобретать мутации, которые приводят к чрезмерной активации пролиферации клеток. Иногда важен хронологический порядок мутаций. Если произошла предыдущая мутация APC, первичная мутация KRAS часто прогрессирует до рака, а не до самоограничивающегося гиперпластического или пограничного поражения. [52] PTEN , супрессор опухолей, обычно ингибирует PI3K, но иногда может мутировать и деактивироваться. [49]
Всесторонний анализ в масштабе генома показал, что колоректальные карциномы можно разделить на гипермутированные и негипермутированные типы опухолей. [53] В дополнение к онкогенным и инактивирующим мутациям, описанным для генов выше, негипермутированные образцы также содержат мутированные CTNNB1 , FAM123B , SOX9 , ATM и ARID1A . Прогрессируя через определенный набор генетических событий, гипермутированные опухоли демонстрируют мутированные формы ACVR2A , TGFBR2 , MSH3 , MSH6 , SLC9A9, TCF7L2 и BRAF . Общей темой среди этих генов, в обоих типах опухолей, является их участие в сигнальных путях Wnt и TGF-β, что приводит к повышенной активности MYC , центрального игрока в колоректальном раке. [53]
Опухоли с дефицитом репарации несоответствий (MMR) характеризуются относительно высоким количеством полинуклеотидных тандемных повторов . [54] Это вызвано дефицитом белков MMR, которые обычно вызваны эпигенетическим подавлением и/или унаследованными мутациями ( например , синдромом Линча ). [55] 15–18 процентов опухолей колоректального рака имеют дефицит MMR, причем 3 процента развиваются из-за синдрома Линча. [56] Роль системы репарации несоответствий заключается в защите целостности генетического материала внутри клеток ( т. е . обнаружении и исправлении ошибок). [55] Следовательно, дефицит белков MMR может привести к неспособности обнаруживать и исправлять генетические повреждения, что позволяет возникать дальнейшим мутациям, вызывающим рак, и прогрессировать колоректальному раку. [55]
Последовательность прогрессирования полипа в рак является классической моделью патогенеза колоректального рака . [57] В этой последовательности аденома-карцинома , [58] нормальные эпителиальные клетки прогрессируют в диспластические клетки, такие как аденомы , а затем в карциному, в процессе прогрессирующей генетической мутации. [59] Центральными в последовательности полипа в CRC являются генные мутации, эпигенетические изменения и локальные воспалительные изменения. [57] Последовательность полипа в CRC может использоваться в качестве базовой структуры для иллюстрации того, как определенные молекулярные изменения приводят к различным подтипам рака. [57]

Термин «полевая канцеризация» был впервые использован в 1953 году для описания области или «поля» эпителия, которое было предварительно обусловлено (в то время в значительной степени неизвестными процессами) для предрасположенности к развитию рака. [60] С тех пор термины «полевая канцеризация», «полевой канцерогенез», «полевой дефект» и « полевой эффект » использовались для описания предраковой или преднеопластической ткани, в которой, вероятно, возникнут новые раковые опухоли. [61]
Дефекты поля играют важную роль в прогрессировании рака толстой кишки. [62] [63]
Однако, как отметил Рубин, «подавляющее большинство исследований в области изучения рака было проведено на четко определенных опухолях in vivo или на дискретных неопластических очагах in vitro . Тем не менее, есть доказательства того, что более 80% соматических мутаций, обнаруженных в человеческих колоректальных опухолях с фенотипом мутатора, происходят до начала терминальной клональной экспансии». [64] [65] Аналогичным образом, Фогельштейн и др. [66] указали, что более половины соматических мутаций, обнаруженных в опухолях, произошли в преднеопластической фазе (в дефекте поля), во время роста, по-видимому, нормальных клеток. Аналогичным образом, эпигенетические изменения, присутствующие в опухолях, могли произойти в преднеопластических дефектах поля. [67]
Расширенный взгляд на эффект поля был назван «этиологическим эффектом поля», который охватывает не только молекулярные и патологические изменения в предраковых клетках, но также влияние экзогенных факторов окружающей среды и молекулярных изменений в локальной микросреде на неопластическую эволюцию от возникновения опухоли до смерти. [68]
Эпигенетические изменения встречаются гораздо чаще при раке толстой кишки, чем генетические (мутационные) изменения. Как описали Фогельштейн и др., [66] средний рак толстой кишки имеет только 1 или 2 мутации онкогенов и от 1 до 5 мутаций супрессоров опухолей (вместе называемых «драйверными мутациями»), с примерно 60 дополнительными мутациями «пассажирами». Онкогены и гены супрессоров опухолей хорошо изучены и описаны выше в разделе «Патогенез». [69] [70]
В дополнение к эпигенетическим изменениям экспрессии miRNA, другие распространенные типы эпигенетических изменений при раке, которые изменяют уровни экспрессии генов, включают прямое гиперметилирование или гипометилирование CpG-островков генов, кодирующих белки, и изменения в гистонах и хромосомной архитектуре, которые влияют на экспрессию генов. [71] Например, 147 гиперметилирований и 27 гипометилирований генов, кодирующих белки, часто были связаны с колоректальным раком. Из гиперметилированных генов 10 были гиперметилированы в 100% случаев рака толстой кишки, а многие другие были гиперметилированы более чем в 50% случаев рака толстой кишки. [72] Кроме того, 11 гиперметилирований и 96 гипометилирований miRNA также были связаны с колоректальным раком. [72] Аномальное (аберрантное) метилирование происходит как нормальное следствие нормального старения, и риск колоректального рака увеличивается по мере того, как человек становится старше. [73] Источник и причина этого возрастного метилирования неизвестны. [73] [74] Примерно половина генов, которые показывают возрастные изменения метилирования, являются теми же генами, которые были идентифицированы как участвующие в развитии колоректального рака. [73] Эти результаты могут указывать на причину, по которой возраст связан с повышенным риском развития колоректального рака. [73]
Эпигенетическое снижение экспрессии ферментов репарации ДНК, вероятно, может привести к геномной и эпигеномной нестабильности, характерной для рака. [75] [76] [67] Как резюмируется в статьях «Канцерогенез и неоплазма» , для спорадических видов рака в целом дефицит репарации ДНК иногда возникает из-за мутации в гене репарации ДНК, но гораздо чаще из-за эпигенетических изменений, которые снижают или подавляют экспрессию генов репарации ДНК. [77]
Эпигенетические изменения, связанные с развитием колоректального рака, могут повлиять на реакцию человека на химиотерапию. [78]
Консенсусная молекулярная классификация подтипов (CMS) колоректального рака была впервые введена в 2015 году. Классификация CMS до сих пор считается наиболее надежной системой классификации, доступной для колоректального рака, которая имеет четкую биологическую интерпретируемость и является основой для будущей клинической стратификации и целевых вмешательств на основе подтипов. [79]
В 2021 году была предложена новая классификация колоректального рака на основе эпигенома (EpiC), в которой были представлены 4 подтипа усилителей у людей с КРР. Состояния хроматина с использованием 6 гистоновых меток характеризуются для идентификации подтипов EpiC. Комбинаторный терапевтический подход, основанный на ранее введенных консенсусных молекулярных подтипах (CMS) и EpiC, может значительно улучшить текущие стратегии лечения. [80]
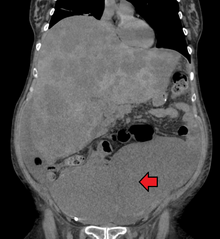
Диагностика колоректального рака осуществляется путем взятия образцов из областей толстой кишки, подозрительных на возможное развитие опухоли, как правило, во время колоноскопии или ректороманоскопии, в зависимости от локализации поражения. [20]
Колоректальный рак иногда первоначально обнаруживается при КТ . [81]
Наличие метастазов определяется с помощью КТ грудной клетки, брюшной полости и таза. [20] В некоторых случаях могут использоваться другие потенциальные методы визуализации, такие как ПЭТ и МРТ . [20] МРТ особенно полезна для определения локальной стадии опухоли и планирования оптимального хирургического подхода. [81]
МРТ также проводится после завершения неоадъювантной химиолучевой терапии для выявления пациентов, достигших полного ответа. Пациентам с полным ответом как по данным МРТ, так и по данным эндоскопии, может не потребоваться хирургическая резекция, и они могут избежать ненужной хирургической заболеваемости и осложнений. [82] Пациенты, отобранные для нехирургического лечения рака прямой кишки, должны периодически проходить МРТ, физические осмотры и процедуры эндоскопии для выявления любого повторного роста опухоли, который может возникнуть у меньшинства этих пациентов. Когда происходит местный рецидив, периодическое наблюдение может обнаружить его, когда он еще мал и излечим с помощью спасательной операции. Кроме того, после химиолучевой терапии могут быть назначены степени регрессии опухоли по данным МРТ, которые коррелируют с долгосрочными результатами выживания пациентов. [83]


Гистопатологические характеристики опухоли сообщаются из анализа ткани, взятой из биопсии или хирургического вмешательства. Патологический отчет содержит описание микроскопических характеристик опухолевой ткани, включая как опухолевые клетки, так и то, как опухоль проникает в здоровые ткани, и, наконец, если опухоль кажется полностью удаленной. Наиболее распространенной формой рака толстой кишки является аденокарцинома , составляющая от 95% [85] до 98% [86] всех случаев колоректального рака. Другие, более редкие типы включают лимфому , аденоплоскоклеточный и плоскоклеточный рак . Некоторые подтипы более агрессивны. [87] Иммуногистохимия может использоваться в неопределенных случаях. [88]
Стадирование рака основано как на радиологических, так и на патологических данных. Как и в случае с большинством других форм рака, стадирование опухоли основано на системе TNM , которая учитывает степень распространения исходной опухоли и наличие метастазов в лимфатических узлах и более отдаленных органах. [20] 8-е издание AJCC было опубликовано в 2018 году . [89]
Было подсчитано, что около половины случаев колоректального рака обусловлены факторами образа жизни, и около четверти всех случаев можно предотвратить. [90] Усиление наблюдения, физическая активность, употребление пищи с высоким содержанием клетчатки, отказ от курения и ограничение потребления алкоголя снижают риск. [91] [92]
Факторы риска, связанные с образом жизни, имеющие убедительные доказательства, включают в себя недостаток физических упражнений, курение сигарет, алкоголь и ожирение. [93] [94] [95] Риск рака толстой кишки можно снизить, поддерживая нормальный вес тела с помощью сочетания достаточных физических упражнений и здорового питания . [96]
Текущие исследования последовательно связывают употребление большего количества красного мяса и переработанного мяса с более высоким риском заболевания. [97] Начиная с 1970-х годов диетические рекомендации по профилактике колоректального рака часто включали увеличение потребления цельного зерна , фруктов и овощей и сокращение потребления красного мяса и переработанного мяса . Это было основано на исследованиях на животных и ретроспективных наблюдательных исследованиях. Однако крупномасштабные проспективные исследования не смогли продемонстрировать значительный защитный эффект, и из-за множественных причин рака и сложности изучения корреляций между диетой и здоровьем неясно, будут ли какие-либо конкретные диетические вмешательства иметь значительный защитный эффект. [98] : 432–433 [99] : 125–126 В 2018 году Национальный институт рака заявил, что «нет надежных доказательств того, что диета, начатая во взрослом возрасте, с низким содержанием жиров и мяса и высоким содержанием клетчатки, фруктов и овощей, снижает риск КРР в клинически важной степени». [93] [100]
Употребление алкогольных напитков и переработанного мяса увеличивает риск развития колоректального рака. [101]
В докладе Всемирной организации здравоохранения о раке за 2014 год отмечалось, что была выдвинута гипотеза о том, что пищевые волокна могут помочь предотвратить колоректальный рак, но большинство исследований на тот момент еще не изучали эту корреляцию. [99] Однако обзор 2019 года обнаружил доказательства пользы пищевых волокон и цельного зерна. [102] Всемирный фонд исследований рака перечислил пользу клетчатки для профилактики колоректального рака как «вероятную» по состоянию на 2017 год. [103] В обзоре 2022 года говорится, что существуют «убедительные доказательства» этой связи. [104]
Рекомендуется более высокая физическая активность. [21] [105] Физические упражнения связаны с умеренным снижением риска рака толстой кишки, но не прямой кишки. [106] [107] Высокий уровень физической активности снижает риск рака толстой кишки примерно на 21%. [108] Регулярное сидение в течение длительного времени связано с более высокой смертностью от рака толстой кишки. Регулярные упражнения не исключают риск, но снижают его. [109]
Аспирин и целекоксиб, по-видимому, снижают риск колоректального рака у лиц с высоким риском. [110] [111] Аспирин рекомендуется лицам в возрасте от 50 до 60 лет, у которых нет повышенного риска кровотечения и которые подвержены риску сердечно-сосудистых заболеваний, для профилактики колоректального рака. [112] Он не рекомендуется лицам со средним риском. [113]
Имеются предварительные данные о пользе добавок кальция , но их недостаточно, чтобы давать рекомендации. [114] Потребление витамина D и его уровень в крови связаны с более низким риском рака толстой кишки. [115] [116]
Поскольку более 80% случаев колоректального рака возникают из аденоматозных полипов , скрининг на этот вид рака эффективен как для раннего выявления, так и для профилактики. [20] [117] Диагностика случаев колоректального рака посредством скрининга, как правило, происходит за 2–3 года до диагностики случаев с симптомами. [20] Любые обнаруженные полипы можно удалить, как правило, с помощью колоноскопии или сигмоидоскопии , и таким образом предотвратить их превращение в рак. Скрининг может снизить смертность от колоректального рака на 60%. [118]
Три основных скрининговых теста — это колоноскопия, анализ кала на скрытую кровь и гибкая сигмоидоскопия . Из трех только сигмоидоскопия не может скрининговать правую сторону толстой кишки , где обнаруживаются 42% случаев рака. [119] Однако гибкая сигмоидоскопия имеет наилучшие доказательства снижения риска смерти от любой причины. [120]
Анализ кала на скрытую кровь (FOBT) обычно рекомендуется проводить каждые два года, и он может быть основан на гваяковой пробе или иммунохимическим методом . [20] Если результаты FOBT отклоняются от нормы, участников обычно направляют на контрольную колоноскопию. При проведении скрининга FOBT один раз в 1–2 года смертность от колоректального рака снижается на 16%, а среди тех, кто участвует в скрининге, смертность от колоректального рака может быть снижена до 23%, хотя не было доказано, что он снижает смертность по всем причинам. [121] Иммунохимические тесты точны и не требуют изменений в диете или приеме лекарств перед тестированием. [122] Однако исследования в Великобритании показали, что для этих иммунохимических тестов порог для дальнейшего исследования установлен на уровне, который может пропустить более половины случаев рака кишечника. Исследование показывает, что программа скрининга рака кишечника Национальной службы здравоохранения Англии могла бы более эффективно использовать способность теста определять точную концентрацию крови в кале (а не только то, выше или ниже она порогового значения). [123] [124]
Другие варианты включают виртуальную колоноскопию и скрининговое тестирование ДНК кала (FIT-DNA). Виртуальная колоноскопия с помощью КТ выглядит так же хорошо, как стандартная колоноскопия для обнаружения рака и больших аденом, но она дорогая, связана с воздействием радиации и не может удалить любые обнаруженные аномальные новообразования, как стандартная колоноскопия. [20] Скрининговое тестирование ДНК кала ищет биомаркеры, связанные с колоректальным раком и предраковыми поражениями, включая измененную ДНК и гемоглобин крови . Положительный результат должен сопровождаться колоноскопией . FIT-DNA имеет больше ложноположительных результатов, чем FIT, и, таким образом, приводит к большему количеству неблагоприятных эффектов. [10] По состоянию на 2016 год требуются дальнейшие исследования, чтобы определить, является ли трехлетний интервал скрининга правильным. [10]
В Соединенных Штатах скрининг обычно рекомендуется проводить в возрасте от 50 до 75 лет. [10] [125] Американское онкологическое общество рекомендует начинать с 45 лет . [126] Для лиц в возрасте от 76 до 85 лет решение о скрининге должно приниматься индивидуально. [10] Для лиц с высоким риском скрининг обычно начинается примерно с 40 лет. [20] [127]
Рекомендуются несколько методов скрининга, включая анализы кала каждые 2 года, сигмоидоскопию каждые 10 лет с иммунохимическим тестированием кала каждые два года и колоноскопию каждые 10 лет. [125] Неясно, какой из этих двух методов лучше. [128] Колоноскопия может обнаружить больше раковых клеток в первой части толстой кишки, но связана с большей стоимостью и большим количеством осложнений. [128] Для людей со средним риском, у которых была высококачественная колоноскопия с нормальными результатами, Американская гастроэнтерологическая ассоциация не рекомендует какой-либо тип скрининга в течение 10 лет после колоноскопии. [129] [130] Для людей старше 75 лет или тех, у кого ожидаемая продолжительность жизни менее 10 лет, скрининг не рекомендуется. [131] Для одного из 1000 человек требуется около 10 лет после скрининга, чтобы получить пользу. [132] USPSTF перечисляет семь потенциальных стратегий скрининга, причем самое важное — чтобы хотя бы одна из этих стратегий использовалась надлежащим образом. [10]
В Канаде среди лиц в возрасте от 50 до 75 лет с нормальным риском иммунохимическое исследование кала или FOBT рекомендуется проводить каждые два года или сигмоидоскопию каждые 10 лет. [133] Колоноскопия менее предпочтительна. [133]
В некоторых странах действуют национальные программы колоректального скрининга, которые предлагают скрининг FOBT для всех взрослых в определенной возрастной группе, как правило, начиная с возраста 50–60 лет. Примерами стран с организованным скринингом являются Великобритания, [134] Австралия, [135] Нидерланды, [136] Гонконг и Тайвань. [137]
Программа скрининга рака кишечника в Великобритании направлена на выявление предупреждающих признаков у людей в возрасте от 60 до 74 лет, рекомендуя проводить иммунохимический анализ кала (FIT) каждые два года. FIT измеряет кровь в кале, и люди с уровнями выше определенного порога могут пройти обследование тканей кишечника на наличие признаков рака. Наросты, имеющие раковый потенциал, удаляются. [138] [124]
Лечение колоректального рака может быть направлено на излечение или паллиативное облегчение. Решение о том, какую цель выбрать, зависит от различных факторов, включая здоровье и предпочтения человека, а также стадию опухоли. [139] Оценка в многопрофильных командах является важнейшей частью определения того, подходит ли пациенту операция или нет. [140] Когда колоректальный рак обнаружен на ранней стадии, операция может быть излечивающей. Однако, когда он обнаружен на более поздних стадиях (при наличии метастазов ), это менее вероятно, и лечение часто направлено на паллиативное облегчение, чтобы облегчить симптомы, вызванные опухолью, и обеспечить максимально возможный комфорт для человека. [20]

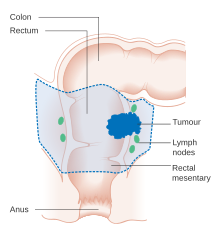

На ранней стадии колоректальный рак может быть удален во время колоноскопии с использованием одного из нескольких методов, включая эндоскопическую резекцию слизистой оболочки или эндоскопическую субмукозную диссекцию . [5] Эндоскопическая резекция возможна, если вероятность метастазов в лимфатические узлы низкая, а размер и расположение опухоли делают возможной резекцию единым блоком. [141] Для людей с локализованным раком предпочтительным лечением является полное хирургическое удаление с адекватными краями , с попыткой достижения излечения. Процедурой выбора является частичная колэктомия (или проктоколэктомия при поражениях прямой кишки), при которой пораженная часть толстой или прямой кишки удаляется вместе с частями ее мезоколона и кровоснабжения для облегчения удаления дренирующих лимфатических узлов . Это может быть сделано либо путем открытой лапаротомии , либо лапароскопически , в зависимости от факторов, связанных с индивидуальными особенностями человека и факторами поражения. [20] Затем толстая кишка может быть повторно соединена, или у человека может быть колостома . [5]
Если в печени или легких есть только несколько метастазов, их также можно удалить. Химиотерапию можно использовать перед операцией, чтобы уменьшить рак перед попыткой его удаления. Два наиболее распространенных места рецидива колоректального рака — это печень и легкие . [ 20] При перитонеальном карциноматозе циторедуктивная операция , иногда в сочетании с HIPEC, может использоваться в попытке удалить рак. [142]
При раке толстой и прямой кишки химиотерапия может использоваться в дополнение к хирургическому вмешательству в некоторых случаях. Решение о добавлении химиотерапии в лечении рака толстой и прямой кишки зависит от стадии заболевания. [143]
При раке толстой кишки I стадии химиотерапия не предлагается, а хирургическое вмешательство является окончательным лечением. Роль химиотерапии при раке толстой кишки II стадии является спорной и обычно не предлагается, если не выявлены такие факторы риска, как опухоль T4, недифференцированная опухоль, сосудистая и периневральная инвазия или неадекватный отбор проб лимфоузлов. [144] Также известно, что люди, которые являются носителями аномалий генов репарации несоответствий, не получают пользы от химиотерапии. При раке толстой кишки III и IV стадии химиотерапия является неотъемлемой частью лечения. [20]
Если рак распространился на лимфатические узлы или отдаленные органы, что имеет место при раке толстой кишки на стадии III и IV соответственно, добавление химиотерапевтических агентов фторурацила , капецитабина или оксалиплатина увеличивает продолжительность жизни. Если лимфатические узлы не содержат рак, преимущества химиотерапии спорны. Если рак широко метастатический или неоперабельный, лечение тогда паллиативное . Обычно в этой ситуации может использоваться ряд различных химиотерапевтических препаратов. [20] Химиотерапевтические препараты для этого состояния могут включать капецитабин , фторурацил , иринотекан , оксалиплатин и UFT . [145] Препараты капецитабин и фторурацил являются взаимозаменяемыми, причем капецитабин является пероральным препаратом, а фторурацил — внутривенным лекарством. Некоторые конкретные схемы, используемые при колоректальном раке, — это CAPOX , FOLFOX , FOLFOXIRI и FOLFIRI . [146] Антиангиогенные препараты, такие как бевацизумаб, часто добавляются в терапию первой линии. [147] Другой класс препаратов, используемых во второй линии, — это ингибиторы рецепторов эпидермального фактора роста , из которых три одобренных FDA препарата — это афлиберцепт , цетуксимаб и панитумумаб . [148] [149]
Основное отличие подхода к лечению рака прямой кишки на низкой стадии заключается во включении лучевой терапии. Часто она используется в сочетании с химиотерапией в неоадъювантном режиме для проведения хирургической резекции, так что в конечном итоге колостома не требуется. Однако это может быть невозможно при низко расположенных опухолях, в этом случае может потребоваться постоянная колостома. Рак прямой кишки на стадии IV лечится аналогично раку толстой кишки на стадии IV.
У некоторых людей колоректальный рак IV стадии, вызванный карциноматозом брюшины, можно лечить с помощью HIPEC в сочетании с циторедуктивной хирургией. [150] [151] [152] Кроме того, колоректальный рак T4 можно лечить с помощью HIPEC, чтобы избежать будущих рецидивов. [153]
Хотя сочетание лучевой терапии и химиотерапии может быть полезным при раке прямой кишки , [20] для некоторых людей, нуждающихся в лечении, химиолучевая терапия может увеличить острую токсичность, связанную с лечением, и не было показано, что она улучшает показатели выживаемости по сравнению с одной лишь лучевой терапией, хотя она связана с меньшим количеством местных рецидивов. [142] Для плоскоклеточного рака анального канала химиолучевая терапия (ХЛТ) с 5-ФУ и митомицином С предпочтительнее, чем только лучевая терапия, предлагая улучшенные результаты выживаемости, но с повышенным риском острой гематологической токсичности . [154]
Использование радиотерапии при раке толстой кишки не является рутинным из-за чувствительности кишечника к радиации. [155] Побочные эффекты радиотерапии (и частота их возникновения) включают острую (27%) и позднюю (17%) дерматологическую токсичность , острую (14%) и позднюю (27%) желудочно-кишечную токсичность , [154] и позднюю тазовую лучевую болезнь (1-10%), например, необратимую пояснично-крестцовую плексопатию . [156]
Как и химиотерапия, радиотерапия может использоваться в качестве неоадъювантной терапии для клинических стадий T3 и T4 рака прямой кишки. [157] Это приводит к уменьшению размера или понижению стадии опухоли, подготавливая ее к хирургической резекции, а также снижает местные показатели рецидивов. [157] Для местно-распространенного рака прямой кишки неоадъювантная химиолучевая терапия стала стандартным лечением. [158] Кроме того, когда операция невозможна, лучевая терапия предлагается в качестве эффективного лечения легочных метастазов колоректального рака, которые развиваются у 10-15% людей с колоректальным раком. [159]
Иммунотерапия с использованием ингибиторов иммунных контрольных точек оказалась полезной для типа колоректального рака с дефицитом репарации несоответствий и нестабильностью микросателлитов. [160] [161] [162] Пембролизумаб одобрен для лечения запущенных опухолей колоректального рака с дефицитом MMR, которые не поддаются обычному лечению. [163] Однако у большинства людей, у которых наступает улучшение, состояние все равно ухудшается через несколько месяцев или лет. [161]
С другой стороны, в проспективном исследовании фазы 2, опубликованном в июне 2022 года в The New England Journal of Medicine, 12 пациентам с аденокарциномой прямой кишки II или III стадии с дефицитом несоответствия (dMMR) вводили однокомпонентный препарат достарлимаб , моноклональное антитело против PD-1, каждые три недели в течение шести месяцев. После медианного наблюдения в 12 месяцев (диапазон от 6 до 25 месяцев) у всех 12 пациентов наблюдался полный клинический ответ без признаков опухоли на МРТ, 18F-фтордезоксиглюкозной-позитронно-эмиссионной томографии, эндоскопической оценке, пальцевом ректальном исследовании или биопсии. Более того, ни один пациент в исследовании не нуждался в химиолучевой терапии или хирургическом вмешательстве, и ни один пациент не сообщил о побочных эффектах 3-й степени или выше. Однако, хотя результаты этого исследования являются многообещающими, исследование небольшое и имеет неопределенности относительно долгосрочных результатов. [164]
Паллиативная помощь может использоваться одновременно с лечением рака и рекомендуется любому человеку с запущенным раком толстой кишки или с существенными симптомами. [165] [166] Участие в паллиативной помощи может быть полезным для улучшения качества жизни как человека, так и его семьи, за счет улучшения симптомов, снижения тревожности и предотвращения госпитализации. [167]
У людей с неизлечимым колоректальным раком паллиативная помощь может состоять из процедур, которые облегчают симптомы или осложнения рака, но не пытаются вылечить лежащий в основе рак, тем самым улучшая качество жизни . Хирургические варианты могут включать нецелесообразное хирургическое удаление части раковой ткани, обход части кишечника или установку стента. Эти процедуры можно рассматривать как улучшающие симптомы и уменьшающие осложнения, такие как кровотечение из опухоли, боли в животе и кишечная непроходимость. [168] Неоперативные методы симптоматического лечения включают лучевую терапию для уменьшения размера опухоли, а также обезболивающие препараты. [169]
В дополнение к медицинскому вмешательству, были реализованы различные психосоциальные вмешательства для решения психосоциальных проблем в контексте колоректального рака. [170] Депрессия и тревожность широко распространены среди пациентов с диагнозом КРР, поэтому психосоциальные вмешательства могут быть полезны для облегчения психологического стресса. [171] [172] Многие пациенты продолжают испытывать симптомы тревожности и депрессии после лечения, независимо от результата лечения. [171] [173] Социальные стигмы, связанные с колоректальным раком, представляют собой дополнительные психосоциальные проблемы для пациентов с КРР и их семей. [174] [175]
У пациентов с колоректальным раком риск депрессии на 51% выше, чем у людей без этого заболевания. [172] Кроме того, у пациентов с колоректальным раком высок риск возникновения сильной тревожности, низкой самооценки, плохой самооценки и социальной тревожности. [171] [176]
Независимо от результата лечения, многие пациенты с колоректальным раком испытывают постоянные симптомы тревоги, депрессии и стресса. [171]
Выживание после колоректального рака может потребовать значительных изменений образа жизни. [175] Послеоперационные проблемы могут включать стомы, проблемы с кишечником, недержание мочи, запах и изменения в сексуальной функции. [175] [176] Эти изменения могут привести к искаженному образу тела, социальной тревожности, депрессии и стрессу — все это способствует ухудшению качества жизни. [175] [177]
Колоректальный рак является второй по значимости причиной смерти от рака во всем мире. [178] Переход к паллиативной помощи и борьба со смертностью могут стать крайне тяжелым испытанием для пациента с колоректальным раком и его близких.
Колоректальный рак сильно стигматизирован и может вызывать чувство отвращения у пациентов, медицинских работников, семьи, интимных партнеров и широкой общественности. [174] Пациенты со стомой особенно уязвимы для стигматизации из-за неизбежных запахов, газов и неприятных шумов из мешочков для стомы. [174] Кроме того, сопутствующие факторы риска КРР, такие как плохое питание, употребление алкоголя и отсутствие физической активности, вызывают негативные предположения о вине и личной ответственности у пациентов с КРР. [175] Осуждение со стороны других вместе с внутренним самообвинением и смущением могут негативно влиять на самооценку, общительность и качество жизни. [175]
Очные вмешательства, такие как терапевтические беседы врача с пациентом, практики тела, разума и духа и сеансы групп поддержки, были определены как наиболее эффективные для снижения тревожности и депрессии у пациентов с колоректальным раком. [170] Кроме того, были реализованы упражнения по ведению дневника и сеансы телефонной терапии. [170] Хотя они считаются менее эффективными, эти неочные вмешательства экономически выгодны и, как было обнаружено, снижают как депрессию, так и тревожность у пациентов с колоректальным раком. [170]
Национальная всеобъемлющая онкологическая сеть США и Американское общество клинической онкологии предоставляют рекомендации по наблюдению за раком толстой кишки. [179] [180] Медицинский анамнез и физикальное обследование рекомендуется проводить каждые 3–6 месяцев в течение 2 лет, затем каждые 6 месяцев в течение 5 лет. Измерения уровня карциноэмбрионального антигена в крови проводятся в те же сроки, но рекомендуются только для людей с поражениями T2 или выше, которые являются кандидатами на вмешательство. КТ грудной клетки, брюшной полости и таза можно рассматривать ежегодно в течение первых 3 лет для людей, которые подвержены высокому риску рецидива (например, тех, у кого были плохо дифференцированные опухоли или венозная или лимфатическая инвазия) и являются кандидатами на лечебную операцию (с целью излечения). Колоноскопию можно сделать через 1 год, за исключением случаев, когда ее нельзя было сделать во время первоначальной стадии из-за препятствующей массы, в этом случае ее следует провести через 3–6 месяцев. Если обнаружен ворсинчатый полип, полип >1 см или дисплазия высокой степени, его можно повторить через 3 года, затем каждые 5 лет. При других отклонениях колоноскопию можно повторить через 1 год. [143]
Не рекомендуется проводить рутинное ПЭТ или ультразвуковое сканирование , рентгенографию грудной клетки , общий анализ крови или тесты на функцию печени . [179] [180]
Для людей, перенесших лечебную операцию или адъювантную терапию (или и то, и другое) для лечения неметастатического колоректального рака, интенсивное наблюдение и тщательное последующее наблюдение не показали дополнительных преимуществ в плане выживаемости. [181]
В будущем упражнения могут быть рекомендованы в качестве вторичной терапии для выживших после рака. В эпидемиологических исследованиях упражнения могут снизить смертность от колоректального рака и смертность от всех причин. Результаты по конкретным объемам упражнений, необходимым для наблюдения пользы, были противоречивыми. Эти различия могут отражать различия в биологии опухоли и экспрессии биомаркеров. Людям с опухолями, у которых отсутствовала экспрессия CTNNB1 (β-катенина), участвующего в сигнальном пути Wnt , требовалось более 18 метаболических эквивалентных (MET) часов в неделю, мера упражнений, чтобы наблюдать снижение смертности от колоректального рака. Механизм того, как упражнения влияют на выживание, может быть вовлечен в иммунный надзор и пути воспаления. В клинических исследованиях провоспалительная реакция была обнаружена у людей с колоректальным раком II-III стадии, которые прошли 2 недели умеренных упражнений после завершения первичной терапии. Окислительный баланс может быть еще одним возможным механизмом наблюдаемой пользы. Значительное снижение 8-oxo-dG было обнаружено в моче людей, которые прошли 2 недели умеренных упражнений после первичной терапии. Другие возможные механизмы могут включать метаболические гормоны и половые стероидные гормоны, хотя эти пути могут быть задействованы и в других типах рака. [182] [183]
Другим потенциальным биомаркером может быть p27 . Было обнаружено, что у выживших с опухолями, которые экспрессировали p27 и выполняли больше или равно 18 часам MET в неделю, снизилась смертность от колоректального рака по сравнению с теми, кто выполнял менее 18 часов MET в неделю. Было показано, что у выживших без экспрессии p27, которые занимались спортом, результаты были хуже. Конститутивная активация пути PI3K/AKT/mTOR может объяснить потерю p27, а избыточный энергетический баланс может повышать регуляцию p27, чтобы остановить деление раковых клеток. [183]
Физическая активность приносит пользу людям с нераспространенным колоректальным раком. Улучшения в аэробной форме, усталости, связанной с раком, и качестве жизни, связанном со здоровьем, были зарегистрированы в краткосрочной перспективе. [184] Однако эти улучшения не были отмечены на уровне психического здоровья, связанного с болезнью, такого как тревожность и депрессия. [184]
Менее 600 генов связаны с результатами колоректального рака. [51] К ним относятся как неблагоприятные гены, где высокая экспрессия связана с плохим исходом, например, белок теплового шока 70 кДа 1 (HSPA1A) , так и благоприятные гены, где высокая экспрессия связана с лучшей выживаемостью, например, предполагаемый РНК-связывающий белок 3 (RBM3) . [51] Прогноз также коррелирует с плохой точностью аппарата сплайсинга пре-мРНК и, следовательно, большим количеством отклоняющихся альтернативных сплайсингов. [185]
Средний пятилетний показатель рецидива у людей с раком толстой кишки , у которых операция прошла успешно, составляет 5% для рака I стадии , 12% для II стадии и 33% для III стадии. Однако в зависимости от количества факторов риска он варьируется от 9 до 22% для II стадии и от 17 до 44% для III стадии. [186] Средний пятилетний показатель рецидива у людей с раком прямой кишки , у которых операция прошла успешно, составляет 9% для рака стадии 0 (после предварительного лечения) , 8% для рака стадии I, 18% для II стадии и 34% для III стадии. В зависимости от количества факторов риска (0-2) риск отдаленных метастазов при раке прямой кишки варьируется от 4 до 11% для стадии 0, 6-12% для стадии I, 11-28% для стадии II и 15-43% для стадии III. [187]
Частота рецидивов снизилась за последние десятилетия в результате улучшения лечения колоректального рака. [188] Риск рецидива после пяти лет наблюдения остается очень низким. [189]
В Европе пятилетняя выживаемость при колоректальном раке составляет менее 60%. В развитых странах от этого заболевания умирает около трети людей. [20]
Выживаемость напрямую связана с обнаружением и типом вовлеченного рака, но в целом она плохая для симптоматических раков, так как они, как правило, довольно запущены. Показатели выживаемости при обнаружении на ранней стадии примерно в пять раз выше, чем при раке на поздней стадии. У людей с опухолью, которая не нарушила мышечную оболочку (стадия TNM Tis, N0, M0), пятилетняя выживаемость составляет 100%, в то время как у людей с инвазивным раком T1 (в подслизистом слое) или T2 (в мышечном слое) средняя пятилетняя выживаемость составляет около 90%. У людей с более инвазивной опухолью, но без поражения лимфатических узлов (T3-4, N0, M0), средняя пятилетняя выживаемость составляет около 70%. Люди с положительными региональными лимфатическими узлами (любой T, N1-3, M0) имеют средний пятилетний показатель выживаемости около 40%, в то время как люди с отдаленными метастазами (любой T, любой N, M1) имеют плохой прогноз, и пятилетний показатель выживаемости колеблется от <5 процентов до 31 процента. [190] [191] [192] [193] [194]
Пятилетняя общая выживаемость (ОВ) при раке прямой кишки после современного предоперационного лечения и хирургического вмешательства составила 90% для стадии 0, 86% для стадии I, 78% для стадии II и 67% для стадии III по данным общенационального популяционного исследования. [187]
Хотя воздействие колоректального рака на тех, кто выживает, сильно различается, часто возникает необходимость адаптироваться как к физическим, так и к психологическим последствиям заболевания и его лечения. [195] Например, люди часто испытывают недержание мочи, [196] сексуальную дисфункцию, [197] проблемы с уходом за стомой [198] и страх рецидива рака [199] после завершения основного лечения.
Качественный систематический обзор, опубликованный в 2021 году, подчеркнул, что существует три основных фактора, влияющих на адаптацию к жизни с колоректальным раком и после него: механизмы поддержки, тяжесть поздних последствий лечения и психосоциальная адаптация. Поэтому крайне важно, чтобы людям предлагалась соответствующая поддержка, которая поможет им лучше адаптироваться к жизни после лечения. [200]
Во всем мире более 1 миллиона человек ежегодно заболевают колоректальным раком [20], что приводит к примерно 715 000 смертей по состоянию на 2010 год по сравнению с 490 000 в 1990 году. [201]
По состоянию на 2012 год [обновлять]это вторая по частоте причина рака у женщин (9,2% диагнозов) и третья по частоте у мужчин (10,0%) [14] : 16, при этом это четвертая по частоте причина смерти от рака после рака легких , желудка и печени . [202] Это более распространено в развитых, чем в развивающихся странах. [203] Глобальная заболеваемость варьируется в 10 раз, с самыми высокими показателями в Австралии, Новой Зеландии, Европе и США и самыми низкими показателями в Африке и Южной и Центральной Азии. [204]
Ожидается, что в 2022 году заболеваемость колоректальным раком в Соединенных Штатах составит около 151 000 взрослых, включая более 106 000 новых случаев рака толстой кишки (около 54 000 мужчин и 52 000 женщин) и около 45 000 новых случаев рака прямой кишки. [205] С 1980-х годов заболеваемость колоректальным раком снизилась, снижаясь примерно на 2% ежегодно с 2014 по 2018 год у взрослых в возрасте 50 лет и старше, в основном благодаря улучшению скрининга. [205] Однако заболеваемость колоректальным раком возросла среди лиц в возрасте от 25 до 50 лет. В начале 2023 года Американское онкологическое общество (ACS) сообщило, что 20% диагнозов (рака толстой кишки) в 2019 году были поставлены пациентам в возрасте до 55 лет, что примерно вдвое превышает показатель 1995 года, а показатели прогрессирования заболевания ежегодно увеличивались примерно на 3% среди людей моложе 50 лет. Оно прогнозировало, что в 2023 году, по оценкам, 19 550 диагнозов и 3750 смертей будут у людей моложе 50 лет. [206] Колоректальный рак также непропорционально сильно поражает чернокожее население, где показатели являются самыми высокими среди всех расовых/этнических групп в США. Афроамериканцы примерно на 20% чаще заболевают колоректальным раком и примерно на 40% чаще умирают от него, чем большинство других групп. Чернокожие американцы часто сталкиваются с большими препятствиями в профилактике, выявлении, лечении и выживании при раке, включая системные расовые различия, которые носят сложный характер и выходят за рамки очевидной связи с раком.
В Великобритании раком толстой кишки заболевают около 41 000 человек в год, что делает его четвертым по распространенности типом. [207]
У одного из 19 мужчин и одной из 28 женщин в Австралии разовьется колоректальный рак до достижения 75 лет; у одного из 10 мужчин и одной из 15 женщин он разовьется к 85 годам. [208]
В Папуа-Новой Гвинее и других островных государствах Тихого океана, включая Соломоновы острова , колоректальный рак является очень редким видом рака по сравнению с раком легких, желудка, печени или груди. По оценкам, 8 из 100 000 человек ежегодно имеют вероятность заболеть колоректальным раком, в то время как 24 из 100 000 женщин имеют вероятность заболеть раком груди. [209]
Диагноз колоректального рака у пациентов в возрасте до 50 лет называется ранним колоректальным раком (EOCC). [178] [210] За последнее десятилетие случаи EOCC увеличились, особенно среди пациентов в возрасте от 20 до 40 лет по всей Северной Америке, Европе, Австралии и Китаю. [210] [211]
Заболеваемость колоректальным раком среди более молодых групп населения возросла за последнее десятилетие. [178] [210] [211] Хотя достижения в диагностических процедурах могут иметь некоторое влияние, снижение вероятности скрининга среди этих групп населения предполагает, что ошибка обнаружения не является основным фактором этой тенденции. Более вероятно, что вносят свой вклад когортные эффекты. [211]
Наибольший рост случаев EOCC наблюдается среди мужчин и женщин в возрасте от 20 до 29 лет, при этом заболеваемость увеличивается на 7,9% в год в период с 2004 по 2016 год. [211] Аналогичным образом, хотя и менее серьезно, мужчины и женщины в возрасте от 30 до 39 лет испытали рост случаев на 3,4% в год в течение того же периода времени. Несмотря на этот рост, уровень смертности от колоректального рака остался прежним. [211]
Факторы риска, связанные с EOCC, схожи с факторами риска всех случаев колоректального рака. [210] Наблюдаемые когортные эффекты, вероятно, являются результатом поколенческих сдвигов в образе жизни и факторах окружающей среды. [178] [210]
В 2018 году Американское онкологическое общество изменило свои предыдущие рекомендации по скринингу колоректального рака с 50 до 45 лет после признания роста случаев EOCC. [211] Лица в возрасте до 60 лет были определены как наиболее восприимчивые к неучастию в скрининге колоректального рака. [212]
Рак прямой кишки был диагностирован у древнеегипетской мумии , которая жила в оазисе Дахле во времена Птолемеев . [213]
В Соединенных Штатах март является месяцем осведомленности о колоректальном раке . [118]
Предварительные данные in vitro свидетельствуют о том, что молочнокислые бактерии (например, лактобациллы , стрептококки или лактококки ) могут защищать от развития и прогрессирования колоректального рака посредством нескольких механизмов, таких как антиоксидантная активность, иммуномодуляция , стимулирование запрограммированной гибели клеток , антипролиферативные эффекты и эпигенетическая модификация раковых клеток. [214]
{{cite book}}: CS1 maint: location missing publisher (link)Несколько крупных перспективных когортных исследований пищевых волокон и риска рака толстой кишки не подтвердили связь, хотя обратная связь была замечена в крупном исследовании European Prospective Investigation into Cancer and Nutrition (EPIC) и недавнем метаанализе. Необходимо лучше понять различия в результатах перспективных исследований; пищевые волокна сложны и неоднородны, и связь с колоректальным раком может различаться в зависимости от источника питания. (стр. 127)
на давнюю гипотезу о том, что диета с высоким содержанием клетчатки может защищать от колоректального рака... эпидемиологические исследования, связывающие потребление клетчатки с последующим риском колоректального рака, дали противоречивые результаты... Тем не менее, основываясь на существующих доказательствах, последний экспертный отчет Всемирного фонда исследований рака и Американского института исследований рака в 2017 году пришел к выводу, что существуют вероятные доказательства
2010/2011