Сера (также пишется как sulphur в британском английском ) — химический элемент ; имеет символ S и атомный номер 16. Он распространен , многовалентен и неметалличен . При нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8 . Элементарная сера — это ярко-желтое кристаллическое твердое вещество при комнатной температуре .
Сера является десятым по массе элементом во Вселенной и пятым по распространенности на Земле. Хотя иногда сера встречается в чистом, самородном виде, на Земле она обычно встречается в виде сульфидных и сульфатных минералов . Будучи широко распространенной в самородном виде, сера была известна в древние времена, упоминаясь для ее использования в Древней Индии , Древней Греции , Китае и Древнем Египте . Исторически и в литературе серу также называют серой , [7] что означает «горящий камень». [8] Сегодня почти вся элементарная сера производится как побочный продукт удаления серосодержащих загрязняющих веществ из природного газа и нефти . [9] [10] Наибольшее коммерческое использование элемента — производство серной кислоты для сульфатных и фосфатных удобрений и других химических процессов. Сера используется в спичках , инсектицидах и фунгицидах . Многие соединения серы имеют запах, и запахи одорированного природного газа, запах скунса , неприятный запах изо рта , грейпфрута и чеснока обусловлены сероорганическими соединениями. Сероводород придает характерный запах гниющим яйцам и другим биологическим процессам.
Сера является необходимым элементом для всей жизни, почти всегда в форме сероорганических соединений или сульфидов металлов. Аминокислоты (две протеиногенные : цистеин и метионин , и многие другие некодируемые : цистин , таурин и т. д.) и два витамина ( биотин и тиамин ) являются сероорганическими соединениями, имеющими решающее значение для жизни. Многие кофакторы также содержат серу, включая глутатион и железо-серные белки . Дисульфиды , связи S–S, придают механическую прочность и нерастворимость (среди прочего) белку кератину , обнаруженному во внешней коже, волосах и перьях. Сера является одним из основных химических элементов, необходимых для биохимического функционирования, и является элементарным макроэлементом для всех живых организмов.

Сера образует несколько многоатомных молекул. Наиболее известным аллотропом является октасульфур , цикло-S 8 . Точечная группа цикло-S 8 - D 4d , а его дипольный момент - 0 D. [11] Октасульфур - мягкое, ярко-желтое твердое вещество без запаха. [a] Он плавится при 115,21 °C (239,38 °F), [b] кипит при 444,6 °C (832,3 °F). [7] При 95,2 °C (203,4 °F), ниже своей температуры плавления, циклооктасера начинает медленно изменяться от α-октасульфура до β- полиморфа . [13] Структура кольца S 8 практически не меняется при этом фазовом изменении, что влияет на межмолекулярные взаимодействия. Охлаждение расплавленной серы дает точку замерзания 119,6 °C (247,3 °F), [14] поскольку она в основном состоит из молекул β-S 8. [c] Между температурами плавления и кипения октасера снова меняет свой аллотроп, превращаясь из β-октасеры в γ-серу, что снова сопровождается более низкой плотностью, но повышенной вязкостью из-за образования полимеров . [13] При более высоких температурах вязкость уменьшается, поскольку происходит деполимеризация. Расплавленная сера приобретает темно-красный цвет выше 200 °C (392 °F). Плотность серы составляет около 2 г/см 3 , в зависимости от аллотропа; все стабильные аллотропы являются превосходными электроизоляторами.
Сера более или менее возгоняется между 20 °C (68 °F) и 50 °C (122 °F). [18]
Сера нерастворима в воде, но растворима в сероуглероде и, в меньшей степени, в других неполярных органических растворителях, таких как бензол и толуол .
В нормальных условиях сера гидролизуется очень медленно, образуя в основном сероводород и серную кислоту :
Реакция включает адсорбцию протонов на S
8кластеры с последующей диспропорцией в продукты реакции. [19]
Вторая, четвертая и шестая энергии ионизации серы составляют 2252 кДж/моль, 4556 кДж/моль и 8495,8 кДж/моль соответственно. Состав продуктов реакций серы с окислителями (и ее степень окисления) зависит от того, преодолевает ли выделяющаяся в реакции энергия эти пороги. Применение катализаторов и/или подвод внешней энергии может изменять степень окисления серы и состав продуктов реакции. В то время как реакция между серой и кислородом при нормальных условиях дает диоксид серы (степень окисления +4), образование триоксида серы (степень окисления +6) требует температуры 400–600 °C (750–1100 °F) и присутствия катализатора.
В реакциях с элементами с меньшей электроотрицательностью он реагирует как окислитель и образует сульфиды, где имеет степень окисления −2.
Сера реагирует почти со всеми другими элементами, за исключением благородных газов, даже с печально известным инертным металлом иридием (давая дисульфид иридия ). [20] Некоторые из этих реакций требуют повышенных температур. [21]

Сера образует более 30 твердых аллотропов , больше, чем любой другой элемент. [22] Помимо S 8 , известно несколько других колец. [23] Удаление одного атома из короны дает S 7 , который имеет более глубокий желтый цвет, чем S 8 . Анализ «элементарной серы» методом ВЭЖХ показывает равновесную смесь в основном S 8 , но с S 7 и небольшими количествами S 6 . [24] Были получены более крупные кольца, включая S 12 и S 18 . [25] [26]
Аморфная или «пластичная» сера получается путем быстрого охлаждения расплавленной серы, например, путем выливания ее в холодную воду. Исследования рентгеновской кристаллографии показывают, что аморфная форма может иметь спиральную структуру с восемью атомами на виток. Длинные спиральные полимерные молекулы делают коричневатое вещество эластичным , и в массе эта форма имеет ощущение сырой резины. Эта форма метастабильна при комнатной температуре и постепенно возвращается в кристаллическую молекулярную аллотропную форму, которая больше не является эластичной. Этот процесс происходит в течение нескольких часов или дней, но может быть быстро катализирован.
У серы имеется 23 известных изотопа , четыре из которых стабильны: 32 S (94,99% ± 0,26% ) ), 33 S (0,75% ± 0,02% ) ), 34 S (4,25% ± 0,24% ) и 36 S (0,01% ± 0,01% ). [27] [28] За исключением 35S , период полураспада которого составляет 87 дней, радиоактивные изотопы серы имеют период полураспада менее 3 часов.
Преобладание 32 S объясняется его образованием в так называемом альфа-процессе (один из основных классов реакций ядерного синтеза) во взрывающихся звездах. Другие стабильные изотопы серы производятся в обходных процессах, связанных с 34 Ar, и их состав зависит от типа звездного взрыва. Например, пропорционально больше 33 S поступает из новых , чем из сверхновых . [29]
На планете Земля изотопный состав серы определялся Солнцем. Хотя предполагается, что распределение различных изотопов серы должно быть более или менее равным, было обнаружено, что пропорции двух наиболее распространенных изотопов серы 32 S и 34 S различаются в разных образцах. Анализ соотношения этих изотопов (δ 34 S) в образцах позволяет делать предположения об их химической истории, а при поддержке других методов позволяет датировать образцы, оценивать температуру равновесия между рудой и водой, определять pH и летучесть кислорода, выявлять активность сульфатредуцирующих бактерий во время формирования образца или предполагать основные источники серы в экосистемах. [30] Однако продолжаются дискуссии о том, что является истинной причиной сдвигов δ 34 S, биологическая активность или постдепозитные изменения. [31]
Например, когда осаждаются сульфидные минералы , изотопное равновесие между твердыми веществами и жидкостью может вызвать небольшие различия в значениях δ 34 S когенетических минералов. Различия между минералами можно использовать для оценки температуры равновесия. δ 13 C и δ 34 S сосуществующих карбонатных минералов и сульфидов можно использовать для определения pH и летучести кислорода рудоносного флюида во время рудообразования.
Ученые измеряют изотопы серы минералов в горных породах и отложениях , чтобы изучить окислительно-восстановительные условия в океанах в прошлом. Сульфатредуцирующие бактерии в морских отложениях фракционируют изотопы серы , поскольку они поглощают сульфат и производят сульфид . До 2010-х годов считалось, что сульфатредукция может фракционировать изотопы серы до 46 промилле [32] , а фракционирование более 46 промилле, зафиксированное в отложениях, должно быть связано с диспропорционированием соединений серы в осадках. Эта точка зрения изменилась с 2010-х годов, поскольку эксперименты показывают, что сульфатредуцирующие бактерии могут фракционировать до 66 промилле. [33] Поскольку субстраты для диспропорционирования ограничены продуктом сульфатредукции , изотопный эффект диспропорционирования должен быть менее 16 промилле в большинстве осадочных условий. [34]
В большинстве лесных экосистем сульфат в основном поступает из атмосферы; выветривание рудных минералов и эвапоритов вносит некоторое количество серы. Сера с характерным изотопным составом использовалась для определения источников загрязнения, а обогащенная сера добавлялась в качестве трассера в гидрологических исследованиях. Различия в естественном содержании могут использоваться в системах, где существует достаточная изменчивость 34S компонентов экосистемы. Было обнаружено, что озера Скалистых гор, в которых, как считается, доминируют атмосферные источники сульфата, имеют заметно отличающиеся значения 34S , чем озера, в которых, как считается, доминируют водораздельные источники сульфата.
Радиоактивный 35 S образуется при расщеплении космическими лучами атмосферного 40 Ar . Этот факт может быть использован для доказательства наличия недавних (не более 1 года) атмосферных осадков в различных вещах. Этот изотоп может быть получен искусственно разными способами. На практике реакция 35 Cl + n → 35 S + p используется при облучении хлорида калия нейтронами. [35] Изотоп 35 S используется в различных серосодержащих соединениях в качестве радиоактивного индикатора для многих биологических исследований, например, эксперимента Херши-Чейза .
Из-за слабой бета-активности 35S его соединения относительно безопасны , если они не попадают в организм или не усваиваются им. [36]




32 S образуется внутри массивных звезд, на глубине, где температура превышает 2,5×10 9 К, путем слияния одного ядра кремния и одного ядра гелия. [37] Поскольку эта ядерная реакция является частью альфа-процесса , который производит элементы в изобилии, сера является 10-м наиболее распространенным элементом во Вселенной .
Сера, обычно в виде сульфида, присутствует во многих типах метеоритов . Обычные хондриты содержат в среднем 2,1% серы, а углистые хондриты могут содержать до 6,6%. Обычно она присутствует в виде троилита (FeS), но есть исключения, когда углистые хондриты содержат свободную серу, сульфаты и другие соединения серы. [38] Отличительные цвета вулканического спутника Юпитера Ио приписываются различным формам расплавленной , твердой и газообразной серы. [39] В июле 2024 года неожиданно было подтверждено существование элементарной серы на Марсе после того, как марсоход Curiosity наехал на скалу и раздавил ее, обнаружив внутри кристаллы серы. [40]
Сера является пятым по массе элементом на Земле. Элементарную серу можно найти вблизи горячих источников и вулканических регионов во многих частях мира, особенно вдоль Тихоокеанского огненного кольца ; такие вулканические месторождения в настоящее время добываются в Индонезии, Чили и Японии. Эти месторождения являются поликристаллическими, с крупнейшим задокументированным монокристаллом размером 22 см × 16 см × 11 см (8,7 дюйма × 6,3 дюйма × 4,3 дюйма). [41] Исторически Сицилия была основным источником серы во время промышленной революции . [42] Озера расплавленной серы диаметром до 200 м (660 футов) были обнаружены на морском дне, связанные с подводными вулканами , на глубинах, где точка кипения воды выше, чем точка плавления серы. [43]
Самородная сера синтезируется анаэробными бактериями, действующими на сульфатные минералы, такие как гипс, в соляных куполах . [44] [45] Значительные месторождения в соляных куполах встречаются вдоль побережья Мексиканского залива , а также в эвапоритах в Восточной Европе и Западной Азии. Самородная сера может быть получена только геологическими процессами. Ископаемые месторождения серы из соляных куполов когда-то были основой для коммерческой добычи в Соединенных Штатах, России, Туркменистане и Украине. [46] В настоящее время коммерческая добыча все еще осуществляется на руднике Осек в Польше. Такие источники сейчас имеют второстепенное коммерческое значение, и большинство из них больше не разрабатываются.
Распространенные природные соединения серы включают сульфидные минералы , такие как пирит (сульфид железа), киноварь (сульфид ртути), галенит (сульфид свинца), сфалерит (сульфид цинка) и стибнит (сульфид сурьмы); и сульфатные минералы , такие как гипс (сульфат кальция), алунит (сульфат калия и алюминия) и барит (сульфат бария). На Земле, как и на спутнике Юпитера Ио, элементарная сера встречается в природе в вулканических выбросах, включая выбросы из гидротермальных источников .
Основным промышленным источником серы в настоящее время являются нефть и природный газ . [9]
Обычные степени окисления серы находятся в диапазоне от −2 до +6. Сера образует устойчивые соединения со всеми элементами, за исключением благородных газов .

Поликатионы серы, S2+8, С2+4и С2+16образуются при реакции серы с окислителями в сильнокислом растворе. [47] Окрашенные растворы, полученные путем растворения серы в олеуме, были впервые описаны еще в 1804 году К. Ф. Бухольцем, но причина цвета и структура задействованных поликатионов были определены только в конце 1960-х годов. S2+8темно-синий, S2+4желтый и S2+16красный. [13]
Восстановление серы дает различные полисульфиды с формулой S2−
х, многие из которых были получены в кристаллической форме. Показательным является производство тетрасульфида натрия :
Некоторые из этих дианионов диссоциируют, образуя радикальные анионы , такие как S−3придает голубой цвет камню лазурит .

Эта реакция подчеркивает отличительное свойство серы: ее способность к катенации (связываться с собой путем образования цепей). Протонирование этих полисульфидных анионов дает полисульфаны , H 2 S x , где x = 2, 3 и 4. [49] В конечном счете, восстановление серы дает сульфидные соли:
Взаимопревращение этих видов используется в натрий-серной батарее .
Обработка серы водородом дает сероводород . При растворении в воде сероводород имеет слабокислую реакцию: [7]
Сернистый газ и гидросульфидный анион чрезвычайно токсичны для млекопитающих из-за того, что они подавляют способность гемоглобина и некоторых цитохромов переносить кислород аналогично цианиду и азиду (см. ниже меры предосторожности ).
При сжигании серы получают два основных оксида серы:
Наблюдается много других оксидов серы, включая оксиды, богатые серой, такие как оксид серы , оксид дисеры , диоксиды дисеры и высшие оксиды, содержащие пероксогруппы.
Сера реагирует с фтором , образуя высокореакционный тетрафторид серы и высокоинертный гексафторид серы . [50] В то время как фтор дает соединения S(IV) и S(VI), хлор дает производные S(II) и S(I). Таким образом, дихлорид серы , дихлорид дисеры и высшие хлорсульфаны возникают в результате хлорирования серы. Хлорид сульфурила и хлорсульфурная кислота являются производными серной кислоты; тионилхлорид (SOCl 2 ) является распространенным реагентом в органическом синтезе . [51] Бром также окисляет серу, образуя дибромид серы и дибромид дисеры . [51]
Сера окисляет цианид и сульфит , образуя тиоцианат и тиосульфат соответственно.
Сера реагирует со многими металлами. Электроположительные металлы дают полисульфидные соли. Медь, цинк и серебро подвергаются воздействию серы; см. потускнение . Хотя известно много сульфидов металлов , большинство из них получаются в результате высокотемпературных реакций элементов. [52] Геофизики также изучают изотопы сульфидов металлов в горных породах и осадках для изучения условий окружающей среды в прошлом Земли. [53]
Некоторые из основных классов органических соединений, содержащих серу, включают следующие: [54]
Соединения с кратными связями углерод-сера встречаются редко, исключением является дисульфид углерода , летучая бесцветная жидкость, которая структурно похожа на диоксид углерода. Он используется в качестве реагента для изготовления полимерного вискозного волокна и многих сероорганических соединений. В отличие от оксида углерода , моносульфид углерода стабилен только как чрезвычайно разбавленный газ, встречающийся между солнечными системами. [55]
Сероорганические соединения ответственны за некоторые неприятные запахи разлагающейся органики. Они широко известны как одорант в бытовом природном газе, запах чеснока и спрей от скунса, а также как компонент неприятного запаха изо рта. Не все органические соединения серы неприятно пахнут при любых концентрациях: серосодержащий монотерпеноид грейпфрутовый меркаптан в малых концентрациях имеет характерный запах грейпфрута, но имеет общий тиоловый запах при больших концентрациях. Сернистый иприт , сильнодействующее везикант , использовался во время Первой мировой войны в качестве парализующего агента. [56]
Связи сера-сера являются структурным компонентом, используемым для придания резине жесткости, подобно дисульфидным мостикам, которые придают жесткость белкам (см. биологический ниже). В наиболее распространенном типе промышленного «отверждения» или закалки и укрепления натурального каучука элементарная сера нагревается с резиной до такой степени, что химические реакции образуют дисульфидные мостики между изопреновыми звеньями полимера. Этот процесс, запатентованный в 1843 году, [ необходима цитата ] сделал резину основным промышленным продуктом, особенно в автомобильных шинах. Из-за тепла и серы процесс был назван вулканизацией , в честь римского бога кузнечного дела и вулканизма .

Будучи широко доступной в самородной форме, сера была известна в древние времена и упоминается в Торе ( Бытие ). Английские переводы христианской Библии обычно называют горящую серу «серой», что дало начало термину « проповеди с огнем и серой » , в которых слушателям напоминают о судьбе вечного проклятия , которое ждет неверующих и нераскаявшихся. Именно из этой части Библии [57] подразумевается , что Ад «пахнет серой» (вероятно, из-за его связи с вулканической активностью). Согласно папирусу Эберса , в Древнем Египте для лечения зернистых век использовалась серная мазь . Сера использовалась для окуривания в доклассической Греции ; [58] об этом упоминается в Одиссее . [59] Плиний Старший обсуждает серу в книге 35 своей « Естественной истории» , говоря, что ее самым известным источником является остров Мелос . Он упоминает его использование для окуривания, в медицине и отбеливании тканей. [60]
Природная форма серы, известная как шилюхуан (石硫黄), была известна в Китае с 6 века до н. э. и была найдена в Ханьчжуне . [61] К 3 веку китайцы обнаружили, что серу можно извлекать из пирита . [61] Китайские даосы интересовались воспламеняемостью серы и ее реакционной способностью с некоторыми металлами, однако ее самые ранние практические применения были обнаружены в традиционной китайской медицине . [61] В «Уцзин Цзунъяо » 1044 года нашей эры описаны различные формулы китайского черного пороха , который представляет собой смесь нитрата калия ( KNO
3), древесный уголь и сера. [62]
Индийские алхимики, практикующие «науку химикатов» ( санскрит : रसशास्त्र , романизировано : rasaśāstra ), много писали об использовании серы в алхимических операциях с ртутью, начиная с восьмого века нашей эры. [64] В традиции расашастры серу называют «вонючей» ( गन्धक , gandhaka ).
Ранние европейские алхимики дали сере уникальный алхимический символ , треугольник на вершине креста (🜍). (Иногда его путают с астрономическим символом скрещенного копья ⚴ для 2 Паллады .) Разновидность, известная как сера, имеет символ, объединяющий двухперекладинный крест на вершине лемнискаты (🜏). В традиционном лечении кожи элементарная сера использовалась (в основном в кремах) для облегчения таких состояний, как чесотка , стригущий лишай , псориаз , экзема и угри . Механизм действия неизвестен, хотя элементарная сера медленно окисляется до сернистой кислоты, которая (благодаря действию сульфита ) является мягким восстанавливающим и антибактериальным средством. [65] [66] [67]

Сера появляется в колонке фиксированных (некислотных) щелочей в химической таблице 1718 года. [69] Антуан Лавуазье использовал серу в экспериментах по горению, описав некоторые из них в 1777 году. [70]
Месторождения серы на Сицилии были доминирующим источником более века. К концу 18 века около 2000 тонн серы в год импортировались в Марсель , Франция, для производства серной кислоты для использования в процессе Леблана . В индустриализации Британии, с отменой тарифов на соль в 1824 году, спрос на серу из Сицилии резко возрос. Растущий британский контроль и эксплуатация добычи, очистки и транспортировки серы, в сочетании с неспособностью этого прибыльного экспорта преобразовать отсталую и обедневшую экономику Сицилии, привели к серному кризису 1840 года , когда король Фердинанд II передал монополию на серную промышленность французской фирме, нарушив более раннее торговое соглашение 1816 года с Великобританией. В конечном итоге Франция договорилась о мирном решении. [71] [72]
В 1867 году в подземных месторождениях Луизианы и Техаса была обнаружена элементарная сера. Для извлечения этого ресурса был разработан весьма успешный процесс Фраша . [73]
В конце 18 века мебельщики использовали расплавленную серу для изготовления декоративных инкрустаций . [74] Расплавленная сера иногда все еще используется для установки стальных болтов в просверленные бетонные отверстия, где требуется высокая ударопрочность для точек крепления напольного оборудования. Чистая порошкообразная сера использовалась как лекарственное тонизирующее и слабительное. [46]
С появлением контактного процесса большая часть серы сегодня используется для производства серной кислоты для широкого спектра применений, в частности, в качестве удобрений. [75]
В последнее время основным источником серы стали нефть и природный газ . Это связано с необходимостью удаления серы из топлива для предотвращения кислотных дождей , что привело к избытку серы. [9]
Сера происходит от латинского слова sulpur , которое было эллинизировано в sulphur из-за ошибочного мнения, что латинское слово произошло от греческого. Это написание было позже переосмыслено как представляющее звук /f/ и привело к написанию neutral , которое появляется в латыни к концу классического периода . Истинное древнегреческое слово для серы, θεῖον , theîon (от более раннего θέειον , théeion ), является источником международного химического префикса thio- . Современное стандартное греческое слово для серы - θείο, theío .
В англо-французском языке XII века это было sulfre . В XIV веке ошибочно эллинизированное латинское -ph- было восстановлено в среднеанглийском sulphre . К XV веку оба полных латинских варианта написания, soil и sulphur, стали обычными в английском языке. Параллельное написание f~ph продолжалось в Британии до XIX века, когда слово было стандартизировано как sulphur . [76] С другой стороны, в Соединенных Штатах была выбрана форма soil , тогда как в Канаде используются обе.
ИЮПАК принял написание « sulfur» в 1990 году [77] [78], как и Номенклатурный комитет Королевского химического общества в 1992 году, восстановив написание « sulfur» в Великобритании. [79] Оксфордские словари отмечают, что «в химии и других технических применениях ... написание -f- теперь является стандартной формой для этого и родственных слов как в британском, так и в американском контексте, и все чаще используется также в общих контекстах». [80]


Сера может быть найдена сама по себе и исторически обычно добывалась в этой форме; пирит также был источником серы. [81] В вулканических регионах Сицилии в древние времена она была найдена на поверхности Земли, и использовался « сицилийский процесс »: залежи серы складывались и укладывались в кирпичные печи, построенные на пологих склонах холмов, с воздушными пространствами между ними. Затем часть серы измельчалась, распределялась по уложенной руде и поджигалась, заставляя свободную серу плавиться вниз по холмам. В конце концов, поверхностные залежи иссякли, и шахтеры выкопали жилы, которые в конечном итоге усеяли сицилийский ландшафт лабиринтными шахтами. Добыча была немеханизированной и трудоемкой, с кайлами, освобождающими руду от породы, и шахтерами или карузи , переносящими корзины с рудой на поверхность, часто через милю или более туннелей. Как только руда оказывалась на поверхности, ее восстанавливали и извлекали в плавильных печах. Условия в сицилийских серных рудниках были ужасающими, что побудило Букера Т. Вашингтона написать: «Я не готов сейчас сказать, в какой степени я верю в физический ад на том свете, но серная шахта на Сицилии — это самое близкое к аду, что я ожидаю увидеть в этой жизни». [82] Серу по-прежнему добывают из поверхностных месторождений в более бедных странах с вулканами, таких как Индонезия , и условия труда не сильно улучшились со времен Букера Т. Вашингтона. [83]
Элементарная сера извлекалась из соляных куполов (в которых она иногда встречается почти в чистом виде) до конца 20-го века. В настоящее время сера производится как побочный продукт других промышленных процессов, таких как переработка нефти, в которых сера нежелательна. Как минерал, самородная сера под соляными куполами считается ископаемым минеральным ресурсом, полученным в результате воздействия анаэробных бактерий на сульфатные отложения. Она извлекалась из таких соляных шахт в основном с помощью процесса Фраша . [46] В этом методе перегретая вода закачивалась в месторождение самородной серы, чтобы расплавить серу, а затем сжатый воздух возвращал 99,5%-ный чистый расплавленный продукт на поверхность. На протяжении 20-го века эта процедура производила элементарную серу, которая не требовала дальнейшей очистки. Из-за ограниченного количества таких месторождений серы и высокой стоимости их разработки этот процесс добычи серы не использовался в значительной степени нигде в мире с 2002 года. [84] [85]

Сегодня сера производится из нефти, природного газа и связанных с ними ископаемых ресурсов, из которых она в основном получается в виде сероводорода . [9] Сероорганические соединения , нежелательные примеси в нефти, могут быть улучшены путем их гидродесульфуризации , которая расщепляет связи C–S: [84] [85]
Полученный в результате этого процесса сероводород, а также как он встречается в природном газе, преобразуется в элементарную серу с помощью процесса Клауса . Этот процесс включает окисление некоторого количества сероводорода до диоксида серы, а затем их пропорционирование : [84] [85]
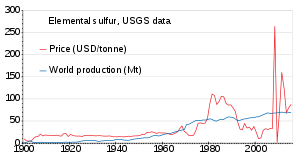
Из-за высокого содержания серы в нефтяных песках Атабаски , запасы элементарной серы, полученные в результате этого процесса, теперь существуют по всей провинции Альберта , Канада. [86] Другой способ хранения серы — использование ее в качестве связующего для бетона, при этом полученный продукт обладает некоторыми желаемыми свойствами (см. серный бетон ). [87]
Мировое производство серы в 2011 году составило 69 миллионов тонн (Мт), причем более 15 стран внесли более 1 Мт каждая. Странами, производящими более 5 Мт, являются Китай (9,6), США (8,8), Канада (7,1) и Россия (7,1). [88] Производство медленно росло с 1900 по 2010 год; цена была нестабильной в 1980-х годах и около 2010 года. [89]
Элементарная сера используется в основном как прекурсор других химикатов. Примерно 85% (1989) преобразуется в серную кислоту ( H2SO4 ) :

В 2010 году Соединенные Штаты произвели больше серной кислоты, чем любого другого неорганического промышленного химиката. [89] Основное применение кислоты — добыча фосфатных руд для производства удобрений. Другие применения серной кислоты включают нефтепереработку, очистку сточных вод и добычу полезных ископаемых. [46]
Сера напрямую реагирует с метаном, образуя сероуглерод , который используется для производства целлофана и вискозы . [46] Одним из применений элементарной серы является вулканизация резины, где полисульфидные цепи сшивают органические полимеры. Большие количества сульфитов используются для отбеливания бумаги и сохранения сухофруктов . Многие поверхностно-активные вещества и моющие средства (например, лаурилсульфат натрия ) являются производными сульфата. Сульфат кальция , гипс (CaSO4 · 2H2O ) добывается в масштабах 100 миллионов тонн каждый год для использования в портландцементе и удобрениях.
В эпоху широкого распространения серебряной фотографии в качестве «фиксаторов» широко использовались тиосульфат натрия и аммония . Сера входит в состав пороха («черный порох»).
Аминокислоты , синтезируемые живыми организмами , такие как метионин и цистеин, содержат органические серосодержащие группы ( тиоэфир и тиол соответственно). Антиоксидант глутатион , защищающий многие живые организмы от свободных радикалов и окислительного стресса, также содержит органическую серу. Некоторые культуры, такие как лук и чеснок, также производят различные органические серосодержащие соединения , такие как син -пропантиаль- S -оксид , ответственный за раздражение слезных желез (лук), или диаллилдисульфид и аллицин (чеснок). Сульфаты , обычно встречающиеся в почвах и грунтовых водах , часто являются достаточным естественным источником серы для растений и бактерий. Атмосферное осаждение диоксида серы (SO2 ) также является распространенным искусственным источником ( сжигание угля ) серы для почв. При нормальных обстоятельствах в большинстве сельскохозяйственных почв сера не является ограничивающим питательным веществом для растений и микроорганизмов (см. бочку Либиха ). Однако при некоторых обстоятельствах почвы могут быть истощены сульфатом , например, если он позже вымывается метеорными водами ( дождем ) или если потребности в сере для некоторых видов сельскохозяйственных культур высоки. Это объясняет, почему сера все чаще признается и используется в качестве компонента удобрений . Наиболее важной формой серы для удобрений является сульфат кальция , обычно встречающийся в природе в виде минерального гипса (CaSO4 · 2H2O ) . Элементарная сера гидрофобна (не растворима в воде) и не может напрямую использоваться растениями. Элементарную серу (ЭС) иногда смешивают с бентонитом для внесения изменений в истощенные почвы для сельскохозяйственных культур с высокой потребностью в органо-сере. Со временем окислительные абиотические процессы с атмосферным кислородом и почвенными бактериями могут окислять и преобразовывать элементарную серу в растворимые производные, которые затем могут использоваться микроорганизмами и растениями. Сера повышает эффективность других основных питательных веществ для растений, особенно азота и фосфора. [90]Биологически полученные частицы серы обладают естественной гидрофильностью благодаря биополимерному покрытию и легче распределяются по земле в виде распыленной разбавленной суспензии, что приводит к более быстрому усвоению растениями.
Потребность растений в сере равна или превышает потребность в фосфоре . Это необходимое питательное вещество для роста растений, образования корневых клубеньков бобовых, а также иммунитета и защитных систем. Дефицит серы стал широко распространенным во многих странах Европы. [91] [92] [93] Поскольку атмосферные поступления серы продолжают уменьшаться, дефицит поступления/выведения серы, вероятно, увеличится, если не будут использоваться серные удобрения. Атмосферные поступления серы уменьшаются из-за мер, принимаемых для ограничения кислотных дождей . [94] [90]

Элементарная сера является одним из старейших фунгицидов и пестицидов . «Пылевидная сера», элементарная сера в порошкообразной форме, является распространенным фунгицидом для винограда, клубники, многих овощей и ряда других культур. Она обладает хорошей эффективностью против широкого спектра заболеваний мучнистой росой , а также черной пятнистости. В органическом производстве сера является наиболее важным фунгицидом. Это единственный фунгицид, используемый в органическом производстве яблок против основного заболевания парши яблони в более холодных условиях. Биосера (биологически полученная элементарная сера с гидрофильными характеристиками) также может использоваться для этих целей.
Стандартная формула для распыления серы применяется к посевам с помощью распылителя серы или с распыляющего самолета . Смачиваемая сера — это коммерческое название распыляемой серы, приготовленной с добавлением дополнительных ингредиентов, делающих ее водосмешиваемой . [ 87] [95] Она имеет схожие области применения и используется в качестве фунгицида против плесени и других проблем с плесенью, связанных с растениями и почвой.
Элементарный порошок серы используется как « органический » (т. е. «зеленый») инсектицид (фактически акарицид ) против клещей и клещей . Распространенный метод применения — посыпание одежды или конечностей порошком серы.
Разбавленный раствор известковой серы (полученный путем соединения гидроксида кальция с элементарной серой в воде) используется в качестве раствора для обработки домашних животных от стригущего лишая (грибка) , чесотки и других дерматозов и паразитов .
Серные свечи, состоящие почти из чистой серы, сжигались для окуривания строений и винных бочек, но сейчас они считаются слишком токсичными для жилых помещений.
Сера (в частности октасульфур , S 8 ) используется в фармацевтических препаратах для кожи для лечения угрей и других состояний. Она действует как кератолитическое средство, а также убивает бактерии, грибки, чесоточных клещей и других паразитов. [96] Осажденная сера и коллоидная сера используются в виде лосьонов , кремов, порошков, мыла и добавок для ванн для лечения угрей обыкновенных , угрей розацеа и себорейного дерматита . [97]
Многие лекарства содержат серу. [98] Ранние примеры включают антибактериальные сульфаниламиды , известные как сульфапрепараты . Более поздний пример — муколитический ацетилцистеин . Сера является частью многих защитных молекул бактерий. Большинство β-лактамных антибиотиков, включая пенициллины , цефалоспорины и монобактамы , содержат серу. [54]
Из-за высокой плотности энергии и доступности серы ведутся постоянные исследования по созданию перезаряжаемых литий-серных батарей . До сих пор карбонатные электролиты вызывали отказы в таких батареях после одного цикла. В феврале 2022 года исследователи из Университета Дрекселя не только создали прототип батареи, которая выдержала 4000 циклов перезарядки, но и обнаружили первую моноклинную гамма-серу, которая оставалась стабильной при температуре ниже 95 градусов по Цельсию. [99]
Сера является неотъемлемым компонентом всех живых клеток . Это восьмой по распространенности элемент в организме человека по весу, [100] примерно равный по распространенности калию и немного превышающий натрий и хлор . [101] В 70-килограммовом (150 фунтов) организме человека содержится около 140 граммов (4,9 унций) серы. [102] Основным источником серы в рационе человека являются серосодержащие аминокислоты, [103] которые можно найти в растительных и животных белках. [104]
В 1880-х годах, изучая Beggiatoa (бактерию, живущую в среде, богатой серой), Сергей Виноградский обнаружил, что она окисляет сероводород (H 2 S) в качестве источника энергии, образуя внутриклеточные капли серы. Виноградский назвал эту форму метаболизма неорганоокислением (окислением неорганических соединений). [105] Другим исследователем, который продолжил ее изучение, был Сельман Ваксман . [106] Примитивные бактерии, которые живут вокруг глубоководных вулканических жерл, окисляют сероводород для своего питания, как обнаружил Роберт Баллард . [10]
Окислители серы могут использовать в качестве источников энергии восстановленные соединения серы, включая сероводород, элементарную серу, сульфит , тиосульфат и различные политионаты (например, тетратионат ). [107] Они зависят от ферментов, таких как серооксигеназа и сульфитоксидаза, для окисления серы до сульфата. Некоторые литотрофы могут даже использовать энергию, содержащуюся в соединениях серы, для производства сахаров, процесс, известный как хемосинтез . Некоторые бактерии и археи используют сероводород вместо воды в качестве донора электронов в хемосинтезе, процессе, похожем на фотосинтез , который производит сахара и использует кислород в качестве акцептора электронов . Хемосинтез на основе серы можно упрощенно сравнить с фотосинтезом:
Существуют бактерии, сочетающие эти два способа питания: зеленые серные бактерии и пурпурные серные бактерии . [108] Также сероокисляющие бактерии могут вступать в симбиоз с более крупными организмами, позволяя последним использовать сероводород в качестве пищи для окисления. Пример: гигантский трубчатый червь . [109]
Существуют сульфатредуцирующие бактерии , которые, напротив, «дышат сульфатом» вместо кислорода. Они используют органические соединения или молекулярный водород в качестве источника энергии. Они используют серу в качестве акцептора электронов и восстанавливают различные окисленные соединения серы обратно в сульфид, часто в сероводород. Они могут расти на других частично окисленных соединениях серы (например, тиосульфатах, тионатах, полисульфидах, сульфитах).
Существуют исследования, указывающие на то, что многие отложения самородной серы в местах, которые были дном древних океанов, имеют биологическое происхождение. [110] [111] [112] Эти исследования указывают на то, что эта самородная сера была получена в результате биологической активности, но что именно за это отвечает (сероокисляющие бактерии или сульфатредуцирующие бактерии) до сих пор точно неизвестно.
Сера поглощается корнями растений из почвы в виде сульфата и транспортируется в виде фосфатного эфира. Сульфат восстанавливается до сульфида через сульфит, прежде чем он включится в цистеин и другие сероорганические соединения. [113]
В то время как роль растений в передаче серы животным по пищевым цепям более или менее понятна, роль серных бактерий только начинает изучаться. [114] [115]
Во всех формах жизни большая часть серы содержится в двух протеиногенных аминокислотах ( цистеине и метионине ), поэтому этот элемент присутствует во всех белках , содержащих эти аминокислоты, а также в соответствующих пептидах . [116] Часть серы содержится в определенных метаболитах, многие из которых являются кофакторами , и сульфатированных полисахаридах соединительной ткани ( хондроитинсульфатах , гепарине ).
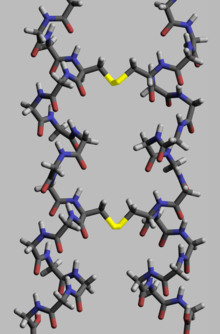
Для выполнения своей биологической функции белки должны иметь определенную пространственную геометрию. Формирование этой геометрии осуществляется в процессе, называемом сворачиванием белка , и обеспечивается внутри- и межмолекулярными связями. Процесс состоит из нескольких стадий. В то время как на начальных стадиях полипептидная цепь сворачивается за счет водородных связей , на более поздних стадиях сворачивание обеспечивается (помимо водородных связей) ковалентными связями между двумя атомами серы двух остатков цистеина (так называемыми дисульфидными мостиками) в разных местах цепи (третичная структура белка), а также между двумя остатками цистеина в двух разделенных субъединицах белка (четвертичная структура белка). Обе структуры легко можно увидеть в инсулине . Поскольку энергия связи ковалентного дисульфидного мостика выше энергии координационной связи или гидрофобного взаимодействия, большее содержание дисульфидных мостиков приводит к большей энергии, необходимой для денатурации белка . В целом дисульфидные связи необходимы в белках, функционирующих вне клеточного пространства, и они не изменяют конформацию (геометрию) белка, но служат его стабилизаторами. [117] В цитоплазме остатки цистеина белков сохраняются в восстановленном состоянии (т.е. в -SH-форме) тиоредоксинами . [ 118]
Это свойство проявляется в следующих примерах. Лизоцим достаточно стабилен, чтобы его можно было применять в качестве лекарственного средства. [119] Перья и волосы обладают относительной прочностью, а содержащийся в них кератин считается неперевариваемым большинством организмов. Однако существуют грибки и бактерии, содержащие кератиназу , которые способны разрушать кератин.
Многие важные клеточные ферменты используют простетические группы, заканчивающиеся на -SH-фрагменты, для обработки реакций с участием ацилсодержащих биохимических веществ: два распространенных примера из основного метаболизма - кофермент А и альфа-липоевая кислота . [120] Метаболиты, связанные с цистеином, гомоцистеин и таурин - это другие серосодержащие аминокислоты, которые похожи по структуре, но не кодируются ДНК и не являются частью первичной структуры белков, принимают участие в различных участках физиологии млекопитающих. [121] [122] Два из 13 классических витаминов, биотин и тиамин , содержат серу и служат кофакторами для нескольких ферментов. [123] [124] Во внутриклеточной химии сера действует как переносчик восстанавливающего водорода и его электронов для клеточного восстановления окисления. Восстановленный глутатион , серосодержащий трипептид, является восстанавливающим агентом через свою сульфгидрильную (–SH) часть, полученную из цистеина .
Метаногенез , путь к большей части мирового метана, представляет собой многоэтапную биохимическую трансформацию углекислого газа . Для этой трансформации требуется несколько сероорганических кофакторов. К ним относятся кофермент M , CH 3 SCH 2 CH 2 SO−3, непосредственный предшественник метана . [125]
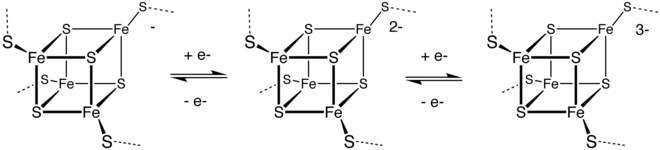
Металлопротеины, в которых активным центром является ион переходного металла (или кластер металл-сульфид), часто координируемый атомами серы остатков цистеина [126] , являются важнейшими компонентами ферментов, участвующих в процессах переноса электронов. Примерами являются пластоцианин (Cu2 + ) и редуктаза закиси азота (Cu–S). Функция этих ферментов зависит от того факта, что ион переходного металла может подвергаться окислительно-восстановительным реакциям . Другие примеры включают множество цинковых белков, [127] , а также кластеры железа и серы . Наиболее распространенными являются ферродоксины , которые служат переносчиками электронов в клетках. У бактерий важные ферменты нитрогеназы содержат кластер Fe–Mo–S и являются катализатором , который выполняет важную функцию фиксации азота , преобразуя атмосферный азот в аммиак, который может использоваться микроорганизмами и растениями для создания белков, ДНК, РНК, алкалоидов и других органических соединений азота, необходимых для жизни. [128]
Сера также присутствует в кофакторе молибдена . [129]
У людей метионин является незаменимой аминокислотой ; цистеин условно незаменим и может быть синтезирован из неэссенциального серина (донором серы в этом случае был бы метионин). Диетический дефицит редко случается при обычных условиях. Искусственный дефицит метионина пытаются применить при лечении рака, [130] но метод все еще потенциально опасен. [131]
Изолированный дефицит сульфитоксидазы — редкое, фатальное генетическое заболевание, препятствующее выработке сульфитоксидазы , необходимой для метаболизма сульфитов в сульфаты. [132]

Хотя элементарная сера лишь в минимальной степени впитывается через кожу и имеет низкую токсичность для человека, вдыхание серной пыли или контакт с глазами или кожей может вызвать раздражение. Чрезмерное употребление серы может вызвать жжение или диарею, [135] и случаи опасного для жизни метаболического ацидоза были зарегистрированы после того, как пациенты преднамеренно употребляли серу в качестве народного средства. [136] [137]
Когда сера горит на воздухе, она производит диоксид серы . В воде этот газ производит сернистую кислоту и сульфиты; сульфиты являются антиоксидантами, которые подавляют рост аэробных бактерий и полезной пищевой добавкой в небольших количествах. При высоких концентрациях эти кислоты вредят легким , глазам или другим тканям . [138] У организмов без легких, таких как насекомые, сульфит в высокой концентрации препятствует дыханию . [139]
Триоксид серы (полученный катализом из диоксида серы) и серная кислота также являются очень кислыми и едкими в присутствии воды. Концентрированная серная кислота является сильным дегидратирующим агентом, который может удалить доступные молекулы воды и водные компоненты из сахара и органической ткани. [140]
Сжигание угля и/или нефти промышленностью и электростанциями генерирует диоксид серы (SO 2 ), который реагирует с атмосферной водой и кислородом , образуя сернистую кислоту (H 2 SO 3 ). [141] Эти кислоты являются компонентами кислотных дождей , снижая pH почвы и пресноводных водоемов, что иногда приводит к существенному ущербу окружающей среде и химическому выветриванию статуй и сооружений. Стандарты топлива все чаще требуют, чтобы производители топлива извлекали серу из ископаемого топлива для предотвращения образования кислотных дождей. Эта извлеченная и очищенная сера составляет большую часть производства серы. На угольных электростанциях дымовые газы иногда очищаются. Более современные электростанции, использующие синтез-газ , извлекают серу до того, как сжигают газ.
Сернистый газ примерно в два раза менее токсичен , чем цианистый газ , и вызывает отравление по тому же механизму (ингибирование дыхательного фермента цитохромоксидазы ), [142] хотя сернистый газ с меньшей вероятностью вызывает внезапные отравления от небольших вдыхаемых количеств (вблизи его допустимого предела воздействия (PEL) 20 ppm) из-за его неприятного запаха. [143] Однако его присутствие в окружающем воздухе в концентрации более 100–150 ppm быстро притупляет обоняние, [144] и жертва может вдыхать увеличивающиеся количества, не замечая этого, пока тяжелые симптомы не приведут к смерти. Растворенные соли сульфида и гидросульфида токсичны по тому же механизму.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на август 2024 г. ( ссылка )Sigel, Astrid; Freisinger, Eva; Sigel, Roland KO, ред. (2020). Переходные металлы и сера: прочная связь для жизни . Приглашенные редакторы Марта Э. Соса Торрес и Питер М. Х. Кронек. Берлин/Бостон: de Gruyter. стр. xlv+455. ISBN 978-3-11-058889-7.