
В органической химии , алкан , или парафин (историческое тривиальное название , которое также имеет другие значения ), является ациклическим насыщенным углеводородом . Другими словами, алкан состоит из атомов водорода и углерода , расположенных в древовидной структуре, в которой все связи углерод-углерод являются одинарными . [1] Алканы имеют общую химическую формулу C n H 2 n +2 . Алканы варьируются по сложности от простейшего случая метана ( CH 4 ), где n = 1 (иногда называемого материнской молекулой), до произвольно больших и сложных молекул, таких как пентаконтан ( C 50 H 102 ) или 6-этил - 2-метил-5-(1-метилэтил) октан, изомер тетрадекана ( C 14 H 30 ).
Международный союз теоретической и прикладной химии (ИЮПАК) определяет алканы как «ациклические разветвленные или неразветвленные углеводороды, имеющие общую формулу C n H 2 n +2 , и, следовательно, состоящие полностью из атомов водорода и насыщенных атомов углерода». Однако некоторые источники используют этот термин для обозначения любого насыщенного углеводорода, включая те, которые являются либо моноциклическими (т. е. циклоалканы ), либо полициклическими , несмотря на то, что они имеют четкую общую формулу (например, циклоалканы — это C n H 2 n ).
В алкане каждый атом углерода sp 3 -гибридизован с 4 сигма-связями (либо C–C, либо C–H ), а каждый атом водорода соединен с одним из атомов углерода (связью C–H). Самая длинная серия связанных атомов углерода в молекуле известна как ее углеродный скелет или углеродный остов. Количество атомов углерода можно рассматривать как размер алкана.
Одна группа высших алканов – это воски , твердые вещества при стандартной температуре и давлении окружающей среды (SATP), у которых число атомов углерода в углеродном скелете превышает примерно 17. С их повторяющимися единицами –CH2 алканы образуют гомологический ряд органических соединений, в котором члены различаются по молекулярной массе на величины, кратные 14,03 а.е.м. ( общая масса каждой такой единицы метиленового мостика , которая состоит из одного атома углерода массой 12,01 а.е.м. и двух атомов водорода массой ~1,01 а.е.м. каждый).
Метан вырабатывается метаногенными бактериями , а некоторые длинноцепочечные алканы действуют как феромоны у некоторых видов животных или как защитные воски у растений и грибов. Тем не менее, большинство алканов не обладают большой биологической активностью . Их можно рассматривать как молекулярные деревья, на которые можно повесить более активные/реактивные функциональные группы биологических молекул.
Алканы имеют два основных коммерческих источника: нефть (сырая нефть) и природный газ .
Алкильная группа — это молекулярный фрагмент на основе алкана, который имеет одну открытую валентность для связывания. Обычно они обозначаются аббревиатурой для любой органильной группы , R, хотя Alk иногда используется для обозначения именно алкильной группы (в отличие от алкенильной группы или арильной группы).
Обычно расстояние одинарной связи CC составляет 1,53 ангстрема (1,53 × 10−10 м). [2] Насыщенные углеводороды могут быть линейными, разветвленными или циклическими . Третью группу иногда называют циклоалканами . [ 1] Очень сложные структуры возможны путем объединения линейных, разветвленных и циклических алканов.

Алканы с более чем тремя атомами углерода могут быть организованы различными способами, образуя структурные изомеры . Простейшим изомером алкана является тот, в котором атомы углерода расположены в одну цепь без ответвлений. Этот изомер иногда называют n -изомером ( n означает «нормальный», хотя это не обязательно самый распространенный вариант). Однако цепь атомов углерода также может быть разветвлена в одной или нескольких точках. Число возможных изомеров быстро увеличивается с числом атомов углерода. Например, для ациклических алканов: [3]
Разветвленные алканы могут быть хиральными . Например, 3-метилгексан и его высшие гомологи хиральны из-за их стереогенного центра у атома углерода номер 3. Приведенный выше список включает только различия в связности, но не стереохимии. В дополнение к изомерам алканов, цепь атомов углерода может образовывать одно или несколько колец. Такие соединения называются циклоалканами и также исключены из приведенного выше списка, поскольку изменение числа колец изменяет молекулярную формулу . Например, циклобутан и метилциклопропан являются изомерами друг друга (C 4 H 8 ), но не являются изомерами бутана (C 4 H 10 ).
Разветвленные алканы более термодинамически стабильны, чем их линейные (или менее разветвленные) изомеры. Например, сильно разветвленный 2,2,3,3-тетраметилбутан примерно на 1,9 ккал/моль стабильнее своего линейного изомера, н- октана. [4]
Номенклатура ИЮПАК (систематический способ наименования соединений) для алканов основана на идентификации углеводородных цепей. Неразветвленные, насыщенные углеводородные цепи именуются систематически с греческим числовым префиксом, обозначающим число атомов углерода, и суффиксом «-ан». [5]
В 1866 году Август Вильгельм фон Гофман предложил систематизировать номенклатуру, используя всю последовательность гласных a, e, i, o и u для создания суффиксов -ane, -ene, -ine (или -yne), -one, -une для углеводородов C n H 2 n +2 , C n H 2 n , C n H 2 n −2 , C n H 2 n −4 , C n H 2 n −6 . [6] В современной номенклатуре первые три специально обозначают углеводороды с одинарными, двойными и тройными связями; [7] в то время как «-one» теперь представляет кетон .
Алканы с прямой цепью иногда обозначаются префиксом "n-" или " n- " (для "нормального"), когда существует нелинейный изомер . Хотя это не является строго необходимым и не является частью системы наименований ИЮПАК, использование все еще распространено в случаях, когда кто-то хочет подчеркнуть или провести различие между линейными и разветвленными изомерами, например, " n -бутан ", а не просто "бутан", чтобы отличить его от изобутана . Альтернативные названия для этой группы, используемые в нефтяной промышленности, - линейные парафины или н -парафины .
Первые восемь членов ряда (по числу атомов углерода) названы следующим образом:
Первые четыре названия были получены из метанола , эфира , пропионовой кислоты и масляной кислоты . Алканы с пятью или более атомами углерода называются путем добавления суффикса -ан к соответствующему числовому множителю [ 8] с опусканием любой конечной гласной ( -а или -о ) из основного числового термина. Таким образом, пентан , C5H12 ; гексан , C6H14 ; гептан , C7H16 ; октан , C8H18 ; и т. д. Численный префикс , как правило , греческий; однако , алканы с числом атомов углерода , заканчивающимся на девять , например, нонан , используют латинский префикс non- .

Простые разветвленные алканы часто имеют общее название, использующее префикс, чтобы отличать их от линейных алканов, например, н -пентан , изопентан и неопентан .
Для создания систематического названия можно использовать правила наименования ИЮПАК.
Ключевые шаги в наименовании более сложных разветвленных алканов следующие: [9]
Хотя технически этот класс углеводородов отличается от алканов, некоторые называют его «циклическими алканами». Как следует из их описания, они содержат одно или несколько колец.
Простые циклоалканы имеют префикс «цикло-», чтобы отличать их от алканов. Циклоалканы называются в соответствии с их ациклическими аналогами в соответствии с числом атомов углерода в их остовах, например, циклопентан (C 5 H 10 ) является циклоалканом с 5 атомами углерода, как и пентан (C 5 H 12 ), но они соединены в пятичленное кольцо. Аналогичным образом, пропан и циклопропан , бутан и циклобутан и т. д.
Замещенные циклоалканы называются аналогично замещенным алканам – указывается циклоалкановое кольцо, а заместители – в соответствии с их положением в кольце, при этом нумерация определяется правилами приоритета Кана–Ингольда–Прелога . [8]
Тривиальное (несистематическое ) название алканов — «парафины». Вместе алканы известны как «парафиновый ряд». Тривиальные названия соединений обычно являются историческими артефактами. Они были придуманы до разработки систематических названий и сохранились из-за привычного использования в промышленности. Циклоалканы также называются нафтенами. [11] [12]
Разветвленные алканы называются изопарафинами . «Парафин» — это общий термин, который часто не делает различий между чистыми соединениями и смесями изомеров , т. е. соединениями с одинаковой химической формулой , например, пентан и изопентан .
В системе ИЮПАК сохранены следующие тривиальные названия:
Иногда используются некоторые тривиальные названия, не входящие в ИЮПАК:
Все алканы бесцветны. [14] [15] Алканы с самой низкой молекулярной массой являются газами, с промежуточной молекулярной массой — жидкостями, а самые тяжелые — воскообразными твердыми веществами. [16] [17]

Алканы испытывают межмолекулярные силы Ван-дер-Ваальса . Кумулятивные эффекты этих межмолекулярных сил приводят к более высоким температурам кипения алканов. [18]
На величину сил Ван-дер-Ваальса влияют два фактора:
При стандартных условиях от CH4 до C4H10 алканы являются газообразными; от C5H12 до C17H36 они являются жидкостями ; а после C18H38 они являются твердыми веществами. Поскольку температура кипения алканов в первую очередь определяется массой, не должно быть сюрпризом, что температура кипения имеет почти линейную зависимость от размера ( молекулярной массы ) молекулы . Как правило, температура кипения повышается на 20–30 °C для каждого добавленного к цепи углерода; это правило применимо и к другим гомологическим рядам. [ 18]
Алкан с прямой цепью будет иметь температуру кипения выше, чем алкан с разветвленной цепью из-за большей площади поверхности контакта и, следовательно, больших сил Ван-дер-Ваальса между соседними молекулами. Например, сравните изобутан (2-метилпропан) и н-бутан (бутан), которые кипят при −12 и 0 °C, и 2,2-диметилбутан и 2,3-диметилбутан, которые кипят при 50 и 58 °C соответственно. [18]
С другой стороны, циклоалканы, как правило, имеют более высокие температуры кипения, чем их линейные аналоги, из-за заблокированных конформаций молекул, которые обеспечивают плоскость межмолекулярного контакта.
Температуры плавления алканов следуют аналогичной тенденции с температурами кипения по той же причине, что и описанная выше. То есть (при прочих равных условиях) чем больше молекула, тем выше температура плавления. Между температурами кипения и температурами плавления есть одно существенное различие. Твердые тела имеют более жесткую и фиксированную структуру, чем жидкости. Эта жесткая структура требует энергии для разрушения. Таким образом, лучше организованные твердые структуры потребуют больше энергии для распада. Для алканов это можно увидеть на графике выше (т. е. синяя линия). Нечетные алканы имеют более низкую тенденцию к температурам плавления, чем четные алканы. Это происходит потому, что четные алканы хорошо упаковываются в твердой фазе, образуя хорошо организованную структуру, для распада которой требуется больше энергии. Нечетные алканы упаковываются хуже, и поэтому «слабо» организованная твердая упаковочная структура требует меньше энергии для распада. [19] Для визуализации кристаллических структур см. [20]
Температуры плавления алканов с разветвленной цепью могут быть как выше, так и ниже, чем у соответствующих алканов с прямой цепью, что опять же зависит от способности рассматриваемого алкана хорошо упаковываться в твердой фазе.
Алканы не проводят электричество никоим образом и не поляризуются в значительной степени электрическим полем . По этой причине они не образуют водородных связей и нерастворимы в полярных растворителях, таких как вода. Поскольку водородные связи между отдельными молекулами воды выровнены от молекулы алкана, сосуществование алкана и воды приводит к увеличению молекулярного порядка (уменьшению энтропии ). Поскольку между молекулами воды и молекулами алкана нет значительной связи, второй закон термодинамики предполагает, что это уменьшение энтропии должно быть минимизировано путем минимизации контакта между алканом и водой: Алканы называются гидрофобными, поскольку они нерастворимы в воде.
Их растворимость в неполярных растворителях относительно высока, это свойство называется липофильностью . Например, алканы смешиваются между собой во всех пропорциях.
Плотность алканов обычно увеличивается с числом атомов углерода, но остается меньше, чем у воды. Поэтому алканы образуют верхний слой в смеси алканов с водой. [21]
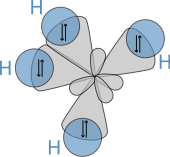
Молекулярная структура алканов напрямую влияет на их физические и химические характеристики. Она вытекает из электронной конфигурации углерода , который имеет четыре валентных электрона . Атомы углерода в алканах описываются как sp 3 гибриды; то есть, в хорошем приближении, валентные электроны находятся на орбиталях , направленных к углам тетраэдра, которые получены из комбинации 2s-орбитали и трех 2p-орбиталей. Геометрически угол между связями равен cos −1 (− 1/3 ) ≈ 109,47°. Это точно для случая метана, тогда как более крупные алканы, содержащие комбинацию связей C–H и C–C, обычно имеют связи, которые находятся в пределах нескольких градусов от этого идеализированного значения.

Алкан имеет только одинарные связи C–H и C–C. Первые возникают в результате перекрытия sp 3 -орбитали углерода с 1s -орбиталью водорода; последние возникают в результате перекрытия двух sp 3 -орбиталей соседних атомов углерода. Длины связей составляют 1,09 × 10 −10 м для связи C–H и 1,54 × 10 −10 м для связи C–C.
Пространственное расположение связей похоже на расположение четырех sp 3 орбиталей — они расположены тетраэдрически, с углом 109,47° между ними. Структурные формулы, представляющие связи как находящиеся под прямым углом друг к другу, хотя и являются общими и полезными, неточно описывают геометрию.


Пространственное расположение связей CC и CH описывается углами кручения молекулы, известными как ее конформация . В этане , простейшем случае для изучения конформации алканов, существует почти свободное вращение вокруг одинарной связи углерод-углерод. Важны две предельные конформации: заслоненная конформация и заторможенная конформация . Заторможенная конформация на 12,6 кДж/моль (3,0 ккал/моль) ниже по энергии (более стабильна), чем заторможенная конформация (наименее стабильная). В сильно разветвленных алканах угол связи может отличаться от оптимального значения (109,5°) для размещения объемных групп. Такие искажения вносят напряжение в молекулу, известное как стерическое препятствие или напряжение. Напряжение существенно увеличивает реакционную способность. [22]
Спектроскопические характеристики алканов можно получить с помощью основных методов характеризации. [23]
Мода растяжения CH дает сильное поглощение между 2850 и 2960 см −1 и более слабые полосы для моды растяжения CC поглощает между 800 и 1300 см −1 . Мода изгиба углерода-водорода зависит от природы группы: метильные группы показывают полосы при 1450 см −1 и 1375 см −1 , в то время как метиленовые группы показывают полосы при 1465 см −1 и 1450 см −1 . [24] Углеродные цепи с более чем четырьмя атомами углерода показывают слабое поглощение около 725 см −1 .
Протонные резонансы алканов обычно находятся при δ H = 0,5–1,5. Резонансы углерода-13 зависят от числа атомов водорода, присоединенных к углероду: δ C = 8–30 (первичный, метил, –CH 3 ), 15–55 (вторичный, метилен, –CH 2 –), 20–60 (третичный, метин, C–H) и четвертичный. Резонанс углерода-13 четвертичных атомов углерода характерно слаб из-за отсутствия ядерного эффекта Оверхаузера и длительного времени релаксации и может быть пропущен в слабых образцах или образцах, которые не были запущены в течение достаточно длительного времени.
Поскольку алканы имеют высокие энергии ионизации , их масс-спектры электронного удара показывают слабые токи для их молекулярных ионов. Картина фрагментации может быть трудной для интерпретации, но в случае алканов с разветвленной цепью углеродная цепь предпочтительно расщепляется на третичных или четвертичных атомах углерода из-за относительной стабильности образующихся свободных радикалов . Масс-спектры для алканов с прямой цепью иллюстрируются спектрами для додекана : фрагмент, полученный в результате потери одной метильной группы ( M − 15), отсутствует, фрагменты более интенсивны, чем молекулярный ион, и разнесены на интервалы в 14 единиц массы, что соответствует потере групп CH 2. [25]
Алканы слабо реагируют с большинством химических соединений. Они реагируют только с самыми сильными электрофильными реагентами благодаря своим сильным связям C–H (~100 ккал/моль) и связям C–C (~90 ккал/моль). Они также относительно неактивны по отношению к свободным радикалам. Эта инертность является источником термина парафины (в данном случае в значении «отсутствие сродства»). В сырой нефти молекулы алканов остаются химически неизменными в течение миллионов лет.
Значения константы диссоциации кислоты (p K a ) всех алканов оцениваются в диапазоне от 50 до 70, в зависимости от метода экстраполяции, поэтому они являются чрезвычайно слабыми кислотами, которые практически инертны к основаниям (см.: углеродные кислоты ). Они также являются чрезвычайно слабыми основаниями, не подвергаясь наблюдаемому протонированию в чистой серной кислоте ( H 0 ~ −12), хотя известно, что суперкислоты , которые по крайней мере в миллионы раз сильнее, протонируют их, давая гиперкоординированные ионы алкания (см.: ион метания ). Таким образом, смесь пентафторида сурьмы (SbF 5 ) и фторсульфоновой кислоты (HSO 3 F), называемая магической кислотой , может протонировать алканы. [26]
Все алканы реагируют с кислородом в реакции горения , хотя их становится все труднее воспламенить по мере увеличения числа атомов углерода. Общее уравнение полного сгорания:
При отсутствии достаточного количества кислорода может образоваться оксид углерода или даже сажа , как показано ниже:
Например, метан :
Подробные данные см . в таблице теплоты образования алканов . Стандартное изменение энтальпии сгорания , Δ c H ⊖ , для алканов увеличивается примерно на 650 кДж/моль на группу CH 2. Разветвленные алканы имеют более низкие значения Δ c H ⊖ , чем линейные алканы с тем же числом атомов углерода, и поэтому могут считаться несколько более стабильными.
Некоторые организмы способны метаболизировать алканы. [27] [28] Метанмонооксигеназы преобразуют метан в метанол . Для высших алканов цитохром P450 преобразует алканы в спирты, которые затем подвержены деградации.
Свободные радикалы , молекулы с неспаренными электронами, играют большую роль в большинстве реакций алканов. Реакции галогенирования свободных радикалов происходят с галогенами, что приводит к образованию галогеналканов . Атомы водорода алкана постепенно заменяются атомами галогена. Реакция алканов и фтора является высокоэкзотермической и может привести к взрыву. [29] Эти реакции являются важным промышленным путем к галогенированным углеводородам. Существует три этапа:
Эксперименты показали, что любое галогенирование дает смесь всех возможных изомеров, что указывает на то, что все атомы водорода восприимчивы к реакции. Полученная смесь, однако, не является статистической: вторичные и третичные атомы водорода предпочтительно заменяются из-за большей стабильности вторичных и третичных свободных радикалов. Пример можно увидеть в монобромировании пропана: [18]

В реакции Рида диоксид серы и хлор под действием света превращают углеводороды в сульфонилхлориды .
При некоторых условиях алканы подвергаются нитрации .
Определенные комплексы переходных металлов способствуют нерадикальным реакциям с алканами, что приводит к реакциям активации связи C–H . [30]
Крекинг разбивает более крупные молекулы на более мелкие. Эта реакция требует тепла и катализаторов. Процесс термического крекинга следует гомолитическому механизму с образованием свободных радикалов . Процесс каталитического крекинга включает присутствие кислотных катализаторов (обычно твердых кислот, таких как алюмосиликат и цеолиты ), которые способствуют гетеролитическому (асимметричному) разрыву связей, в результате чего образуются пары ионов противоположных зарядов, обычно карбокатион . Локализованные на углероде свободные радикалы и катионы являются крайне нестабильными и подвергаются процессам перегруппировки цепей, разрыву связи C–C в положении бета (т. е. крекингу) и внутри- и межмолекулярному переносу водорода или переносу гидрида . В обоих типах процессов соответствующие реакционноспособные промежуточные продукты (радикалы, ионы) постоянно регенерируются, и, таким образом, они протекают по самораспространяющемуся цепному механизму. Цепь реакций в конечном итоге завершается радикальной или ионной рекомбинацией. [ необходима цитата ]
Драган и его коллега были первыми, кто сообщил об изомеризации в алканах. [31] Изомеризация и реформация — это процессы, в которых алканы с прямой цепью нагреваются в присутствии платинового катализатора. При изомеризации алканы становятся изомерами с разветвленной цепью. Другими словами, они не теряют ни углерода, ни водорода, сохраняя ту же молекулярную массу. [31] При реформации алканы становятся циклоалканами или ароматическими углеводородами , выделяя водород в качестве побочного продукта. Оба эти процесса повышают октановое число вещества. Бутан является наиболее распространенным алканом, который подвергается процессу изомеризации, поскольку он производит много разветвленных алканов с высокими октановыми числами. [31]
При паровом риформинге алканы реагируют с паром в присутствии никелевого катализатора, образуя водород и оксид углерода.


Алканы составляют небольшую часть атмосфер внешних газовых планет, таких как Юпитер (0,1% метана, 2 ppm этана), Сатурн (0,2% метана, 5 ppm этана), Уран (1,99% метана, 2,5 ppm этана) и Нептун (1,5% метана, 1,5 ppm этана). Титан (1,6% метана), спутник Сатурна, был исследован зондом Гюйгенс , который показал, что атмосфера Титана периодически проливает жидкий метан на поверхность луны. [32] Также на Титане миссия Кассини сфотографировала сезонные метановые/этановые озера вблизи полярных областей Титана. Метан и этан также были обнаружены в хвосте кометы Хиякутаке . Химический анализ показал, что содержание этана и метана было примерно равным, что, как полагают, подразумевает, что его льды образовались в межзвездном пространстве, вдали от Солнца, которое могло испарить эти летучие молекулы. [33] Алканы также были обнаружены в метеоритах, таких как углеродистые хондриты .
Следы метана (около 0,0002% или 1745 частей на миллиард) присутствуют в атмосфере Земли и производятся в основном метаногенными микроорганизмами, такими как археи в кишечнике жвачных животных. [34]
Наиболее важными коммерческими источниками алканов являются природный газ и нефть . [18] Природный газ содержит в основном метан и этан, а также некоторое количество пропана и бутана : нефть представляет собой смесь жидких алканов и других углеводородов . Эти углеводороды образовались, когда морские животные и растения (зоопланктон и фитопланктон) погибли и опустились на дно древних морей и были покрыты осадками в бескислородной среде и преобразованы в течение многих миллионов лет при высоких температурах и высоком давлении в их нынешнюю форму. Природный газ получился, например, в результате следующей реакции:
Эти залежи углеводородов, собранные в пористых породах, запертых под непроницаемыми покрышками, составляют коммерческие нефтяные месторождения . Они формировались в течение миллионов лет и после истощения не могут быть легко заменены. Истощение этих запасов углеводородов является основой того, что известно как энергетический кризис .
Алканы имеют низкую растворимость в воде, поэтому их содержание в океанах незначительно; однако при высоких давлениях и низких температурах (например, на дне океанов) метан может сокристаллизоваться с водой, образуя твердый клатрат метана (гидрат метана). Хотя в настоящее время это не может быть использовано в коммерческих целях, количество горючей энергии известных месторождений клатрата метана превышает энергосодержание всех месторождений природного газа и нефти вместе взятых. Таким образом, метан, извлеченный из клатрата метана, является кандидатом на использование в качестве топлива будущего.

Помимо нефти и природного газа, алканы встречаются в природе в значительном количестве только в виде метана, который вырабатывается некоторыми археями в процессе метаногенеза . Эти организмы встречаются в кишечнике термитов [35] и коров. [36] Метан вырабатывается из углекислого газа или других органических соединений. Энергия выделяется при окислении водорода :
Вероятно, что наши нынешние месторождения природного газа образовались аналогичным образом. [37]
RCH2\sCH3}} (R = алкил )
Другой путь к алканам - гидрогенолиз , который подразумевает разрыв связей C-гетероатом с использованием водорода. В промышленности основными субстратами являются азоторганические и сероорганические примеси, т.е. гетероатомами являются N и S. Конкретные процессы называются гидроденитрификацией и гидродесульфуризацией :
Гидрогенолиз может быть применен для преобразования практически любой функциональной группы в углеводороды. Субстраты включают галогеналканы, спирты, альдегиды, кетоны, карбоновые кислоты и т. д. Как гидрогенолиз, так и гидрирование практикуются на нефтеперерабатывающих заводах. Их можно осуществить с помощью литийалюминийгидрида , восстановления Клемменсона и других специализированных путей.
Уголь является более традиционным предшественником алканов. Широкий спектр технологий интенсивно практиковался на протяжении столетий. [38] Простое нагревание угля дает алканы, оставляя после себя кокс . Соответствующие технологии включают процесс Бергиуса и сжижение угля . Частичное сжигание угля и связанных с ним твердых органических соединений генерирует оксид углерода , который можно гидрогенизировать с помощью процесса Фишера-Тропша . Эта технология позволяет синтезировать жидкие углеводороды, включая алканы. Этот метод используется для производства заменителей нефтяных дистиллятов .
Редко возникает интерес к синтезу алканов, поскольку они обычно коммерчески доступны и менее ценны, чем практически любой прекурсор. Наиболее известным методом является гидрирование алкенов . Многие связи CX могут быть преобразованы в связи CH с использованием литийалюминийгидрида , восстановления Клемменсона и других специализированных путей. [39] Гидролиз алкильных реагентов Гриньяра и алкиллитиевых соединений дает алканы. [40]
Преобладающее использование алканов — в качестве топлива. Пропан и бутан , легко сжижаемые газы, обычно известны как сжиженный нефтяной газ (СНГ). [41] От пентана до октана алканы являются высоколетучими жидкостями. Они используются в качестве топлива в двигателях внутреннего сгорания , поскольку они легко испаряются при попадании в камеру сгорания, не образуя капель, которые могли бы ухудшить равномерность сгорания. Разветвленные алканы предпочтительны, поскольку они гораздо менее склонны к преждевременному воспламенению, которое вызывает детонацию , чем их гомологи с прямой цепью. Эта склонность к преждевременному воспламенению измеряется октановым числом топлива, где 2,2,4-триметилпентан ( изооктан ) имеет произвольное значение 100, а гептан — ноль. Помимо их использования в качестве топлива, средние алканы также являются хорошими растворителями для неполярных веществ. Алканы от нонана до, например, гексадекана (алкан с шестнадцатью атомами углерода) являются жидкостями с более высокой вязкостью , все менее подходящими для использования в бензине. Вместо этого они образуют большую часть дизельного и авиационного топлива . Дизельное топливо характеризуется своим цетановым числом , цетан — старое название гексадекана. Однако более высокие температуры плавления этих алканов могут вызывать проблемы при низких температурах и в полярных регионах, где топливо становится слишком густым, чтобы правильно течь.
В процессе крекинга алканы могут быть преобразованы в алкены . Простые алкены являются предшественниками полимеров, таких как полиэтилен и полипропилен . Когда крекинг доведен до крайности, алканы могут быть преобразованы в сажу , которая является важным компонентом шин.
Хлорирование метана дает хлорметаны, которые используются в качестве растворителей и строительных блоков для сложных соединений. Аналогично обработка метана серой дает сероуглерод . Другие химикаты получаются путем реакции с триоксидом серы и оксидом азота .
Некоторые легкие углеводороды используются в качестве аэрозольных распылителей .
Алканы от гексадекана и выше образуют важнейшие компоненты мазута и смазочного масла . В последней функции они работают одновременно как антикоррозионные агенты, поскольку их гидрофобная природа означает, что вода не может достичь поверхности металла. Многие твердые алканы находят применение в качестве парафинового воска , например, в свечах . Однако его не следует путать с истинным воском , который состоит в основном из эфиров .
Алканы с длиной цепи около 35 или более атомов углерода встречаются в битуме , используемом, например, в дорожном покрытии. Однако высшие алканы имеют небольшую ценность и обычно расщепляются на низшие алканы путем крекинга .
Алканы легко воспламеняются, но обладают низкой токсичностью. Метан «токсикологически практически инертен». Алканы могут быть удушающими и наркотическими. [38]