Алюминий (или алюминий в североамериканском английском ) — химический элемент ; он имеет символ Al и атомный номер 13. Плотность алюминия ниже, чем у других распространенных металлов , примерно на треть меньше, чем у стали . Он имеет большое сродство к кислороду , образуя защитный слой оксида на поверхности при контакте с воздухом. Алюминий визуально напоминает серебро , как по цвету, так и по своей большой способности отражать свет. Он мягкий, немагнитный и пластичный . Он имеет один стабильный изотоп, 27 Al , который очень распространен, что делает алюминий двенадцатым по распространенности элементом во Вселенной. Радиоактивность 26 Al , более нестабильного изотопа, приводит к тому, что его используют в радиометрическом датировании .
Химически алюминий является постпереходным металлом в группе бора ; как это обычно бывает в этой группе, алюминий образует соединения в основном в степени окисления +3. Катион алюминия Al3 + мал и сильно заряжен ; как таковой, он обладает большей поляризующей способностью , а связи, образованные алюминием, имеют более ковалентный характер. Сильное сродство алюминия к кислороду приводит к частому появлению его оксидов в природе. Алюминий встречается на Земле в основном в породах в земной коре , где он является третьим по распространенности элементом после кислорода и кремния , а не в мантии , и практически никогда не встречается в виде свободного металла . Его добывают в промышленных масштабах путем добычи бокситов , осадочной породы, богатой алюминиевыми минералами.
Открытие алюминия было объявлено в 1825 году датским физиком Гансом Христианом Эрстедом . Первое промышленное производство алюминия было начато французским химиком Анри Этьеном Сент-Клером Девилем в 1856 году. Алюминий стал гораздо более доступным для общественности с процессом Холла-Эру, разработанным независимо французским инженером Полем Эру и американским инженером Чарльзом Мартином Холлом в 1886 году, и массовое производство алюминия привело к его широкому использованию в промышленности и повседневной жизни. Во время Первой и Второй мировых войн алюминий был важнейшим стратегическим ресурсом для авиации . В 1954 году алюминий стал самым производимым цветным металлом , превзойдя медь . В 21 веке большая часть алюминия потреблялась в транспорте, машиностроении, строительстве и упаковке в Соединенных Штатах, Западной Европе и Японии.
Несмотря на распространенность в окружающей среде, ни один живой организм не метаболизирует соли алюминия , но этот алюминий хорошо переносится растениями и животными. Из-за обилия этих солей потенциал их биологической роли представляет интерес, и исследования продолжаются.
Из изотопов алюминия только27
Эл
стабилен. Такая ситуация характерна для элементов с нечетным атомным числом. [b] Это единственный первичный изотоп алюминия, т. е. единственный, который существовал на Земле в его нынешнем виде с момента образования планеты. Поэтому он является мононуклидным элементом , и его стандартный атомный вес практически такой же, как у изотопа. Это делает алюминий очень полезным в ядерном магнитном резонансе (ЯМР), поскольку его единственный стабильный изотоп имеет высокую чувствительность ЯМР. [14] Стандартный атомный вес алюминия низок по сравнению со многими другими металлами. [c]
Все остальные изотопы алюминия радиоактивны . Самым стабильным из них является 26 Al : хотя он присутствовал вместе со стабильным 27 Al в межзвездной среде, из которой образовалась Солнечная система, будучи также произведенным звездным нуклеосинтезом , его период полураспада составляет всего 717 000 лет, и поэтому обнаруживаемое количество не сохранилось с момента образования планеты. [15] Однако мельчайшие следы 26 Al производятся из аргона в атмосфере путем расщепления, вызванного протонами космических лучей . Соотношение 26 Al к 10 Be использовалось для радиодатирования геологических процессов в масштабах времени от 10 5 до 10 6 лет, в частности, переноса, осаждения, хранения осадков , времени захоронения и эрозии. [16] Большинство ученых, изучающих метеориты, полагают, что энергия, высвобождаемая при распаде 26 Al, была ответственна за плавление и дифференциацию некоторых астероидов после их образования 4,55 миллиарда лет назад. [17]
Оставшиеся изотопы алюминия с массовыми числами от 21 до 43 имеют период полураспада менее часа. Известно три метастабильных состояния, все с периодом полураспада менее минуты. [13]
Атом алюминия имеет 13 электронов, расположенных в электронной конфигурации [ Ne ] 3s 2 3p 1 , [18] с тремя электронами за пределами стабильной конфигурации благородного газа. Соответственно, объединенные первые три энергии ионизации алюминия намного ниже, чем четвертая энергия ионизации в одиночку. [19] Такая электронная конфигурация разделяется с другими хорошо охарактеризованными членами его группы, бором , галлием , индием и таллием ; это также ожидается для нихония . Алюминий может отдавать свои три внешних электрона во многих химических реакциях (см. ниже). Электроотрицательность алюминия составляет 1,61 (шкала Полинга). [20]

Свободный атом алюминия имеет радиус 143 пм . [21] При удалении трех внешних электронов радиус уменьшается до 39 пм для 4-координированного атома или до 53,5 пм для 6-координированного атома. [21] При стандартной температуре и давлении атомы алюминия (когда на них не воздействуют атомы других элементов) образуют гранецентрированную кубическую кристаллическую систему, связанную металлической связью, обеспечиваемой внешними электронами атомов; следовательно, алюминий (при этих условиях) является металлом. [22] Эта кристаллическая система является общей для многих других металлов, таких как свинец и медь ; размер элементарной ячейки алюминия сопоставим с таковым у этих других металлов. [22] Однако эта система не является общей для других членов ее группы: у бора энергия ионизации слишком высока, чтобы допустить металлизацию, у таллия гексагональная плотноупакованная структура, а у галлия и индия необычные структуры, которые не являются плотноупакованными, как у алюминия и таллия. Небольшое количество электронов, доступных для металлической связи в алюминии, вероятно, является причиной его мягкости, низкой температуры плавления и низкого электрического сопротивления . [23]
Алюминиевый металл имеет внешний вид от серебристо-белого до тускло-серого в зависимости от шероховатости поверхности . [d] Алюминиевые зеркала являются наиболее отражающими из всех металлических зеркал для ближнего ультрафиолетового и дальнего инфракрасного света. Он также является одним из наиболее отражающих для света в видимом спектре, почти наравне с серебром в этом отношении, и поэтому они выглядят похожими. Алюминий также хорошо отражает солнечное излучение , хотя длительное воздействие солнечного света на воздухе увеличивает износ поверхности металла; этого можно избежать, если алюминий анодировать , что добавляет защитный слой оксида на поверхность.
Плотность алюминия составляет 2,70 г/см3 , что составляет около 1/3 плотности стали, что намного ниже, чем у других часто встречающихся металлов, что делает алюминиевые детали легко идентифицируемыми по их легкости. [26] Низкая плотность алюминия по сравнению с большинством других металлов возникает из-за того, что его ядра намного легче, в то время как разница в размере элементарной ячейки не компенсирует эту разницу. Единственными более легкими металлами являются металлы групп 1 и 2 , которые, за исключением бериллия и магния, слишком реакционноспособны для структурного использования (а бериллий очень токсичен). [27] Алюминий не такой прочный или жесткий, как сталь, но низкая плотность компенсирует это в аэрокосмической промышленности и во многих других областях, где решающее значение имеют малый вес и относительно высокая прочность. [28]
Чистый алюминий довольно мягкий и непрочный. В большинстве случаев вместо него используются различные алюминиевые сплавы из-за их более высокой прочности и твердости. [29] Предел текучести чистого алюминия составляет 7–11 МПа , в то время как алюминиевые сплавы имеют предел текучести в диапазоне от 200 МПа до 600 МПа. [30] Алюминий пластичен , с процентным удлинением 50–70%, [31] и ковок, что позволяет легко его вытягивать и экструдировать . [32] Он также легко обрабатывается и отливается . [32]
Алюминий является прекрасным тепловым и электрическим проводником , имея около 60% проводимости меди , как тепловой, так и электрической, при этом имея только 30% плотности меди. [33] Алюминий способен к сверхпроводимости , с критической температурой сверхпроводимости 1,2 Кельвина и критическим магнитным полем около 100 Гаусс (10 миллитесла ). [34] Он парамагнитен и, таким образом, по существу не подвержен влиянию статических магнитных полей. [35] Однако высокая электропроводность означает, что на него сильно влияют переменные магнитные поля через индукцию вихревых токов . [36]
Алюминий сочетает в себе характеристики до- и постпереходных металлов. Поскольку у него мало доступных электронов для металлической связи, как и у его более тяжелых сородичей группы 13 , он обладает характерными физическими свойствами постпереходного металла с более длинными, чем ожидалось, межатомными расстояниями. [23] Кроме того, поскольку Al 3+ является небольшим и высокозаряженным катионом, он сильно поляризуется, а связывание в алюминиевых соединениях имеет тенденцию к ковалентности ; [37] это поведение похоже на поведение бериллия (Be 2+ ), и оба демонстрируют пример диагональной связи . [38]
Базовое ядро под валентной оболочкой алюминия - это ядро предшествующего благородного газа , тогда как ядра его более тяжелых сородичей галлия , индия , таллия и нихония также включают заполненную d-подоболочку и в некоторых случаях заполненную f-подоболочку. Следовательно, внутренние электроны алюминия почти полностью экранируют валентные электроны, в отличие от электронов более тяжелых сородичей алюминия. Таким образом, алюминий является самым электроположительным металлом в своей группе, а его гидроксид фактически более основной, чем у галлия. [37] [e] Алюминий также имеет небольшое сходство с металлоидом бором в той же группе: соединения AlX 3 являются валентно изоэлектронными соединениям BX 3 (они имеют одинаковую валентную электронную структуру), и оба ведут себя как кислоты Льюиса и легко образуют аддукты . [39] Кроме того, одним из основных мотивов химии бора являются регулярные икосаэдрические структуры, а алюминий образует важную часть многих икосаэдрических квазикристаллических сплавов, включая класс Al–Zn–Mg. [40]
Алюминий имеет высокое химическое сродство к кислороду, что делает его пригодным для использования в качестве восстановителя в термитной реакции. Мелкий порошок алюминия реагирует взрывчато при контакте с жидким кислородом ; однако в нормальных условиях алюминий образует тонкий оксидный слой (~5 нм при комнатной температуре) [41] , который защищает металл от дальнейшей коррозии кислородом, водой или разбавленной кислотой, процесс, называемый пассивацией . [37] [42] Благодаря своей общей устойчивости к коррозии алюминий является одним из немногих металлов, который сохраняет серебристое отражение в тонкоизмельченной форме, что делает его важным компонентом серебристых красок. [43] Алюминий не подвергается воздействию окисляющих кислот из-за своей пассивации. Это позволяет использовать алюминий для хранения реагентов, таких как азотная кислота , концентрированная серная кислота и некоторые органические кислоты. [44]
В горячей концентрированной соляной кислоте алюминий реагирует с водой с выделением водорода, а в водном растворе гидроксида натрия или гидроксида калия при комнатной температуре — с образованием алюминатов — защитная пассивация в этих условиях незначительна. [45] Царская водка также растворяет алюминий. [44] Алюминий подвергается коррозии под действием растворенных хлоридов , таких как обычный хлорид натрия , поэтому бытовая сантехника никогда не изготавливается из алюминия. [45] Оксидный слой на алюминии также разрушается при контакте с ртутью из-за амальгамирования или с солями некоторых электроположительных металлов. [37] Таким образом, самые прочные алюминиевые сплавы менее устойчивы к коррозии из-за гальванических реакций с легированной медью , [30] а коррозионная стойкость алюминия значительно снижается водными солями, особенно в присутствии разнородных металлов. [23]
Алюминий реагирует с большинством неметаллов при нагревании, образуя такие соединения, как нитрид алюминия (AlN), сульфид алюминия (Al 2 S 3 ) и галогениды алюминия (AlX 3 ). Он также образует широкий спектр интерметаллических соединений , включающих металлы из каждой группы периодической таблицы. [37]
Подавляющее большинство соединений, включая все содержащие алюминий минералы и все коммерчески значимые алюминиевые соединения, содержат алюминий в степени окисления 3+. Координационное число таких соединений варьируется, но обычно Al 3+ является либо шести-, либо четырехкоординированным. Почти все соединения алюминия(III) бесцветны. [37]
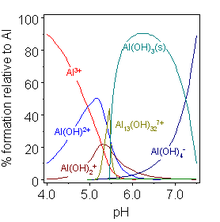
В водном растворе Al 3+ существует в виде гексааквакатиона [Al(H 2 O) 6 ] 3+ , который имеет приблизительную K a 10 −5 . [14] Такие растворы являются кислыми, поскольку этот катион может действовать как донор протонов и постепенно гидролизоваться до тех пор, пока не образуется осадок гидроксида алюминия , Al(OH) 3 . Это полезно для осветления воды, поскольку осадок зарождается на взвешенных частицах в воде, тем самым удаляя их. Еще большее увеличение pH приводит к тому, что гидроксид снова растворяется, образуя алюминат , [Al(H 2 O) 2 (OH) 4 ] − .
Гидроксид алюминия образует как соли, так и алюминаты и растворяется в кислоте и щелочи, а также при сплавлении с кислотными и основными оксидами. [37] Такое поведение Al(OH) 3 называется амфотерностью и характерно для слабоосновных катионов, которые образуют нерастворимые гидроксиды и чьи гидратированные виды также могут отдавать свои протоны. Одним из эффектов этого является то, что соли алюминия со слабыми кислотами гидролизуются в воде до водного гидроксида и соответствующего неметаллического гидрида: например, сульфид алюминия дает сероводород . Однако некоторые соли, такие как карбонат алюминия, существуют в водном растворе, но как таковые нестабильны; и для солей с сильными кислотами, таких как галогениды, нитрат и сульфат , происходит только неполный гидролиз. По аналогичным причинам безводные соли алюминия не могут быть получены путем нагревания их «гидратов»: гидратированный хлорид алюминия на самом деле представляет собой не AlCl 3 ·6H 2 O, а [Al(H 2 O) 6 ]Cl 3 , и связи Al–O настолько прочны, что нагревания недостаточно для их разрыва и образования вместо этого связей Al–Cl: [37]
Все четыре тригалогенида хорошо известны. В отличие от структур трех более тяжелых тригалогенидов, фторид алюминия (AlF 3 ) имеет шестикоординированный алюминий, что объясняет его нелетучесть и нерастворимость, а также высокую теплоту образования . Каждый атом алюминия окружен шестью атомами фтора в искаженном октаэдрическом расположении, причем каждый атом фтора распределен между углами двух октаэдров. Такие единицы {AlF 6 } также существуют в сложных фторидах, таких как криолит , Na 3 AlF 6 . [f] AlF 3 плавится при 1290 °C (2354 °F) и получается в результате реакции оксида алюминия с фтористым водородом при 700 °C (1300 °F). [47]
У более тяжелых галогенидов координационные числа ниже. Другие тригалогениды являются димерными или полимерными с тетраэдрическими четырехкоординированными алюминиевыми центрами. [g] Трихлорид алюминия (AlCl 3 ) имеет слоистую полимерную структуру ниже своей точки плавления 192,4 °C (378 °F), но при плавлении превращается в димеры Al 2 Cl 6 . При более высоких температурах они все больше диссоциируют на тригональные плоские мономеры AlCl 3 , подобные структуре BCl 3 . Трибромид алюминия и трииодид алюминия образуют димеры Al 2 X 6 во всех трех фазах и, следовательно, не показывают столь значительных изменений свойств при фазовом переходе. [47] Эти материалы получают путем обработки алюминия галогеном. Тригалогениды алюминия образуют множество аддитивных соединений или комплексов; их льюисовская кислотная природа делает их полезными в качестве катализаторов для реакций Фриделя-Крафтса . Трихлорид алюминия имеет основные промышленные применения, связанные с этой реакцией, например, в производстве антрахинонов и стирола ; он также часто используется в качестве предшественника многих других соединений алюминия и в качестве реагента для преобразования фторидов неметаллов в соответствующие хлориды ( реакция трансгалогенирования ). [47]
Алюминий образует один стабильный оксид с химической формулой Al2O3 , обычно называемый глиноземом . [48] В природе его можно найти в минерале корунде , α-глиноземе; [ 49] также существует фаза γ-глинозема. [14] Его кристаллическая форма, корунд , очень твердая ( твердость по Моосу 9), имеет высокую температуру плавления 2045 °C (3713 °F), имеет очень низкую летучесть, химически инертна и является хорошим электроизолятором, ее часто используют в абразивах (например, зубной пасте), в качестве огнеупорного материала и в керамике , а также в качестве исходного материала для электролитического производства алюминия. Сапфир и рубин представляют собой нечистый корунд, загрязненный следовыми количествами других металлов. [14] Два основных оксида-гидроксида, AlO(OH), — это бёмит и диаспор . Существует три основных тригидроксида: байерит , гиббсит и нордстрандит, которые различаются по своей кристаллической структуре ( полиморфы ). Известно также множество других промежуточных и родственных структур. [14] Большинство из них производятся из руд различными влажными процессами с использованием кислоты и основания. Нагревание гидроксидов приводит к образованию корунда. Эти материалы имеют центральное значение для производства алюминия и сами по себе чрезвычайно полезны. Некоторые смешанные оксидные фазы также очень полезны, такие как шпинель (MgAl 2 O 4 ), Na-β-глинозем (NaAl 11 O 17 ) и трикальцийалюминат (Ca 3 Al 2 O 6 , важная минеральная фаза в портландцементе ). [14]
Единственными стабильными халькогенидами при нормальных условиях являются сульфид алюминия (Al 2 S 3 ), селенид (Al 2 Se 3 ) и теллурид (Al 2 Te 3 ). Все три получаются путем прямой реакции их элементов при температуре около 1000 °C (1800 °F) и быстро полностью гидролизуются в воде с образованием гидроксида алюминия и соответствующего халькогенида водорода . Поскольку алюминий является небольшим атомом по сравнению с этими халькогенами, они имеют четырехкоординированный тетраэдрический алюминий с различными полиморфами, имеющими структуры, связанные с вюрцитом , причем две трети возможных позиций металла заняты либо упорядоченным (α), либо случайным (β) образом; сульфид также имеет γ-форму, связанную с γ-оксидом алюминия, и необычную высокотемпературную гексагональную форму, где половина атомов алюминия имеет тетраэдрическую четырехкоординацию, а другая половина имеет тригональную бипирамидальную пятикоординацию. [50]
Известны четыре пниктида : нитрид алюминия (AlN), фосфид алюминия (AlP), арсенид алюминия (AlAs) и антимонид алюминия (AlSb). Все они являются полупроводниками III-V, изоэлектронными кремнию и германию , все из которых, кроме AlN, имеют структуру цинковой обманки . Все четыре могут быть получены прямой реакцией их компонентов при высокой температуре (и, возможно, при высоком давлении). [50]
Алюминиевые сплавы хорошо сочетаются с большинством других металлов (за исключением большинства щелочных металлов и металлов группы 13) и известны более 150 интерметаллических соединений с другими металлами. Приготовление включает нагревание фиксированных металлов вместе в определенной пропорции с последующим постепенным охлаждением и отжигом . Связь в них преимущественно металлическая , а кристаллическая структура в первую очередь зависит от эффективности упаковки. [51]
Существует несколько соединений с более низкими степенями окисления. Существует несколько соединений алюминия(I) : AlF, AlCl, AlBr и AlI существуют в газовой фазе, когда соответствующий тригалогенид нагревается с алюминием, и при криогенных температурах. [47] Стабильным производным моноиодида алюминия является циклический аддукт, образованный с триэтиламином , Al4I4 ( NEt3 ) 4 . Al2O и Al2S также существуют, но они очень нестабильны. [52] Очень простые соединения алюминия(II) вызываются или наблюдаются в реакциях металлического Al с окислителями. Например, монооксид алюминия, AlO, был обнаружен в газовой фазе после взрыва [53] и в спектрах поглощения звезд. [54] Более тщательно исследованы соединения формулы R4Al2 , которые содержат связь Al – Al и где R представляет собой большой органический лиганд . [55]
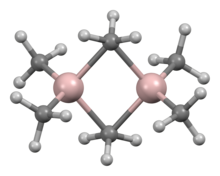
Существует множество соединений эмпирической формулы AlR 3 и AlR 1,5 Cl 1,5 . [56] Триалкилы и триарилы алюминия являются реакционноспособными, летучими и бесцветными жидкостями или легкоплавкими твердыми веществами. Они самопроизвольно воспламеняются на воздухе и реагируют с водой, что требует мер предосторожности при обращении с ними. Они часто образуют димеры, в отличие от своих аналогов бора, но эта тенденция уменьшается для алкилов с разветвленной цепью (например, Pr i , Bu i , Me 3 CCH 2 ); например, триизобутилалюминий существует в виде равновесной смеси мономера и димера. [57] [58] Эти димеры, такие как триметилалюминий (Al 2 Me 6 ), обычно имеют тетраэдрические центры Al, образованные димеризацией с некоторой алкильной группой, соединяющей оба атома алюминия. Они являются жесткими кислотами и легко реагируют с лигандами, образуя аддукты. В промышленности они в основном используются в реакциях внедрения алкенов, как открыл Карл Циглер , и, что наиболее важно, в «реакциях роста», которые образуют длинноцепочечные неразветвленные первичные алкены и спирты, а также в полимеризации этилена и пропена при низком давлении . Существуют также некоторые гетероциклические и кластерные алюминийорганические соединения, включающие связи Al–N. [57]
Наиболее важным в промышленном отношении гидридом алюминия является алюмогидрид лития (LiAlH 4 ), который используется в качестве восстановителя в органической химии . Его можно получить из гидрида лития и трихлорида алюминия . [59] Самый простой гидрид, гидрид алюминия или алан, не так важен. Это полимер с формулой (AlH 3 ) n , в отличие от соответствующего гидрида бора , который является димером с формулой (BH 3 ) 2 . [59]
Содержание алюминия в расчете на одну частицу в Солнечной системе составляет 3,15 ppm (частей на миллион). [60] [h] Это двенадцатый по распространенности из всех элементов и третий по распространенности среди элементов с нечетными атомными числами после водорода и азота. [60] Единственный стабильный изотоп алюминия, 27 Al, является восемнадцатым по распространенности ядром во Вселенной. Он создается почти полностью после слияния углерода в массивных звездах, которые позже станут сверхновыми типа II : это слияние создает 26 Mg, который после захвата свободных протонов и нейтронов становится алюминием. Некоторые меньшие количества 27 Al создаются в оболочках проэволюционировавших звезд, где 26 Mg может захватывать свободные протоны. [61] По сути, весь существующий сейчас алюминий — это 27 Al. 26 Al присутствовал в ранней Солнечной системе с обилием 0,005% относительно 27 Al, но его период полураспада 728 000 лет слишком короток для того, чтобы какие-либо исходные ядра выжили; поэтому 26 Al вымер . [61] В отличие от 27 Al, основным источником 26 Al является горение водорода, при этом нуклид появляется после того, как ядро 25 Mg захватывает свободный протон. Однако следовые количества 26 Al, которые существуют, являются наиболее распространенным излучателем гамма-лучей в межзвездном газе ; [61] если бы исходный 26 Al все еще присутствовал, карты гамма-лучей Млечного Пути были бы ярче. [61]

В целом, Земля содержит около 1,59% алюминия по массе (седьмое место по распространенности по массе). [62] Алюминий встречается в большей пропорции в земной коре, чем во вселенной в целом. Это связано с тем, что алюминий легко образует оксид, связывается с горными породами и остается в земной коре , в то время как менее реактивные металлы опускаются в ядро. [61] В земной коре алюминий является наиболее распространенным металлическим элементом (8,23% по массе [31] ) и третьим по распространенности из всех элементов (после кислорода и кремния). [63] Большое количество силикатов в земной коре содержит алюминий. [64] Напротив, мантия Земли содержит всего 2,38% алюминия по массе. [65] Алюминий также встречается в морской воде в концентрации 2 мкг/кг. [31]
Из-за своего сильного сродства к кислороду алюминий почти никогда не встречается в элементарном состоянии; вместо этого он находится в оксидах или силикатах. Полевые шпаты , наиболее распространенная группа минералов в земной коре, являются алюмосиликатами. Алюминий также встречается в минералах берилл , криолит , гранат , шпинель и бирюза . [66] Примеси в Al 2 O 3 , такие как хром и железо , дают драгоценные камни рубин и сапфир соответственно. [67] Самородный металлический алюминий чрезвычайно редок и может быть найден только в качестве второстепенной фазы в средах с низкой летучестью кислорода , таких как внутренние части некоторых вулканов. [68] Самородный алюминий был обнаружен в холодных просачиваниях на северо-восточном континентальном склоне Южно -Китайского моря . Возможно, что эти отложения возникли в результате бактериального восстановления тетрагидроксоалюмината Al(OH) 4 − . [69]
Хотя алюминий является обычным и широко распространенным элементом, не все алюминиевые минералы являются экономически выгодными источниками металла. Почти весь металлический алюминий производится из руды бокситов (AlO x (OH) 3–2 x ). Бокситы встречаются как продукт выветривания низкожелезистых и кремнистых пород в тропических климатических условиях. [70] В 2017 году большая часть бокситов добывалась в Австралии, Китае, Гвинее и Индии. [71]

История алюминия была сформирована использованием квасцов . Первое письменное упоминание о квасцах, сделанное греческим историком Геродотом , датируется V веком до н. э. [72] Известно, что древние использовали квасцы в качестве протравы для окрашивания и для защиты городов. [72] После крестовых походов квасцы, незаменимый товар в европейской текстильной промышленности, [73] стали предметом международной торговли; [74] они импортировались в Европу из восточного Средиземноморья до середины XV века. [75]
Природа квасцов оставалась неизвестной. Около 1530 года швейцарский врач Парацельс предположил, что квасцы являются солью земли квасцов. [76] В 1595 году немецкий врач и химик Андреас Либавиус экспериментально подтвердил это. [77] В 1722 году немецкий химик Фридрих Гофман объявил о своей вере в то, что основой квасцов является отдельная земля. [78] В 1754 году немецкий химик Андреас Сигизмунд Маргграф синтезировал глинозем путем кипячения глины в серной кислоте и последующего добавления поташа . [78]
Попытки получить алюминий датируются 1760 годом. [79] Однако первая успешная попытка была завершена в 1824 году датским физиком и химиком Гансом Христианом Эрстедом . Он прореагировал безводный хлорид алюминия с амальгамой калия , получив кусок металла, похожий на олово. [80] [81] [82] Он представил свои результаты и продемонстрировал образец нового металла в 1825 году. [83] [84] В 1827 году немецкий химик Фридрих Вёлер повторил эксперименты Эрстеда, но не идентифицировал никакого алюминия. [85] (Причина этого несоответствия была обнаружена только в 1921 году.) [86] Он провел аналогичный эксперимент в том же году, смешав безводный хлорид алюминия с калием и получив порошок алюминия. [82] В 1845 году он смог получить небольшие кусочки металла и описал некоторые физические свойства этого металла. [86] В течение многих лет после этого Вёлер считался первооткрывателем алюминия. [87]

Поскольку метод Вёлера не позволял получать большое количество алюминия, металл оставался редким; его стоимость превышала стоимость золота. [85] Первое промышленное производство алюминия было налажено в 1856 году французским химиком Анри Этьеном Сент-Клером Девилем и его товарищами. [88] Девиль обнаружил, что трихлорид алюминия можно восстановить натрием, что было удобнее и дешевле калия, который использовал Вёлер. [89] Даже тогда алюминий все еще не был очень чистым, и полученный алюминий отличался по свойствам в зависимости от образца. [90] Благодаря своей электропроводящей способности алюминий использовался в качестве колпака Монумента Вашингтона , построенного в 1885 году. Это было самое высокое здание в мире на тот момент, и некорродирующий металлический колпак должен был служить пиком громоотвода .
Первый промышленный крупномасштабный метод производства был независимо разработан в 1886 году французским инженером Полем Эру и американским инженером Чарльзом Мартином Холлом ; теперь он известен как процесс Холла–Эру . [91] Процесс Холла–Эру превращает глинозем в металл. Австрийский химик Карл Йозеф Байер открыл способ очистки бокситов для получения глинозема, теперь известный как процесс Байера , в 1889 году . [92] Современное производство алюминия основано на процессах Байера и Холла–Эру. [93]
Поскольку крупномасштабное производство привело к падению цен на алюминий, металл стал широко использоваться в ювелирных изделиях, оправах для очков, оптических приборах, столовых приборах, фольге и других повседневных предметах в 1890-х и начале 20-го века. Способность алюминия образовывать твердые, но легкие сплавы с другими металлами обеспечила металлу множество применений в то время. [94] Во время Первой мировой войны правительства крупных стран требовали больших партий алюминия для легких прочных планеров самолетов; [95] во время Второй мировой войны спрос со стороны правительств крупных стран на авиацию был еще выше. [96] [97] [98]
К середине 20-го века алюминий стал частью повседневной жизни и неотъемлемым компонентом предметов домашнего обихода. [99] В 1954 году производство алюминия превзошло производство меди , [i] исторически второе по производству после железа, [102] что сделало его самым производимым цветным металлом . В середине 20-го века алюминий появился как материал гражданского строительства, с применением как в основных строительных работах, так и в отделочных работах, [103] и все чаще используется в военной технике, как для самолетов, так и для двигателей наземной бронетехники. [104] Первый искусственный спутник Земли , запущенный в 1957 году, состоял из двух отдельных алюминиевых полусфер, соединенных, и все последующие космические аппараты в той или иной степени использовали алюминий. [93] Алюминиевая банка была изобретена в 1956 году и использовалась в качестве хранилища для напитков в 1958 году. [105]
На протяжении всего XX века производство алюминия стремительно росло: в то время как мировое производство алюминия в 1900 году составляло 6800 метрических тонн, годовое производство впервые превысило 100 000 метрических тонн в 1916 году; 1 000 000 тонн в 1941 году; 10 000 000 тонн в 1971 году. [100] В 1970-х годах возросший спрос на алюминий сделал его биржевым товаром; в 1978 году он поступил на Лондонскую биржу металлов , старейшую промышленную биржу металлов в мире. [93] Производство продолжало расти: в 2013 году годовое производство алюминия превысило 50 000 000 метрических тонн. [100]
Реальная цена на алюминий снизилась с 14 000 долларов за метрическую тонну в 1900 году до 2 340 долларов в 1948 году (в долларах США 1998 года). [100] Расходы на добычу и переработку были снижены за счет технического прогресса и масштаба экономики. Однако необходимость разработки месторождений более низкого качества и использование быстро растущих затрат на вводимые ресурсы (прежде всего, энергии) увеличили себестоимость алюминия; [106] реальная цена начала расти в 1970-х годах с ростом стоимости энергии. [107] Производство переместилось из промышленно развитых стран в страны, где производство было дешевле. [108] Расходы на производство в конце 20-го века изменились из-за достижений в области технологий, более низких цен на энергию, обменного курса доллара США и цен на глинозем. [109] Совокупная доля стран БРИК в первичном производстве и первичном потреблении существенно выросла в первое десятилетие 21-го века. [110] Китай аккумулирует особенно большую долю мирового производства благодаря обилию ресурсов, дешевой энергии и правительственным стимулам; [111] он также увеличил свою долю потребления с 2% в 1972 году до 40% в 2010 году. [112] В Соединенных Штатах, Западной Европе и Японии большая часть алюминия потреблялась в транспорте, машиностроении, строительстве и упаковке. [113] В 2021 году цены на промышленные металлы, такие как алюминий, взлетели до почти рекордных уровней, поскольку дефицит энергии в Китае приводит к росту расходов на электроэнергию. [114]
Названия алюминий и алюминий происходят от слова alumine , устаревшего термина для alumina , [j] первичного природного оксида алюминия . [116] Alumine был заимствован из французского языка, который, в свою очередь, получил его от alumen , классического латинского названия alum , минерала, из которого он был получен. [117] Латинское слово alumen происходит от протоиндоевропейского корня *alu-, что означает «горький» или «пиво». [118]

Британский химик Гемфри Дэви , который провел ряд экспериментов, направленных на выделение металла, считается человеком, который дал название элементу. Первым названием, предложенным для металла, который должен был быть выделен из квасцов, было alumium , которое Дэви предложил в статье 1808 года о своих электрохимических исследованиях, опубликованной в Philosophical Transactions of the Royal Society . [119] Оказалось, что название было создано из английского слова alum и латинского суффикса -ium ; но тогда было принято давать элементам названия, происходящие от латинского языка, поэтому это название не было принято повсеместно. Это название критиковалось современными химиками из Франции, Германии и Швеции, которые настаивали на том, что металл должен быть назван в честь оксида, alumina, из которого он будет выделен. [120] Английское название alum не происходит напрямую от латыни, тогда как alumine / alumina, очевидно , происходит от латинского слова alumen (при склонении alumen изменяется на alumin- ).
Одним из примеров является Essai sur la Nomenclature chimique (июль 1811 г.), написанная на французском языке шведским химиком Йенсом Якобом Берцелиусом , в которой название алюминий дано элементу, который будет синтезирован из квасцов. [121] [k] (Другая статья в том же номере журнала также ссылается на металл, оксид которого является основой сапфира , т. е. того же металла, что и алюминий .) [123] В январе 1811 г. в резюме одной из лекций Дэви в Королевском обществе упоминалось название алюминий как возможное. [124] В следующем году Дэви опубликовал учебник по химии, в котором использовал написание алюминий . [125] С тех пор оба написания сосуществуют. В настоящее время их использование является региональным: алюминий доминирует в Соединенных Штатах и Канаде; алюминий распространен в остальной части англоязычного мира. [126]
В 1812 году британский ученый Томас Янг [127] написал анонимный обзор книги Дэви, в котором предложил название Aluminum вместо Aluminum , которое, по его мнению, имело «менее классическое звучание». [128] Это название сохранилось: хотя написание -um иногда использовалось в Британии, американский научный язык использовал -ium с самого начала. [129] Большинство ученых во всем мире использовали -ium в 19 веке; [126] и оно укрепилось в нескольких других европейских языках, таких как французский , немецкий и голландский . [l] В 1828 году американский лексикограф Ноа Вебстер ввел только написание Aluminum в свой Американский словарь английского языка . [130] В 1830-х годах написание -um стало использоваться в Соединенных Штатах; к 1860-м годам оно стало более распространенным написанием там за пределами науки. [129] В 1892 году Холл использовал написание -um в своей рекламной листовке для своего нового электролитического метода получения металла, несмотря на то, что он постоянно использовал написание -ium во всех патентах, которые он подал между 1886 и 1903 годами. Неизвестно, было ли это написание введено по ошибке или намеренно, но Холл предпочитал алюминий с момента его введения, потому что он напоминал платину , название престижного металла. [131] К 1890 году оба написания были распространены в Соединенных Штатах, написание -ium было немного более распространено; к 1895 году ситуация изменилась; к 1900 году алюминий стал в два раза более распространенным, чем алюминий ; в следующем десятилетии написание -um доминировало в американском употреблении. В 1925 году Американское химическое общество приняло это написание. [126]
Международный союз теоретической и прикладной химии (ИЮПАК) принял алюминий в качестве стандартного международного названия элемента в 1990 году. [132] В 1993 году они признали алюминий приемлемым вариантом; [132] последнее издание номенклатуры ИЮПАК по неорганической химии 2005 года также признает это написание. [133] Официальные публикации ИЮПАК используют написание -ium в качестве основного, и они перечисляют оба, где это уместно. [m]
Производство алюминия начинается с добычи бокситовой породы из земли. Боксит обрабатывается и преобразуется с помощью процесса Байера в глинозем , который затем перерабатывается с помощью процесса Холла-Эру , в результате чего получается конечный алюминий.
Производство алюминия требует больших энергозатрат, поэтому производители стремятся размещать плавильные заводы в местах, где электроэнергия имеется в изобилии и стоит недорого. [136] Для производства одного килограмма алюминия требуется 7 килограммов нефтяного эквивалента по сравнению с 1,5 килограммами для стали и 2 килограммами для пластика. [137] По состоянию на 2019 год крупнейшие в мире плавильные заводы по производству алюминия расположены в Китае, Индии, России, Канаде и Объединенных Арабских Эмиратах, [135] при этом Китай является крупнейшим производителем алюминия с долей в 55% в мире.
Согласно отчету International Resource Panel 's Metal Stocks in Society , глобальный запас алюминия на душу населения , используемый в обществе (т. е. в автомобилях, зданиях, электронике и т. д.), составляет 80 кг (180 фунтов). Большая часть этого объема приходится на более развитые страны (350–500 кг (770–1100 фунтов) на душу населения), а не на менее развитые страны (35 кг (77 фунтов) на душу населения). [138]
Боксит преобразуется в глинозем по методу Байера. Боксит смешивается для получения однородного состава, а затем измельчается. Полученная пульпа смешивается с горячим раствором гидроксида натрия ; затем смесь обрабатывается в реакторе при давлении, значительно превышающем атмосферное, растворяя гидроксид алюминия в боксите, при этом примеси преобразуются в относительно нерастворимые соединения: [139]
После этой реакции пульпа находится при температуре выше ее точки кипения при атмосферном давлении. Она охлаждается путем удаления пара при снижении давления. Остаток боксита отделяется от раствора и выбрасывается. Раствор, свободный от твердых частиц, затравливается мелкими кристаллами гидроксида алюминия; это вызывает разложение ионов [Al(OH) 4 ] − до гидроксида алюминия. После того, как около половины алюминия выпадет в осадок, смесь отправляется в классификаторы. Мелкие кристаллы гидроксида алюминия собираются, чтобы служить затравочными агентами; крупные частицы превращаются в глинозем путем нагревания; избыток раствора удаляется путем испарения, (при необходимости) очищается и перерабатывается. [139]

Превращение глинозема в алюминий достигается с помощью процесса Холла-Эру . В этом энергоемком процессе раствор глинозема в расплавленной (950 и 980 °C (1740 и 1800 °F)) смеси криолита (Na 3 AlF 6 ) с фторидом кальция подвергается электролизу для получения металлического алюминия. Жидкий алюминий опускается на дно раствора и выливается, и обычно отливается в большие блоки, называемые алюминиевыми заготовками для дальнейшей обработки. [44]
Аноды электролизера изготавливаются из углерода — наиболее стойкого материала к фтористой коррозии — и либо обжигаются в процессе, либо предварительно обжигаются. Первые, также называемые анодами Содерберга, менее энергоэффективны, а пары, выделяющиеся во время обжига, требуют больших затрат на сбор, поэтому их заменяют предварительно обожженными анодами, хотя они экономят электроэнергию, энергию и трудозатраты на предварительную обжиг катодов. Углерод для анодов должен быть предпочтительно чистым, чтобы ни алюминий, ни электролит не были загрязнены золой. Несмотря на устойчивость углерода к коррозии, он все равно расходуется в размере 0,4–0,5 кг на каждый килограмм произведенного алюминия. Катоды изготавливаются из антрацита ; высокая чистота для них не требуется, поскольку примеси выщелачиваются очень медленно. Катод расходуется в размере 0,02–0,04 кг на каждый килограмм произведенного алюминия. Ячейка обычно выключается через 2–6 лет после выхода из строя катода. [44]
Процесс Холла-Эру производит алюминий с чистотой более 99%. Дальнейшая очистка может быть выполнена с помощью процесса Хупса . Этот процесс включает электролиз расплавленного алюминия с электролитом из натрия, бария и фторида алюминия. Полученный алюминий имеет чистоту 99,99%. [44] [140]
Электроэнергия составляет около 20–40 % стоимости производства алюминия, в зависимости от местоположения плавильного завода. Производство алюминия потребляет около 5 % электроэнергии, вырабатываемой в Соединенных Штатах. [132] По этой причине были исследованы альтернативы процессу Холла–Эру, но ни одна из них не оказалась экономически целесообразной. [44]

Восстановление металла путем переработки стало важной задачей алюминиевой промышленности. Переработка была малозаметной деятельностью до конца 1960-х годов, пока растущее использование алюминиевых банок для напитков не привлекло к ней внимание общественности. [141] Переработка включает в себя плавку лома, процесс, требующий всего 5% энергии, используемой для производства алюминия из руды, хотя значительная часть (до 15% исходного материала) теряется в виде шлака (золообразного оксида). [142] Плавильная печь для алюминия производит значительно меньше шлака, при этом сообщаемые значения составляют менее 1%. [143]
Белый шлак от первичного производства алюминия и от вторичных операций по переработке все еще содержит полезные количества алюминия, которые можно извлечь промышленным путем . В результате этого процесса получаются алюминиевые заготовки вместе с очень сложными отходами. Эти отходы трудно поддаются обработке. Они реагируют с водой, выделяя смесь газов (включая, среди прочего, водород , ацетилен и аммиак ), которая самопроизвольно воспламеняется при контакте с воздухом; [144] контакт с влажным воздухом приводит к выделению большого количества газообразного аммиака. Несмотря на эти трудности, отходы используются в качестве наполнителя в асфальте и бетоне . [145]

Мировое производство алюминия в 2016 году составило 58,8 млн тонн. Это превысило производство любого другого металла, за исключением железа (1231 млн тонн). [146] [147]
Алюминий почти всегда легирован, что заметно улучшает его механические свойства, особенно при закалке . Например, обычная алюминиевая фольга и банки для напитков представляют собой сплавы от 92% до 99% алюминия. [148] Основными легирующими агентами являются медь , цинк , магний , марганец и кремний (например, дюралюминий ) с уровнями других металлов в несколько процентов по весу. [149] Алюминий, как деформируемый, так и литой, легируется: марганцем , кремнием , магнием , медью и цинком среди других. [150]

Основные области применения алюминия: [151]
Подавляющее большинство (около 90%) оксида алюминия преобразуется в металлический алюминий. [139] Будучи очень твердым материалом ( твердость по Моосу 9), [152] оксид алюминия широко используется в качестве абразива; [153] будучи чрезвычайно химически инертным, он полезен в высокореакционных средах, таких как натриевые лампы высокого давления . [154] Оксид алюминия обычно используется в качестве катализатора для промышленных процессов; [139] например, процесс Клауса для преобразования сероводорода в серу на нефтеперерабатывающих заводах и в алкилированные амины . [155] [156] Многие промышленные катализаторы поддерживаются оксидом алюминия, что означает, что дорогостоящий каталитический материал диспергируется на поверхности инертного оксида алюминия. [157] Другое основное применение - в качестве осушающего агента или абсорбента. [139] [158]

Несколько сульфатов алюминия имеют промышленное и коммерческое применение. Сульфат алюминия (в форме гидрата) производится в год в количестве нескольких миллионов метрических тонн. [159] Около двух третей потребляется при очистке воды . [159] Следующее крупное применение — производство бумаги. [159] Он также используется в качестве протравы при крашении, при солении семян, при дезодорировании минеральных масел, при дублении кожи и в производстве других соединений алюминия. [159] Два вида квасцов, аммонийные квасцы и калиевые квасцы , ранее использовались в качестве протравы и при дублении кожи, но их использование значительно сократилось после появления высокочистого сульфата алюминия. [159] Безводный хлорид алюминия используется в качестве катализатора в химической и нефтехимической промышленности, в красильной промышленности и в синтезе различных неорганических и органических соединений. [159] Гидроксихлориды алюминия используются для очистки воды, в бумажной промышленности и в качестве антиперспирантов . [159] Алюминат натрия используется для очистки воды и в качестве ускорителя затвердевания цемента. [159]
Многие соединения алюминия имеют узкоспециализированные области применения, например:

Несмотря на широкое распространение в земной коре, алюминий не имеет известной функции в биологии. [44] При pH 6–9 (соответствующем большинству природных вод) алюминий выпадает из воды в виде гидроксида и, следовательно, недоступен; большинство элементов, ведущих себя таким образом, не играют биологической роли или являются токсичными. [172] Сульфат алюминия имеет LD 50 6207 мг/кг (перорально, мышь), что соответствует 435 граммам (около одного фунта) для мыши весом 70 кг (150 фунтов).
Министерство здравоохранения и социальных служб США классифицирует алюминий как неканцерогенный материал . [173] [n] В обзоре, опубликованном в 1988 году, говорится, что существует мало доказательств того, что нормальное воздействие алюминия представляет риск для здорового взрослого человека, [176] а многоэлементный токсикологический обзор 2014 года не смог обнаружить вредных эффектов алюминия, потребляемого в количествах, не превышающих 40 мг/день на кг массы тела . [173] Большая часть потребляемого алюминия покидает организм с калом; большая часть его небольшой части, которая попадает в кровоток, будет выводиться с мочой; [177] тем не менее, некоторое количество алюминия проходит через гематоэнцефалический барьер и преимущественно оседает в мозге пациентов с болезнью Альцгеймера. [178] [179] Данные, опубликованные в 1989 году, указывают на то, что у пациентов с болезнью Альцгеймера алюминий может действовать путем электростатического сшивания белков, тем самым подавляя гены в верхней височной извилине . [180]
Алюминий, хотя и редко, может вызывать витамин D-резистентную остеомаляцию , эритропоэтин -резистентную микроцитарную анемию и изменения центральной нервной системы. Люди с почечной недостаточностью особенно подвержены риску. [173] Хронический прием гидратированных силикатов алюминия (для контроля избыточной кислотности желудка) может привести к связыванию алюминия с содержимым кишечника и повышенному выведению других металлов, таких как железо или цинк ; достаточно высокие дозы (>50 г/день) могут вызвать анемию. [173]

Во время инцидента с загрязнением воды в Кэмелфорде в 1988 году питьевая вода в Кэмелфорде в течение нескольких недель была загрязнена сульфатом алюминия . В окончательном отчете об инциденте в 2013 году сделан вывод о том, что маловероятно, что это вызвало долгосрочные проблемы со здоровьем. [181]
Алюминий предположительно является возможной причиной болезни Альцгеймера , [182] но исследования в этой области, которые велись более 40 лет, по состоянию на 2018 год не выявили [обновлять]никаких убедительных доказательств причинно-следственной связи. [183] [184]
Алюминий увеличивает экспрессию генов , связанных с эстрогеном , в клетках рака молочной железы человека , культивируемых в лабораторных условиях. [185] В очень высоких дозах алюминий связан с изменением функции гематоэнцефалического барьера. [186] Небольшой процент людей [187] имеет контактную аллергию на алюминий и испытывает зудящую красную сыпь, головную боль, мышечные боли, боли в суставах, плохую память, бессонницу, депрессию, астму, синдром раздраженного кишечника или другие симптомы при контакте с продуктами, содержащими алюминий. [188]
Воздействие порошкообразного алюминия или дыма, образующегося при сварке алюминия, может вызвать фиброз легких . [189] Мелкий алюминиевый порошок может воспламениться или взорваться, что представляет собой еще одну опасность на рабочем месте. [190] [191]
Пища является основным источником алюминия. Питьевая вода содержит больше алюминия, чем твердая пища; [173] однако алюминий из пищи может усваиваться больше, чем алюминий из воды. [192] Основными источниками перорального воздействия алюминия на человека являются пища (из-за его использования в пищевых добавках, упаковке продуктов питания и напитков, а также кухонных принадлежностях), питьевая вода (из-за ее использования в муниципальной очистке воды) и содержащие алюминий лекарства (особенно антацидные/противоязвенные и буферные формулы аспирина). [193] Пищевое воздействие у европейцев в среднем составляет 0,2–1,5 мг/кг/неделю, но может достигать 2,3 мг/кг/неделю. [173] Более высокие уровни воздействия алюминия в основном ограничиваются шахтерами, рабочими алюминиевого производства и пациентами, находящимися на диализе . [194]
Потребление антацидов , антиперспирантов, вакцин и косметики обеспечивает возможные пути воздействия. [195] Потребление кислых продуктов или жидкостей с алюминием усиливает абсорбцию алюминия, [196] а мальтол , как было показано, увеличивает накопление алюминия в нервных и костных тканях. [197]
В случае подозрения на внезапное поступление большого количества алюминия единственным лечением является дефероксамин мезилат , который может быть назначен для выведения алюминия из организма с помощью хелатной терапии . [198] [199] Однако это следует применять с осторожностью, поскольку это снижает не только уровень алюминия в организме, но и уровень других металлов, таких как медь или железо. [198]

Высокие уровни алюминия наблюдаются вблизи мест добычи; небольшие количества алюминия выбрасываются в окружающую среду на угольных электростанциях или мусоросжигательных заводах . [177] Алюминий в воздухе вымывается дождем или обычно оседает, но небольшие частицы алюминия остаются в воздухе в течение длительного времени. [177]
Кислотные осадки являются основным природным фактором мобилизации алюминия из природных источников [173] и основной причиной воздействия алюминия на окружающую среду; [200] однако основным фактором присутствия алюминия в соленой и пресной воде являются промышленные процессы, которые также выбрасывают алюминий в воздух. [173]
В воде алюминий действует как токсичный агент на дышащих жабрами животных, таких как рыбы , когда вода кислая, в которой алюминий может осаждаться на жабрах, [201] что вызывает потерю ионов плазмы и гемолимфы , что приводит к нарушению осморегуляции . [200] Органические комплексы алюминия могут легко всасываться и мешать метаболизму у млекопитающих и птиц, хотя на практике это случается редко. [200]
Алюминий является основным фактором, который снижает рост растений на кислых почвах. Хотя он, как правило, безвреден для роста растений в почвах с нейтральным pH, в кислых почвах концентрация токсичных катионов Al 3+ увеличивается и нарушает рост и функционирование корней. [202] [203] [204] [205] Пшеница выработала толерантность к алюминию, выделяя органические соединения , которые связываются с вредными катионами алюминия . Считается, что сорго имеет тот же механизм толерантности. [206 ]
Производство алюминия имеет свои собственные проблемы для окружающей среды на каждом этапе производственного процесса. Основная проблема - выбросы парниковых газов . [194] Эти газы возникают в результате потребления электроэнергии плавильными печами и побочных продуктов переработки. Наиболее мощными из этих газов являются перфторуглероды из процесса плавки. [194] Выделяющийся диоксид серы является одним из основных предшественников кислотных дождей . [194]
Биодеградация металлического алюминия встречается крайне редко; большинство организмов, разъедающих алюминий, не атакуют и не потребляют алюминий напрямую, а вместо этого производят едкие отходы. [207] [208] Грибок Geotrichum candidum может потреблять алюминий в компакт-дисках . [209] [210] [211] Бактерия Pseudomonas aeruginosa и грибок Cladosporium resinae обычно обнаруживаются в топливных баках самолетов, в которых используется топливо на основе керосина (не авиационный бензин ), а лабораторные культуры могут разлагать алюминий. [212]
Французские химики дали новое название этой чистой земле: по-французски alumine, по-латыни alumina. Признаюсь, мне этот alumina не нравится.
Происхождение: Образовано в английском языке путем деривации. Этимоны: alumine сущ. , суффикс -ium , Aluminum сущ.
Этимология: < французское alumine (LB Guyton de Morveau 1782, Observ. sur la Physique 19 378) < классическое латинское alūmin- , alūmen alum n. 1 , после французского -ine суффикса -ine 4 .
Калий, действуя на алюмин и глюцин, производит пирофорные вещества темно-серого цвета, которые сгорали, выбрасывая блестящие искры и оставляя после себя щелочь и землю, и которые, будучи брошены в воду, разлагали ее с большой силой. Результат этого эксперимента не является полностью решающим относительно существования того, что можно было бы назвать алюминием и глюцинием
алюминий сущ. сосуществовал со своим синонимом алюминий сущ. на протяжении всего 19-го века. С начала 20-го века алюминий постепенно стал преобладающей формой в Северной Америке; он был принят в качестве официального названия металла в Соединенных Штатах Американским химическим обществом в 1925 году. В других местах алюминий постепенно вытеснялся алюминием , который был принят в качестве международного стандарта ИЮПАК в 1990 году.
гриб типа
Geotrichum
был выделен авторами из испорченного компакт-диска, найденного в Белизе (Центральная Америка)....В настоящей статье мы сообщаем об очистке и характеристике H
2
O
2
-генерирующей внеклеточной оксидазы, продуцируемой этим грибом, которая разделяет каталитические свойства как с
P. eryngii
AAO, так и с
P. simplicissimum
VAO.
См. также реферат Romero et al. 2007.