Щелочные металлы состоят из химических элементов лития (Li), натрия (Na), калия (K), [примечание 1] рубидия (Rb), цезия (Cs), [примечание 2] и франция (Fr). Вместе с водородом они составляют группу 1 , [примечание 3], которая лежит в s-блоке периодической таблицы . Все щелочные металлы имеют свой внешний электрон на s-орбитали : эта общая электронная конфигурация приводит к тому, что они имеют очень похожие характерные свойства. [примечание 4] Действительно, щелочные металлы представляют собой лучший пример групповых тенденций в свойствах в периодической таблице, причем элементы демонстрируют хорошо охарактеризованное гомологическое поведение. [5] Это семейство элементов также известно как семейство лития по имени его ведущего элемента.
Все щелочные металлы являются блестящими, мягкими , высокореакционными металлами при стандартной температуре и давлении и легко теряют свой внешний электрон , образуя катионы с зарядом +1. Все они легко режутся ножом из-за своей мягкости, обнажая блестящую поверхность, которая быстро тускнеет на воздухе из-за окисления атмосферной влагой и кислородом (а в случае лития — азотом ). Из-за их высокой реакционной способности их необходимо хранить под маслом, чтобы предотвратить реакцию с воздухом, и они встречаются в природе только в солях и никогда в виде свободных элементов. Цезий, пятый щелочной металл, является самым реакционноспособным из всех металлов. Все щелочные металлы реагируют с водой, причем более тяжелые щелочные металлы реагируют более энергично, чем более легкие.
Все обнаруженные щелочные металлы встречаются в природе в виде своих соединений: в порядке распространенности наиболее распространенным является натрий, за ним следуют калий, литий, рубидий, цезий и, наконец, франций, который очень редок из-за своей чрезвычайно высокой радиоактивности ; франций встречается в природе только в мельчайших следах как промежуточный шаг в некоторых неясных побочных ветвях естественных цепочек распада . Были проведены эксперименты по попытке синтеза элемента 119 , который, вероятно, станет следующим членом группы; ни один из них не увенчался успехом. Однако унуненний может не быть щелочным металлом из-за релятивистских эффектов , которые, как предсказывают, оказывают большое влияние на химические свойства сверхтяжелых элементов ; даже если он действительно окажется щелочным металлом, предсказывают, что он будет иметь некоторые отличия в физических и химических свойствах от своих более легких гомологов.
Большинство щелочных металлов имеют множество различных применений. Одним из самых известных применений чистых элементов является использование рубидия и цезия в атомных часах , из которых цезиевые атомные часы составляют основу вторых. Распространенным применением соединений натрия является натриевая лампа , которая излучает свет очень эффективно. Поваренная соль , или хлорид натрия, используется с древних времен. Литий находит применение в качестве психиатрического препарата и в качестве анода в литиевых батареях . Натрий, калий и, возможно, литий являются незаменимыми элементами , играющими важную биологическую роль в качестве электролитов , и хотя другие щелочные металлы не являются незаменимыми, они также оказывают различное воздействие на организм, как полезное, так и вредное.

Соединения натрия известны с древних времен; соль ( хлорид натрия ) была важным товаром в человеческой деятельности. Хотя поташ использовался с древних времен, на протяжении большей части своей истории не понималось, что это принципиально иное вещество, нежели минеральные соли натрия. Георг Эрнст Шталь получил экспериментальные доказательства, которые привели его к предположению о принципиальном различии солей натрия и калия в 1702 году [6] , а Анри-Луи Дюамель дю Монсо смог доказать это различие в 1736 году [7]. Точный химический состав соединений калия и натрия, а также статус калия и натрия как химических элементов тогда не были известны, и поэтому Антуан Лавуазье не включил ни одну из щелочей в свой список химических элементов в 1789 году. [8] [9]
Чистый калий был впервые выделен в 1807 году в Англии Хэмфри Дэви , который получил его из едкого кали (KOH, гидроксид калия) с помощью электролиза расплавленной соли с помощью недавно изобретенного вольтова столба . Предыдущие попытки электролиза водной соли были безуспешными из-за чрезвычайной реакционной способности калия. [10] : 68 Калий был первым металлом, который был выделен электролизом. [11] Позднее в том же году Дэви сообщил об извлечении натрия из похожего вещества едкого натра (NaOH, щелок) с помощью аналогичной техники, продемонстрировав, что элементы, а следовательно, и соли, различны. [8] [9] [12] [13]

Петалит ( Li Al Si 4 O 10 ) был открыт в 1800 году бразильским химиком Жозе Бонифасио де Андрада в шахте на острове Утё, Швеция . [14] [15] [16] Однако только в 1817 году Йохан Август Арфведсон , работавший тогда в лаборатории химика Йенса Якоба Берцелиуса , обнаружил присутствие нового элемента при анализе петалитовой руды . [17] [18] Он отметил, что этот новый элемент образует соединения, похожие на соединения натрия и калия, хотя его карбонат и гидроксид были менее растворимы в воде и более щелочными , чем другие щелочные металлы. [19] Берцелиус дал неизвестному материалу название литион / литина , от греческого слова λιθoς (транслитерируемого как lithos , что означает «камень»), чтобы отразить его открытие в твердом минерале, в отличие от калия, который был обнаружен в растительной золе, и натрия, который был известен отчасти своим высоким содержанием в крови животных. Он назвал металл внутри материала литием . [20] [15] [18] Литий, натрий и калий были частью открытия периодичности , поскольку они входят в ряд триад элементов в той же группе , которые были отмечены Иоганном Вольфгангом Дёберейнером в 1850 году как имеющие схожие свойства. [21]

Рубидий и цезий были первыми элементами, которые были открыты с помощью спектроскопа , изобретенного в 1859 году Робертом Бунзеном и Густавом Кирхгофом . [22] В следующем году они обнаружили цезий в минеральной воде из Бад-Дюркгейма , Германия. Их открытие рубидия произошло в следующем году в Гейдельберге , Германия, где его нашли в минерале лепидолите . [23] Названия рубидия и цезия происходят от наиболее заметных линий в их спектрах излучения : ярко-красная линия для рубидия (от латинского слова rubidus , что означает темно-красный или ярко-красный), и небесно-голубая линия для цезия (происходит от латинского слова caesius , что означает небесно-голубой). [24] [25]
Около 1865 года Джон Ньюлендс опубликовал ряд статей, в которых он перечислил элементы в порядке возрастания атомного веса и схожих физических и химических свойств, которые повторялись с интервалом в восемь; он сравнил такую периодичность с октавами музыки, где ноты, отстоящие друг от друга на октаву, имеют схожие музыкальные функции. [26] [27] Его версия объединила все известные тогда щелочные металлы (литий и цезий), а также медь, серебро и таллий (которые показывают степень окисления +1, характерную для щелочных металлов), в одну группу. Его таблица поместила водород вместе с галогенами . [ 21]

После 1869 года Дмитрий Менделеев предложил свою периодическую таблицу, поместив литий на вершину группы с натрием, калием, рубидием, цезием и таллием. [28] Два года спустя Менделеев пересмотрел свою таблицу, поместив водород в группу 1 над литием, а также переместив таллий в группу бора . В этой версии 1871 года медь, серебро и золото были размещены дважды, один раз как часть группы IB , и один раз как часть «группы VIII», охватывающей сегодняшние группы с 8 по 11. [29] [примечание 5] После введения таблицы из 18 столбцов элементы группы IB были перемещены на их нынешнее положение в d-блоке , в то время как щелочные металлы остались в группе IA . Позднее, в 1988 году, название группы было изменено на группу 1. [4] Тривиальное название «щелочные металлы» происходит от того факта, что гидроксиды элементов группы 1 являются сильными щелочами при растворении в воде. [5]
Было по крайней мере четыре ошибочных и неполных открытия [30] [31] [32] [33] до того, как Маргерит Перей из Института Кюри в Париже, Франция, открыла франций в 1939 году, очистив образец актиния-227 , который, как сообщалось, имел энергию распада 220 кэВ . Однако Перей заметил частицы распада с уровнем энергии ниже 80 кэВ. Перей подумал, что эта активность распада могла быть вызвана ранее неопознанным продуктом распада, который был отделен во время очистки, но снова появился из чистого актиния -227. Различные тесты исключили возможность того, что неизвестный элемент был торием , радием , свинцом, висмутом или таллием . Новый продукт проявил химические свойства щелочного металла (например, соосаждение с солями цезия), что привело Перея к мысли, что это был элемент 87, вызванный альфа-распадом актиния-227. [34] Затем Перей попыталась определить соотношение бета-распада к альфа-распаду в актинии-227. Ее первый тест показал альфа-ветвление в 0,6%, цифру, которую она позже пересмотрела до 1%. [35]
Следующим элементом после франция ( eka -francium) в периодической таблице будет унуненний (Uue), элемент 119. [36] : 1729–1730 Синтез унуненния был впервые предпринят в 1985 году путем бомбардировки мишени эйнштейния -254 ионами кальция -48 на ускорителе superHILAC в Национальной лаборатории Лоуренса в Беркли в Беркли, Калифорния. Атомы не были идентифицированы, что привело к предельному выходу в 300 нб . [37] [38]
Крайне маловероятно [37] , что эта реакция сможет создать какие-либо атомы унуненния в ближайшем будущем, учитывая чрезвычайно сложную задачу создания достаточного количества эйнштейния-254, который благоприятен для производства сверхтяжелых элементов из-за его большой массы, относительно длительного периода полураспада в 270 дней и доступности в значительных количествах в несколько микрограммов, [39] чтобы создать достаточно большую мишень для повышения чувствительности эксперимента до требуемого уровня; эйнштейний не был обнаружен в природе и производился только в лабораториях, и в количествах, меньших тех, которые необходимы для эффективного синтеза сверхтяжелых элементов. Однако, учитывая, что унуненний является только первым элементом 8 периода в расширенной периодической таблице , он вполне может быть обнаружен в ближайшем будущем с помощью других реакций, и действительно, в настоящее время в Японии ведется попытка его синтеза. [40] В настоящее время ни один из элементов 8-го периода еще не открыт, и также возможно, из-за нестабильности капель , что только элементы 8-го периода, примерно до элемента 128, физически возможны. [41] [42] Никаких попыток синтеза более тяжелых щелочных металлов не предпринималось: из-за их чрезвычайно высокого атомного числа для их получения потребуются новые, более мощные методы и технологии. [36] : 1737–1739

Правило Оддо-Харкинса гласит, что элементы с четными атомными номерами встречаются чаще, чем элементы с нечетными атомными номерами, за исключением водорода. Это правило утверждает, что элементы с нечетными атомными номерами имеют один неспаренный протон и с большей вероятностью захватят другой, тем самым увеличивая свой атомный номер. В элементах с четными атомными номерами протоны спарены, причем каждый член пары компенсирует спин другого, повышая стабильность. [44] [45] [46] Все щелочные металлы имеют нечетные атомные номера, и они не так распространены, как элементы с четными атомными номерами, соседствующие с ними ( благородные газы и щелочноземельные металлы ) в Солнечной системе. Более тяжелые щелочные металлы также менее распространены, чем более легкие, поскольку щелочные металлы, начиная с рубидия, могут быть синтезированы только в сверхновых , а не в звездном нуклеосинтезе . Литий также встречается гораздо реже, чем натрий и калий, поскольку он плохо синтезируется как в нуклеосинтезе Большого взрыва , так и в звездах: Большой взрыв мог произвести только следовые количества лития, бериллия и бора из-за отсутствия стабильного ядра с 5 или 8 нуклонами , а звездный нуклеосинтез мог обойти это узкое место только с помощью тройного альфа-процесса , сплавляя три ядра гелия с образованием углерода и пропуская эти три элемента. [43]

Земля образовалась из того же облака материи, что и Солнце, но планеты приобрели разный состав в ходе формирования и эволюции Солнечной системы . В свою очередь, естественная история Земли привела к тому, что части этой планеты имели разную концентрацию элементов. Масса Земли составляет приблизительно 5,98 × 1024 кг. Он состоит в основном из железа (32,1%), кислорода (30,1%), кремния (15,1%), магния (13,9%), серы (2,9%), никеля (1,8%), кальция (1,5%) и алюминия (1,4%); оставшиеся 1,2% состоят из следовых количеств других элементов. Из-за планетарной дифференциации считается, что область ядра в основном состоит из железа (88,8%), с меньшим количеством никеля (5,8%), серы (4,5%) и менее 1% следовых элементов. [47]
Щелочные металлы, из-за их высокой реакционной способности, не встречаются в природе в чистом виде. Они являются литофилами и поэтому остаются близко к поверхности Земли, поскольку они легко соединяются с кислородом и, таким образом, прочно ассоциируются с кремнием , образуя относительно низкоплотные минералы, которые не погружаются в ядро Земли. Калий, рубидий и цезий также являются несовместимыми элементами из-за их больших ионных радиусов . [48]
Натрий и калий очень распространены на Земле, оба входят в десятку самых распространенных элементов в земной коре ; [49] [50] натрий составляет приблизительно 2,6% земной коры по весу, что делает его шестым по распространенности элементом в целом [51] и самым распространенным щелочным металлом. Калий составляет приблизительно 1,5% земной коры и является седьмым по распространенности элементом. [51] Натрий содержится во многих различных минералах, из которых наиболее распространенной является обычная соль (хлорид натрия), которая в огромных количествах растворена в морской воде. Другие твердые отложения включают галит , амфибол , криолит , нитратин и цеолит . [51] Многие из этих твердых отложений возникают в результате испарения древних морей, что все еще происходит в таких местах, как Большое Соленое озеро в штате Юта и Мертвое море . [10] : 69 Несмотря на их почти одинаковое содержание в земной коре, натрий гораздо более распространен в океане, чем калий, как потому, что больший размер калия делает его соли менее растворимыми, так и потому, что калий связан с силикатами в почве, и то, что выщелачивает калий, гораздо легче усваивается растениями, чем натрий. [10] : 69
Несмотря на химическое сходство, литий обычно не встречается вместе с натрием или калием из-за его меньшего размера. [10] : 69 Из-за своей относительно низкой реакционной способности его можно найти в морской воде в больших количествах; по оценкам, концентрация лития в морской воде составляет приблизительно от 0,14 до 0,25 частей на миллион (ppm) [52] [53] или 25 микромоль . [54] Его диагональное соотношение с магнием часто позволяет ему заменять магний в ферромагниевых минералах, где его концентрация в земной коре составляет около 18 ppm , что сопоставимо с концентрацией галлия и ниобия . С коммерческой точки зрения наиболее важным минералом лития является сподумен , который встречается в крупных месторождениях по всему миру. [10] : 69
Рубидий примерно так же распространен, как цинк , и более распространен, чем медь. Он встречается в природе в минералах лейцит , поллуцит , карналлит , циннвальдит и лепидолит , [55] хотя ни один из них не содержит только рубидий и никаких других щелочных металлов. [10] : 70 Цезий более распространен, чем некоторые общеизвестные элементы, такие как сурьма , кадмий , олово и вольфрам , но гораздо менее распространен, чем рубидий. [56]
Франций-223 , единственный встречающийся в природе изотоп франция, [57] [58] является продуктом альфа -распада актиния-227 и может быть обнаружен в следовых количествах в урановых минералах. [59] В данном образце урана, по оценкам, содержится только один атом франция на каждые 1018 атомов урана. [60] [61] Было подсчитано, что в земной коре в любой момент времени находится не более 30 граммов франция из-за его чрезвычайно короткого периода полураспада в 22 минуты. [62] [63]
Физические и химические свойства щелочных металлов можно легко объяснить тем, что они имеют ns 1 конфигурацию валентных электронов , что приводит к слабой металлической связи . Следовательно, все щелочные металлы мягкие и имеют низкие плотности , [5] температуры плавления [5] и кипения , [5], а также теплоты сублимации , испарения и диссоциации . [10] : 74 Все они кристаллизуются в объемно-центрированной кубической кристаллической структуре, [10] : 73 и имеют отличительные цвета пламени , потому что их внешний s-электрон очень легко возбуждается. [10] : 75 Действительно, эти цвета пламени являются наиболее распространенным способом их идентификации, поскольку все их соли с общими ионами растворимы. [10] : 75 Конфигурация ns 1 также приводит к тому, что щелочные металлы имеют очень большие атомные и ионные радиусы , а также очень высокую тепло- и электропроводность . [10] : 75 Их химия определяется потерей их одиночного валентного электрона на самой внешней s-орбитали для образования степени окисления +1 из-за легкости ионизации этого электрона и очень высокой второй энергии ионизации. [10] : 76 Большая часть химии наблюдалась только для первых пяти членов группы. Химия франция не очень хорошо изучена из-за его чрезвычайной радиоактивности ; [5] таким образом, представление его свойств здесь ограничено. То немногое, что известно о франции, показывает, что он очень близок по поведению к цезию, как и ожидалось. Физические свойства франция еще более схематичны, потому что основной элемент никогда не наблюдался; поэтому любые данные, которые могут быть найдены в литературе, безусловно, являются спекулятивными экстраполяциями. [64]
Щелочные металлы более похожи друг на друга, чем элементы в любой другой группе друг на друга. [5] Действительно, сходство настолько велико, что довольно трудно разделить калий, рубидий и цезий из-за их схожих ионных радиусов ; литий и натрий более различимы. Например, при движении вниз по таблице все известные щелочные металлы показывают увеличение атомного радиуса , [71] уменьшение электроотрицательности , [71] увеличение реакционной способности , [5] и уменьшение точек плавления и кипения [71], а также теплот плавления и испарения. [10] : 75 В целом, их плотности увеличиваются при движении вниз по таблице, за исключением того, что калий менее плотный, чем натрий. [71] Одним из очень немногих свойств щелочных металлов, которое не демонстрирует очень плавной тенденции, являются их восстановительные потенциалы : значение лития аномально, будучи более отрицательным, чем другие. [10] : 75 Это связано с тем, что ион Li + имеет очень высокую энергию гидратации в газовой фазе: хотя ион лития значительно нарушает структуру воды, вызывая более высокое изменение энтропии, этой высокой энергии гидратации достаточно, чтобы восстановительные потенциалы указывали на него как на наиболее электроположительный щелочной металл, несмотря на сложность его ионизации в газовой фазе. [10] : 75
Стабильные щелочные металлы — это все металлы серебристого цвета, за исключением цезия, который имеет бледно-золотистый оттенок: [72] это один из трех металлов, которые имеют четкую окраску (два других — медь и золото). [10] : 74 Кроме того, тяжелые щелочноземельные металлы кальций , стронций и барий , а также двухвалентные лантаноиды европий и иттербий , имеют бледно-желтый цвет, хотя цвет гораздо менее выражен, чем у цезия. [10] : 74 Их блеск быстро тускнеет на воздухе из-за окисления. [5]
Все щелочные металлы очень реакционноспособны и никогда не встречаются в природе в элементарных формах. [20] Из-за этого их обычно хранят в минеральном масле или керосине (парафиновом масле). [73] Они агрессивно реагируют с галогенами, образуя галогениды щелочных металлов , которые представляют собой белые ионные кристаллические соединения, которые все растворимы в воде, за исключением фторида лития (LiF). [5] Щелочные металлы также реагируют с водой, образуя сильнощелочные гидроксиды , и поэтому с ними следует обращаться с большой осторожностью. Более тяжелые щелочные металлы реагируют более энергично, чем более легкие; например, при попадании в воду цезий производит более сильный взрыв, чем калий, если используется одинаковое количество молей каждого металла. [5] [74] [56] Щелочные металлы имеют самые низкие первые энергии ионизации в своих соответствующих периодах периодической таблицы [64] из-за их низкого эффективного заряда ядра [5] и способности достигать конфигурации благородного газа , теряя всего один электрон . [5] Щелочные металлы реагируют не только с водой, но и с донорами протонов, такими как спирты и фенолы , газообразный аммиак и алкины , причем последние демонстрируют феноменальную степень своей реакционной способности. Их огромная сила как восстановителей делает их очень полезными в освобождении других металлов из их оксидов или галогенидов. [10] : 76
Вторая энергия ионизации всех щелочных металлов очень высока [5] [64], поскольку она находится в полной оболочке, которая также ближе к ядру; [5] таким образом, они почти всегда теряют один электрон, образуя катионы. [10] : 28 Алкалиды являются исключением: они являются нестабильными соединениями, которые содержат щелочные металлы в степени окисления −1, что очень необычно, поскольку до открытия алкалидов не ожидалось, что щелочные металлы смогут образовывать анионы , и считалось, что они могут появляться в солях только как катионы. Анионы алкалидов имеют заполненные s-подоболочки , что дает им достаточную стабильность для существования. Известно, что все стабильные щелочные металлы, за исключением лития, способны образовывать алкалиды, [75] [76] [77] , а алкалиды представляют большой теоретический интерес из-за их необычной стехиометрии и низких потенциалов ионизации . Алкалиды химически похожи на электриды , которые представляют собой соли с захваченными электронами, действующими как анионы. [78] Особенно ярким примером алкалида является «обратный гидрид натрия », H + Na − (оба иона находятся в комплексе ), в отличие от обычного гидрида натрия, Na + H − : [79] он нестабилен в изоляции из-за своей высокой энергии, возникающей в результате смещения двух электронов от водорода к натрию, хотя несколько производных, как предсказывают, будут метастабильными или стабильными. [79] [80]
В водном растворе ионы щелочных металлов образуют акваионы формулы [M(H 2 O) n ] + , где n — число сольватации. Их координационные числа и формы хорошо согласуются с ожидаемыми из их ионных радиусов. В водном растворе молекулы воды, непосредственно присоединенные к иону металла, относятся к первой координационной сфере , также известной как первая или первичная сольватная оболочка. Связь между молекулой воды и ионом металла является дативной ковалентной связью , при этом атом кислорода отдает оба электрона связи. Каждая координированная молекула воды может быть присоединена водородными связями к другим молекулам воды. Говорят, что последние находятся во второй координационной сфере. Однако для катионов щелочных металлов вторая координационная сфера не определена четко, поскольку заряд +1 на катионе недостаточно высок, чтобы поляризовать молекулы воды в первичной сольватной оболочке достаточно для того, чтобы они могли образовать прочные водородные связи с молекулами во второй координационной сфере, создавая более стабильную структуру. [81] [82] : 25 Число сольватации для Li + было экспериментально определено как 4, образуя тетраэдрический [Li(H 2 O) 4 ] + : в то время как числа сольватации от 3 до 6 были обнаружены для литиевых акваионов, числа сольватации менее 4 могут быть результатом образования контактных ионных пар , а более высокие числа сольватации могут быть интерпретированы в терминах молекул воды, которые приближаются к [Li(H 2 O) 4 ] + через грань тетраэдра, хотя молекулярно-динамическое моделирование может указывать на существование октаэдрического гексаакваиона. Вероятно, также есть шесть молекул воды в первичной сольватной сфере иона натрия, образуя октаэдрический ион [Na(H 2 O) 6 ] + . [65] [82] : 126–127 Хотя ранее считалось, что более тяжелые щелочные металлы также образуют октаэдрические гексаакваионы, с тех пор было обнаружено, что калий и рубидий, вероятно, образуют ионы [K(H 2 O) 8 ] + и [Rb(H 2 O) 8 ] + , которые имеют квадратную антипризматическую структуру, а цезий образует 12-координированный ион [Cs(H 2 O) 12 ] + . [83]
Химия лития показывает несколько отличий от химии остальной группы, поскольку небольшой катион Li + поляризует анионы и придает его соединениям более ковалентный характер. [5] Литий и магний имеют диагональную связь из-за их схожих атомных радиусов, [5] так что они демонстрируют некоторое сходство. Например, литий образует стабильный нитрид , свойство, общее для всех щелочноземельных металлов (группа магния), но уникальное среди щелочных металлов. [84] Кроме того, среди их соответствующих групп только литий и магний образуют металлоорганические соединения со значительным ковалентным характером (например, Li Me и MgMe 2 ). [85]
Фторид лития — единственный галогенид щелочного металла, который плохо растворяется в воде, [5] а гидроксид лития — единственный гидроксид щелочного металла, который не расплывается . [5] Наоборот, перхлорат лития и другие соли лития с большими анионами, которые не могут быть поляризованы, намного более стабильны, чем аналогичные соединения других щелочных металлов, вероятно, потому, что Li + имеет высокую энергию сольватации . [10] : 76 Этот эффект также означает, что большинство простых солей лития обычно встречаются в гидратированной форме, поскольку безводные формы чрезвычайно гигроскопичны : это позволяет использовать такие соли, как хлорид лития и бромид лития , в осушителях воздуха и кондиционерах . [10] : 76
Также предсказывается, что франций покажет некоторые различия из-за своего высокого атомного веса , заставляя свои электроны перемещаться со значительными долями скорости света и, таким образом, делая релятивистские эффекты более заметными. В отличие от тенденции к снижению электроотрицательности и энергии ионизации щелочных металлов, электроотрицательность и энергия ионизации франция, как предсказывают, будут выше, чем у цезия из-за релятивистской стабилизации 7s-электронов; также ожидается, что его атомный радиус будет аномально низким. Таким образом, вопреки ожиданиям, цезий является наиболее реактивным из щелочных металлов, а не франций. [67] [36] : 1729 [86] Все известные физические свойства франция также отклоняются от четких тенденций, идущих от лития к цезию, таких как первая энергия ионизации, сродство к электрону и поляризуемость аниона, хотя из-за скудности известных данных о франции многие источники приводят экстраполированные значения, игнорируя тот факт, что релятивистские эффекты делают тенденцию от лития к цезию неприменимой к францию. [86] Некоторые из немногих свойств франция, которые были предсказаны с учетом теории относительности, - это сродство к электрону (47,2 кДж/моль) [87] и энтальпия диссоциации молекулы Fr2 ( 42,1 кДж/моль). [88] Молекула CsFr поляризована как Cs + Fr − , показывая, что 7s подоболочка франция гораздо сильнее подвержена влиянию релятивистских эффектов, чем 6s подоболочка цезия. [86] Кроме того, ожидается, что супероксид франция (FrO 2 ) будет иметь значительный ковалентный характер, в отличие от других супероксидов щелочных металлов, из-за связывающих вкладов 6p-электронов франция. [86]
Все щелочные металлы имеют нечетные атомные числа; следовательно, их изотопы должны быть либо нечетно-нечетными ( число протонов и нейтронов нечетное), либо нечетно-четными ( число протонов нечетное, но число нейтронов четное). Нечетно-нечетные ядра имеют четные массовые числа , тогда как нечетно-четные ядра имеют нечетные массовые числа. Нечетно-нечетные первичные нуклиды редки, поскольку большинство нечетно-нечетных ядер крайне нестабильны по отношению к бета-распаду , поскольку продукты распада четно-четные и, следовательно, более прочно связаны из-за эффектов ядерного спаривания . [89]
Из-за большой редкости нечетно-нечетных ядер почти все первичные изотопы щелочных металлов являются нечетно-четными (исключения составляют легкий стабильный изотоп литий-6 и долгоживущий радиоизотоп калий-40). Для данного нечетного массового числа может быть только один бета-стабильный нуклид , поскольку нет разницы в энергии связи между четно-нечетными и нечетно-четными, сравнимой с таковой между четно-четными и нечетно-нечетными, оставляя другие нуклиды с тем же массовым числом ( изобары ) свободными для бета-распада в сторону нуклида с наименьшей массой. Эффект нестабильности нечетного числа нуклонов любого типа заключается в том, что нечетные элементы, такие как щелочные металлы, имеют тенденцию иметь меньше стабильных изотопов, чем четные элементы. Из 26 моноизотопных элементов , имеющих только один стабильный изотоп, все, кроме одного, имеют нечетное атомное число, и все, кроме одного, также имеют четное число нейтронов. Бериллий является единственным исключением из обоих правил из-за его низкого атомного числа. [89]
Все щелочные металлы, за исключением лития и цезия, имеют по крайней мере один встречающийся в природе радиоизотоп : натрий-22 и натрий-24 являются следовыми радиоизотопами, образующимися космогенным путем , [90] калий-40 и рубидий-87 имеют очень долгий период полураспада и, таким образом, встречаются в природе, [91] и все изотопы франция радиоактивны . [91] Цезий также считался радиоактивным в начале 20-го века, [ 92] [93] хотя он не имеет встречающихся в природе радиоизотопов. [91] (Франций в то время еще не был открыт.) Природный долгоживущий радиоизотоп калия, калий-40, составляет около 0,012% природного калия, [94] и, таким образом, природный калий слабо радиоактивен. Эта естественная радиоактивность стала основой для ошибочного заявления об открытии элемента 87 (следующего щелочного металла после цезия) в 1925 году. [30] [31] Природный рубидий также слабо радиоактивен, 27,83% его приходится на долгоживущий радиоизотоп рубидий-87. [10] : 74
Цезий-137 , с периодом полураспада 30,17 лет, является одним из двух основных среднеживущих продуктов деления , наряду со стронцием-90 , которые ответственны за большую часть радиоактивности отработанного ядерного топлива после нескольких лет охлаждения, вплоть до нескольких сотен лет после использования. Он составляет большую часть радиоактивности, все еще оставшейся после аварии на Чернобыльской АЭС . Цезий-137 подвергается высокоэнергетическому бета-распаду и в конечном итоге становится стабильным барием-137 . Он является сильным излучателем гамма-излучения. Цезий-137 имеет очень низкую скорость захвата нейтронов и не может быть практически утилизирован таким образом, но должен распадаться. [95] Цезий-137 использовался в качестве трассера в гидрологических исследованиях, аналогично использованию трития . [96] Небольшие количества цезия-134 и цезия-137 были выброшены в окружающую среду во время почти всех испытаний ядерного оружия и некоторых ядерных аварий , наиболее заметными из которых являются авария в Гоянии и катастрофа на Чернобыльской АЭС . По состоянию на 2005 год цезий-137 является основным источником радиации в зоне отчуждения вокруг Чернобыльской АЭС . [97] Его химические свойства как одного из щелочных металлов делают его одним из самых проблемных продуктов деления с коротким и средним сроком жизни, поскольку он легко перемещается и распространяется в природе из-за высокой растворимости его солей в воде и усваивается организмом, который ошибочно принимает его за его основные конгенеры натрий и калий. [98] : 114
Щелочные металлы более похожи друг на друга, чем элементы в любой другой группе друг на друга. [5] Например, при движении вниз по таблице все известные щелочные металлы показывают увеличение атомного радиуса , [71] уменьшение электроотрицательности , [71] увеличение реакционной способности , [5] и уменьшение температур плавления и кипения [71], а также теплот плавления и испарения. [10] : 75 В целом, их плотности увеличиваются при движении вниз по таблице, за исключением калия, который менее плотный, чем натрий. [71]

Атомные радиусы щелочных металлов увеличиваются по мере продвижения вниз по группе. [71] Из-за экранирующего эффекта , когда атом имеет более одной электронной оболочки , каждый электрон чувствует электрическое отталкивание от других электронов, а также электрическое притяжение от ядра. [99] В щелочных металлах самый внешний электрон чувствует только чистый заряд +1, так как часть ядерного заряда (который равен атомному номеру ) компенсируется внутренними электронами; число внутренних электронов щелочного металла всегда на один меньше ядерного заряда. Поэтому единственным фактором, который влияет на атомный радиус щелочных металлов, является число электронных оболочек. Поскольку это число увеличивается вниз по группе, атомный радиус также должен увеличиваться вниз по группе. [71]
Ионные радиусы щелочных металлов намного меньше их атомных радиусов. Это происходит потому, что внешний электрон щелочных металлов находится в другой электронной оболочке, чем внутренние электроны, и, таким образом, когда он удаляется, полученный атом имеет на одну электронную оболочку меньше и становится меньше. Кроме того, эффективный заряд ядра увеличился, и, таким образом, электроны сильнее притягиваются к ядру, и ионный радиус уменьшается. [5]

Первая энергия ионизации элемента или молекулы — это энергия, необходимая для перемещения наиболее слабо удерживаемого электрона из одного моля газообразных атомов элемента или молекул для образования одного моля газообразных ионов с электрическим зарядом +1. Факторами, влияющими на первую энергию ионизации, являются заряд ядра , величина экранирования внутренними электронами и расстояние от наиболее слабо удерживаемого электрона до ядра, которое всегда является внешним электроном в элементах главной группы . Первые два фактора изменяют эффективный заряд ядра, который ощущает наиболее слабо удерживаемый электрон. Поскольку наиболее удаленный электрон щелочных металлов всегда ощущает тот же эффективный заряд ядра (+1), единственным фактором, влияющим на первую энергию ионизации, является расстояние от наиболее удаленного электрона до ядра. Поскольку это расстояние увеличивается вниз по группе, наиболее удаленный электрон ощущает меньшее притяжение со стороны ядра, и, таким образом, первая энергия ионизации уменьшается. [71] Эта тенденция нарушается во франции из-за релятивистской стабилизации и сжатия 7s-орбитали, что приближает валентный электрон франция к ядру, чем можно было бы ожидать из нерелятивистских расчетов. Это заставляет внешний электрон франция чувствовать большее притяжение со стороны ядра, увеличивая его первую энергию ионизации немного больше, чем у цезия. [36] : 1729
Вторая энергия ионизации щелочных металлов намного выше первой, поскольку второй по слабости электрон является частью полностью заполненной электронной оболочки и, таким образом, его трудно удалить. [5]
Реакционная способность щелочных металлов увеличивается по мере продвижения вниз по группе. Это является результатом комбинации двух факторов: первой энергии ионизации и энергии атомизации щелочных металлов. Поскольку первая энергия ионизации щелочных металлов уменьшается по мере продвижения вниз по группе, наиболее удаленному электрону легче удалиться от атома и участвовать в химических реакциях , тем самым увеличивая реакционную способность вниз по группе. Энергия атомизации измеряет прочность металлической связи элемента, которая ослабевает по мере продвижения вниз по группе по мере увеличения радиуса атомов , и, таким образом, металлическая связь должна увеличиваться в длине, делая делокализованные электроны дальше от притяжения ядер более тяжелых щелочных металлов. Сложение энергий атомизации и первой энергии ионизации дает величину, тесно связанную (но не равную) с энергией активации реакции щелочного металла с другим веществом. Эта величина уменьшается по мере продвижения вниз по группе, как и энергия активации; таким образом, химические реакции могут происходить быстрее, а реакционная способность увеличивается вниз по группе. [100]
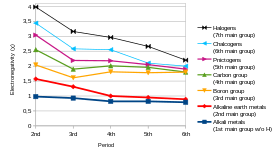
Электроотрицательность — это химическое свойство , которое описывает тенденцию атома или функциональной группы притягивать электроны (или электронную плотность ) к себе. [101] Если бы связь между натрием и хлором в хлориде натрия была ковалентной , пара общих электронов притягивалась бы к хлору, поскольку эффективный ядерный заряд на внешних электронах равен +7 в хлоре, но только +1 в натрии. Электронная пара притягивается так близко к атому хлора, что они практически переносятся на атом хлора ( ионная связь ). Однако, если атом натрия был заменен атомом лития, электроны не будут притягиваться так близко к атому хлора, как раньше, поскольку атом лития меньше, что делает электронную пару более сильно притягивающейся к более близкому эффективному ядерному заряду от лития. Следовательно, более крупные атомы щелочных металлов (дальше по группе) будут менее электроотрицательными, поскольку связывающая пара менее сильно притягивается к ним. Как упоминалось ранее, ожидается, что франций будет исключением. [71]
Из-за более высокой электроотрицательности лития некоторые из его соединений имеют более ковалентный характер. Например, иодид лития (LiI) растворяется в органических растворителях , что является свойством большинства ковалентных соединений. [71] Фторид лития (LiF) является единственным галогенидом щелочного металла , который не растворяется в воде, [5] а гидроксид лития (LiOH) является единственным гидроксидом щелочного металла , который не расплывается . [5]
Температура плавления вещества — это точка, в которой оно меняет состояние с твердого на жидкое, в то время как точка кипения вещества (в жидком состоянии) — это точка, в которой давление паров жидкости равно давлению окружающей среды, окружающей жидкость [102] [103], и вся жидкость меняет состояние на газообразное. Когда металл нагревается до температуры плавления, металлические связи, удерживающие атомы на месте, ослабевают, так что атомы могут перемещаться, и металлические связи в конечном итоге полностью разрываются в точке кипения металла. [71] [104] Таким образом, падение температур плавления и кипения щелочных металлов указывает на то, что прочность металлических связей щелочных металлов уменьшается вниз по группе. [71] Это происходит потому, что атомы металла удерживаются вместе электромагнитным притяжением от положительных ионов к делокализованным электронам. [71] [104] По мере того, как атомы увеличиваются в размерах по мере продвижения вниз по группе (потому что их атомный радиус увеличивается), ядра ионов отдаляются от делокализованных электронов, и, следовательно, металлическая связь становится слабее, так что металл может легче плавиться и кипеть, тем самым понижая температуры плавления и кипения. [71] Увеличенный заряд ядра не является значимым фактором из-за экранирующего эффекта. [71]
Все щелочные металлы имеют одинаковую кристаллическую структуру ( объемно-центрированная кубическая ) [10] , и поэтому единственными значимыми факторами являются количество атомов, которые могут поместиться в определенный объем, и масса одного из атомов, поскольку плотность определяется как масса на единицу объема. Первый фактор зависит от объема атома и, следовательно, атомного радиуса, который увеличивается с понижением группы; таким образом, объем атома щелочного металла увеличивается с понижением группы. Масса атома щелочного металла также увеличивается с понижением группы. Таким образом, тенденция плотностей щелочных металлов зависит от их атомных весов и атомных радиусов; если известны значения этих двух факторов, то можно рассчитать соотношения между плотностями щелочных металлов. Результирующая тенденция заключается в том, что плотности щелочных металлов увеличиваются вниз по таблице, за исключением калия. Из-за того, что у них самый низкий атомный вес и самый большой атомный радиус из всех элементов в их периодах, щелочные металлы являются наименее плотными металлами в периодической таблице. [71] Литий, натрий и калий — единственные три металла в периодической таблице, которые менее плотны, чем вода: [5] фактически, литий является наименее плотным известным твердым веществом при комнатной температуре . [10] : 75
Щелочные металлы образуют полный ряд соединений со всеми обычно встречающимися анионами, которые хорошо иллюстрируют групповые тенденции. Эти соединения можно описать как включающие щелочные металлы, теряющие электроны акцепторным видам и образующие моноположительные ионы. [10] : 79 Это описание наиболее точно для галогенидов щелочных металлов и становится все менее и менее точным по мере увеличения катионного и анионного заряда, а также по мере того, как анион становится больше и более поляризуемым. Например, ионная связь уступает место металлической связи вдоль ряда NaCl, Na 2 O, Na 2 S, Na 3 P, Na 3 As, Na 3 Sb, Na 3 Bi, Na. [10] : 81

Все щелочные металлы бурно или взрывчато реагируют с холодной водой, образуя водный раствор сильноосновного гидроксида щелочного металла и выделяя газообразный водород. [100] Эта реакция становится более бурной по мере продвижения вниз по группе: литий реагирует устойчиво с вскипанием , но натрий и калий могут воспламеняться, а рубидий и цезий тонут в воде и выделяют газообразный водород так быстро, что в воде образуются ударные волны, которые могут разбить стеклянные контейнеры. [5] Когда щелочной металл падает в воду, он производит взрыв, который состоит из двух отдельных стадий. Сначала металл реагирует с водой, разрывая водородные связи в воде и выделяя газообразный водород; это происходит быстрее для более реактивных тяжелых щелочных металлов. Во-вторых, тепло, выделяемое первой частью реакции, часто воспламеняет газообразный водород, заставляя его взрывообразно гореть в окружающем воздухе. Этот вторичный взрыв газообразного водорода производит видимое пламя над чашей с водой, озером или другим водоемом, а не первоначальную реакцию металла с водой (которая, как правило, происходит в основном под водой). [74] Гидроксиды щелочных металлов являются наиболее основными известными гидроксидами. [10] : 87
Недавние исследования показали, что взрывное поведение щелочных металлов в воде обусловлено кулоновским взрывом , а не только быстрым образованием самого водорода. [105] Все щелочные металлы плавятся в ходе реакции с водой. Молекулы воды ионизируют голую металлическую поверхность жидкого металла, оставляя положительно заряженную металлическую поверхность и отрицательно заряженные ионы воды. Притяжение между заряженным металлом и ионами воды быстро увеличит площадь поверхности, вызывая экспоненциальное увеличение ионизации. Когда силы отталкивания внутри поверхности жидкого металла превышают силы поверхностного натяжения, он энергично взрывается. [105]
Сами гидроксиды являются наиболее основными известными гидроксидами, реагирующими с кислотами с образованием солей и со спиртами с образованием олигомерных алкоксидов . Они легко реагируют с диоксидом углерода с образованием карбонатов или бикарбонатов , или с сероводородом с образованием сульфидов или бисульфидов , и могут использоваться для отделения тиолов от нефти. Они реагируют с амфотерными оксидами: например, оксиды алюминия , цинка , олова и свинца реагируют с гидроксидами щелочных металлов с образованием алюминатов, цинкатов, станнатов и плюмбатов. Диоксид кремния является кислотным, и поэтому гидроксиды щелочных металлов также могут воздействовать на силикатное стекло . [10] : 87

Щелочные металлы образуют множество интерметаллических соединений друг с другом и с элементами групп 2–13 периодической таблицы с различной стехиометрией, [10] : 81 например, амальгамы натрия с ртутью , включая Na5Hg8 и Na3Hg . [ 106] Некоторые из них имеют ионные характеристики : если взять, например, сплавы с золотом, самым электроотрицательным из металлов, то NaAu и KAu являются металлами, а RbAu и CsAu являются полупроводниками . [10] : 81 NaK — это сплав натрия и калия, который очень полезен, поскольку он жидкий при комнатной температуре, хотя необходимо соблюдать меры предосторожности из-за его чрезвычайной реакционной способности по отношению к воде и воздуху. Эвтектическая смесь плавится при температуре -12,6 °C. [107] Сплав 41% цезия, 47% натрия и 12% калия имеет самую низкую известную температуру плавления среди всех металлов и сплавов, −78 °C. [22]
Интерметаллические соединения щелочных металлов с более тяжелыми элементами группы 13 (алюминий, галлий , индий и таллий ), такие как NaTl, являются плохими проводниками или полупроводниками , в отличие от обычных сплавов с предыдущими элементами, что подразумевает, что вовлеченный щелочной металл потерял электрон из-за вовлеченных анионов Цинтля . [108] Тем не менее, в то время как элементы в группе 14 и далее имеют тенденцию образовывать дискретные анионные кластеры, элементы группы 13 имеют тенденцию образовывать полимерные ионы с катионами щелочных металлов, расположенными между гигантской ионной решеткой. Например, NaTl состоит из полимерного аниона (—Tl − —) n с ковалентной алмазной кубической структурой с ионами Na +, расположенными между анионной решеткой. Более крупные щелочные металлы не могут аналогично вписаться в анионную решетку и имеют тенденцию заставлять более тяжелые элементы группы 13 образовывать анионные кластеры. [109]
Бор является особым случаем, будучи единственным неметаллом в группе 13. Бориды щелочных металлов , как правило, богаты бором, включая заметные связи бор-бор с участием дельтаэдрических структур, [10] : 147–8 и термически нестабильны из-за того, что щелочные металлы имеют очень высокое давление паров при повышенных температурах. Это делает прямой синтез проблематичным, поскольку щелочные металлы не реагируют с бором ниже 700 °C, и, таким образом, это должно быть выполнено в герметичных контейнерах с избытком щелочного металла. Кроме того, в исключительной ситуации в этой группе реакционная способность с бором уменьшается вниз по группе: литий полностью реагирует при 700 °C, но натрий при 900 °C, а калий не ранее 1200 °C, и реакция является мгновенной для лития, но занимает часы для калия. Бориды рубидия и цезия даже не были охарактеризованы. Известны различные фазы, такие как LiB 10 , NaB 6 , NaB 15 и KB 6 . [110] [111] Под высоким давлением связь бор-бор в боридах лития изменяется от следования правилам Уэйда к образованию анионов Цинтля, как и в остальной части группы 13. [112]
Литий и натрий реагируют с углеродом , образуя ацетилиды Li 2 C 2 и Na 2 C 2 , которые также могут быть получены реакцией металла с ацетиленом . Калий, рубидий и цезий реагируют с графитом ; их атомы интеркалируются между гексагональными слоями графита, образуя интеркалированные соединения графита с формулами MC 60 (темно-серый, почти черный), MC 48 (темно-серый, почти черный), MC 36 (синий), MC 24 (стально-синий) и MC 8 (бронзовый) (M = K, Rb или Cs). Эти соединения более чем в 200 раз более электропроводны, чем чистый графит, что позволяет предположить, что валентный электрон щелочного металла переносится в слои графита (например, M + C−8). [65] При нагревании KC 8 удаление атомов калия приводит к последовательному преобразованию в KC 24 , KC 36 , KC 48 и, наконец, KC 60 . KC 8 является очень сильным восстановителем , пирофорен и взрывается при контакте с водой. [113] [114] В то время как более крупные щелочные металлы (K, Rb и Cs) изначально образуют MC 8 , более мелкие изначально образуют MC 6 , и действительно, для их образования требуется реакция металлов с графитом при высоких температурах около 500 °C. [115] Помимо этого, щелочные металлы являются настолько сильными восстановителями, что они могут даже восстанавливать бакминстерфуллерен с образованием твердых фуллеридов M n C 60 ; Натрий, калий, рубидий и цезий могут образовывать фуллериды, где n = 2, 3, 4 или 6, а рубидий и цезий дополнительно могут достигать n = 1. [10] : 285
При взаимодействии щелочных металлов с более тяжелыми элементами углеродной группы ( кремний , германий , олово и свинец) образуются ионные вещества с клеточной структурой, такие как силициды M4Si4 (M = K, Rb или Cs), которые содержат M + и тетраэдрический Si .4−4ионы. [65] Химия германидов щелочных металлов , включающая германид-ион Ge 4− и другие кластерные ( цинтлевые ) ионы, такие как Ge2−4, Ге4−9, Ге2−9, и [(Ge 9 ) 2 ] 6− , во многом аналогичен соответствующим силицидам. [10] : 393 Станниды щелочных металлов в основном ионные, иногда с ионом станнида ( Sn 4− ), [109] а иногда с более сложными ионами Цинтля, такими как Sn4−9, который появляется в тетракалий нонастанниде (K 4 Sn 9 ). [116] Одноатомный ион плюмбида ( Pb 4− ) неизвестен, и действительно, его образование, как предсказывают, энергетически невыгодно; плюмбиды щелочных металлов имеют сложные ионы Цинтля, такие как Pb4−9. Эти германиды, станниды и плюмбиды щелочных металлов могут быть получены путем восстановления германия, олова и свинца металлическим натрием в жидком аммиаке. [10] : 394

Литий, самый легкий из щелочных металлов, является единственным щелочным металлом, который реагирует с азотом при стандартных условиях , а его нитрид является единственным стабильным нитридом щелочного металла. Азот является инертным газом, поскольку разрыв прочной тройной связи в молекуле диазота (N2 ) требует большого количества энергии. Образование нитрида щелочного металла потребляет энергию ионизации щелочного металла (образуя ионы M + ), энергию, необходимую для разрыва тройной связи в N2 и образования ионов N3− , а вся энергия, высвобождаемая при образовании нитрида щелочного металла, исходит из энергии решетки нитрида щелочного металла. Энергия решетки максимизируется с помощью небольших, высокозаряженных ионов; щелочные металлы не образуют высокозаряженных ионов, образуя только ионы с зарядом +1, поэтому только литий, самый маленький щелочной металл, может высвободить достаточно энергии решетки, чтобы сделать реакцию с азотом экзотермической , образуя нитрид лития . Реакции других щелочных металлов с азотом не высвободят достаточно энергии решетки и, таким образом, будут эндотермическими , поэтому они не образуют нитриды при стандартных условиях. [84] Нитрид натрия (Na 3 N) и нитрид калия (K 3 N), хотя и существуют, крайне нестабильны, склонны к обратному разложению на составляющие их элементы и не могут быть получены путем взаимодействия элементов друг с другом при стандартных условиях. [118] [119] Стерические препятствия запрещают существование нитрида рубидия или цезия. [10] : 417 Однако натрий и калий образуют бесцветные азидные соли, включающие линейную N−3анион; из-за большого размера катионов щелочных металлов они достаточно термически стабильны, чтобы иметь возможность плавиться перед разложением. [10] : 417
Все щелочные металлы легко реагируют с фосфором и мышьяком, образуя фосфиды и арсениды с формулой M 3 Pn (где M представляет собой щелочной металл, а Pn представляет собой пниктоген – фосфор, мышьяк, сурьму или висмут ). Это связано с большим размером ионов P 3− и As 3− , поэтому для образования солей требуется высвобождение меньшей энергии решетки. [65] Это не единственные фосфиды и арсениды щелочных металлов: например, у калия есть девять различных известных фосфидов с формулами K 3 P, K 4 P 3 , K 5 P 4 , KP, K 4 P 6 , K 3 P 7 , K 3 P 11 , KP 10.3 и KP 15 . [120] В то время как большинство металлов образуют арсениды, только щелочные и щелочноземельные металлы образуют в основном ионные арсениды. Структура Na 3 As является сложной с необычно короткими расстояниями Na–Na 328–330 пм, которые короче, чем в металлическом натрии, и это указывает на то, что даже с этими электроположительными металлами связь не может быть прямо ионной. [10] Известны другие арсениды щелочных металлов , не соответствующие формуле M 3 As, такие как LiAs, который имеет металлический блеск и электропроводность, указывающую на наличие некоторой металлической связи . [10] Антимониды нестабильны и реакционноспособны, поскольку ион Sb 3− является сильным восстановителем; их реакция с кислотами образует токсичный и нестабильный газ стибин (SbH 3 ). [121] Действительно, они обладают некоторыми металлическими свойствами, и антимониды щелочных металлов стехиометрии MSb включают атомы сурьмы, связанные в спиральной структуре Цинтля. [122] Висмутиды даже не являются полностью ионными; они представляют собой интерметаллические соединения, содержащие частично металлические и частично ионные связи. [123]
Все щелочные металлы бурно реагируют с кислородом при стандартных условиях. Они образуют различные типы оксидов, такие как простые оксиды (содержащие ион O 2− ), пероксиды (содержащие ион O2−2ион, где есть одинарная связь между двумя атомами кислорода), супероксиды (содержащие O−2ион) и многие другие. Литий горит на воздухе, образуя оксид лития , а натрий реагирует с кислородом, образуя смесь оксида натрия и пероксида натрия . Калий образует смесь пероксида калия и супероксида калия , тогда как рубидий и цезий образуют исключительно супероксид. Их реакционная способность увеличивается по мере продвижения вниз по группе: в то время как литий, натрий и калий просто горят на воздухе, рубидий и цезий являются пирофорными (спонтанно загораются на воздухе). [84]
Меньшие щелочные металлы имеют тенденцию поляризовать более крупные анионы (пероксид и супероксид) из-за их малого размера. Это притягивает электроны в более сложных анионах к одному из его составляющих атомов кислорода, образуя ион оксида и атом кислорода. Это заставляет литий образовывать оксид исключительно при реакции с кислородом при комнатной температуре. Этот эффект резко ослабевает для более крупных натрия и калия, позволяя им образовывать менее стабильные пероксиды. Рубидий и цезий, находящиеся в нижней части группы, настолько велики, что могут образовываться даже наименее стабильные супероксиды. Поскольку супероксид выделяет больше всего энергии при образовании, супероксид предпочтительно образуется для более крупных щелочных металлов, где более сложные анионы не поляризованы. Оксиды и пероксиды для этих щелочных металлов существуют, но не образуются при прямой реакции металла с кислородом при стандартных условиях. [84] Кроме того, небольшой размер ионов Li + и O 2− способствует формированию ими стабильной структуры ионной решетки. Однако в контролируемых условиях все щелочные металлы, за исключением франция, как известно, образуют свои оксиды, пероксиды и супероксиды. Пероксиды и супероксиды щелочных металлов являются мощными окислителями . Пероксид натрия и супероксид калия реагируют с углекислым газом, образуя карбонат щелочного металла и газообразный кислород, что позволяет использовать их в подводных воздухоочистителях; присутствие водяного пара , естественно присутствующего в дыхании, делает удаление углекислого газа супероксидом калия еще более эффективным. [65] [124] Все стабильные щелочные металлы, за исключением лития, могут образовывать красные озониды (MO 3 ) посредством низкотемпературной реакции порошкообразного безводного гидроксида с озоном : озониды затем могут быть извлечены с помощью жидкого аммиака . Они медленно разлагаются при стандартных условиях на супероксиды и кислород и немедленно гидролизуются до гидроксидов при контакте с водой. [10] : 85 Калий, рубидий и цезий также образуют полуторные оксиды M 2 O 3 , которые лучше рассматривать как пероксидные дисупероксиды, [(M + ) 4 (O2−2)(О−2) 2 ] . [10] : 85
Рубидий и цезий могут образовывать большое разнообразие субоксидов с металлами в формальных степенях окисления ниже +1. [10] : 85 Рубидий может образовывать Rb 6 O и Rb 9 O 2 (медного цвета) при окислении на воздухе, в то время как цезий образует огромное разнообразие оксидов, таких как озонид CsO 3 [125] [126] и несколько ярко окрашенных субоксидов , [127] таких как Cs 7 O (бронзовый), Cs 4 O (красно-фиолетовый), Cs 11 O 3 (фиолетовый), Cs 3 O (темно-зеленый), [128] CsO, Cs 3 O 2 , [129] а также Cs 7 O 2 . [130] [131] Последний из них может быть нагрет в вакууме для получения Cs 2 O. [56]
Щелочные металлы также могут реагировать аналогично с более тяжелыми халькогенами ( сера , селен , теллур и полоний ), и известны все халькогениды щелочных металлов (за исключением франция). Реакция с избытком халькогена может аналогичным образом приводить к образованию низших халькогенидов, с ионами халькогена, содержащими цепи рассматриваемых атомов халькогена. Например, натрий может реагировать с серой, образуя сульфид ( Na2S ) и различные полисульфиды с формулой Na2Sx ( x от 2 до 6), содержащие S2−
хионы. [65] Благодаря основности ионов Se 2− и Te 2− селениды и теллуриды щелочных металлов имеют щелочную среду в растворе; при непосредственном взаимодействии с селеном и теллуром образуются полиселениды и полителлуриды щелочных металлов наряду с селенидами и теллуридами с Se2−
хи Те2−
хионы. [132] Их можно получить непосредственно из элементов в жидком аммиаке или при отсутствии воздуха, и они представляют собой бесцветные, водорастворимые соединения, которые на воздухе быстро окисляются обратно в селен или теллур. [10] : 766 Все полониды щелочных металлов представляют собой ионные соединения, содержащие ион Po 2− ; они очень химически стабильны и могут быть получены прямой реакцией элементов при температуре около 300–400 °C. [10] : 766 [133] [134]
Щелочные металлы являются одними из самых электроположительных элементов в периодической таблице и, таким образом, имеют тенденцию к ионным связям с самыми электроотрицательными элементами в периодической таблице, галогенами ( фтор , хлор , бром , йод и астат ), образуя соли , известные как галогениды щелочных металлов. Реакция очень бурная и иногда может приводить к взрывам. [10] : 76 Известны все двадцать стабильных галогенидов щелочных металлов; нестабильные неизвестны, за исключением астатида натрия, из-за большой нестабильности и редкости астата и франция. Самым известным из двадцати, безусловно, является хлорид натрия , также известный как поваренная соль. Все стабильные галогениды щелочных металлов имеют формулу MX, где M — щелочной металл, а X — галоген. Все они представляют собой белые ионные кристаллические твердые вещества с высокими температурами плавления. [5] [84] Все галогениды щелочных металлов растворимы в воде, за исключением фторида лития (LiF), который нерастворим в воде из-за очень высокой энтальпии решетки . Высокая энтальпия решетки фторида лития обусловлена малыми размерами ионов Li + и F − , что приводит к сильному электростатическому взаимодействию между ними: [5] аналогичный эффект наблюдается для фторида магния , что согласуется с диагональной связью между литием и магнием. [10] : 76
Щелочные металлы также реагируют аналогичным образом с водородом, образуя ионные гидриды щелочных металлов, где гидрид- анион действует как псевдогалогенид : они часто используются в качестве восстановителей, образуя гидриды, сложные гидриды металлов или газообразный водород. [10] : 83 [65] Известны также другие псевдогалогениды, в частности цианиды . Они изоструктурны соответствующим галогенидам, за исключением цианида лития , что указывает на то, что ионы цианида могут свободно вращаться. [ 10] : 322 Известны также тройные оксиды галогенидов щелочных металлов, такие как Na3ClO , K3BrO (желтый), Na4Br2O , Na4I2O и K4Br2O . [ 10 ] : 83 Полигалогениды довольно нестабильны, хотя полигалогениды рубидия и цезия в значительной степени стабилизированы слабой поляризующей способностью этих чрезвычайно больших катионов. [10] : 835
Катионы щелочных металлов обычно не образуют координационные комплексы с простыми основаниями Льюиса из-за их низкого заряда, составляющего всего +1, и их относительно большого размера; таким образом, ион Li + образует большинство комплексов, а более тяжелые ионы щелочных металлов образуют все меньше и меньше (хотя исключения случаются для слабых комплексов). [10] : 90 Литий, в частности, имеет очень богатую координационную химию, в которой он демонстрирует координационные числа от 1 до 12, хотя октаэдрическая гексакоординация является его предпочтительным режимом. [10] : 90–1 В водном растворе ионы щелочных металлов существуют в виде октаэдрических гексагидратных комплексов [M(H 2 O) 6 ] + , за исключением иона лития, который из-за своего малого размера образует тетраэдрические тетрагидратные комплексы [Li(H 2 O) 4 ] + ; щелочные металлы образуют эти комплексы, потому что их ионы притягиваются электростатическими силами притяжения к полярным молекулам воды. Из-за этого безводные соли, содержащие катионы щелочных металлов, часто используются в качестве осушителей . [65] Щелочные металлы также легко образуют комплексы с краун-эфирами (например, 12-краун-4 для Li + , 15-краун-5 для Na + , 18-краун-6 для K + и 21-краун-7 для Rb + ) и криптандами из-за электростатического притяжения. [65]
Щелочные металлы медленно растворяются в жидком аммиаке , образуя аммиачные растворы сольватированного катиона металла M + и сольватированного электрона e − , которые реагируют с образованием газообразного водорода и амида щелочного металла (MNH 2 , где M представляет собой щелочной металл): это было впервые отмечено Гемфри Дэви в 1809 году и переоткрыто В. Вейлем в 1864 году. Процесс может быть ускорен катализатором . Аналогичные растворы образуют тяжелые двухвалентные щелочноземельные металлы кальций , стронций , барий , а также двухвалентные лантаноиды , европий и иттербий . Амидная соль совершенно нерастворима и легко выпадает в осадок из раствора, оставляя интенсивно окрашенные аммиачные растворы щелочных металлов. В 1907 году Чарльз А. Краус определил, что цвет обусловлен наличием сольватированных электронов , которые способствуют высокой электропроводности этих растворов. При низких концентрациях (ниже 3 М) раствор темно-синий и имеет в десять раз большую проводимость, чем водный раствор хлорида натрия ; при более высоких концентрациях (выше 3 М) раствор имеет медный цвет и имеет приблизительно такую же проводимость, как жидкие металлы, такие как ртуть . [10] [65] [136] Помимо соли амида щелочного металла и сольватированных электронов, такие растворы аммиака также содержат катион щелочного металла (M + ), нейтральный атом щелочного металла (M ), двухатомные молекулы щелочного металла (M 2 ) и анионы щелочного металла (M − ). Они нестабильны и в конечном итоге становятся более термодинамически стабильными амидом щелочного металла и газообразным водородом. Сольватированные электроны являются мощными восстановителями и часто используются в химическом синтезе. [65]
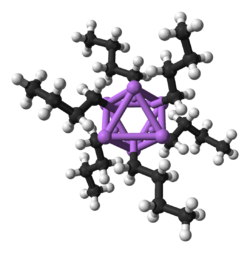
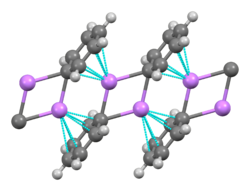
Будучи наименьшим щелочным металлом, литий образует самое большое разнообразие и наиболее стабильных металлоорганических соединений , которые связаны ковалентно. Литийорганические соединения являются электрически непроводящими летучими твердыми веществами или жидкостями, которые плавятся при низких температурах и имеют тенденцию образовывать олигомеры со структурой (RLi) x , где R — органическая группа. Поскольку электроположительная природа лития накладывает большую часть плотности заряда связи на атом углерода, эффективно создавая карбанион , литийорганические соединения являются чрезвычайно мощными основаниями и нуклеофилами . Для использования в качестве оснований часто используются бутиллитии , которые имеются в продаже. Примером литийорганического соединения является метиллитий (( CH3Li ) x ), который существует в тетрамерной ( x = 4, тетраэдрический) и гексамерной ( x = 6, октаэдрический) формах. [65] [140] Литийорганические соединения, особенно н -бутиллитий, являются полезными реагентами в органическом синтезе, как и следовало ожидать, учитывая диагональную связь лития с магнием, который играет важную роль в реакции Гриньяра . [10] : 102 Например, алкиллитии и ариллитии могут быть использованы для синтеза альдегидов и кетонов путем реакции с карбонилами металлов . Реакция с тетракарбонилом никеля , например, протекает через нестабильный ацил-никель-карбонильный комплекс, который затем подвергается электрофильному замещению с получением желаемого альдегида (с использованием H + в качестве электрофила) или кетона (с использованием алкилгалогенида) продукта. [10] : 105
Алкиллитии и ариллитии также могут реагировать с N , N -дизамещенными амидами , давая альдегиды и кетоны, а также симметричные кетоны, реагируя с оксидом углерода . Они термически разлагаются, чтобы устранить β-водород, производя алкены и гидрид лития : другой путь - это реакция эфиров с алкил- и ариллитиями, которые действуют как сильные основания. [10] : 105 В неполярных растворителях ариллитии реагируют как карбанионы, которыми они фактически являются, превращая диоксид углерода в ароматические карбоновые кислоты (ArCO 2 H), а арилкетоны - в третичные карбинолы (Ar' 2 C(Ar)OH). Наконец, их можно использовать для синтеза других металлоорганических соединений посредством обмена металл-галоген. [10] : 106
В отличие от литийорганических соединений, металлоорганические соединения более тяжелых щелочных металлов являются преимущественно ионными. Применение натрийорганических соединений в химии ограничено отчасти из-за конкуренции со стороны литийорганических соединений , которые коммерчески доступны и проявляют более удобную реакционную способность. Основным натрийорганическим соединением, имеющим коммерческое значение, является циклопентадиенид натрия . Тетрафенилборат натрия также можно классифицировать как натрийорганическое соединение, поскольку в твердом состоянии натрий связан с арильными группами. Металлоорганические соединения высших щелочных металлов еще более реакционноспособны, чем натрийорганические соединения, и имеют ограниченную полезность. Известным реагентом является основание Шлоссера , смесь н -бутиллития и трет- бутоксида калия . Этот реагент реагирует с пропеном , образуя соединение аллилкалий (KCH 2 CHCH 2 ). цис -2-бутен и транс -2-бутен уравновешиваются при контакте со щелочными металлами. В то время как изомеризация быстрая с литием и натрием, она медленная с более тяжелыми щелочными металлами. Более тяжелые щелочные металлы также благоприятствуют стерически перегруженной конформации. [141] Было сообщено о нескольких кристаллических структурах калийорганических соединений, устанавливающих, что они, как и соединения натрия, являются полимерными. [142] Натрийорганические, калийорганические, рубидийорганические и цезиевые соединения в основном являются ионными и нерастворимы (или почти нерастворимы) в неполярных растворителях. [65]
Алкильные и арильные производные натрия и калия имеют тенденцию реагировать с воздухом. Они вызывают расщепление эфиров , образуя алкоксиды. В отличие от алкиллитиевых соединений, алкилнатрий и алкилкалий не могут быть получены путем взаимодействия металлов с алкилгалогенидами, поскольку происходит сочетание Вюрца : [122] : 265
Как таковые, они должны быть получены путем реакции соединений алкилртути с металлическим натрием или калием в инертных углеводородных растворителях. В то время как метилнатрий образует тетрамеры, такие как метиллитий, метилкалий более ионный и имеет структуру арсенида никеля с дискретными анионами метила и катионами калия. [122] : 265
Щелочные металлы и их гидриды реагируют с кислыми углеводородами, например, циклопентадиенами и терминальными алкинами, с образованием солей. Используются жидкий аммиак, эфир или углеводородные растворители, наиболее распространенным из которых является тетрагидрофуран . Наиболее важным из этих соединений является циклопентадиенид натрия , NaC5H5 , важный предшественник многих производных циклопентадиенила переходных металлов. [ 122] : 265 Аналогично , щелочные металлы реагируют с циклооктатетраеном в тетрагидрофуране с образованием циклооктатетраенидов щелочных металлов ; например , дикалийциклооктатетраенид ( K2C8H8 ) является важным предшественником многих производных циклооктатетраенила металлов, таких как ураноцен . [122] : 266 Большие и очень слабо поляризующие катионы щелочных металлов могут стабилизировать большие, ароматические, поляризуемые радикальные анионы, такие как темно-зеленый нафталинид натрия , Na + [C 10 H 8 •] − , сильный восстановитель. [122] : 266
При реакции с кислородом щелочные металлы образуют оксиды , пероксиды , супероксиды и субоксиды . Однако первые три встречаются чаще. В таблице ниже [143] показаны типы соединений, образующихся при реакции с кислородом. Соединение в скобках представляет собой второстепенный продукт сгорания.
Пероксиды щелочных металлов — это ионные соединения, нестабильные в воде. Анион пероксида слабо связан с катионом и гидролизуется, образуя более прочные ковалентные связи.
Другие соединения кислорода также нестабильны в воде.
С серой они образуют сульфиды и полисульфиды . [145]
Поскольку сульфиды щелочных металлов по сути являются солями слабой кислоты и сильного основания, они образуют основные растворы.
Литий — единственный металл, который напрямую соединяется с азотом при комнатной температуре.
Li 3 N может реагировать с водой с выделением аммиака.
С водородом щелочные металлы образуют солевые гидриды , которые гидролизуются в воде.
Литий — единственный металл, который напрямую реагирует с углеродом, образуя дилитийацетилид . Na и K могут реагировать с ацетиленом , образуя ацетилиды . [146]
При реакции с водой они генерируют гидроксид- ионы и водородный газ. Эта реакция является энергичной и высокоэкзотермической, а полученный водород может воспламениться на воздухе или даже взорваться в случае Rb и Cs. [143]
Щелочные металлы являются очень хорошими восстановителями. Они могут восстанавливать катионы металлов, которые менее электроположительны. Титан производится в промышленности путем восстановления тетрахлорида титана с Na при 400 °C ( процесс Ван Аркеля–де Бура ).
Щелочные металлы реагируют с галогенпроизводными с образованием углеводородов по реакции Вюрца .
Щелочные металлы растворяются в жидком аммиаке или других донорных растворителях, таких как алифатические амины или гексаметилфосфорамид, давая синие растворы. Считается, что эти растворы содержат свободные электроны. [143]
Благодаря наличию сольватированных электронов эти растворы являются очень мощными восстановителями, используемыми в органическом синтезе.

Реакция 1) известна как восстановление Берча . Другие восстановления [143] , которые могут быть осуществлены этими растворами:

Хотя франций является самым тяжелым щелочным металлом, который был обнаружен, были некоторые теоретические работы, предсказывающие физические и химические характеристики гипотетических более тяжелых щелочных металлов. Будучи первым элементом 8 периода , неоткрытый элемент унуненний (элемент 119) предположительно будет следующим щелочным металлом после франция и будет вести себя во многом как их более легкие сородичи ; однако также предсказывается, что он будет отличаться от более легких щелочных металлов некоторыми свойствами. [36] : 1729–1730 Его химия, как предсказывают, будет ближе к химии калия [41] или рубидия [36] : 1729–1730 вместо цезия или франция. Это необычно, поскольку периодические тенденции , игнорируя релятивистские эффекты, предсказали бы, что унуненний будет даже более реакционноспособным, чем цезий и франций. Эта пониженная реакционная способность обусловлена релятивистской стабилизацией валентного электрона унуненния, увеличивающей первую энергию ионизации унуненния и уменьшающей металлический и ионный радиусы ; [41] этот эффект уже замечен для франция. [36] : 1729–1730 Это предполагает, что унуненний будет вести себя химически как щелочной металл, что, хотя и вероятно, может быть не так из-за релятивистских эффектов. [148] Релятивистская стабилизация 8s-орбитали также увеличивает электронное сродство унуненния намного больше, чем у цезия и франция; действительно, ожидается, что унуненний будет иметь электронное сродство выше, чем все щелочные металлы, более легкие, чем он. Релятивистские эффекты также вызывают очень большое падение поляризуемости унуненния . [36] : 1729–1730 С другой стороны, прогнозируется, что унуненний продолжит тенденцию к снижению температуры плавления по мере продвижения вниз по группе, и ожидается, что его температура плавления будет находиться в диапазоне от 0 °C до 30 °C. [36] : 1724

Стабилизация валентного электрона унуненния и, таким образом, сокращение 8s-орбитали приводит к снижению его атомного радиуса до 240 пм [36] : 1729–1730, что очень близко к радиусу рубидия (247 пм) [5] , так что химия унуненния в степени окисления +1 должна быть больше похожа на химию рубидия, чем на химию франция. С другой стороны, ионный радиус иона Uue + , как предсказывают, больше, чем у Rb + , поскольку 7p-орбитали дестабилизированы и, таким образом, больше, чем p-орбитали нижних оболочек. Унуненний также может проявлять степени окисления +3 [36] : 1729–1730 и +5 , [149] которые не наблюдаются ни в одном другом щелочном металле, [10] : 28 в дополнение к степени окисления +1, которая характерна для других щелочных металлов и также является основной степенью окисления всех известных щелочных металлов: это происходит из-за дестабилизации и расширения спинора 7p 3/2 , в результате чего его самые внешние электроны имеют более низкую энергию ионизации, чем можно было бы ожидать. [10] : 28 [36] : 1729–1730 Действительно, ожидается, что многие соединения унуненния будут иметь большой ковалентный характер из-за участия электронов 7p 3/2 в связывании. [86]
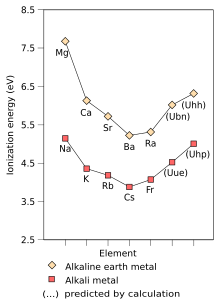
Не так много работы было сделано для предсказания свойств щелочных металлов за пределами унуненния. Хотя простая экстраполяция периодической таблицы (по принципу Ауфбау ) поместила бы элемент 169, унгексенний, под унуненний, вычисления Дирака-Фока предсказывают, что следующим элементом после унуненния со свойствами, подобными свойствам щелочного металла, может быть элемент 165, унгексенний, который, как предсказано, имеет электронную конфигурацию [Og] 5g 18 6f 14 7d 10 8s 2 8p 1/2 2 9s 1 . [36] : 1729–1730 [147] Этот элемент будет промежуточным по свойствам между щелочным металлом и элементом группы 11 , и хотя его физические и атомные свойства будут ближе к первым, его химия может быть ближе к химии последнего. Дальнейшие расчеты показывают, что унгекспенций будет следовать тенденции увеличения энергии ионизации после цезия, имея энергию ионизации, сравнимую с энергией натрия, и что он также должен продолжить тенденцию уменьшения атомных радиусов после цезия, имея атомный радиус, сравнимый с радиусом калия. [36] : 1729–1730 Однако 7d-электроны унгекспенция также могут участвовать в химических реакциях вместе с 9s-электроном, возможно, допуская состояния окисления за пределами +1, откуда и следует вероятное поведение унгекспенция как переходного металла. [36] : 1732–1733 [150] Поскольку щелочные и щелочноземельные металлы являются элементами s-блока , эти прогнозы относительно тенденций и свойств унуненния и унгекспенция также в основном справедливы для соответствующих щелочноземельных металлов унбинилия (Ubn) и унгексгексия (Uhh). [36] : 1729–1733 Унсепттрий, элемент 173, может быть даже лучшим, более тяжелым гомологом унуненния; с предсказанной электронной конфигурацией [Usb] 6g 1 он возвращается к ситуации, подобной щелочному металлу, имея один легко удаляемый электрон намного выше закрытой p-оболочки по энергии, и, как ожидается, будет даже более реакционноспособным, чем цезий. [151] [152]
Вероятные свойства других щелочных металлов за пределами унсептрия еще не были изучены по состоянию на 2019 год, и они могут существовать, а могут и не существовать. [147] В периодах 8 и выше периодической таблицы релятивистские и оболочечные эффекты становятся настолько сильными, что экстраполяции от более легких конгенеров становятся совершенно неточными. Кроме того, релятивистские и оболочечные эффекты (которые стабилизируют s-орбитали и дестабилизируют и расширяют d-, f- и g-орбитали более высоких оболочек) имеют противоположные эффекты, вызывая еще большую разницу между релятивистскими и нерелятивистскими расчетами свойств элементов с такими высокими атомными номерами. [36] : 1732–1733 Интерес к химическим свойствам унуненния, унгекспентия и унсептрия обусловлен тем фактом, что они расположены близко к ожидаемым местоположениям островов стабильности , сосредоточенных вокруг элементов 122 ( 306 Ubb) и 164 ( 482 Uhq). [153] [154] [155]
Многие другие вещества похожи на щелочные металлы в их тенденции образовывать моноположительные катионы. По аналогии с псевдогалогенами , их иногда называют «псевдощелочными металлами». Эти вещества включают некоторые элементы и много больше многоатомных ионов ; многоатомные ионы особенно похожи на щелочные металлы по их большому размеру и слабой поляризующей способности. [156]
Элемент водород , с одним электроном на нейтральный атом, обычно помещается в верхнюю часть группы 1 периодической таблицы из-за его электронной конфигурации. Но водород обычно не считается щелочным металлом. [157] Металлический водород , который существует только при очень высоких давлениях, известен своими электрическими и магнитными свойствами, а не химическими свойствами. [158] При типичных условиях чистый водород существует в виде двухатомного газа, состоящего из двух атомов на молекулу (H 2 ); [159] однако щелочные металлы образуют двухатомные молекулы (такие как дилитий , Li 2 ) только при высоких температурах, когда они находятся в газообразном состоянии. [160]
Водород, как и щелочные металлы, имеет один валентный электрон [122] и легко реагирует с галогенами , [122] но на этом сходство в основном заканчивается из-за малого размера голого протона H + по сравнению с катионами щелочных металлов. [122] Его расположение над литием в первую очередь обусловлено его электронной конфигурацией . [157] Иногда его помещают над фтором из-за их схожих химических свойств, хотя сходство также не абсолютное. [161]
Первая энергия ионизации водорода (1312,0 кДж/моль ) намного выше, чем у щелочных металлов. [162] [163] Поскольку для заполнения внешней оболочки атома водорода требуется только один дополнительный электрон, водород часто ведет себя как галоген, образуя отрицательный ион гидрида , и очень редко считается галогеном на этом основании. (Щелочные металлы также могут образовывать отрицательные ионы, известные как алкалиды , но они представляют собой не более чем лабораторные диковинки, будучи нестабильными.) [79] [80] Аргументом против такого размещения является то, что образование гидрида из водорода является эндотермическим, в отличие от экзотермического образования галогенидов из галогенов. Радиус аниона H− также не соответствует тенденции увеличения размера по мере спуска галогенов: действительно, H− очень размыт, потому что его единственный протон не может легко контролировать оба электрона. [122] : 15–6 Некоторое время ожидалось, что жидкий водород будет проявлять металлические свойства; [161] хотя было показано, что это не так, при чрезвычайно высоких давлениях , таких как те, которые обнаружены в ядрах Юпитера и Сатурна , водород действительно становится металлическим и ведет себя как щелочной металл; в этой фазе он известен как металлический водород . [164] Электрическое сопротивление жидкого металлического водорода при 3000 К приблизительно равно сопротивлению жидких рубидия и цезия при 2000 К при соответствующих давлениях, когда они претерпевают переход из неметалла в металл. [165]
Электронная конфигурация водорода 1s 1 , хотя и аналогична конфигурации щелочных металлов (ns 1 ), уникальна, поскольку не имеет подоболочки 1p. Следовательно, он может потерять электрон, образуя гидрон H + , или получить один, образуя гидрид- ион H − . [10] : 43 В первом случае он внешне напоминает щелочные металлы; во втором случае — галогены, но различия, обусловленные отсутствием подоболочки 1p, достаточно важны, чтобы ни одна из групп не соответствовала свойствам водорода. [10] : 43 Группа 14 также хорошо подходит с точки зрения термодинамических свойств, таких как энергия ионизации и сродство к электрону , но водород не может быть четырехвалентным. Таким образом, ни одно из трех размещений не является полностью удовлетворительным, хотя группа 1 является наиболее распространенным размещением (если оно выбрано) из-за электронной конфигурации и того факта, что гидрон является наиболее важным из всех одноатомных видов водорода, являясь основой кислотно-щелочной химии. [161] В качестве примера неортодоксальных свойств водорода, вытекающих из его необычной электронной конфигурации и малого размера, ион водорода очень мал (радиус около 150 фм по сравнению с размером 50–220 пм большинства других атомов и ионов) и поэтому не существует в конденсированных системах, кроме как в ассоциации с другими атомами или молекулами. Действительно, перенос протонов между химическими веществами является основой кислотно-щелочной химии . [10] : 43 Также уникальной является способность водорода образовывать водородные связи , которые являются эффектом переноса заряда, электростатического и электронно-коррелятивного вклада явлений. [161] Хотя аналогичные литиевые связи также известны, они в основном электростатические. [161] Тем не менее, водород может играть ту же структурную роль, что и щелочные металлы в некоторых молекулярных кристаллах, и имеет тесную связь с самыми легкими щелочными металлами (особенно литием). [166]

Ион аммония ( NH+4) имеет очень похожие свойства с более тяжелыми щелочными металлами, выступая в качестве щелочного металла, промежуточного между калием и рубидием, [156] [167] [168] и часто считается близким родственником. [169] [170] [171] Например, большинство солей щелочных металлов растворимы в воде, свойство, которое разделяют соли аммония. [ 172] Ожидается, что аммоний будет вести себя стабильно как металл ( NH+4ионы в море делокализованных электронов) при очень высоких давлениях (хотя и меньше типичного давления, при котором происходят переходы от изолирующего к металлическому поведению, около 100 ГПа ), и, возможно, могут происходить внутри ледяных гигантов Урана и Нептуна , что может оказать значительное влияние на их внутренние магнитные поля. [170] [171] Было подсчитано, что переход от смеси молекул аммиака и дигидрогена к металлическому аммонию может происходить при давлениях чуть ниже 25 ГПа. [170] В стандартных условиях аммоний может образовывать металлическую амальгаму с ртутью. [173]
Другие «псевдощелочные металлы» включают катионы алкиламмония , в которых некоторые атомы водорода в катионе аммония замещены алкильными или арильными группами. В частности, катионы четвертичного аммония ( NR+4) очень полезны, поскольку они постоянно заряжены, и их часто используют в качестве альтернативы дорогостоящим Cs + для стабилизации очень больших и очень легко поляризуемых анионов, таких как HI−2. [10] : 812–9 Тетраалкиламмониевые гидроксиды, как и гидроксиды щелочных металлов, являются очень сильными основаниями, которые реагируют с атмосферным углекислым газом с образованием карбонатов. [122] : 256 Кроме того, атом азота может быть заменен атомом фосфора, мышьяка или сурьмы (более тяжелые неметаллические пниктогены ), создавая фосфоний ( PH+4) или арсоний ( AsH+4) катион, который сам по себе может быть замещен аналогичным образом; в то время как стибоний ( SbH+4) сам по себе неизвестен, некоторые из его органических производных охарактеризованы. [156]
Кобальтоцен , Co(C 5 H 5 ) 2 , является металлоценом , кобальтовым аналогом ферроцена . Это темно-фиолетовое твердое вещество. Кобальтоцен имеет 19 валентных электронов, на один больше, чем обычно встречается в органопереходных металлических комплексах, таких как его очень стабильный родственник ферроцен, в соответствии с правилом 18 электронов . Этот дополнительный электрон занимает орбиталь, которая является антисвязывающей по отношению к связям Co–C. Следовательно, многие химические реакции Co(C 5 H 5 ) 2 характеризуются его тенденцией терять этот «дополнительный» электрон, давая очень стабильный 18-электронный катион, известный как кобальтоцений. Многие соли кобальтоцения соосаждаются с солями цезия, а гидроксид кобальтоцения является сильным основанием, которое поглощает атмосферный углекислый газ, образуя карбонат кобальтоцения. [122] : 256 Подобно щелочным металлам, кобальтоцен является сильным восстановителем, а декаметилкобальтоцен еще сильнее из-за объединенного индуктивного эффекта десяти метильных групп. [174] Кобальт может быть заменен его более тяжелым родственником родием, чтобы получить родоцен , еще более сильный восстановитель. [175] Иридоцен (с участием иридия ), по-видимому, был бы еще более сильным, но не очень хорошо изучен из-за своей нестабильности. [176]

Таллий является самым тяжелым стабильным элементом в группе 13 периодической таблицы. В нижней части периодической таблицы эффект инертной пары довольно силен из-за релятивистской стабилизации 6s-орбитали и уменьшения энергии связи по мере увеличения размера атомов, так что количество энергии, выделяемой при образовании еще двух связей, не стоит высоких энергий ионизации 6s-электронов. [10] : 226–7 Он демонстрирует степень окисления +1 [10] : 28 , которую демонстрируют все известные щелочные металлы, [10] : 28 и соединения таллия с таллием в степени окисления +1 очень похожи на соответствующие соединения калия или серебра стехиометрически из-за схожих ионных радиусов ионов Tl + (164 пм ), K + (152 пм) и Ag + (129 пм). [177] [178] Иногда его считали щелочным металлом в континентальной Европе (но не в Англии) в годы, непосредственно последовавшие за его открытием, [178] : 126 , и он был помещен сразу после цезия как шестой щелочной металл в периодической таблице Дмитрия Менделеева 1869 года и периодической таблице Юлиуса Лотара Мейера 1868 года. [21] Периодическая таблица Менделеева 1871 года и периодическая таблица Мейера 1870 года поместили таллий на его нынешнее положение в группе бора и оставили место под цезием пустым. [21] Однако таллий также проявляет степень окисления +3, [10] : 28 , которую не проявляет ни один известный щелочной металл [10] : 28 (хотя предсказывают, что унуненний, неоткрытый седьмой щелочной металл, возможно, проявляет степень окисления +3). [36] : 1729–1730 Шестым щелочным металлом теперь считается франций. [179] В то время как Tl + стабилизируется эффектом инертной пары, эта инертная пара 6s-электронов все еще способна участвовать химически, так что эти электроны стереохимически активны в водном растворе. Кроме того, галогениды таллия (кроме TlF ) совершенно нерастворимы в воде, а TlI имеет необычную структуру из-за присутствия стереохимически активной инертной пары в таллии. [180]
Металлы 11-й группы (или монетные металлы), медь, серебро и золото, обычно классифицируются как переходные металлы, поскольку они могут образовывать ионы с неполными d-оболочками. Физически они имеют относительно низкие температуры плавления и высокие значения электроотрицательности, связанные с постпереходными металлами . «Заполненная d- подоболочка и свободный s- электрон Cu, Ag и Au способствуют их высокой электро- и теплопроводности. Переходные металлы слева от 11-й группы испытывают взаимодействия между s -электронами и частично заполненной d- подоболочкой, которые снижают подвижность электронов». [181] Химически металлы 11-й группы ведут себя как металлы основной группы в своих валентных состояниях +1 и, следовательно, в некоторой степени связаны со щелочными металлами: это одна из причин, по которой их ранее обозначали как «группу IB», параллельно с «группой IA» щелочных металлов. Иногда их классифицируют как постпереходные металлы. [182] Их спектры аналогичны спектрам щелочных металлов. [29] Их моноположительные ионы парамагнитны и не придают окраски своим солям, как и соли щелочных металлов. [183]
В периодической таблице Менделеева 1871 года медь, серебро и золото перечислены дважды, один раз в группе VIII (с триадой железа и металлами платиновой группы ), и один раз в группе IB. Тем не менее, группа IB была заключена в скобки, чтобы отметить, что она была предварительной. Главным критерием Менделеева для отнесения к группе была максимальная степень окисления элемента: на этом основании элементы группы 11 не могли быть отнесены к группе IB из-за существования соединений меди (II) и золота (III), известных в то время. [29] Однако исключение группы IB сделало бы группу I единственной основной группой (группа VIII была обозначена как переходная группа), в которой отсутствовала бы бифуркация A–B. [29] Вскоре после этого большинство химиков решили классифицировать эти элементы в группе IB и удалить их из группы VIII для результирующей симметрии: это была преобладающая классификация до появления современной средне-длинной 18-колоночной периодической таблицы, которая разделила щелочные металлы и металлы группы 11. [29]
Металлы для чеканки монет традиционно рассматривались как подразделение группы щелочных металлов, поскольку они разделяют характерную s 1 электронную конфигурацию щелочных металлов (группа 1: p 6 s 1 ; группа 11: d 10 s 1 ). Однако сходство в значительной степени ограничивается стехиометрией соединений +1 обеих групп, а не их химическими свойствами. [10] : 1177 Это происходит из-за того, что заполненная d-подоболочка обеспечивает гораздо более слабый экранирующий эффект на внешний s-электрон, чем заполненная p-подоболочка, так что металлы для чеканки монет имеют гораздо более высокие энергии первой ионизации и меньшие ионные радиусы, чем соответствующие щелочные металлы. [10] : 1177 Кроме того, они имеют более высокие температуры плавления, твердость и плотность, а также более низкую реакционную способность и растворимость в жидком аммиаке , а также имеют более ковалентный характер в своих соединениях. [10] : 1177 Наконец, щелочные металлы находятся наверху электрохимического ряда , тогда как монетные металлы находятся почти в самом низу. [10] : 1177 Заполненная d-оболочка монетных металлов гораздо легче разрушается, чем заполненная p-оболочка щелочных металлов, так что вторая и третья энергии ионизации ниже, что обеспечивает более высокие степени окисления, чем +1, и более богатую координационную химию, тем самым придавая металлам группы 11 явный характер переходного металла . [10] : 1177 Особого внимания заслуживает золото, образующее ионные соединения с рубидием и цезием, в которых оно образует аурид-ион (Au− ) , который также встречается в сольватированной форме в жидком растворе аммиака: здесь золото ведет себя как псевдогалоген , поскольку его конфигурация 5d 10 6s 1 имеет на один электрон меньше, чем квазизакрытая оболочка 5d 10 6s 2 конфигурации ртути . [10] : 1177
Производство чистых щелочных металлов несколько осложнено из-за их чрезвычайной реакционной способности с обычно используемыми веществами, такими как вода. [5] [65] Из их силикатных руд все стабильные щелочные металлы могут быть получены одним и тем же способом: серная кислота сначала используется для растворения желаемого иона щелочного металла и ионов алюминия (III) из руды (выщелачивание), после чего основное осаждение удаляет ионы алюминия из смеси, осаждая его в виде гидроксида . Оставшийся нерастворимый карбонат щелочного металла затем селективно осаждается; затем соль растворяется в соляной кислоте для получения хлорида. Затем результат оставляют испаряться, и затем щелочной металл можно выделить. [65] Литий и натрий обычно выделяют электролизом из их жидких хлоридов, причем хлорид кальция обычно добавляют для снижения температуры плавления смеси. Однако более тяжелые щелочные металлы чаще выделяют другим способом, когда для восстановления хлорида щелочного металла используют восстановитель (обычно натрий для калия и магния или кальций для самых тяжелых щелочных металлов). Жидкий или газообразный продукт (щелочной металл) затем подвергается фракционной перегонке для очистки. [65] Большинство путей получения чистых щелочных металлов требуют использования электролиза из-за их высокой реакционной способности; один из немногих, который не требует этого, — это пиролиз соответствующего азида щелочного металла , который дает металл для натрия, калия, рубидия и цезия и нитрид для лития. [122] : 77
Соли лития приходится извлекать из воды минеральных источников , соляных бассейнов и соляных месторождений. Металл получают электролитическим способом из смеси расплавленного хлорида лития и хлорида калия . [184]
Натрий встречается в основном в морской воде и на высохшем морском дне , [5] но теперь его производят путем электролиза хлорида натрия путем понижения температуры плавления вещества до температуры ниже 700 °C с помощью ячейки Даунса . [185] [186] Чрезвычайно чистый натрий можно получить путем термического разложения азида натрия . [187] Калий встречается во многих минералах, таких как сильвин ( хлорид калия ). [5] Раньше калий обычно получали путем электролиза хлорида калия или гидроксида калия , [188] широко распространенного в таких местах, как Канада, Россия, Беларусь, Германия, Израиль, США и Иордания, методом, аналогичным тому, как натрий производился в конце 1800-х и начале 1900-х годов. [189] Его также можно производить из морской воды . [5] Однако эти методы проблематичны, поскольку металлический калий имеет тенденцию растворяться в своем расплавленном хлориде и значительно испаряется при рабочих температурах, потенциально образуя взрывоопасный супероксид. В результате чистый металлический калий теперь получают путем восстановления расплавленного хлорида калия металлическим натрием при температуре 850 °C. [10] : 74
Хотя натрий менее реактивен, чем калий, этот процесс работает, потому что при таких высоких температурах калий более летуч, чем натрий, и его можно легко отогнать, так что равновесие смещается вправо, образуя больше газообразного калия, и процесс идет почти до конца. [10] : 74
Такие металлы, как натрий, получают электролизом расплавленных солей. Rb и Cs получают в основном как побочные продукты переработки Li. Чтобы получить чистый цезий, руды цезия и рубидия измельчают и нагревают до 650 °C с металлическим натрием, получая сплав, который затем можно отделить методом фракционной перегонки . Поскольку металлический цезий слишком реактивен для обработки, его обычно предлагают в виде азида цезия (CsN3). Гидроксид цезия образуется при агрессивном взаимодействии цезия с водой и льдом (CsOH). [190]
Рубидий является 16-м наиболее распространенным элементом в земной коре; однако, он довольно редок. Некоторые минералы, найденные в Северной Америке, Южной Африке, России и Канаде, содержат рубидий. Некоторые калийные минералы ( лепидолиты , биотиты , полевые шпаты , карналлиты ) содержат его вместе с цезием. Поллуцит , карналлит , лейцит и лепидолит — все это минералы, которые содержат рубидий. Как побочный продукт извлечения лития, он коммерчески добывается из лепидолита . Рубидий также содержится в калийных породах и рассолах , что является коммерческим поставками. Большая часть рубидия в настоящее время добывается как побочный продукт очистки лития. Рубидий используется в вакуумных лампах в качестве геттера , материала, который соединяется с и удаляет следовые газы из вакуумных ламп. [191] [192]

В течение нескольких лет в 1950-х и 1960-х годах побочный продукт производства калия под названием Alkarb был основным источником рубидия. Alkarb содержал 21% рубидия, в то время как остальное составлял калий и небольшая доля цезия. [193] Сегодня крупнейшие производители цезия, например, рудник Tanco в Манитобе, Канада, производят рубидий как побочный продукт из поллуцита . [194] Сегодня распространенным методом отделения рубидия от калия и цезия является фракционная кристаллизация рубидиевых и цезиевых квасцов ( Cs , Rb ) Al ( SO 4 ) 2 · 12 H 2 O , которая дает чистые рубидиевые квасцы после примерно 30 перекристаллизаций. [194] [195] Ограниченные области применения и отсутствие минерала, богатого рубидием, ограничивают производство соединений рубидия до 2–4 тонн в год. [194] Однако цезий не производится в результате вышеуказанной реакции. Вместо этого добыча поллуцитовой руды является основным методом получения чистого цезия, извлекаемого из руды в основном тремя методами: кислотным разложением, щелочным разложением и прямым восстановлением. [194] [196] Оба металла производятся как побочные продукты производства лития: после 1958 года, когда интерес к термоядерным свойствам лития резко возрос, производство рубидия и цезия также соответственно возросло. [10] : 71 Чистые металлы рубидий и цезий производятся путем восстановления их хлоридов металлическим кальцием при 750 °C и низком давлении. [10] : 74
В результате его чрезвычайной редкости в природе [62] большая часть франция синтезируется в ядерной реакции 197 Au + 18 O → 210 Fr + 5 n , что дает франций-209 , франций-210 и франций-211 . [197] Наибольшее количество франция, когда-либо собранное на сегодняшний день, составляет около 300 000 нейтральных атомов, [198] которые были синтезированы с использованием ядерной реакции, приведенной выше. [198] Когда конкретно требуется единственный природный изотоп франций-223, он производится как альфа-дочернее вещество актиния-227, которое в свою очередь производится синтетически из нейтронного облучения природного радия-226, одного из дочерних элементов природного урана-238. [199]
Литий, натрий и калий имеют множество полезных применений, в то время как рубидий и цезий очень заметны в академическом контексте, но пока не имеют большого количества применений. [10] : 68 Литий является ключевым ингредиентом для ряда литиевых батарей , а оксид лития может помочь в обработке кремния. Стеарат лития является загустителем и может использоваться для изготовления смазок; он производится из гидроксида лития, который также используется для поглощения углекислого газа в космических капсулах и подводных лодках. [10] : 70 Хлорид лития используется в качестве припоя для алюминиевых деталей. [200] В медицине некоторые соли лития используются в качестве фармацевтических препаратов, стабилизирующих настроение. Металлический литий используется в сплавах с магнием и алюминием для получения очень прочных и легких сплавов. [10] : 70
Соединения натрия имеют множество применений, наиболее известным из которых является хлорид натрия в качестве поваренной соли . Натриевые соли жирных кислот используются в качестве мыла. [201] Чистый металлический натрий также имеет множество применений, включая использование в натриевых лампах , которые производят очень эффективный свет по сравнению с другими типами освещения, [202] [203] и могут помочь сгладить поверхность других металлов. [204] [205] Будучи сильным восстановителем, он часто используется для восстановления многих других металлов, таких как титан и цирконий , из их хлоридов. Кроме того, он очень полезен в качестве теплообменной жидкости в быстрых ядерных реакторах-размножителях из-за своей низкой температуры плавления, вязкости и поперечного сечения к поглощению нейтронов. [10] : 74 Натрий-ионные батареи могут обеспечить более дешевую альтернативу их эквивалентным элементам на основе лития. Как натрий, так и калий обычно используются в качестве противоионов GRAS для создания более водорастворимых и, следовательно, более биодоступных солевых форм кислотных фармацевтических препаратов. [206]
Соединения калия часто используются в качестве удобрений [10] : 73 [207], поскольку калий является важным элементом для питания растений. Гидроксид калия является очень сильным основанием и используется для контроля pH различных веществ. [208] [209] Нитрат калия и перманганат калия часто используются в качестве мощных окислителей. [10] : 73 Супероксид калия используется в дыхательных масках, поскольку он реагирует с углекислым газом, образуя карбонат калия и газообразный кислород. Чистый металлический калий используется нечасто, но его сплавы с натрием могут заменить чистый натрий в быстрых ядерных реакторах-размножителях. [10] : 74
Рубидий и цезий часто используются в атомных часах . [210] Цезиевые атомные часы необычайно точны; если бы часы были сделаны во времена динозавров, они бы отставали менее чем на четыре секунды (через 80 миллионов лет). [56] По этой причине атомы цезия используются в качестве определения секунды. [211] Ионы рубидия часто используются в фиолетовых фейерверках , [212] а цезий часто используется в буровых растворах в нефтяной промышленности. [56] [213]
Франций не имеет коммерческого применения, [60] [61] [214] но из-за относительно простой атомной структуры франция , среди прочего, он использовался в экспериментах по спектроскопии , что привело к получению дополнительной информации об уровнях энергии и константах связи между субатомными частицами . [215] Исследования света, испускаемого захваченными лазером ионами франция-210, предоставили точные данные о переходах между атомными уровнями энергии, аналогичные тем, которые предсказывает квантовая теория . [216]
Чистые щелочные металлы опасно реагируют с воздухом и водой и должны храниться вдали от тепла, огня, окислителей, кислот, большинства органических соединений, галогенуглеродов , пластиков и влаги. Они также реагируют с углекислым газом и четыреххлористым углеродом, поэтому обычные огнетушители являются контрпродуктивными при использовании на возгораниях щелочных металлов. [217] Некоторые сухие порошковые огнетушители класса D, предназначенные для возгораний металлов, эффективны, лишая огонь кислорода и охлаждая щелочной металл. [218]
Эксперименты обычно проводятся с использованием только небольших количеств в несколько граммов в вытяжном шкафу . Небольшие количества лития можно утилизировать путем реакции с холодной водой, но более тяжелые щелочные металлы следует растворять в менее реакционноспособном изопропаноле . [217] [219] Щелочные металлы следует хранить под минеральным маслом или в инертной атмосфере. В качестве инертной атмосферы может использоваться аргон или азот, за исключением лития, который реагирует с азотом. [217] Рубидий и цезий следует хранить вдали от воздуха, даже под маслом, поскольку даже небольшое количество воздуха, диффундировавшего в масло, может вызвать образование опасно взрывоопасной перекиси; по той же причине калий нельзя хранить под маслом в кислородсодержащей атмосфере дольше 6 месяцев. [220] [221]

Биоорганическая химия ионов щелочных металлов была подробно рассмотрена. [222] Твердотельные кристаллические структуры были определены для многих комплексов ионов щелочных металлов в небольших пептидах, компонентах нуклеиновых кислот, углеводах и комплексах ионофоров. [223]
Литий в природе встречается только в следовых количествах в биологических системах и не имеет известной биологической роли, но оказывает воздействие на организм при приеме внутрь. [224] Карбонат лития используется в качестве стабилизатора настроения в психиатрии для лечения биполярного расстройства ( маниакально-депрессивного психоза ) в суточных дозах около 0,5–2 граммов, хотя есть побочные эффекты. [224] Чрезмерное употребление лития вызывает сонливость, невнятную речь и рвоту, среди прочих симптомов, [224] и отравляет центральную нервную систему , [224] что опасно, поскольку требуемая доза лития для лечения биполярного расстройства лишь немного ниже токсической дозы. [224] [225] Его биохимия, то, как он обрабатывается человеческим организмом, и исследования с использованием крыс и коз предполагают, что он является важным микроэлементом , хотя естественная биологическая функция лития в организме человека еще не определена. [226] [227]
Натрий и калий встречаются во всех известных биологических системах, обычно функционируя как электролиты внутри и снаружи клеток . [228] [229] Натрий является важным питательным веществом, которое регулирует объем крови, артериальное давление, осмотическое равновесие и pH ; минимальная физиологическая потребность в натрии составляет 500 миллиграммов в день. [230] Хлорид натрия (также известный как поваренная соль) является основным источником натрия в рационе и используется в качестве приправы и консерванта, например, для солений и вяленого мяса ; большая его часть поступает из обработанных пищевых продуктов. [231] Рекомендуемая норма потребления натрия составляет 1,5 грамма в день, [232] но большинство людей в Соединенных Штатах потребляют более 2,3 грамма в день, [233] минимальное количество, которое способствует гипертонии; [234] это, в свою очередь, является причиной 7,6 миллионов преждевременных смертей во всем мире. [235]
Калий является основным катионом (положительным ионом) внутри клеток животных , [228] в то время как натрий является основным катионом снаружи клеток животных. [228] [229] Различия в концентрации этих заряженных частиц вызывают разницу в электрическом потенциале между внутренней и внешней частью клеток, известную как мембранный потенциал . Баланс между калием и натрием поддерживается белками -переносчиками ионов в клеточной мембране . [236] Потенциал клеточной мембраны, создаваемый ионами калия и натрия, позволяет клетке генерировать потенциал действия — «всплеск» электрического разряда. Способность клеток производить электрический разряд имеет решающее значение для таких функций организма, как нейротрансмиссия , сокращение мышц и работа сердца. [236] Таким образом, нарушение этого баланса может быть фатальным: например, прием большого количества соединений калия может привести к гиперкалиемии, сильно влияющей на сердечно-сосудистую систему. [237] [238] Хлорид калия используется в Соединенных Штатах для смертных казней с помощью инъекций. [237]

Из-за схожих атомных радиусов рубидий и цезий в организме имитируют калий и усваиваются аналогично. Рубидий не имеет известной биологической роли, но может способствовать стимуляции метаболизма , [239] [240] [241] и, подобно цезию, [239] [242] замещать калий в организме, вызывая дефицит калия . [239] [241] Частичная замена вполне возможна и довольно нетоксична: человек весом 70 кг содержит в среднем 0,36 г рубидия, и увеличение этого значения в 50–100 раз не показало отрицательных эффектов у подопытных. [243] Крысы могут выживать при замене калия рубидием до 50%. [241] [244] Рубидий (и в гораздо меньшей степени цезий) могут действовать как временное средство от гипокалиемии; в то время как рубидий может адекватно физиологически заменять калий в некоторых системах, цезий никогда не может этого сделать. [240] Существуют лишь очень ограниченные доказательства в виде симптомов дефицита, подтверждающие, что рубидий, возможно, необходим козам; даже если это правда, следовых количеств, обычно присутствующих в пище, более чем достаточно. [245] [246]
Соединения цезия редко встречаются большинству людей, но большинство соединений цезия умеренно токсичны. Как и рубидий, цезий имеет тенденцию замещать калий в организме, но он значительно больше и поэтому является более плохой заменой. [242] Избыток цезия может привести к гипокалиемии , аритмии и острой остановке сердца, [247] но такие количества обычно не встречаются в природных источниках. [ 248] Таким образом, цезий не является основным химическим загрязнителем окружающей среды. [248] Значение средней летальной дозы ( LD50 ) для хлорида цезия у мышей составляет 2,3 г на килограмм, что сопоставимо со значениями LD50 хлорида калия и хлорида натрия . [249] Хлорид цезия пропагандировался как альтернативная терапия рака, [250] но был связан со смертью более 50 пациентов, у которых он использовался как часть научно неподтвержденного лечения рака. [251]
Радиоизотопы цезия требуют особых мер предосторожности: неправильное обращение с источниками гамма-излучения цезия-137 может привести к выбросу этого радиоизотопа и лучевым поражениям. Возможно, самым известным случаем является авария в Гоянии в 1987 году, когда неправильно утилизированная система лучевой терапии из заброшенной клиники в городе Гояния , Бразилия, была найдена на свалке, а светящаяся соль цезия была продана любопытным, необразованным покупателям. Это привело к четырем смертям и серьезным травмам от воздействия радиации. Вместе с цезием-134 , йодом-131 и стронцием-90 цезий-137 был среди изотопов, распространенных в результате чернобыльской катастрофы , которые представляют наибольший риск для здоровья. [97] Радиоизотопы франция, вероятно, также были бы опасны из-за их высокой энергии распада и короткого периода полураспада, но ни один из них не был произведен в достаточно больших количествах, чтобы представлять какой-либо серьезный риск. [199]
{{cite journal}}: CS1 maint: numeric names: authors list (link)