
Ферменты ( / ˈ ɛ n z aɪ m z / ) — это белки , которые действуют как биологические катализаторы , ускоряя химические реакции . Молекулы , на которые могут действовать ферменты, называются субстратами , а фермент преобразует субстраты в различные молекулы, известные как продукты . Почти все метаболические процессы в клетке нуждаются в ферментативном катализе , чтобы происходить со скоростью, достаточной для поддержания жизни. [1] : 8.1 Метаболические пути зависят от ферментов, катализирующих отдельные этапы. Изучение ферментов называется энзимологией , а область псевдоферментного анализа признает, что в ходе эволюции некоторые ферменты утратили способность осуществлять биологический катализ, что часто отражается в их аминокислотных последовательностях и необычных «псевдокаталитических» свойствах. [2] [3]
Известно, что ферменты катализируют более 5000 типов биохимических реакций. [4]
Другие биокатализаторы — это каталитические молекулы РНК , также называемые рибозимами . Иногда их описывают как тип фермента, а не как фермент, но даже в десятилетия, прошедшие с момента открытия рибозимов в 1980–1982 годах, само слово фермент часто означает конкретно тип белка (как это используется в этой статье).
Специфичность фермента обусловлена его уникальной трехмерной структурой .
Как и все катализаторы, ферменты увеличивают скорость реакции , снижая ее энергию активации . Некоторые ферменты могут заставить свое превращение субстрата в продукт происходить во много миллионов раз быстрее. Крайним примером является оротидин 5'-фосфатдекарбоксилаза , которая позволяет реакции, которая в противном случае заняла бы миллионы лет, происходить за миллисекунды. [5] [6] Химически ферменты подобны любому катализатору и не расходуются в химических реакциях, а также не изменяют равновесие реакции. Ферменты отличаются от большинства других катализаторов тем, что они гораздо более специфичны. На активность фермента могут влиять другие молекулы: ингибиторы — это молекулы, которые снижают активность фермента, а активаторы — это молекулы, которые повышают активность. Многие терапевтические препараты и яды являются ингибиторами ферментов. Активность фермента заметно снижается за пределами его оптимальной температуры и pH , и многие ферменты (навсегда) денатурируются при воздействии чрезмерного тепла, теряя свою структуру и каталитические свойства.
Некоторые ферменты используются в коммерческих целях, например, в синтезе антибиотиков . Некоторые бытовые продукты используют ферменты для ускорения химических реакций: ферменты в биологических стиральных порошках расщепляют пятна белка, крахмала или жира на одежде, а ферменты в размягчителе мяса расщепляют белки на более мелкие молекулы, что облегчает пережевывание мяса.

К концу XVII и началу XVIII веков были известны процессы переваривания мяса желудочными секретами [7] и превращения крахмала в сахара растительными экстрактами и слюной , но механизмы, посредством которых это происходит, не были идентифицированы. [8]
Французский химик Ансельм Пайен был первым, кто открыл фермент диастазу в 1833 году. [ 9] Несколько десятилетий спустя, изучая ферментацию сахара в спирт дрожжами , Луи Пастер пришел к выводу, что это брожение было вызвано жизненной силой, содержащейся в дрожжевых клетках, называемых «ферментами», которые, как считалось, функционируют только внутри живых организмов. Он писал, что «спиртовое брожение — это акт, связанный с жизнью и организацией дрожжевых клеток, а не со смертью или гниением клеток». [10]
В 1877 году немецкий физиолог Вильгельм Кюне (1837–1900) впервые использовал термин «фермент» , который происходит от древнегреческого ἔνζυμον (энзим) « заквашенный , на дрожжах», для описания этого процесса. [11] Слово «фермент» позже стало использоваться для обозначения неживых веществ, таких как пепсин , а слово «фермент» стало использоваться для обозначения химической активности, производимой живыми организмами. [12]
Эдуард Бухнер представил свою первую работу по изучению дрожжевых экстрактов в 1897 году. В серии экспериментов в Берлинском университете он обнаружил, что сахар сбраживался дрожжевыми экстрактами даже тогда, когда в смеси не было живых дрожжевых клеток. [13] Он назвал фермент, вызывающий сбраживание сахарозы, « зимазой ». [14] В 1907 году он получил Нобелевскую премию по химии за «открытие бесклеточной ферментации». Следуя примеру Бухнера, ферменты обычно называют в соответствии с реакцией, которую они выполняют: суффикс -аза сочетается с названием субстрата ( например, лактаза — это фермент, расщепляющий лактозу ) или с типом реакции (например, ДНК-полимераза образует ДНК-полимеры). [15]
Биохимическая идентичность ферментов была еще неизвестна в начале 1900-х годов. Многие ученые наблюдали, что ферментативная активность связана с белками, но другие (например, лауреат Нобелевской премии Ричард Вильштеттер ) утверждали, что белки были просто носителями для настоящих ферментов и что белки сами по себе неспособны к катализу. [16] В 1926 году Джеймс Б. Самнер показал, что фермент уреаза является чистым белком, и кристаллизовал его; он сделал то же самое для фермента каталазы в 1937 году. Вывод о том, что чистые белки могут быть ферментами, был окончательно продемонстрирован Джоном Говардом Нортропом и Венделлом Мередитом Стэнли , которые работали над пищеварительными ферментами пепсином (1930), трипсином и химотрипсином . Эти три ученых были удостоены Нобелевской премии по химии 1946 года. [17]
Открытие того, что ферменты могут быть кристаллизованы, в конечном итоге позволило решить их структуры с помощью рентгеновской кристаллографии . Впервые это было сделано для лизоцима , фермента, обнаруженного в слезах, слюне и яичных белках , который переваривает оболочку некоторых бактерий; структура была решена группой под руководством Дэвида Чилтона Филлипса и опубликована в 1965 году. [18] Эта структура лизоцима с высоким разрешением ознаменовала начало области структурной биологии и попытки понять, как работают ферменты на атомном уровне детализации. [19]
Ферменты можно классифицировать по двум основным критериям: либо по сходству аминокислотной последовательности (и, следовательно, по эволюционному родству), либо по ферментативной активности.
Активность фермента . Название фермента часто происходит от его субстрата или химической реакции, которую он катализирует, при этом слово заканчивается на -аза . [1] : 8.1.3 Примерами являются лактаза , алкогольдегидрогеназа и ДНК-полимераза . Различные ферменты, катализирующие одну и ту же химическую реакцию, называются изоферментами . [1] : 10.3
Международный союз биохимии и молекулярной биологии разработал номенклатуру для ферментов, номера EC (для «Комиссии по ферментам») . Каждый фермент описывается «EC», за которым следует последовательность из четырех чисел, которые представляют иерархию ферментативной активности (от очень общей до очень конкретной). То есть, первое число в целом классифицирует фермент на основе его механизма, в то время как другие цифры добавляют все больше и больше специфичности. [20]
Классификация высшего уровня:
Эти разделы подразделяются по другим признакам, таким как субстрат, продукты и химический механизм . Фермент полностью определяется четырьмя числовыми обозначениями. Например, гексокиназа (EC 2.7.1.1) представляет собой трансферазу (EC 2), которая добавляет фосфатную группу (EC 2.7) к гексозному сахару, молекуле, содержащей спиртовую группу (EC 2.7.1). [21]
Сходство последовательностей . Категории EC не отражают сходство последовательностей. Например, две лигазы с одинаковым номером EC, катализирующие абсолютно одну и ту же реакцию, могут иметь совершенно разные последовательности. Независимо от их функции, ферменты, как и любые другие белки, были классифицированы по сходству последовательностей в многочисленные семейства. Эти семейства были задокументированы в десятках различных баз данных белков и семейств белков, таких как Pfam . [22]
Негомологичные изофункциональные ферменты . Неродственные ферменты, которые имеют одинаковую ферментативную активность, называются негомологичными изофункциональными ферментами . [23] Горизонтальный перенос генов может распространять эти гены на неродственные виды, особенно бактерии, где они могут заменять эндогенные гены той же функции, что приводит к гомологичному замещению генов.

Ферменты, как правило, представляют собой глобулярные белки , действующие по отдельности или в составе более крупных комплексов . Последовательность аминокислот определяет структуру, которая, в свою очередь, определяет каталитическую активность фермента. [24] Хотя структура определяет функцию, новую ферментативную активность пока нельзя предсказать только по структуре. [25] Структуры ферментов разворачиваются ( денатурируют ) при нагревании или воздействии химических денатурантов, и это нарушение структуры обычно приводит к потере активности. [26] Денатурация ферментов обычно связана с температурами выше обычного уровня для вида; в результате ферменты из бактерий, живущих в вулканических средах, таких как горячие источники, ценятся промышленными пользователями за их способность функционировать при высоких температурах, что позволяет катализируемым ферментами реакциям работать с очень высокой скоростью.
Ферменты обычно намного больше своих субстратов. Размеры варьируются от всего лишь 62 аминокислотных остатков, для мономера 4-оксалокротонаттаутомеразы , [ 27] до более чем 2500 остатков в синтазе жирных кислот животных . [28] Только небольшая часть их структуры (около 2–4 аминокислот) напрямую участвует в катализе: каталитический сайт. [29] Этот каталитический сайт расположен рядом с одним или несколькими сайтами связывания , где остатки ориентируют субстраты. Каталитический сайт и сайт связывания вместе составляют активный сайт фермента . Оставшаяся большая часть структуры фермента служит для поддержания точной ориентации и динамики активного сайта. [30]
В некоторых ферментах аминокислоты не участвуют напрямую в катализе; вместо этого фермент содержит сайты для связывания и ориентации каталитических кофакторов . [30] Структуры ферментов могут также содержать аллостерические сайты , где связывание небольшой молекулы вызывает конформационное изменение , которое увеличивает или уменьшает активность. [31]
Существует небольшое количество биологических катализаторов на основе РНК , называемых рибозимами , которые снова могут действовать самостоятельно или в комплексе с белками. Наиболее распространенной из них является рибосома , которая представляет собой комплекс белковых и каталитических компонентов РНК. [1] : 2.2

Ферменты должны связывать свои субстраты, прежде чем они смогут катализировать любую химическую реакцию. Ферменты обычно очень специфичны в отношении того, какие субстраты они связывают, а затем катализируют химическую реакцию. Специфичность достигается путем связывания карманов с комплементарной формой, зарядом и гидрофильными / гидрофобными характеристиками с субстратами. Поэтому ферменты могут различать очень похожие молекулы субстрата, чтобы быть хемоселективными , региоселективными и стереоспецифичными . [32]
Некоторые из ферментов, демонстрирующих наивысшую специфичность и точность, участвуют в копировании и экспрессии генома . Некоторые из этих ферментов имеют механизмы « корректировки ». Здесь фермент, такой как ДНК-полимераза, катализирует реакцию на первом этапе, а затем проверяет правильность продукта на втором этапе. [ 33] Этот двухэтапный процесс приводит к среднему уровню ошибок менее 1 ошибки на 100 миллионов реакций в полимеразах млекопитающих с высокой точностью. [1] : 5.3.1 Аналогичные механизмы корректуры также обнаружены в РНК-полимеразе , [34] аминоацил-тРНК-синтетазах [35] и рибосомах . [36]
Наоборот, некоторые ферменты проявляют ферментативную неразборчивость , имея широкую специфичность и действуя на ряд различных физиологически значимых субстратов. Многие ферменты обладают небольшими побочными активностями, которые возникли случайно (т.е. нейтрально ), что может быть отправной точкой для эволюционного отбора новой функции. [37] [38]

Чтобы объяснить наблюдаемую специфичность ферментов, в 1894 году Эмиль Фишер предположил, что и фермент, и субстрат обладают определенными дополнительными геометрическими формами, которые точно соответствуют друг другу. [39] Это часто называют моделью «замка и ключа». [1] : 8.3.2 Эта ранняя модель объясняет специфичность ферментов, но не может объяснить стабилизацию переходного состояния, которого достигают ферменты. [40]
В 1958 году Дэниел Кошланд предложил модификацию модели замка и ключа: поскольку ферменты являются довольно гибкими структурами, активный центр непрерывно перестраивается за счет взаимодействия с субстратом, когда субстрат взаимодействует с ферментом. [41] В результате субстрат не просто связывается с жестким активным центром; боковые цепи аминокислот , составляющие активный центр, формируются в точные положения, которые позволяют ферменту выполнять свою каталитическую функцию. В некоторых случаях, таких как гликозидазы , молекула субстрата также немного меняет форму, когда она входит в активный центр. [42] Активный центр продолжает изменяться до тех пор, пока субстрат не будет полностью связан, после чего определяется окончательная форма и распределение заряда. [43] Индуцированное соответствие может повысить точность молекулярного распознавания в присутствии конкуренции и шума через механизм конформационной корректуры . [44]
Ферменты могут ускорять реакции несколькими способами, каждый из которых снижает энергию активации (ΔG ‡ , свободную энергию Гиббса ) [45]
Ферменты могут использовать несколько из этих механизмов одновременно. Например, протеазы , такие как трипсин, выполняют ковалентный катализ с использованием каталитической триады , стабилизируют накопление заряда в переходных состояниях с использованием оксианионной дырки , осуществляют полный гидролиз с использованием ориентированного водного субстрата. [51]
Ферменты не являются жесткими, статическими структурами; вместо этого они имеют сложные внутренние динамические движения, то есть движения частей структуры фермента, таких как отдельные аминокислотные остатки, группы остатков, образующие белковую петлю или единицу вторичной структуры , или даже целый домен белка . Эти движения приводят к образованию конформационного ансамбля немного отличающихся структур, которые взаимопревращаются друг с другом в равновесии . Различные состояния внутри этого ансамбля могут быть связаны с различными аспектами функции фермента. Например, различные конформации фермента дигидрофолатредуктазы связаны со связыванием субстрата, катализом, высвобождением кофактора и этапами высвобождения продукта каталитического цикла, [52] что согласуется с теорией каталитического резонанса .
Представление субстрата — это процесс, при котором фермент изолируется от своего субстрата. Ферменты могут изолироваться в плазматической мембране от субстрата в ядре или цитозоле. Или внутри мембраны фермент может изолироваться в липидных плотах от своего субстрата в неупорядоченной области. Когда фермент высвобождается, он смешивается со своим субстратом. В качестве альтернативы фермент может изолироваться около своего субстрата для активации фермента. Например, фермент может быть растворимым и при активации связываться с липидом в плазматической мембране, а затем воздействовать на молекулы в плазматической мембране.
Аллостерические сайты — это карманы на ферменте, отличные от активного сайта, которые связываются с молекулами в клеточной среде. Затем эти молекулы вызывают изменение конформации или динамики фермента, которое трансдуцируется в активный сайт и, таким образом, влияет на скорость реакции фермента. [53] Таким образом, аллостерические взаимодействия могут либо ингибировать, либо активировать ферменты. Аллостерические взаимодействия с метаболитами выше или ниже по течению в метаболическом пути фермента вызывают регуляцию обратной связи , изменяя активность фермента в соответствии с потоком через остальную часть пути. [54]

Некоторые ферменты не нуждаются в дополнительных компонентах для проявления полной активности. Другим для активности требуются небелковые молекулы, называемые кофакторами. [55] Кофакторы могут быть как неорганическими (например, ионы металлов и кластеры железа и серы ), так и органическими соединениями (например, флавин и гем ). Эти кофакторы служат многим целям; например, ионы металлов могут помочь в стабилизации нуклеофильных видов в активном центре. [56] Органические кофакторы могут быть либо коферментами , которые высвобождаются из активного центра фермента во время реакции, либо простетическими группами , которые прочно связаны с ферментом. Органические простетические группы могут быть ковалентно связаны (например, биотин в ферментах, таких как пируваткарбоксилаза ). [57]
Примером фермента, содержащего кофактор, является карбоангидраза , которая использует цинковый кофактор, связанный как часть ее активного центра. [58] Эти прочно связанные ионы или молекулы обычно находятся в активном центре и участвуют в катализе. [1] : 8.1.1 Например, кофакторы флавина и гема часто участвуют в окислительно-восстановительных реакциях. [1] : 17
Ферменты, которым требуется кофактор, но которые не имеют ни одной связи, называются апоферментами или апопротеинами . Фермент вместе с кофактором(ами), необходимыми для активности, называется голоферментом (или галоферментом). Термин голофермент может также применяться к ферментам, которые содержат несколько белковых субъединиц, таких как ДНК-полимеразы ; здесь голофермент — это полный комплекс, содержащий все субъединицы, необходимые для активности. [1] : 8.1.1
Коферменты — это небольшие органические молекулы, которые могут быть слабо или прочно связаны с ферментом. Коферменты переносят химические группы от одного фермента к другому. [59] Примерами являются НАДН , НАДФН и аденозинтрифосфат (АТФ). Некоторые коферменты, такие как флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД), тиаминпирофосфат (ТФП) и тетрагидрофолат (ТГФ), получены из витаминов . Эти коферменты не могут быть синтезированы организмом de novo , и близкородственные соединения (витамины) должны быть получены из пищи. Переносимые химические группы включают:
Поскольку коферменты химически изменяются в результате действия ферментов, полезно рассматривать коферменты как особый класс субстратов или вторых субстратов, которые являются общими для многих различных ферментов. Например, известно, что около 1000 ферментов используют кофермент НАДН. [60]
Коферменты обычно непрерывно регенерируются, и их концентрации поддерживаются на постоянном уровне внутри клетки. Например, НАДФН регенерируется через пентозофосфатный путь , а S- аденозилметионин - метионин-аденозилтрансферазой . Эта непрерывная регенерация означает, что небольшие количества коферментов могут использоваться очень интенсивно. Например, человеческое тело ежедневно перерабатывает собственный вес в АТФ. [61]

Как и все катализаторы, ферменты не изменяют положение химического равновесия реакции. В присутствии фермента реакция протекает в том же направлении, что и без фермента, просто быстрее. [1] : 8.2.3 Например, карбоангидраза катализирует свою реакцию в любом направлении в зависимости от концентрации ее реагентов: [62]
Скорость реакции зависит от энергии активации, необходимой для образования переходного состояния , которое затем распадается на продукты. Ферменты увеличивают скорость реакции, понижая энергию переходного состояния. Во-первых, связывание образует низкоэнергетический комплекс фермент-субстрат (ES). Во-вторых, фермент стабилизирует переходное состояние таким образом, что для его достижения требуется меньше энергии по сравнению с некатализируемой реакцией (ES ‡ ). Наконец, комплекс фермент-продукт (EP) диссоциирует, высвобождая продукты. [1] : 8.3
Ферменты могут объединять две или более реакции, так что термодинамически благоприятная реакция может быть использована для «управления» термодинамически неблагоприятной, так что объединенная энергия продуктов будет ниже, чем у субстратов. Например, гидролиз АТФ часто используется для управления другими химическими реакциями. [63]
Кинетика ферментов — это исследование того, как ферменты связывают субстраты и превращают их в продукты. [64] Данные о скорости, используемые в кинетическом анализе, обычно получают из ферментативных анализов . В 1913 году Леонор Михаэлис и Мод Леонора Ментен предложили количественную теорию кинетики ферментов, которая называется кинетикой Михаэлиса–Ментен . [65] Основным вкладом Михаэлиса и Ментен было представление ферментативных реакций в две стадии. На первой стадии субстрат обратимо связывается с ферментом, образуя комплекс фермент-субстрат. Это иногда называют комплексом Михаэлиса–Ментен в их честь. Затем фермент катализирует химическую стадию реакции и высвобождает продукт. Эта работа была далее развита Г. Э. Бриггсом и Дж. Б. С. Холдейном , которые вывели кинетические уравнения, которые широко используются и сегодня. [66]
Скорости фермента зависят от условий раствора и концентрации субстрата . Чтобы найти максимальную скорость ферментативной реакции, концентрацию субстрата увеличивают до тех пор, пока не будет видна постоянная скорость образования продукта. Это показано на кривой насыщения справа. Насыщение происходит потому, что по мере увеличения концентрации субстрата все больше и больше свободного фермента преобразуется в связанный с субстратом комплекс ES. При максимальной скорости реакции ( V max ) фермента все активные центры фермента связаны с субстратом, а количество комплекса ES равно общему количеству фермента. [1] : 8,4
V max — это лишь один из нескольких важных кинетических параметров. Количество субстрата, необходимое для достижения заданной скорости реакции, также важно. Оно определяется константой Михаэлиса-Ментен ( K m ), которая представляет собой концентрацию субстрата, необходимую для того, чтобы фермент достиг половины своей максимальной скорости реакции; как правило, каждый фермент имеет характерную K M для данного субстрата. Другая полезная константа — k cat , также называемая числом оборотов , которое представляет собой число молекул субстрата, обрабатываемых одним активным центром в секунду. [1] : 8,4
Эффективность фермента может быть выражена в терминах k cat / K m . Это также называется константой специфичности и включает константы скорости для всех этапов реакции вплоть до первого необратимого этапа. Поскольку константа специфичности отражает как сродство, так и каталитическую способность, она полезна для сравнения различных ферментов друг с другом или одного и того же фермента с различными субстратами. Теоретический максимум константы специфичности называется пределом диффузии и составляет около 10 8 - 10 9 (M −1 s −1 ). В этой точке каждое столкновение фермента с его субстратом приведет к катализу, и скорость образования продукта ограничена не скоростью реакции, а скоростью диффузии. Ферменты с этим свойством называются каталитически совершенными или кинетически совершенными . Примерами таких ферментов являются триозофосфатизомераза , карбоангидраза , ацетилхолинэстераза , каталаза , фумараза , β-лактамаза и супероксиддисмутаза . [1] : 8.4.2 Оборот таких ферментов может достигать нескольких миллионов реакций в секунду. [1] : 9.2 Но большинство ферментов далеки от совершенства: средние значения и составляют около и соответственно. [67]
Кинетика Михаэлиса-Ментена основана на законе действия масс , который выводится из предположений о свободной диффузии и термодинамически обусловленном случайном столкновении. Многие биохимические или клеточные процессы значительно отклоняются от этих условий из-за макромолекулярной скученности и ограниченного молекулярного движения. [68] Более поздние, сложные расширения модели пытаются исправить эти эффекты. [69]
Скорость ферментативной реакции можно снизить с помощью различных типов ингибиторов ферментов. [70] : 73–74
Конкурентный ингибитор и субстрат не могут связываться с ферментом одновременно. [71] Часто конкурентные ингибиторы сильно напоминают реальный субстрат фермента. Например, препарат метотрексат является конкурентным ингибитором фермента дигидрофолатредуктазы , который катализирует восстановление дигидрофолата до тетрагидрофолата. [72] Сходство между структурами дигидрофолата и этого препарата показано на сопроводительном рисунке. Этот тип ингибирования можно преодолеть с помощью высокой концентрации субстрата. В некоторых случаях ингибитор может связываться с сайтом, отличным от сайта связывания обычного субстрата, и оказывать аллостерический эффект, изменяя форму обычного сайта связывания. [73]
Неконкурентный ингибитор связывается с сайтом, отличным от того, где связывается субстрат. Субстрат все еще связывается с его обычным сродством, и, следовательно, K m остается прежним. Однако ингибитор снижает каталитическую эффективность фермента, так что V max уменьшается. В отличие от конкурентного ингибирования, неконкурентное ингибирование не может быть преодолено высокой концентрацией субстрата. [70] : 76–78
Неконкурентный ингибитор не может связываться со свободным ферментом, только с комплексом фермент-субстрат; следовательно, эти типы ингибиторов наиболее эффективны при высокой концентрации субстрата. В присутствии ингибитора комплекс фермент-субстрат неактивен. [70] : 78 Этот тип ингибирования встречается редко. [74]
Смешанный ингибитор связывается с аллостерическим сайтом, и связывание субстрата и ингибитора влияет друг на друга. Функция фермента снижается, но не устраняется при связывании с ингибитором. Этот тип ингибитора не подчиняется уравнению Михаэлиса–Ментен. [70] : 76–78
Необратимый ингибитор навсегда инактивирует фермент, обычно путем образования ковалентной связи с белком. [75] Пенициллин [76] и аспирин [77] являются распространенными препаратами, которые действуют таким образом.
Во многих организмах ингибиторы могут действовать как часть механизма обратной связи . Если фермент производит слишком много одного вещества в организме, это вещество может действовать как ингибитор для фермента в начале пути, который его производит, вызывая замедление или остановку производства вещества, когда его достаточно. Это форма отрицательной обратной связи . Основные метаболические пути, такие как цикл лимонной кислоты, используют этот механизм. [1] : 17.2.2
Поскольку ингибиторы модулируют функцию ферментов, их часто используют в качестве лекарств. Многие из таких лекарств являются обратимыми конкурентными ингибиторами, которые напоминают собственный субстрат фермента, подобно метотрексату , указанному выше; другие известные примеры включают статины, используемые для лечения высокого уровня холестерина , [78] и ингибиторы протеазы, используемые для лечения ретровирусных инфекций, таких как ВИЧ . [79] Распространенным примером необратимого ингибитора, который используется в качестве лекарства, является аспирин , который ингибирует ферменты ЦОГ-1 и ЦОГ-2 , которые производят мессенджер воспаления простагландин . [77] Другие ингибиторы ферментов являются ядами. Например, яд цианид является необратимым ингибитором фермента, который соединяется с медью и железом в активном центре фермента цитохром с оксидазы и блокирует клеточное дыхание . [80]
Поскольку ферменты состоят из белков, их действие чувствительно к изменению многих физико-химических факторов, таких как pH, температура, концентрация субстрата и т. д.
В следующей таблице показаны оптимальные значения pH для различных ферментов. [81]
Ферменты выполняют широкий спектр функций внутри живых организмов. Они незаменимы для передачи сигнала и регуляции клеток, часто через киназы и фосфатазы . [82] Они также генерируют движение, при этом миозин гидролизует аденозинтрифосфат (АТФ) для создания мышечного сокращения , а также транспортируют грузы по клетке как часть цитоскелета . [ 83] Другие АТФазы в клеточной мембране являются ионными насосами, участвующими в активном транспорте . Ферменты также участвуют в более экзотических функциях, таких как люцифераза, генерирующая свет у светлячков . [84] Вирусы также могут содержать ферменты для инфицирования клеток, такие как интеграза и обратная транскриптаза ВИЧ , или для высвобождения вируса из клеток, как нейраминидаза вируса гриппа . [85]
Важная функция ферментов находится в пищеварительной системе животных. Такие ферменты, как амилазы и протеазы, расщепляют большие молекулы ( крахмал или белки соответственно) на более мелкие, чтобы они могли быть усвоены кишечником. Молекулы крахмала, например, слишком велики, чтобы быть усвоенными из кишечника, но ферменты гидролизуют цепи крахмала на более мелкие молекулы, такие как мальтоза и, в конечном итоге, глюкоза , которые затем могут быть усвоены. Различные ферменты переваривают различные пищевые вещества. У жвачных животных , которые питаются травоядными , микроорганизмы в кишечнике вырабатывают другой фермент, целлюлазу , чтобы расщеплять стенки целлюлозных клеток растительных волокон. [86]
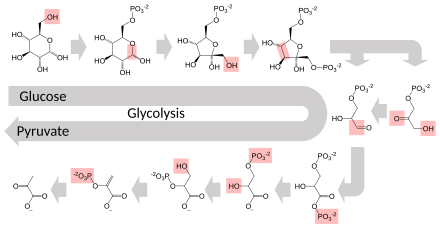
Несколько ферментов могут работать вместе в определенном порядке, создавая метаболические пути . [1] : 30.1 В метаболическом пути один фермент берет продукт другого фермента в качестве субстрата. После каталитической реакции продукт затем передается другому ферменту. Иногда более одного фермента могут катализировать одну и ту же реакцию параллельно; это может позволить более сложную регуляцию: например, с низкой постоянной активностью, обеспечиваемой одним ферментом, но индуцируемой высокой активностью от второго фермента. [87]
Ферменты определяют, какие этапы происходят в этих путях. Без ферментов метаболизм не развивался бы по тем же этапам и не мог бы регулироваться для обслуживания потребностей клетки. Большинство центральных метаболических путей регулируются на нескольких ключевых этапах, как правило, с помощью ферментов, чья активность включает гидролиз АТФ. Поскольку эта реакция высвобождает так много энергии, другие реакции, которые термодинамически неблагоприятны, могут быть связаны с гидролизом АТФ, управляя общей серией связанных метаболических реакций. [1] : 30.1
Существует пять основных способов контроля активности ферментов в клетке. [1] : 30.1.1
Ферменты могут быть либо активированы , либо ингибированы другими молекулами. Например, конечный продукт(ы) метаболического пути часто являются ингибиторами для одного из первых ферментов пути (обычно первого необратимого шага, называемого предопределенным шагом), таким образом регулируя количество конечного продукта, произведенного путями. Такой регуляторный механизм называется механизмом отрицательной обратной связи , поскольку количество произведенного конечного продукта регулируется его собственной концентрацией. [88] : 141–48 Механизм отрицательной обратной связи может эффективно регулировать скорость синтеза промежуточных метаболитов в соответствии с потребностями клеток. Это помогает эффективно распределять материалы и экономить энергию, а также предотвращает избыточное производство конечных продуктов. Как и другие гомеостатические устройства , контроль ферментативного действия помогает поддерживать стабильную внутреннюю среду в живых организмах. [88] : 141
Примеры посттрансляционной модификации включают фосфорилирование , миристоилирование и гликозилирование . [88] : 149–69 Например, в ответ на инсулин фосфорилирование нескольких ферментов, включая гликогенсинтазу , помогает контролировать синтез или деградацию гликогена и позволяет клетке реагировать на изменения уровня сахара в крови . [89] Другим примером посттрансляционной модификации является расщепление полипептидной цепи. Химотрипсин , пищеварительная протеаза , вырабатывается в неактивной форме как химотрипсиноген в поджелудочной железе и транспортируется в этой форме в желудок , где он активируется. Это останавливает фермент от переваривания поджелудочной железы или других тканей до того, как он попадет в кишечник. Этот тип неактивного предшественника фермента известен как зимоген [ 88] : 149–53 или профермент.
Выработка ферментов ( транскрипция и трансляция генов ферментов) может быть усилена или уменьшена клеткой в ответ на изменения в среде клетки. Эта форма регуляции генов называется индукцией ферментов . Например, бактерии могут стать устойчивыми к антибиотикам, таким как пенициллин , потому что индуцируются ферменты, называемые бета-лактамазами , которые гидролизуют важное бета-лактамное кольцо в молекуле пенициллина. [90] Другой пример — ферменты в печени , называемые цитохром P450 оксидазами , которые важны в метаболизме лекарств . Индукция или ингибирование этих ферментов может вызывать лекарственные взаимодействия . [91] Уровни ферментов также можно регулировать, изменяя скорость деградации ферментов . [1] : 30.1.1 Противоположностью индукции ферментов является репрессия ферментов .
Ферменты могут быть разделены на компартменты, при этом в разных клеточных компартментах происходят различные метаболические пути . Например, жирные кислоты синтезируются одним набором ферментов в цитозоле , эндоплазматическом ретикулуме и аппарате Гольджи и используются другим набором ферментов в качестве источника энергии в митохондриях посредством β-окисления . [92] Кроме того, перемещение фермента в разные компартменты может изменить степень протонирования (например, нейтральная цитоплазма и кислая лизосома ) или окислительное состояние (например, окисление периплазмы или восстановление цитоплазмы ), что, в свою очередь, влияет на активность фермента. [93] В отличие от разделения на связанные с мембраной органеллы, субклеточная локализация фермента также может быть изменена посредством полимеризации ферментов в макромолекулярные цитоплазматические филаменты. [94] [95]
У многоклеточных эукариот клетки в разных органах и тканях имеют разные паттерны экспрессии генов и, следовательно, разные наборы ферментов (известных как изоферменты ), доступных для метаболических реакций. Это обеспечивает механизм регулирования общего метаболизма организма. Например, гексокиназа , первый фермент в пути гликолиза , имеет специализированную форму, называемую глюкокиназой, экспрессируемую в печени и поджелудочной железе , которая имеет меньшее сродство к глюкозе, но более чувствительна к концентрации глюкозы. [96] Этот фермент участвует в определении уровня сахара в крови и регулировании выработки инсулина. [97]


Поскольку жесткий контроль активности ферментов необходим для гомеостаза , любая неисправность (мутация, перепроизводство, недопроизводство или делеция) одного критического фермента может привести к генетическому заболеванию. Неисправность всего лишь одного типа фермента из тысяч типов, присутствующих в организме человека, может быть фатальной. Примером фатального генетического заболевания, вызванного недостаточностью фермента, является болезнь Тея-Сакса , при которой у пациентов отсутствует фермент гексозаминидаза . [98] [99]
Одним из примеров дефицита фермента является наиболее распространенный тип фенилкетонурии . Множество различных мутаций отдельных аминокислот в ферменте фенилаланингидроксилазе , который катализирует первый шаг в деградации фенилаланина , приводят к накоплению фенилаланина и связанных с ним продуктов. Некоторые мутации находятся в активном центре, напрямую нарушая связывание и катализ, но многие находятся далеко от активного центра и снижают активность, дестабилизируя структуру белка или влияя на правильную олигомеризацию. [100] [101] Это может привести к умственной отсталости , если болезнь не лечить. [102] Другим примером является дефицит псевдохолинэстеразы , при котором нарушается способность организма расщеплять препараты эфира холина. [103] Пероральное введение ферментов может использоваться для лечения некоторых функциональных дефицитов ферментов, таких как недостаточность поджелудочной железы [104] и непереносимость лактозы . [105]
Другой способ, которым сбои в работе ферментов могут вызывать заболевания, происходит из-за мутаций зародышевой линии в генах, кодирующих ферменты репарации ДНК . Дефекты в этих ферментах вызывают рак, потому что клетки менее способны восстанавливать мутации в своих геномах . Это вызывает медленное накопление мутаций и приводит к развитию рака . Примером такого наследственного ракового синдрома является пигментная ксеродерма , которая вызывает развитие рака кожи в ответ даже на минимальное воздействие ультрафиолетового света . [106] [107]
Подобно любому другому белку, ферменты со временем изменяются посредством мутаций и расхождения последовательностей. Учитывая их центральную роль в метаболизме , эволюция ферментов играет решающую роль в адаптации . Поэтому ключевым вопросом является то, могут ли ферменты и каким образом одновременно изменять свою ферментативную активность. Общепринято, что многие новые ферментативные активности развились посредством дупликации генов и мутации дублированных копий, хотя эволюция может происходить и без дупликации. Одним из примеров фермента, который изменил свою активность, является предок метиониламинопептидазы (MAP) и креатинамидиногидролазы ( креатиназа ), которые явно гомологичны, но катализируют совершенно разные реакции (MAP удаляет аминоконцевой метионин в новых белках, в то время как креатиназа гидролизует креатин до саркозина и мочевины ). Кроме того, MAP зависит от ионов металлов, в то время как креатиназа — нет, поэтому это свойство также было утрачено со временем. [108] Небольшие изменения ферментативной активности чрезвычайно распространены среди ферментов. В частности, специфичность связывания субстрата (см. выше) может легко и быстро меняться с помощью изменений отдельных аминокислот в их субстратсвязывающих карманах. Это часто наблюдается в основных классах ферментов, таких как киназы . [109]
Искусственная (in vitro) эволюция в настоящее время широко используется для изменения активности или специфичности ферментов в промышленных целях (см. ниже).
Ферменты используются в химической промышленности и других промышленных приложениях, когда требуются чрезвычайно специфические катализаторы. Ферменты в целом ограничены в количестве реакций, которые они развили для катализа, а также в связи с их недостаточной стабильностью в органических растворителях и при высоких температурах. Как следствие, белковая инженерия является активной областью исследований и включает попытки создания новых ферментов с новыми свойствами либо посредством рационального проектирования, либо посредством эволюции in vitro . [110] [111] Эти усилия начали приносить успех, и несколько ферментов теперь были разработаны «с нуля» для катализа реакций, которые не встречаются в природе. [112]