.jpg/440px-E._coli_Bacteria_(7316101966).jpg)
Микробиота кишечника , микробиом кишечника или флора кишечника — это микроорганизмы , включая бактерии , археи , грибы и вирусы , которые живут в пищеварительном тракте животных . [1] [2] Метагеном желудочно-кишечного тракта — это совокупность всех геномов микробиоты кишечника . [ 3] [4] Кишечник является основным местом обитания микробиома человека . [5] Микробиота кишечника оказывает широкое влияние, включая влияние на колонизацию , устойчивость к патогенам , поддержание эпителия кишечника , метаболизм пищевых и фармацевтических соединений, контроль иммунной функции и даже поведение через ось кишечник-мозг . [4]
Микробный состав микробиоты кишечника различается в зависимости от области пищеварительного тракта. Толстая кишка содержит самую высокую микробную плотность из всех изученных до сих пор сообществ микробов, связанных с человеком, представляя от 300 до 1000 различных видов . [6] Бактерии являются крупнейшим и на сегодняшний день наиболее изученным компонентом, и 99% бактерий кишечника происходят из примерно 30 или 40 видов. [7] До 60% сухой массы фекалий составляют бактерии. [8] Более 99% бактерий в кишечнике являются анаэробами , но в слепой кишке аэробные бактерии достигают высокой плотности. [5] Подсчитано, что микробиота кишечника человека имеет примерно в сто раз больше генов , чем в геноме человека .

У людей микробиота кишечника имеет наибольшее количество и виды бактерий по сравнению с другими частями тела. [9] Приблизительное количество бактерий, составляющих микробиоту кишечника, составляет около 10 13 –10 14 (от 10 000 до 100 000 миллиардов). [10] У людей флора кишечника формируется при рождении и постепенно переходит в состояние, напоминающее таковое у взрослых, к двум годам, [11] совпадающее с развитием и созреванием кишечного эпителия и кишечного слизистого барьера . Этот барьер необходим для поддержания симбиотических отношений с флорой кишечника, обеспечивая при этом защиту от патогенных организмов. [12] [13]
Отношения между некоторыми видами кишечной микробиоты и людьми не просто комменсальные (безвредное сосуществование), а скорее мутуалистические отношения. [5] : 700 Некоторые микроорганизмы кишечника человека приносят пользу хозяину, ферментируя пищевые волокна в короткоцепочечные жирные кислоты (SCFA), такие как уксусная кислота и масляная кислота , которые затем усваиваются хозяином. [9] [14] Кишечные бактерии также играют роль в синтезе некоторых витаминов группы В и витамина К , а также в метаболизме желчных кислот , стеринов и ксенобиотиков . [5] [14] Системное значение SCFA и других соединений, которые они производят, подобно гормонам , а сама кишечная флора, по-видимому, функционирует как эндокринный орган . [14] Нарушение регуляции кишечной флоры коррелирует с множеством воспалительных и аутоиммунных состояний. [9] [15]
Состав микробиоты кишечника человека меняется со временем, при изменении рациона питания и общего состояния здоровья. [9] [15] Систематический обзор 2016 года изучил доклинические и небольшие испытания на людях, которые были проведены с определенными коммерчески доступными штаммами пробиотических бактерий, и выявил те, которые имели наибольший потенциал быть полезными при определенных расстройствах центральной нервной системы . [16] Следует также подчеркнуть, что средиземноморская диета, богатая овощами и клетчаткой, стимулирует активность и рост полезных для мозга бактерий. [17]
Микробный состав микробиоты кишечника различается в зависимости от пищеварительного тракта. В желудке и тонком кишечнике обычно присутствует относительно немного видов бактерий. [6] [18] Толстая кишка , напротив, содержит самую высокую микробную плотность любого связанного с человеком микробного сообщества, изученного до сих пор [19] - от 10 10 до 10 11 (от 10 до 100 миллиардов) клеток на грамм содержимого кишечника. [20] Эти бактерии представляют от 300 до 1000 различных видов . [6] [18] Однако 99% бактерий происходят из примерно 30 или 40 видов. [7] Вследствие их обилия в кишечнике бактерии также составляют до 60% сухой массы фекалий . [8] Грибы , простейшие , археи и вирусы также присутствуют во флоре кишечника, но об их активности известно меньше. [21]
Более 99% бактерий в кишечнике являются анаэробами , но в слепой кишке аэробные бактерии достигают высокой плотности. [5] По оценкам, эта кишечная флора имеет в общей сложности примерно в сто раз больше генов , чем в геноме человека . [22]
Многие виды в кишечнике не были изучены вне их хозяев, поскольку их невозможно культивировать . [18] [7] [23] Хотя существует небольшое количество основных видов микроорганизмов, общих для большинства людей, популяции микробов могут сильно различаться. [24] Внутри человека их популяции микробов остаются довольно постоянными с течением времени, с некоторыми изменениями, происходящими из-за изменений в образе жизни, диете и возрасте. [6] [25] Проект «Микробиом человека» был направлен на более точное описание микробиоты человеческого кишечника и других частей тела. [ необходима ссылка ]
Четыре доминирующих типа бактерий в кишечнике человека — это Bacillota (Firmicutes), Bacteroidota , Actinomycetota и Pseudomonadota . [26] Большинство бактерий относятся к родам Bacteroides , Clostridium , Faecalibacterium , [6] [7] Eubacterium , Ruminococcus , Peptococcus , Peptostreptococcus и Bifidobacterium . [6] [7] Другие роды, такие как Escherichia и Lactobacillus , присутствуют в меньшей степени. [6] Виды только из рода Bacteroides составляют около 30% всех бактерий в кишечнике, что позволяет предположить, что этот род особенно важен для функционирования хозяина. [18]
Роды грибов, которые были обнаружены в кишечнике, включают Candida , Saccharomyces , Aspergillus , Penicillium , Rhodotorula , Trametes , Pleospora , Sclerotinia , Bullera и Galactomyces , среди прочих. [27] [28] Rhodotorula чаще всего встречается у людей с воспалительным заболеванием кишечника , тогда как Candida чаще всего встречается у людей с циррозом гепатита B и хроническим гепатитом B. [27]
Из-за распространенности грибков в естественной среде сложно определить, какие роды и виды являются постоянными членами кишечной микобиомы . [29] [30] Ведутся исследования относительно того, является ли Penicillium постоянным или временным членом кишечной флоры, получаемым из пищевых источников, таких как сыр , хотя известно, что несколько видов этого рода выживают при температуре около 37 °C, что примерно соответствует температуре тела . [30] Известно, что Saccharomyces cerevisiae , пивные дрожжи, попадают в кишечник после попадания в организм и могут быть ответственны за состояние синдрома автопивоварни в случаях, когда они избыточны, [30] [31] [32] в то время как Candida albicans , вероятно, является постоянным членом и, как полагают, приобретается при рождении путем вертикальной передачи . [33] [ необходима медицинская ссылка ]
Археи составляют еще один большой класс кишечной флоры, играющий важную роль в метаболизме бактериальных продуктов брожения.
Индустриализация связана с изменениями в микробиоте, а сокращение разнообразия может привести к вымиранию некоторых видов; в 2018 году исследователи предложили создать биобанк, хранящий микробиоту человека. [34]
Энтеротип — это классификация живых организмов, основанная на их бактериологической экосистеме в микробиоме кишечника человека, не зависящая от возраста, пола, массы тела или национальных различий. [35] Имеются данные о том, что долгосрочная диета влияет на энтеротип. [36] Было предложено три человеческих энтеротипа, [35] [37], но их ценность была поставлена под сомнение. [38]
Из-за высокой кислотности желудка большинство микроорганизмов не могут там выжить. Основные бактерии желудочной микробиоты принадлежат к пяти основным типам: Firmicutes , Bacteroidetes , Actinobacteria , Fusobacteriota и Proteobacteria . Доминирующими родами являются Prevotella , Streptococcus , Veillonella , Rothia и Haemophilus . [39] Взаимодействие между уже существующей желудочной микробиотой и введением H. pylori может влиять на прогрессирование заболевания . [39] При наличии H. pylori она становится доминантой микробиоты. [40]
Тонкий кишечник содержит следовое количество микроорганизмов из-за близости и влияния желудка. Грамположительные кокки и палочковидные бактерии являются преобладающими микроорганизмами, обнаруженными в тонком кишечнике. [5] Однако в дистальной части тонкого кишечника щелочные условия поддерживают грамотрицательные бактерии Enterobacteriaceae . [ 5] Бактериальная флора тонкого кишечника помогает в широком спектре кишечных функций. Бактериальная флора обеспечивает регуляторные сигналы, которые обеспечивают развитие и полезность кишечника. Избыточный рост бактерий в тонком кишечнике может привести к кишечной недостаточности. [42] Кроме того, толстый кишечник содержит самую большую бактериальную экосистему в организме человека. [5] Около 99% флоры толстого кишечника и фекалий состоят из облигатных анаэробов, таких как Bacteroides и Bifidobacterium. [43] Факторы, которые нарушают популяцию микроорганизмов толстого кишечника, включают антибиотики, стресс и паразитов. [5]
Бактерии составляют большую часть флоры толстой кишки [ 44] и составляют 60% фекального азота. [6] Этот факт делает фекалии идеальным источником кишечной флоры для любых тестов и экспериментов путем извлечения нуклеиновой кислоты из образцов фекалий, а последовательности генов бактериальной 16S рРНК генерируются с помощью бактериальных праймеров. Эта форма тестирования также часто предпочтительнее более инвазивных методов, таких как биопсия.
В кишечной микробиоте доминируют пять типов : Bacteroidota , Bacillota (Firmicutes), Actinomycetota , Pseudomonadota и Verrucomicrobiota , при этом Bacteroidota и Bacillota составляют 90% состава. [45] В кишечнике обитает от 300 [6] до 1000 различных видов , [18] по большинству оценок их около 500. [46] [47] Однако вполне вероятно, что 99% бактерий относятся к 30 или 40 видам, причем Faecalibacterium prausnitzii (филум firmicutes) является наиболее распространенным видом у здоровых взрослых. [7] [48]
Исследования показывают, что отношения между кишечной флорой и людьми не просто комменсальные (безвредное сосуществование), а скорее мутуалистические , симбиотические отношения. [18] Хотя люди могут выживать без кишечной флоры, [46] микроорганизмы выполняют множество полезных функций, таких как ферментация неиспользованных энергетических субстратов, тренировка иммунной системы с помощью конечных продуктов метаболизма, таких как пропионат и ацетат , предотвращение роста вредных видов, регулирование развития кишечника, выработка витаминов для хозяина (таких как биотин и витамин К ) и выработка гормонов, направляющих хозяина на запасание жиров. [5] Обширные изменения и дисбалансы кишечной микробиоты и ее микробиома или набора генов связаны с ожирением. [49] Однако при определенных условиях считается, что некоторые виды способны вызывать заболевания , вызывая инфекцию или увеличивая риск рака у хозяина. [6] [44]
Грибы и простейшие также составляют часть кишечной флоры, но об их деятельности известно меньше. [50]
Человеческий виром в основном состоит из бактериофагов . [51]
Существуют общие закономерности эволюции состава микробиома в течение жизни. [52] В целом, разнообразие состава микробиоты фекальных образцов значительно выше у взрослых, чем у детей, хотя межличностные различия у детей выше, чем у взрослых. [53] Большая часть созревания микробиоты до конфигурации, подобной взрослой, происходит в течение первых трех лет жизни. [53]
По мере изменения состава микробиома меняется и состав бактериальных белков, вырабатываемых в кишечнике. В микробиомах взрослых обнаружено высокое распространение ферментов, участвующих в ферментации , метаногенезе и метаболизме аргинина , глутамата , аспартата и лизина . Напротив, в микробиомах младенцев доминирующие ферменты участвуют в метаболизме цистеина и путях ферментации. [53]
Состав микробиома кишечника зависит от географического происхождения популяций. Изменения в компромиссе Prevotella , представленности гена уреазы и представленности генов, кодирующих глутаматсинтазу/деградацию или другие ферменты, участвующие в деградации аминокислот или биосинтезе витаминов, показывают значительные различия между популяциями из США, Малави или индейского происхождения. [53]
Население США имеет высокую представленность ферментов, кодирующих деградацию глутамина , и ферментов, участвующих в биосинтезе витаминов и липоевой кислоты ; тогда как население Малави и американских индейцев имеет высокую представленность ферментов, кодирующих глутаматсинтазу, а также у них в микробиомах наблюдается повышенная представленность α-амилазы . Поскольку население США имеет рацион, более богатый жирами, чем американские индейцы или малавийцы, которые имеют рацион, богатый кукурузой, рацион, вероятно, является основным фактором, определяющим состав бактерий кишечника. [53]
Дальнейшие исследования показали большую разницу в составе микробиоты между европейскими и сельскими африканскими детьми. Фекальные бактерии детей из Флоренции сравнивались с бактериями детей из небольшой сельской деревни Бульпон в Буркина-Фасо . Рацион типичного ребенка, живущего в этой деревне, в значительной степени лишен жиров и животных белков и богат полисахаридами и растительными белками. Фекальные бактерии европейских детей были представлены Firmicutes и показали заметное снижение биоразнообразия, в то время как фекальные бактерии детей Бульпона были представлены Bacteroidetes . Возросшее биоразнообразие и другой состав микробиома кишечника в африканских популяциях могут способствовать перевариванию обычно неперевариваемых растительных полисахаридов, а также могут привести к снижению частоты неинфекционных заболеваний толстой кишки. [54]
В меньшем масштабе было показано, что совместное использование многочисленных общих экологических воздействий в семье является сильным фактором, определяющим индивидуальный состав микробиома. Этот эффект не имеет генетического влияния и постоянно наблюдается в культурно различных популяциях. [53]
У недоедающих детей микробиота кишечника менее зрелая и менее разнообразная, чем у здоровых детей, а изменения в микробиоме, связанные с дефицитом питательных веществ, могут, в свою очередь, быть патофизиологической причиной недоедания. [55] [56] У недоедающих детей также обычно больше потенциально патогенной кишечной флоры и больше дрожжей во рту и горле. [57] Изменение рациона питания может привести к изменениям в составе и разнообразии микробиоты кишечника. [58]
Исследователи из American Gut Project и Human Microbiome Project обнаружили, что двенадцать семейств микробов различаются по численности в зависимости от расы или этнической принадлежности человека. Сила этих связей ограничена небольшим размером выборки: American Gut Project собрал данные от 1375 человек, 90% из которых были белыми. [59] Исследование Healthy Life in an Urban Setting (HELIUS) в Амстердаме показало, что у людей голландского происхождения самый высокий уровень разнообразия микробиоты кишечника, в то время как у людей южноазиатского и суринамского происхождения — самый низкий уровень разнообразия. Результаты исследования показали, что у людей одной расы или этнической принадлежности микробиомы более схожи, чем у людей с другим расовым происхождением. [59]
По состоянию на 2020 год, по крайней мере, два исследования продемонстрировали связь между социально-экономическим статусом человека (SES) и его микробиотой кишечника. Исследование в Чикаго показало, что у людей в районах с более высоким SES было большее разнообразие микробиоты. У людей из районов с более высоким SES также было больше бактерий Bacteroides . Аналогичным образом, исследование близнецов в Соединенном Королевстве показало, что более высокий SES также был связан с большим разнообразием кишечника. [59]
Формирование кишечной флоры имеет решающее значение для здоровья взрослого человека, а также для функционирования желудочно-кишечного тракта. [60] У людей кишечная флора, похожая на взрослую, формируется в течение одного-двух лет после рождения, поскольку микробиота приобретается путем передачи от родителя к ребенку и передается через пищу, воду и другие источники окружающей среды. [61] [12]

Традиционное представление о желудочно-кишечном тракте нормального плода заключается в том, что он стерилен, хотя в последние несколько лет это представление было оспорено. [ временные рамки? ] [62] Начали появляться многочисленные линии доказательств, которые предполагают, что во внутриутробной среде могут быть бактерии. У людей исследования показали, что микробная колонизация может происходить у плода [63] при этом одно исследование показало, что виды Lactobacillus и Bifidobacterium присутствовали в биопсиях плаценты. [64] Несколько исследований на грызунах продемонстрировали присутствие бактерий в амниотической жидкости и плаценте, а также в меконии детей, рожденных путем стерильного кесарева сечения. [65] [66] В другом исследовании исследователи вводили культуру бактерий перорально беременным мышам и обнаружили бактерии у потомства, вероятно, в результате передачи между пищеварительным трактом и амниотической жидкостью через кровоток. [67] Однако исследователи предупреждают, что источник этих внутриутробных бактерий, живые ли они и их роль пока не изучены. [68] [64]
Во время родов и вскоре после этого бактерии от матери и окружающей среды колонизируют кишечник младенца. [12] Точные источники бактерий до конца не изучены, но могут включать родовые пути, других людей (родителей, братьев и сестер, работников больницы), грудное молоко, пищу и общую среду, с которой взаимодействует младенец. [69] Исследования показали, что микробиом детей, рожденных вагинально, значительно отличается от микробиома детей, рожденных с помощью кесарева сечения , и что дети, рожденные вагинально, получили большую часть своих кишечных бактерий от своей матери, в то время как микробиота детей, рожденных с помощью кесарева сечения, содержала больше бактерий, связанных с больничной средой. [70]
В течение первого года жизни состав кишечной флоры, как правило, прост и сильно меняется со временем, а также не одинаков у разных людей. [12] Первоначальная бактериальная популяция, как правило, представляет собой факультативные анаэробные организмы ; исследователи полагают, что эти первоначальные колонизаторы снижают концентрацию кислорода в кишечнике, что, в свою очередь, позволяет облигатным анаэробным бактериям, таким как Bacteroidota , Actinomycetota и Bacillota , закрепляться и развиваться. [12] У грудных детей преобладают бифидобактерии , возможно, из-за содержания факторов роста бифидобактерий в грудном молоке, а также из-за того, что грудное молоко содержит пребиотические компоненты, обеспечивающие здоровый рост бактерий. [64] [71] Грудное молоко также содержит более высокие уровни иммуноглобулина А (IgA), что помогает с толерантностью и регуляцией иммунной системы ребенка. [72] Напротив, микробиота детей, находящихся на искусственном вскармливании , более разнообразна и содержит большое количество Enterobacteriaceae , энтерококков , бифидобактерий, бактероидов и клостридий. [73]
Кесарево сечение, антибиотики и искусственное вскармливание могут изменить состав микробиома кишечника. [64] Дети, леченные антибиотиками, имеют менее стабильные и менее разнообразные цветочные сообщества. [74] Было показано, что кесарево сечение нарушает передачу бактерий от матери к потомству, что влияет на общее состояние здоровья потомства, повышая риск таких заболеваний, как целиакия , астма и диабет 1 типа . [64] Это еще раз подтверждает важность здорового микробиома кишечника. Изучаются различные методы восстановления микробиома, обычно включающие воздействие на младенца содержимого влагалища матери и пероральных пробиотиков. [64]
Когда в 1995 году началось изучение кишечной флоры, [75] считалось, что она играет три ключевые роли: прямая защита от патогенов , укрепление защиты хозяина за счет своей роли в развитии и поддержании кишечного эпителия и индукции выработки антител там, а также метаболизм в противном случае неперевариваемых соединений в пище. Последующие исследования обнаружили ее роль в обучении развивающейся иммунной системы, и еще одна работа была сосредоточена на ее роли в оси кишечник-мозг . [76]
Сообщество кишечной флоры играет прямую роль в защите от патогенов, полностью колонизируя пространство, используя все доступные питательные вещества и секретируя соединения, известные как цитокины, которые убивают или подавляют нежелательные организмы, которые будут конкурировать с ним за питательные вещества. [77] Различные штаммы кишечных бактерий вызывают выработку различных цитокинов. Цитокины — это химические соединения, вырабатываемые нашей иммунной системой для инициирования воспалительного ответа на инфекции. Нарушение кишечной флоры позволяет конкурирующим организмам, таким как Clostridioides difficile, закрепляться, которые в противном случае остаются в состоянии бездействия. [77]
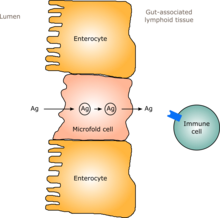
У людей кишечная флора, похожая на взрослую, формируется в течение одного-двух лет после рождения. [12] По мере того, как кишечная флора формируется, слизистая оболочка кишечника — кишечный эпителий и секретируемый им слизистый барьер кишечника — также развиваются таким образом, что становятся толерантными и даже поддерживающими комменсалистические микроорганизмы в определенной степени, а также обеспечивают барьер для патогенных микроорганизмов. [12] В частности, бокаловидные клетки , которые производят слизистую оболочку, размножаются, и слизистый слой утолщается, обеспечивая внешний слизистый слой, в котором могут закрепляться и питаться «дружественные» микроорганизмы, и внутренний слой, в который даже эти организмы не могут проникнуть. [12] [13] Кроме того, развитие лимфоидной ткани, ассоциированной с кишечником (GALT), которая является частью кишечного эпителия и которая обнаруживает и реагирует на патогены, появляется и развивается в то время, когда развивается и закрепляется кишечная флора. [12] Развивающаяся GALT толерантна к видам кишечной флоры, но не к другим микроорганизмам. [12] GALT также обычно становится толерантной к пище, которой подвергается младенец, а также к продуктам переваривания пищи и метаболитам кишечной флоры (молекулам, образующимся в результате метаболизма), вырабатываемым из пищи. [12]
Иммунная система человека вырабатывает цитокины , которые могут заставить иммунную систему вызывать воспаление, чтобы защитить себя, и которые могут подавлять иммунный ответ для поддержания гомеостаза и обеспечения заживления после инсульта или травмы. [12] Было показано, что различные виды бактерий, которые появляются в кишечной флоре, способны заставлять иммунную систему избирательно вырабатывать цитокины; например, Bacteroides fragilis и некоторые виды Clostridia, по-видимому, вызывают противовоспалительную реакцию, в то время как некоторые сегментированные нитчатые бактерии вызывают выработку воспалительных цитокинов. [12] [78] Кишечная флора также может регулировать выработку антител иммунной системой. [12] [79] Одна из функций этой регуляции заключается в том, чтобы заставить В-клетки переключиться на IgA . В большинстве случаев В-клетки нуждаются в активации от Т-хелперных клеток , чтобы вызвать переключение класса ; однако в другом пути кишечная флора вызывает сигнализацию NF-kB кишечными эпителиальными клетками, что приводит к секреции дополнительных сигнальных молекул. [80] Эти сигнальные молекулы взаимодействуют с В-клетками, чтобы вызвать переключение класса на IgA. [80] IgA является важным типом антител, который используется в слизистых оболочках, таких как кишечник. Было показано, что IgA может помочь разнообразить сообщество кишечника и помогает избавиться от бактерий, вызывающих воспалительные реакции. [81] В конечном счете, IgA поддерживает здоровую среду между хозяином и кишечными бактериями. [81] Эти цитокины и антитела могут оказывать действие за пределами кишечника, в легких и других тканях. [12]
Иммунная система также может быть изменена из-за способности кишечных бактерий производить метаболиты , которые могут влиять на клетки иммунной системы. Например, короткоцепочечные жирные кислоты (SCFA) могут вырабатываться некоторыми кишечными бактериями посредством ферментации . [82] SCFA стимулируют быстрое увеличение производства врожденных иммунных клеток, таких как нейтрофилы , базофилы и эозинофилы . [82] Эти клетки являются частью врожденной иммунной системы, которая пытается ограничить распространение инфекции.
Без кишечной флоры организм человека не смог бы использовать некоторые непереваренные углеводы, которые он потребляет, потому что некоторые типы кишечной флоры имеют ферменты , которых не хватает человеческим клеткам для расщепления определенных полисахаридов . [14] Грызуны, выращенные в стерильной среде и лишенные кишечной флоры, должны потреблять на 30% больше калорий , чтобы оставаться того же веса, что и их нормальные сородичи. [14] Углеводы, которые человек не может переварить без помощи бактерий, включают определенные крахмалы , клетчатку , олигосахариды и сахара , которые организм не смог переварить и усвоить, такие как лактоза в случае непереносимости лактозы и сахарные спирты , слизь , вырабатываемая кишечником, и белки. [9] [14]
Бактерии превращают углеводы, которые они ферментируют, в короткоцепочечные жирные кислоты с помощью формы ферментации, называемой сахаролитической ферментацией. [47] Продукты включают уксусную кислоту , пропионовую кислоту и масляную кислоту . [7] [47] Эти материалы могут использоваться клетками-хозяевами, обеспечивая основной источник энергии и питательных веществ. [47] Газы (которые участвуют в передаче сигналов [87] и могут вызывать метеоризм ) и органические кислоты , такие как молочная кислота , также производятся путем ферментации. [7] Уксусная кислота используется мышцами , пропионовая кислота способствует выработке АТФ печенью , а масляная кислота обеспечивает энергией клетки кишечника. [47]
Кишечная флора также синтезирует витамины, такие как биотин и фолат , и способствует усвоению пищевых минералов , включая магний, кальций и железо. [6] [25] Methanobrevibacter smithii уникален, поскольку он не является видом бактерий, а скорее членом домена Archaea и является наиболее распространенным видом архей, продуцирующих метан, в микробиоте желудочно-кишечного тракта человека. [88]
Микробиота кишечника также служит источником витаминов K и B 12 , которые не вырабатываются организмом или вырабатываются в небольших количествах. [89] [90]
Бактерии, которые разлагают целлюлозу (например, Ruminococcus ), распространены среди человекообразных обезьян , древних человеческих обществ, сообществ охотников-собирателей и даже современных сельских популяций. Однако они редки в индустриальных обществах. Штаммы, связанные с человеком, приобрели гены, которые могут разлагать определенные растительные волокна, такие как кукуруза , рис и пшеница . Бактериальные штаммы, обнаруженные у приматов, также могут разлагать хитин , полимер, в изобилии встречающийся в насекомых, которые являются частью рациона многих нечеловеческих приматов . Сокращение этих бактерий в кишечнике человека, вероятно, было обусловлено переходом на западный образ жизни. [91]
Человеческий метагеном (т. е. генетический состав человека и всех микроорганизмов, которые находятся на теле человека или внутри него) значительно различается у разных людей. [92] [93] Поскольку общее количество микробных клеток в организме человека (более 100 триллионов) значительно превышает количество клеток Homo sapiens (десятки триллионов), [примечание 1] [92] [94] существует значительный потенциал для взаимодействия между лекарственными средствами и микробиомом человека, включая: лекарственные средства, изменяющие состав микробиома человека , метаболизм лекарственных средств микробными ферментами, изменяющими фармакокинетический профиль лекарственного средства , и микробный метаболизм лекарственных средств, влияющий на клиническую эффективность и профиль токсичности лекарственного средства . [92] [93] [95]
Помимо углеводов, кишечная микробиота может также метаболизировать другие ксенобиотики , такие как лекарства, фитохимические вещества и пищевые токсиканты. Было показано, что более 30 лекарств метаболизируются кишечной микробиотой. [96] Микробный метаболизм лекарств иногда может инактивировать лекарство. [97]
Микробиота кишечника представляет собой обогащенное сообщество, содержащее разнообразные гены с огромными биохимическими возможностями для модификации лекарств, особенно тех, которые принимаются внутрь. [98] Микробиота кишечника может влиять на метаболизм лекарств через прямые и косвенные механизмы. [99] Прямой механизм опосредован микробными ферментами, которые могут изменять химическую структуру вводимых лекарств. [100] Наоборот, косвенный путь опосредован микробными метаболитами, которые влияют на экспрессию ферментов метаболизма хозяина, таких как цитохром P450 . [101] [99] Влияние микробиоты кишечника на фармакокинетику и биодоступность лекарств было исследовано несколько десятилетий назад. [102] [103] [104] Эти эффекты могут быть различными; они могут активировать неактивные лекарства, такие как ловастатин, [105] инактивировать активное лекарство, такое как дигоксин [106] или вызывать токсичность лекарств, как в случае с иринотеканом . [107] С тех пор активно изучалось влияние микробиоты кишечника на фармакокинетику многих лекарственных препаратов. [108] [98]
Микробиота кишечника человека играет решающую роль в модулировании эффекта вводимых лекарств на человека. Непосредственно микробиота кишечника может синтезировать и высвобождать ряд ферментов, способных метаболизировать лекарства, такие как микробная биотрансформация L-допы ферментами декарбоксилазы и дегидроксилазы. [100] Напротив, микробиота кишечника может также изменять метаболизм лекарств, модулируя метаболизм лекарств хозяина. Этот механизм может быть опосредован микробными метаболитами или путем модификации метаболитов хозяина, которые, в свою очередь, изменяют экспрессию ферментов, метаболизирующих хозяина. [101]
Большое количество исследований продемонстрировало метаболизм более 50 препаратов микробиотой кишечника. [108] [99] Например, ловастатин (средство для снижения уровня холестерина), который является пролекарством лактона, частично активируется микробиотой кишечника человека, образуя активные гидроксилированные метаболиты кислоты. [105] Напротив, дигоксин (препарат, используемый для лечения застойной сердечной недостаточности) инактивируется членом микробиоты кишечника (то есть Eggerthella lanta ). [109] Eggerthella lanta имеет оперон, кодирующий цитохром, который активируется дигоксином и связан с инактивацией дигоксина. [109] Микробиота кишечника также может модулировать эффективность и токсичность химиотерапевтических агентов, таких как иринотекан. [110] Этот эффект обусловлен ферментами β-глюкуронидазы, кодируемыми микробиомом, которые восстанавливают активную форму иринотекана, вызывая желудочно-кишечную токсичность. [111]
Это микробное сообщество в кишечнике обладает огромной биохимической способностью производить различные вторичные метаболиты, которые иногда производятся в результате метаболического преобразования диетических продуктов, таких как волокна , эндогенные биологические соединения, такие как индол или желчные кислоты . [112] [113] [114] Микробные метаболиты, особенно короткоцепочечные жирные кислоты (КЦЖК) и вторичные желчные кислоты (ВЖК), играют важную роль для человека в состоянии здоровья и при заболеваниях. [115] [116] [117]
Одним из важнейших бактериальных метаболитов, продуцируемых микробиотой кишечника, являются вторичные желчные кислоты (BAs). [114] Эти метаболиты продуцируются путем бактериальной биотрансформации первичных желчных кислот, таких как холевая кислота (CA) и хенодезоксихолевая кислота (CDCA), во вторичные желчные кислоты (BAs), литохолевую кислоту (LCA) и дезоксихолевую кислоту (DCA) соответственно. [118] Первичные желчные кислоты, которые синтезируются гепатоцитами и хранятся в желчном пузыре, обладают гидрофобными свойствами. Эти метаболиты впоследствии метаболизируются микробиотой кишечника во вторичные метаболиты с повышенной гидрофобностью. [118] Гидролазы желчных солей (BSH), которые сохраняются во всех типах микробиоты кишечника, таких как Bacteroides , Firmicutes и Actinobacteria , отвечают за первый этап метаболизма вторичных желчных кислот. [118] Было показано, что вторичные желчные кислоты (BAs), такие как DCA и LCA, подавляют как прорастание, так и рост Clostridioides difficile . [117]
Микробиота кишечника важна для поддержания гомеостаза в кишечнике. Развитие рака кишечника связано с дисбалансом естественной микрофлоры (дисбактериозом). [119] Вторичная желчная кислота — дезоксихолевая кислота — связана с изменениями микробного сообщества, которые приводят к усилению канцерогенеза в кишечнике. [119] Повышенное воздействие вторичных желчных кислот на толстую кишку в результате дисбактериоза может вызвать повреждение ДНК , а такое повреждение может привести к канцерогенным мутациям в клетках толстой кишки. [120] Высокая плотность бактерий в толстой кишке (около 10 12 на мл), которые подвержены дисбактериозу, по сравнению с относительно низкой плотностью в тонкой кишке (около 10 2 на мл), может объяснить более чем 10-кратную более высокую заболеваемость раком в толстой кишке по сравнению с тонкой кишкой. [120]
Ось кишечник–мозг — это биохимическая сигнализация, которая происходит между желудочно-кишечным трактом и центральной нервной системой . [76] Этот термин был расширен, чтобы включить роль кишечной флоры во взаимодействии; термин «ось микробиом–мозг» иногда используется для описания парадигм, явно включающих кишечную флору. [76] [121] [122] В широком смысле ось кишечник–мозг включает центральную нервную систему, нейроэндокринную и нейроиммунную системы, включая гипоталамо-гипофизарно-надпочечниковую ось (ось HPA), симпатическую и парасимпатическую ветви автономной нервной системы, включая энтеральную нервную систему , блуждающий нерв и микробиоту кишечника . [76] [122]
Систематический обзор 2016 года изучил доклинические и небольшие испытания на людях, которые были проведены с некоторыми коммерчески доступными штаммами пробиотических бактерий, и обнаружил, что среди протестированных роды Bifidobacterium и Lactobacillus ( B. longum , B. breve , B. infantis , L. helveticus , L. rhamnosus , L. plantarum и L. casei ) имели наибольший потенциал для использования при некоторых расстройствах центральной нервной системы . [16]
Изменение количества кишечных бактерий, например, путем приема антибиотиков широкого спектра действия , может повлиять на здоровье хозяина и его способность переваривать пищу. [123] Антибиотики могут вызывать диарею, связанную с антибиотиками , путем непосредственного раздражения кишечника , изменения уровня микробиоты или разрешения патогенным бактериям расти. [7] Другим вредным эффектом антибиотиков является увеличение количества устойчивых к антибиотикам бактерий, обнаруживаемых после их использования, которые, попадая в организм хозяина, вызывают заболевания, которые трудно поддаются лечению антибиотиками. [123]
Изменение количества и видов кишечной микробиоты может снизить способность организма ферментировать углеводы и метаболизировать желчные кислоты, а также может вызвать диарею . Углеводы, которые не расщепляются, могут поглощать слишком много воды и вызывать жидкий стул, или недостаток короткоцепочечных жирных кислот, вырабатываемых кишечной микробиотой, может вызвать диарею. [7]
Снижение уровня местных видов бактерий также нарушает их способность подавлять рост вредных видов, таких как C. difficile и Salmonella Kedougou, и эти виды могут выйти из-под контроля, хотя их чрезмерный рост может быть случайным и не быть истинной причиной диареи. [6] [7] [123] Новые протоколы лечения инфекций C. difficile включают трансплантацию фекальной микробиоты донорских фекалий (см. Трансплантация фекалий ). [124] Первоначальные отчеты о лечении описывают показатели успешности в 90% с небольшим количеством побочных эффектов. Предполагается, что эффективность является результатом восстановления бактериального баланса классов бактерий Bacteroides и Firmicutes. [125]
Состав микробиома кишечника также меняется при тяжелых заболеваниях, не только из-за использования антибиотиков, но и из-за таких факторов, как ишемия кишечника, отказ от еды и иммунодефицит . Отрицательные эффекты этого привели к интересу к селективной деконтаминации пищеварительного тракта, лечению, направленному на уничтожение только патогенных бактерий и позволяющему восстановить здоровые. [126]
Антибиотики изменяют популяцию микробиоты в желудочно-кишечном тракте , и это может изменить внутрисообщественные метаболические взаимодействия, изменить потребление калорий за счет использования углеводов и в целом повлиять на метаболический, гормональный и иммунный гомеостаз хозяина. [127]
Имеются обоснованные доказательства того, что прием пробиотиков, содержащих виды Lactobacillus, может помочь предотвратить диарею, связанную с приемом антибиотиков, а прием пробиотиков с Saccharomyces (например, Saccharomyces boulardii ) может помочь предотвратить инфекцию Clostridioides difficile после системного лечения антибиотиками. [128]
Микробиота кишечника женщины меняется по мере развития беременности , причем изменения аналогичны тем, что наблюдаются при метаболических синдромах, таких как диабет. Изменение микробиоты кишечника не вызывает никаких побочных эффектов. Микробиота кишечника новорожденного напоминает образцы микробиоты матери в первом триместре. Разнообразие микробиома уменьшается от первого к третьему триместру, так как количество определенных видов увеличивается. [64] [129]
Пробиотики содержат живые микроорганизмы . Считается, что при употреблении они приносят пользу здоровью, изменяя состав микробиома. [130] [131] [132] Текущие исследования изучают использование пробиотиков как способ восстановления микробного баланса кишечника путем стимуляции иммунной системы и ингибирования провоспалительных цитокинов . [130]
Что касается микробиоты кишечника, пребиотики, как правило, представляют собой неперевариваемые волокнистые соединения, которые проходят непереваренными через верхнюю часть желудочно-кишечного тракта и стимулируют рост или активность полезной кишечной флоры, выступая для них в качестве субстрата . [47] [133]
Синбиотики относятся к пищевым ингредиентам или диетическим добавкам, объединяющим пробиотики и пребиотики в форме синергизма . [134]
Термин «фармабиотики» используется в различных значениях, для обозначения: фармацевтических формул (стандартизированное производство, которое может получить одобрение регулирующих органов в качестве лекарственного средства) пробиотиков, пребиотиков или синбиотиков ; [135] пробиотиков, которые были генетически модифицированы или иным образом оптимизированы для лучшей эффективности (срок хранения, выживаемость в пищеварительном тракте и т. д.); [136] и натуральных продуктов метаболизма кишечной флоры (витамины и т. д.). [137]
Есть некоторые доказательства того, что лечение некоторыми пробиотическими штаммами бактерий может быть эффективным при синдроме раздраженного кишечника , [138] [139] вздутии живота [140] и хроническом идиопатическом запоре . К числу организмов, которые с наибольшей вероятностью приведут к уменьшению симптомов, относятся:
Фекалии примерно 10–15% людей постоянно плавают в туалетной воде («плавающие»), в то время как остальные производят фекалии, которые тонут («тонущие»), и выработка газа заставляет фекалии плавать. [144] В то время как обычные мыши часто производят «плавающие», гнотобиотические стерильные мыши без микробиоты кишечника (выращенные в стерильном изоляторе) производят «тонущих», а колонизация микробиоты кишечника у стерильных мышей приводит к преобразованию пищи в микробную биомассу и обогащению множественными газообразующими видами бактерий, что превращает «тонущих» в «плавающих». [145]
Тесты на то, могут ли неантибиотические препараты влиять на кишечные бактерии человека, проводились с помощью анализа in vitro более 1000 продаваемых препаратов против 40 штаммов кишечных бактерий, показывая, что 24% препаратов подавляли рост по крайней мере одного из штаммов бактерий. [146]
Недавно было показано, что кишечная микробиота и упражнения взаимосвязаны. Как умеренные, так и интенсивные упражнения обычно являются частью режима тренировок выносливых спортсменов, но они оказывают разное воздействие на здоровье. Взаимосвязь между кишечной микробиотой и видами спорта на выносливость зависит от интенсивности упражнений и статуса подготовки. [147]
Бактерии в пищеварительном тракте могут способствовать возникновению и быть затронутыми болезнью различными способами. Наличие или избыток некоторых видов бактерий может способствовать возникновению воспалительных заболеваний, таких как воспалительное заболевание кишечника . [6] Кроме того, метаболиты некоторых представителей кишечной флоры могут влиять на сигнальные пути хозяина, способствуя возникновению таких заболеваний, как ожирение и рак толстой кишки . [6] Некоторые кишечные бактерии также могут вызывать инфекции и сепсис , например, когда им позволяют проникать из кишечника в остальную часть тела . [6]
Инфекция Helicobacter pylori может инициировать образование язв желудка, когда бактерии проникают в эпителиальную оболочку желудка, вызывая затем воспалительную фагоцитарную реакцию . [148] В свою очередь, воспаление повреждает париетальные клетки, которые выделяют избыточное количество соляной кислоты в желудок и производят меньше защитной слизи. [149] Повреждение слизистой оболочки желудка, приводящее к язвам , развивается, когда желудочная кислота подавляет защитные свойства клеток и подавляет синтез эндогенных простагландинов , снижает секрецию слизи и бикарбоната, снижает кровоток в слизистой оболочке и снижает устойчивость к травмам. [149] Снижение защитных свойств слизистой оболочки желудка увеличивает уязвимость к дальнейшему повреждению и образованию язв желудочной кислотой, пепсином и желчными солями. [148] [149]
Обычно комменсальные бактерии могут нанести вред хозяину, если они выталкиваются из кишечного тракта. [12] [13] Транслокация, которая происходит, когда бактерии покидают кишечник через его слизистую оболочку, может происходить при ряде различных заболеваний. [13] Если кишечник перфорирован, бактерии проникают в интерстиций , вызывая потенциально смертельную инфекцию . [5] : 715
Два основных типа воспалительных заболеваний кишечника , болезнь Крона и язвенный колит , являются хроническими воспалительными расстройствами кишечника; причины этих заболеваний неизвестны, и проблемы с кишечной флорой и ее взаимоотношениями с хозяином были связаны с этими состояниями. [15] [150] [151] [152] Кроме того, по-видимому, взаимодействие кишечной флоры с осью кишечник-мозг играет роль в ВЗК, при этом физиологический стресс, опосредованный через гипоталамо-гипофизарно-надпочечниковую ось, приводит к изменениям в эпителии кишечника, а кишечная флора, в свою очередь, высвобождает факторы и метаболиты, которые запускают сигнализацию в энтеральной нервной системе и блуждающем нерве . [4]
Разнообразие кишечной флоры, по-видимому, значительно снижено у людей с воспалительными заболеваниями кишечника по сравнению со здоровыми людьми; кроме того, у людей с язвенным колитом, по-видимому, доминируют Proteobacteria и Actinobacteria; у людей с болезнью Крона, по-видимому, преобладают Enterococcus faecium и несколько Proteobacteria. [4]
Имеются обоснованные доказательства того, что коррекция дисбаланса кишечной флоры путем приема пробиотиков с лактобациллами и бифидобактериями может уменьшить висцеральную боль и воспаление кишечника при ВЗК. [128]
Синдром раздраженного кишечника является результатом стресса и хронической активации оси HPA; его симптомы включают боль в животе, изменения в дефекации и увеличение провоспалительных цитокинов. В целом, исследования показали, что люминальная и слизистая микробиота изменены у людей с синдромом раздраженного кишечника, и эти изменения могут быть связаны с типом раздражения, таким как диарея или запор . Кроме того, наблюдается снижение разнообразия микробиома с низким уровнем фекальных лактобацилл и бифидобактерий, высоким уровнем факультативных анаэробных бактерий, таких как Escherichia coli , и повышенным соотношением Firmicutes: Bacteroidetes. [122]
Что касается астмы, то для объяснения ее растущей распространенности в развитых странах были выдвинуты две гипотезы. Гигиеническая гипотеза утверждает, что дети в развитых странах не подвергаются воздействию достаточного количества микробов и, таким образом, могут содержать более низкую распространенность определенных бактериальных таксонов, которые играют защитные роли. [153] Вторая гипотеза фокусируется на западном образце питания , в котором отсутствуют цельные зерна и клетчатка и имеется переизбыток простых сахаров . [15] Обе гипотезы сходятся во мнении о роли короткоцепочечных жирных кислот (SCFA) в иммуномодуляции . Эти метаболиты бактериальной ферментации участвуют в иммунной сигнализации, которая предотвращает возникновение астмы, а более низкие уровни SCFA связаны с заболеванием. [153] [154] Отсутствие защитных родов, таких как Lachnospira , Veillonella , Rothia и Faecalibacterium , было связано со снижением уровней SCFA. [153] Кроме того, SCFA являются продуктом бактериальной ферментации клетчатки, которая низкая в западном образце питания. [15] [154] SCFAs предлагают связь между кишечной флорой и иммунными расстройствами, и по состоянию на 2016 год это было активной областью исследований. [15] Аналогичные гипотезы также были выдвинуты относительно роста пищевой и других аллергий. [155]
Связь между микробиотой кишечника и сахарным диабетом 1 типа также была связана с короткоцепочечными жирными кислотами, такими как бутират и ацетат. Диеты, дающие бутират и ацетат в результате бактериальной ферментации, показывают повышенную экспрессию T reg . [156] Клетки T reg подавляют эффекторные Т-клетки , что, в свою очередь, снижает воспалительную реакцию в кишечнике. [157] Бутират является источником энергии для клеток толстой кишки. Таким образом, диеты, дающие бутират, снижают проницаемость кишечника , обеспечивая достаточно энергии для образования плотных соединений . [158] Кроме того, было показано, что бутират снижает резистентность к инсулину, что позволяет предположить, что кишечные сообщества с низким содержанием микробов, продуцирующих бутират, могут повышать вероятность приобретения сахарного диабета 2 типа . [159] Диеты, дающие бутират, также могут иметь потенциальные эффекты подавления колоректального рака . [158]
Кишечная флора вовлечена в ожирение и метаболический синдром из-за ключевой роли в процессе пищеварения; диета западного образца, по-видимому, стимулирует и поддерживает изменения во флоре кишечника, которые, в свою очередь, изменяют количество энергии, получаемой из пищи, и то, как эта энергия используется. [152] [160] Одним из аспектов здорового питания , которого часто не хватает в диете западного образца, являются волокна и другие сложные углеводы, которые необходимы для процветания здоровой кишечной флоры; изменения кишечной флоры в ответ на диету западного образца, по-видимому, увеличивают количество энергии, вырабатываемой кишечной флорой, что может способствовать ожирению и метаболическому синдрому. [128] Также есть доказательства того, что микробиота влияет на пищевое поведение, основанное на предпочтениях микробиоты, что может привести к тому, что хозяин будет потреблять больше пищи, что в конечном итоге приведет к ожирению. В целом было замечено, что при более высоком разнообразии микробиома кишечника микробиота будет тратить энергию и ресурсы на конкуренцию с другой микробиотой и меньше на манипулирование хозяином. Противоположность наблюдается при меньшем разнообразии микробиома кишечника, и эти микробиоты могут работать вместе, создавая пищевые пристрастия хозяина. [58]
Кроме того, печень играет доминирующую роль в гомеостазе глюкозы в крови , поддерживая баланс между поглощением и хранением глюкозы через метаболические пути гликогенеза и глюконеогенеза . Липиды кишечника регулируют гомеостаз глюкозы, вовлекая ось кишечник–мозг–печень. Прямое введение липидов в верхний отдел кишечника увеличивает уровни длинноцепочечного жирного ацил-кофермента А (LCFA-CoA) в верхнем отделе кишечника и подавляет выработку глюкозы даже при поддиафрагмальной ваготомии или деафферентации блуждающего нерва кишечника . Это прерывает нейронную связь между мозгом и кишечником и блокирует способность липидов верхнего отдела кишечника ингибировать выработку глюкозы. Ось кишечник–мозг–печень и состав микробиоты кишечника могут регулировать гомеостаз глюкозы в печени и обеспечивать потенциальные терапевтические методы лечения ожирения и диабета. [161]
Так же, как кишечная флора может функционировать в цикле обратной связи, который может способствовать развитию ожирения, есть данные, что ограничение потребления калорий (т. е. диета ) может приводить к изменениям в составе кишечной флоры. [152]
Состав микробиома кишечника человека похож на состав микробиома других человекообразных обезьян. Однако, с момента нашего эволюционного отделения от Pan, разнообразие и состав кишечной биоты человека уменьшились . [162] У людей наблюдается увеличение Bacteroidetes, бактериального типа, связанного с рационом с высоким содержанием животного белка и жира, и уменьшение Methanobrevibacter и Fibrobacter, групп, которые ферментируют сложные растительные полисахариды. [162] Эти изменения являются результатом комбинированных диетических, генетических и культурных изменений, которые претерпели люди с момента эволюционного расхождения с Pan . [ требуется ссылка ]
Помимо людей и позвоночных, некоторые насекомые также имеют сложную и разнообразную микробиоту кишечника, которая играет ключевую роль в питании. [2] Микробные сообщества, связанные с термитами, могут составлять большую часть веса особей и выполнять важные роли в переваривании лигноцеллюлозы и фиксации азота . [163] Известно, что нарушение микробиоты кишечника термитов с использованием таких агентов, как антибиотики [164] или борная кислота [165] (распространенное средство, используемое при профилактическом лечении), вызывает серьезные нарушения пищеварительной функции и приводит к росту оппортунистических патогенов. [165] Эти сообщества являются специфичными для хозяина, и близкородственные виды насекомых имеют сопоставимые сходства в составе микробиоты кишечника. [166] [167] Было показано, что у тараканов микробиота кишечника собирается детерминированным образом, независимо от инокулята ; [168] причина этой специфичной для хозяина сборки остается неясной. Бактериальные сообщества, связанные с насекомыми, такими как термиты и тараканы, определяются комбинацией факторов, в первую очередь диетой, но есть некоторые указания на то, что филогения хозяина также может играть роль в выборе линий. [166] [167]
Уже более 51 года известно, что введение низких доз антибактериальных препаратов способствует росту сельскохозяйственных животных и увеличению набора веса. [127]
В исследовании, проведенном на мышах, соотношение Firmicutes и Lachnospiraceae было значительно повышено у животных, получавших субтерапевтические дозы различных антибиотиков. Анализируя калорийность фекалий и концентрацию короткоцепочечных жирных кислот (SCFA) в желудочно-кишечном тракте, был сделан вывод, что изменения в составе микробиоты приводят к повышению способности извлекать калории из неперевариваемых компонентов и к повышению продукции SCFA. Эти результаты свидетельствуют о том, что антибиотики нарушают не только состав микробиома ЖК, но и его метаболические возможности, особенно в отношении SCFA. [127]
ученых теперь сообщает всего о трех различных экосистемах в кишечнике людей, которых они изучали.
Lactobacillus
spp. преобразуют триптофан в индол-3-альдегид (I3A) с помощью неидентифицированных ферментов [125].
Clostridium sporogenes
преобразуют триптофан в IPA [6], вероятно, с помощью триптофандезаминазы. ... IPA также эффективно удаляет гидроксильные радикалы
Было показано, что производство ИПА полностью зависит от присутствия микрофлоры кишечника и может быть установлено путем колонизации бактерией
Clostridium sporogenes
.
[Индол-3-пропионовая кислота (ИПК)] ранее была обнаружена в плазме и спинномозговой жидкости людей, но ее функции неизвестны. ... В экспериментах по кинетической конкуренции с использованием агентов, улавливающих свободные радикалы, способность IPA удалять гидроксильные радикалы превысила способность мелатонина, индоламина, который считается самым мощным естественным поглотителем свободных радикалов. В отличие от других антиоксидантов, IPA не был преобразован в реактивные промежуточные продукты с прооксидантной активностью.
микробиома варьируется в зависимости от анатомического местоположения (рисунок 1). Основным фактором, определяющим состав сообщества, является анатомическое местоположение: межличностные различия существенны
23,24
и выше временной изменчивости, наблюдаемой в большинстве мест у одного человека
25
.