Пиридин представляет собой основное гетероциклическое органическое соединение с химической формулой C 5 H 5 N . Структурно он связан с бензолом , в котором одна метиновая группа (=CH-) заменена атомом азота ( =N-) . Это легковоспламеняющаяся, слабощелочная , смешивающаяся с водой жидкость с характерным неприятным рыбным запахом. Пиридин бесцветен, но старые или загрязненные образцы могут выглядеть желтыми из-за образования протяженных ненасыщенных полимерных цепей, которые обладают значительной электропроводностью . [17] Пиридиновое кольцо встречается во многих важных соединениях, включая агрохимикаты , фармацевтические препараты и витамины . Исторически пиридин производился из каменноугольной смолы . По состоянию на 2016 год во всем мире его синтезируют в объеме около 20 000 тонн в год. [2]


Пиридин диамагнитен . Его критические параметры : давление 5,63 МПа, температура 619 К и объем 248 см 3 ·моль -1 . [19] В диапазоне температур 340–426 °C давление пара p можно описать уравнением Антуана.
где T — температура, A = 4,16272, B = 1371,358 К и C = −58,496 К. [20]
Пиридиновое кольцо образует шестиугольник C 5 N. Наблюдаются небольшие изменения расстояний C-C и C-N , а также валентных углов.
Пиридин кристаллизуется в ромбической кристаллической системе с пространственной группой Pna2 1 и параметрами решетки a = 1752 пм , b = 897 пм, c = 1135 пм и 16 формульных единиц на элементарную ячейку (измерено при 153 К). Для сравнения, кристаллический бензол также ромбический, с пространственной группой Pbca , a = 729,2 пм, b = 947,1 пм, c = 674,2 пм (при 78 К), но число молекул на ячейку составляет всего 4. [18] Эта разница отчасти связано с более низкой симметрией отдельной молекулы пиридина (C 2v по сравнению с D 6h для бензола). Известен тригидрат (пиридин·3H 2 O ) ; он также кристаллизуется в ромбической системе в пространственной группе Pbca , параметры решетки a = 1244 пм, b = 1783 пм, c = 679 пм и восемь формульных единиц на элементарную ячейку (измерено при 223 К). [21]
Спектр оптического поглощения пиридина в гексане состоит из полос с длинами волн 195, 251 и 270 нм. При коэффициентах экстинкции ( ε ) 7500, 2000 и 450 л·моль -1 ·см -1 соответствующие полосы относят к переходам π → π*, π → π* и n → π*.
Спектр 1 H ядерного магнитного резонанса (ЯМР) показывает сигналы α-( δ 8,5), γ-(δ7,5) и β-протонов (δ7). Напротив, сигнал протона бензола находится при δ7,27. Большие химические сдвиги α- и γ-протонов по сравнению с бензолом обусловлены более низкой плотностью электронов в α- и γ-положениях, что можно вывести из резонансных структур. Ситуация довольно аналогична для спектров ЯМР 13 С пиридина и бензола: пиридин показывает триплет при δ (α-C) = 150 м.д., δ(β-C) = 124 м.д. и δ(γ-C) = 136 м.д. , тогда как бензол имеет одну линию при 129 ppm. Все смены указаны для веществ, не содержащих растворителей. [22] Пиридин традиционно обнаруживают методами газовой хроматографии и масс-спектрометрии . [23]
Пиридин имеет сопряженную систему из шести π-электронов , делокализованных по кольцу. Молекула плоская и, таким образом, соответствует критериям Хюккеля для ароматических систем. В отличие от бензола электронная плотность распределена по кольцу неравномерно, что отражает отрицательное индуктивное действие атома азота. По этой причине пиридин обладает дипольным моментом и более слабой резонансной стабилизацией , чем бензол ( энергия резонанса 117 кДж·моль -1 в пиридине против 150 кДж·моль -1 в бензоле). [24]
Атомы кольца в молекуле пиридина sp 2 -гибридизированы . Азот участвует в π-связывающей ароматической системе, используя свою негибридизованную p-орбиталь. Неподеленная пара находится на sp2 - орбитали, выступающей наружу из кольца в той же плоскости, что и σ-связи . В результате неподеленная пара не вносит вклада в ароматическую систему, но существенно влияет на химические свойства пиридина, поскольку она легко поддерживает образование связей посредством электрофильной атаки. [25] Однако из-за отделения неподеленной пары от ароматической кольцевой системы атом азота не может проявлять положительный мезомерный эффект .
Известно множество аналогов пиридина, в которых N заменен другими гетероатомами из того же столбца Периодической таблицы элементов (см. рисунок ниже). Замещение одного C–H в пиридине на второй N приводит к образованию диазиновых гетероциклов (C 4 H 4 N 2 ), получивших названия пиридазин , пиримидин и пиразин .




.jpg/440px-ThomasAnderson(1819-1874).jpg)
Нечистый пиридин, несомненно, был получен ранними алхимиками путем нагревания костей животных и других органических веществ, [26] но самая ранняя документированная ссылка приписывается шотландскому ученому Томасу Андерсону . [27] [28] В 1849 году Андерсон исследовал состав масла, полученного путем высокотемпературного нагрева костей животных . [28] Среди других веществ он выделил из нефти бесцветную жидкость с неприятным запахом, из которой два года спустя выделил чистый пиридин. Он описал его как хорошо растворимый в воде, легко растворимый в концентрированных кислотах и солях при нагревании и лишь слабо растворимый в маслах.
Из-за его воспламеняемости Андерсон назвал новое вещество пиридином , в честь греческого πῦρ (pyr), что означает огонь . Суффикс идин добавлен в соответствии с химической номенклатурой, как и в толуидине , для обозначения циклического соединения , содержащего атом азота. [29] [30]
Химическая структура пиридина была определена спустя десятилетия после его открытия. Вильгельм Кёрнер (1869) [31] и Джеймс Дьюар (1871) [32] [33] предположили, что по аналогии между хинолином и нафталином структура пиридина образуется из бензола путем замены одного звена C–H атомом азота. [34] [35] Предложение Кернера и Дьюара позже было подтверждено в эксперименте, в котором пиридин восстанавливался до пиперидина натрием в этаноле . [36] [37] В 1876 году Уильям Рамзи объединил ацетилен и цианистый водород в пиридин в раскаленной железной трубчатой печи. [38] Это был первый синтез гетероароматического соединения. [23] [39]
Первый крупный синтез производных пиридина был описан в 1881 году Артуром Рудольфом Ханчем . [40] В синтезе пиридина Ганча обычно используется смесь 2:1:1 β-кетокислоты ( часто ацетоацетата ), альдегида (часто формальдегида ) и аммиака или его соли в качестве донора азота. Сначала получают дважды гидрированный пиридин, который затем окисляют до соответствующего производного пиридина. Эмиль Кневенагель показал, что с помощью этого процесса можно получать асимметрично замещенные производные пиридина. [41]

Современные методы производства пиридина имели низкий выход, а растущий спрос на новое соединение заставил искать более эффективные пути его получения. Прорыв произошел в 1924 году, когда русский химик Алексей Чичибабин изобрел реакцию синтеза пиридина , основанную на недорогих реагентах. [42] Этот метод до сих пор используется для промышленного производства пиридина. [2]
Пиридин не распространен в природе, за исключением листьев и корней красавки ( Atropa belladonna ) [43] и алтея лекарственного ( Althaea officinalis ). [44] Производные пиридина, однако, часто являются частью биомолекул, таких как алкалоиды .
В повседневной жизни следовые количества пиридина являются компонентами летучих органических соединений , которые образуются в процессах обжарки и консервирования , например, в жареной курице, [45] сукияки , [46] жареном кофе, [47] картофельных чипсах, [48] и жареный бекон . [49] Следы пиридина можно обнаружить в сыре Бофорт , [50] вагинальных выделениях , [51] черном чае , [52] слюне больных гингивитом , [53] и подсолнечном меде . [54]
Исторически пиридин извлекали из каменноугольной смолы или получали как побочный продукт газификации угля . Процесс трудоемкий и неэффективный: каменноугольная смола содержит всего около 0,1% пиридина [55] , поэтому требовалась многоступенчатая очистка, что еще больше снижало выход. В настоящее время большинство пиридинов синтезируют из аммиака, альдегидов и нитрилов, некоторые комбинации которых подходят для получения самого пиридина. Известны также различные именные реакции , но они не практикуются в массовом порядке. [2]
В 1989 году во всем мире было произведено 26 000 тонн пиридина. Другими основными производными являются 2- , 3- , 4-метилпиридины и 5-этил-2-метилпиридин . Общий масштаб этих алкилпиридинов соответствует масштабу самого пиридина. [2] Среди 25 крупнейших предприятий по производству пиридина одиннадцать расположены в Европе (по состоянию на 1999 год). [23] Основными производителями пиридина являются Evonik Industries , Rütgers Chemicals, Jubilant Life Sciences, Imperial Chemical Industries и Koei Chemical. [2] Производство пиридина значительно выросло в начале 2000-х годов, годовая производственная мощность составила 30 000 тонн только в материковом Китае. [56] Совместное американо-китайское предприятие Vertellus в настоящее время является мировым лидером по производству пиридина. [57]
О синтезе пиридина Чичибабина было сообщено в 1924 году, и этот основной подход лежит в основе нескольких промышленных направлений. [42] В своей общей форме реакция включает реакцию конденсации альдегидов , кетонов , α , β-ненасыщенных карбонильных соединений или любой комбинации вышеперечисленного в аммиаке или производных аммиака . Применение синтеза пиридина Чичибабина страдает от низких выходов, часто около 30%, [58] однако прекурсоры недороги. В частности, незамещенный пиридин получают из формальдегида и ацетальдегида . Сначала акролеин образуется в результате конденсации Кнёвенагеля из ацетальдегида и формальдегида. Затем акролеин конденсируется с ацетальдегидом и аммиаком с образованием дигидропиридина , который окисляется до пиридина. Этот процесс осуществляется в газовой фазе при температуре 400–450 °С. Типичными катализаторами являются модифицированные формы оксида алюминия и кремнезема . Реакция была адаптирована для получения различных метилпиридинов . [2]


Пиридин можно получить деалкилированием алкилированных пиридинов, которые получаются как побочные продукты при синтезе других пиридинов. Окислительное деалкилирование проводят либо с использованием воздуха над катализатором на основе оксида ванадия (V) [59] путем парового деалкилирования на катализаторе на основе никеля [60] [61] или гидродеалкилирования с использованием катализатора на основе серебра или платины . [62] Выходы пиридина до 93% могут быть достигнуты с помощью катализатора на основе никеля. [2] Пиридин также можно получить путем декарбоксилирования никотиновой кислоты хромитом меди . [63]

Тримеризация части молекулы нитрила и двух частей ацетилена в пиридин называется циклизацией Беннемана . Эту модификацию синтеза Реппе можно активировать либо теплом, либо светом . Хотя термическая активация требует высоких давлений и температур, фотоиндуцированное циклоприсоединение протекает в условиях окружающей среды с CoCp 2 (cod) (Cp = циклопентадиенил, cod = 1,5-циклооктадиен ) в качестве катализатора и может осуществляться даже в воде. [64] Таким способом можно получить ряд производных пиридина. При использовании в качестве нитрила ацетонитрила получается 2-метилпиридин, который можно деалкилировать до пиридина.
Синтез пиридина Крёнке представляет собой довольно общий метод получения замещенных пиридинов с использованием самого пиридина в качестве реагента, который не включается в конечный продукт. Реакция пиридина с бромметилкетонами дает родственную соль пиридиния , в которой метиленовая группа является очень кислой. Этот вид подвергается присоединению по типу Михаэля к α,β-ненасыщенным карбонилам в присутствии ацетата аммония с замыканием кольца и образованием целевого замещенного пиридина, а также бромида пиридиния. [65]

Перегруппировка Циамициана-Деннстедта [ 66] приводит к расширению кольца пиррола дихлоркарбеном до 3-хлорпиридина . [67] [68] [69]

В синтезе Гаттермана-Скиты [70] соль малонатного эфира реагирует с дихлорметиламином . [71]

Другие методы включают синтез пиридина Богера и реакцию Дильса - Альдера алкена и оксазола . [72]
Некоторые производные пиридина играют важную роль в биологических системах. Хотя ее биосинтез до конца не изучен, никотиновая кислота (витамин B3 ) встречается у некоторых бактерий , грибов и млекопитающих . Млекопитающие синтезируют никотиновую кислоту путем окисления аминокислоты триптофана , где промежуточный продукт, производное анилина кинуренин , создает производное пиридина, хинолинат , а затем никотиновую кислоту. Напротив, бактерии Mycobacterium Tuberculosis и Escherichia coli продуцируют никотиновую кислоту путем конденсации глицеральдегид-3-фосфата и аспарагиновой кислоты . [73]
Из-за электроотрицательного азота в пиридиновом кольце пиридин хуже вступает в реакции электрофильного ароматического замещения , чем производные бензола. [74] Вместо этого, с точки зрения реакционной способности, пиридин напоминает нитробензол . [75]
Соответственно пиридин более склонен к нуклеофильному замещению , о чем свидетельствует легкость металлирования сильными металлоорганическими основаниями. [76] [77] Реакционную способность пиридина можно разделить на три химические группы. У электрофилов происходит электрофильное замещение , при котором пиридин проявляет ароматические свойства. С нуклеофилами пиридин реагирует в положениях 2 и 4 и, таким образом, ведет себя подобно иминам и карбонилам . Реакция со многими кислотами Льюиса приводит к присоединению к атому азота пиридина, что аналогично реакционной способности третичных аминов. Способность пиридина и его производных окисляться с образованием аминооксидов ( N -оксидов) также является особенностью третичных аминов. [78]
Азотистый центр пиридина имеет основную неподеленную пару электронов . Эта неподеленная пара не перекрывается с кольцом ароматической π-системы, следовательно, пиридин является основным и имеет химические свойства, аналогичные свойствам третичных аминов . Протонирование дает пиридиний , C 5 H 5 NH + . P K a сопряженной кислоты (катиона пиридиния) составляет 5,25. Структуры пиридина и пиридиния практически идентичны. [79] Катион пиридиния изоэлектронен бензолу. п - толуолсульфонат пиридиния (ППТС) представляет собой показательную соль пиридиния; его получают обработкой пиридина п -толуолсульфоновой кислотой . Помимо протонирования , пиридин подвергается N-центрированному алкилированию , ацилированию и N -окислению . Было показано, что пиридин и поли(4-винил)пиридин образуют проводящие молекулярные провода с замечательной полиениминовой структурой при УФ-облучении - процессе, который объясняет, по крайней мере, часть поглощения видимого света состаренными образцами пиридина. Теоретически было предсказано, что эти провода являются высокоэффективными донорами и акцепторами электронов, но при этом устойчивы к окислению на воздухе. [80]
Из-за пониженной электронной плотности в ароматической системе в пиридине и его производных подавляются электрофильные замещения . Алкилирование или ацилирование по Фриделю-Крафтсу обычно не удается для пиридина, поскольку они приводят только к присоединению по атому азота. Замещения обычно происходят в положении 3, которое является наиболее богатым электронами атомом углерода в кольце и, следовательно, более восприимчиво к электрофильному присоединению.



Прямое нитрование пиридина протекает вяло. [81] [82] Производные пиридина, в которых атом азота экранирован стерически и/или электронно, могут быть получены нитрованием тетрафторборатом нитрония (NO 2 BF 4 ). Таким путем 3-нитропиридин можно получить синтезом 2,6-дибромпиридина с последующим нитрованием и дебромированием. [83] [84]
Сульфирование пиридина еще сложнее, чем нитрование. Однако пиридин-3-сульфоновую кислоту можно получить. Реакция с группой SO 3 также облегчает присоединение серы к атому азота, особенно в присутствии катализатора сульфата ртути(II) . [76] [85]
В отличие от вялых процессов нитрования и сульфирования, бромирование и хлорирование пиридина протекают хорошо. [2]


Окисление пиридина происходит азотом с образованием N -оксида пиридина . Окисление может быть достигнуто перкислотами : [86]
Некоторые электрофильные замещения пиридина целесообразно осуществлять с использованием N -оксида пиридина с последующим дезоксигенированием. Добавление кислорода подавляет дальнейшие реакции по атому азота и способствует замещению у 2- и 4-углеродов. Атом кислорода затем можно удалить, например, с помощью цинковой пыли. [87]
В отличие от бензольного кольца пиридин эффективно поддерживает несколько нуклеофильных замещений. Причиной этого является сравнительно меньшая электронная плотность атомов углерода кольца. Эти реакции включают замещения с отщеплением гидрид- иона и отщепления-присоединения с образованием промежуточной ариновой конфигурации и обычно протекают во 2- или 4-положении. [76] [77]



Многие нуклеофильные замещения легче происходят не с голым пиридином, а с пиридином, модифицированным фрагментами брома, хлора, фтора или сульфоновой кислоты, которые затем становятся уходящей группой. Таким образом, фтор является лучшей уходящей группой для замещения литийорганическими соединениями . Нуклеофильными атакующими соединениями могут быть алкоксиды , тиолаты, амины и аммиак (при повышенном давлении). [88]
Как правило, гидрид-ион является плохой уходящей группой и встречается лишь в немногих гетероциклических реакциях. К ним относится реакция Чичибабина , в результате которой образуются производные пиридина , аминированные во 2-м положении. Здесь в качестве нуклеофила используется амид натрия , дающий 2-аминопиридин. Высвобождающийся в этой реакции гидрид-ион соединяется с протоном доступной аминогруппы, образуя молекулу водорода. [77] [89]
Аналогично бензолу, нуклеофильное замещение пиридина может привести к образованию промежуточных соединений пиридина в виде гетероарина . Для этой цели производные пиридина можно удалить с помощью хороших уходящих групп, используя сильные основания, такие как трет-бутоксид натрия и калия . Последующее присоединение нуклеофила к тройной связи имеет низкую селективность, и в результате образуется смесь двух возможных аддуктов. [76]
Пиридин поддерживает ряд радикальных реакций, которые используются при его димеризации до бипиридинов. Радикальная димеризация пиридина с элементарным натрием или никелем Ренея избирательно дает 4,4'-бипиридин [90] или 2,2'-бипиридин [91] , которые являются важными исходными реагентами в химической промышленности. Одной из названных реакций с участием свободных радикалов является реакция Миниши . Он может производить 2- трет -бутилпиридин при взаимодействии пиридина с пивалиновой кислотой , нитратом серебра и аммонием в серной кислоте с выходом 97%. [76]

Кислоты Льюиса легко присоединяются к атому азота пиридина, образуя соли пиридиния. Реакция с алкилгалогенидами приводит к алкилированию атома азота. Это создает положительный заряд в кольце, что увеличивает реакционную способность пиридина как к окислению, так и к восстановлению. Реакцию Цинке используют для селективного введения радикалов в соединения пиридиния (к химическому элементу цинку она отношения не имеет ).

Пиперидин получают гидрированием пиридина с помощью катализатора на основе никеля , кобальта или рутения при повышенных температурах. [92] При гидрировании пиридина до пиперидина выделяется 193,8 кДж·моль -1 , [93] что несколько меньше энергии гидрирования бензола (205,3 кДж·моль -1 ). [93]
Частично гидрированные производные получают в более мягких условиях. Например, восстановление алюмогидридом лития дает смесь 1,4-дигидропиридина, 1,2-дигидропиридина и 2,5-дигидропиридина. [94] Селективный синтез 1,4-дигидропиридина достигается в присутствии металлоорганических комплексов магния и цинка , [95] а (Δ3,4)-тетрагидропиридин получается электрохимическим восстановлением пиридина. [96] Восстановление Берча превращает пиридин в дигидропиридины. [97]
Пиридин — это основание Льюиса , отдающее свою пару электронов кислоте Льюиса. Его базовые свойства по Льюису обсуждаются в модели ECW . Его относительная донорная сила по отношению к ряду кислот по сравнению с другими основаниями Льюиса может быть проиллюстрирована графиками CB . [98] [99] Одним из примеров является пиридиновый комплекс триоксида серы (температура плавления 175 ° C), который представляет собой сульфатирующий агент, используемый для преобразования спиртов в сложные эфиры сульфатов . Пиридинборан ( C 5 H 5 NBH 3 , температура плавления 10–11 °С) — мягкий восстановитель.

Пиридиновые комплексы переходных металлов многочисленны. [100] [101] Типичные октаэдрические комплексы имеют стехиометрию MCl 2 (py) 4 и MCl 3 (py) 3 . Октаэдрические гомолептические комплексы типа M(py)+6редки или имеют тенденцию диссоциировать пиридин. Известны многочисленные плоские квадратные комплексы, такие как катализатор Крэбтри . [102] Пиридиновый лиганд, замененный в ходе реакции, восстанавливается после ее завершения.
Координационный режим η 6 , как и в бензольных комплексах η 6 , наблюдается только в стерически затрудненных производных, блокирующих азотистый центр. [103]
Основное применение пиридина — в качестве предшественника гербицидов параквата и диквата . [2] Первый этап синтеза инсектицида хлорпирифоса заключается в хлорировании пиридина. Пиридин также является исходным соединением для приготовления фунгицидов на основе пиритиона . [23] Цетилпиридиний и лаурилпиридиний, которые можно получить из пиридина реакцией Цинке , используются в качестве антисептиков в средствах по уходу за полостью рта и зубами. [104] Пиридин легко подвергается воздействию алкилирующих агентов с образованием солей N -алкилпиридиния. Одним из примеров является хлорид цетилпиридиния .

Он также используется в текстильной промышленности для улучшения пропускной способности сети по переработке хлопка. [104]
Пиридин используется в качестве полярного основного малореактивного растворителя, например, в конденсациях Кнёвенагеля . [23] [106] Он особенно подходит для дегалогенирования, где он действует как основа для реакции элиминирования . При этерификации и ацилировании пиридин активирует хлориды и ангидриды карбоновых кислот . Еще более активны в этих реакциях производные 4-диметиламинопиридина (ДМАП) и 4-(1-пирролидинил)пиридина. Пиридин также используется в качестве основания в некоторых реакциях конденсации . [107]


В качестве основания можно использовать пиридин в качестве реактива Карла Фишера , но его обычно заменяют альтернативами с более приятным запахом, например имидазолом . [108]
Хлорхромат пиридиния , дихромат пиридиния и реактив Коллинза (комплекс оксида хрома (VI) ) применяют для окисления спиртов. [109]
Пиридин — токсичная, легковоспламеняющаяся жидкость с резким и неприятным рыбным запахом. Его порог запаха от 0,04 до 20 частей на миллион близок к пороговому значению в 5 частей на миллион для побочных эффектов, [110] таким образом, большинство (но не все) взрослые смогут определить, когда он присутствует на вредных уровнях. Пиридин легко растворяется в воде и наносит вред как животным, так и растениям в водных системах. [111]
Пиридин имеет температуру вспышки 20 °C и поэтому легко воспламеняется. При горении образуются токсичные пары, которые могут включать бипиридины , оксиды азота и окись углерода . [12]
Пиридин может вызвать химические ожоги при контакте с кожей, а его пары могут раздражать глаза или при вдыхании. [112] Пиридин угнетает нервную систему , вызывая симптомы, подобные интоксикации, при концентрации паров выше 3600 частей на миллион , что представляет больший риск для здоровья. [2] Эффекты могут проявляться с задержкой в несколько часов и включать головокружение, головную боль, нарушение координации , тошноту, слюнотечение и потерю аппетита. Они могут прогрессировать до болей в животе, застоя в легких и потери сознания. [113] Самая низкая известная смертельная доза (LD Lo ) при приеме внутрь пиридина у человека составляет 500 мг·кг -1 .
Длительное воздействие пиридина может привести к повреждению печени, сердца и почек. [12] [23] [114] Оценка возможного канцерогенного агента показала, что нет достаточных доказательств канцерогенности пиридина у людей, хотя имеется достаточно доказательств на экспериментальных животных. Таким образом, МАИР считает пиридин потенциально канцерогенным для человека (группа 2B). [115]
В табачном дыме обнаружены следовые количества до 16 мкг·м -3 . [23] Незначительные количества пиридина выбрасываются в окружающую среду в результате некоторых промышленных процессов, таких как производство стали, [116] переработка сланца , газификация угля , коксохимические заводы и мусоросжигательные заводы . [23] Атмосфера на заводах по переработке сланца может содержать концентрацию пиридина до 13 мкг·м -3 , [117] и уровни 53 мкг/м -3 были измерены в грунтовых водах вблизи завода по газификации угля. [118] Согласно исследованию Национального института охраны труда США , около 43 000 американцев работают в контакте с пиридином. [119]
Пиридин исторически добавлялся в продукты питания для придания им горького вкуса, хотя сейчас эта практика запрещена в США [120] [121] Его все еще можно добавлять в этанол , чтобы сделать его непригодным для питья. [104]
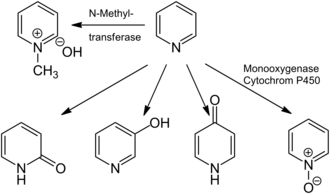
Воздействие пиридина обычно приводит к его вдыханию и всасыванию в легких и желудочно-кишечном тракте, где он либо остается в неизмененном виде, либо метаболизируется . Основными продуктами метаболизма пиридина являются N -метилпиридинийгидроксид, образующиеся N -метилтрансферазами (например, пиридин -N -метилтрансферазой ), а также N -оксид пиридина и 2-, 3- и 4-гидроксипиридин, которые образуются под действием монооксигеназы . У человека пиридин метаболизируется только до N -метилпиридинийгидроксида. [12] [114]
Пиридин легко разлагается бактериями до аммиака и углекислого газа. [122] Незамещенное пиридиновое кольцо разлагается быстрее, чем пиколин , лутидин , хлорпиридин или аминопиридины , [123] и было показано, что ряд веществ, разрушающих пиридин, сверхпродуцируют рибофлавин в присутствии пиридина. [124] Ионизируемые N -гетероциклические соединения, включая пиридин, взаимодействуют с поверхностями окружающей среды (такими как почвы и отложения) посредством множества pH-зависимых механизмов, включая распределение органических веществ почвы , катионный обмен и поверхностное комплексообразование. [125] Такая адсорбция на поверхности снижает биодоступность пиридинов для микробов-разрушителей и других организмов, тем самым замедляя скорость разложения и снижая экотоксичность . [126]
Систематическое название пиридина в номенклатуре Ханча-Видмана, рекомендованной ИЮПАК , — азинин . Однако систематические названия простых соединений используются очень редко; вместо этого гетероциклическая номенклатура соответствует исторически сложившимся общим названиям. ИЮПАК не рекомендует использовать азинин / азин в пользу пиридина . [127] Нумерация атомов кольца в пиридине начинается с азота (см. информационный блок). Иногда используется распределение позиций по буквам греческого алфавита (α-γ) и номенклатура шаблонов замещения , общая для гомоароматических систем ( орто , мета , пара ). Здесь α ( орто ), β ( мета ) и γ ( пара ) относятся к положению 2, 3 и 4 соответственно. Систематическое название производных пиридина — пиридинил , где положению замещенного атома предшествует число. Однако историческое название пиридил поддерживается ИЮПАК и используется вместо систематического названия. [128] Катионное производное, образующееся при присоединении электрофила к атому азота , называется пиридинием .
{{cite book}}: |work=игнорируется ( помощь ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: DOI неактивен по состоянию на февраль 2024 г. ( ссылка ){{cite book}}: |work=игнорируется ( помощь ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )