

Клеточный цикл , или цикл деления клеток , представляет собой последовательную серию событий, происходящих в клетке , которая заставляет ее делиться на две дочерние клетки. Эти события включают рост клетки, удвоение ее ДНК ( репликация ДНК ) и некоторых ее органелл , а затем разделение ее цитоплазмы, хромосом и других компонентов на две дочерние клетки в процессе, называемом делением клетки .
В эукариотических клетках (имеющих клеточное ядро ), включая клетки животных , растений , грибов и простейших , клеточный цикл делится на две основные стадии: интерфазу и фазу М , которая включает митоз и цитокинез. [1] Во время интерфазы клетка растет, накапливая питательные вещества, необходимые для митоза, и реплицирует свою ДНК и некоторые из своих органелл. Во время фазы М реплицированные хромосомы , органеллы и цитоплазма разделяются на две новые дочерние клетки. Чтобы обеспечить правильную репликацию клеточных компонентов и деление, существуют контрольные механизмы, известные как контрольные точки клеточного цикла после каждого из ключевых этапов цикла, которые определяют, может ли клетка перейти к следующей фазе.
В клетках без ядра , прокариотах , бактериях и археях , клеточный цикл делится на периоды B, C и D. Период B длится от конца деления клетки до начала репликации ДНК. Репликация ДНК происходит в течение периода C. Период D относится к стадии между концом репликации ДНК и разделением бактериальной клетки на две дочерние клетки. [2]
В одноклеточных организмах один цикл деления клеток — это то, как организм размножается, чтобы обеспечить свое выживание. В многоклеточных организмах, таких как растения и животные, серия циклов деления клеток — это то, как организм развивается из одноклеточной оплодотворенной яйцеклетки в зрелый организм, а также процесс, посредством которого волосы , кожа , клетки крови и некоторые внутренние органы регенерируются и заживают (за возможным исключением нервов ; см. повреждение нервов ). После деления клетки каждая из дочерних клеток начинает интерфазу нового клеточного цикла. Хотя различные стадии интерфазы обычно морфологически неразличимы, каждая фаза клеточного цикла имеет отдельный набор специализированных биохимических процессов, которые подготавливают клетку к началу клеточного деления.
Цикл эукариотических клеток состоит из четырех отдельных фаз: G 1 фаза , S фаза (синтез), G 2 фаза (в совокупности известные как интерфаза ) и M фаза (митоз и цитокинез). M фаза сама по себе состоит из двух тесно связанных процессов: митоза, в котором делится ядро клетки, и цитокинеза , в котором делятся цитоплазма и клеточная мембрана клетки, образуя две дочерние клетки. Активация каждой фазы зависит от правильного развития и завершения предыдущей. Говорят, что клетки, которые временно или обратимо прекратили делиться, вошли в состояние покоя, называемое G 0 фазой или фазой покоя.
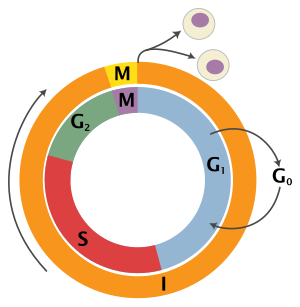

G 0 — это фаза покоя, в которой клетка вышла из цикла и прекратила делиться. Клеточный цикл начинается с этой фазы. Непролиферативные (неделящиеся) клетки в многоклеточных эукариотах обычно переходят в состояние покоя G 0 из G 1 и могут оставаться в состоянии покоя в течение длительных периодов времени, возможно, бесконечно (как это часто бывает с нейронами ). Это очень распространено для клеток, которые полностью дифференцированы . Некоторые клетки переходят в фазу G 0 полупостоянно и считаются постмитотическими, например, некоторые клетки печени, почек и желудка. Многие клетки не переходят в G 0 и продолжают делиться на протяжении всей жизни организма, например, эпителиальные клетки.
Термин «постмитотический» иногда используется для обозначения как покоящихся , так и стареющих клеток. Клеточное старение происходит в ответ на повреждение ДНК и внешний стресс и обычно представляет собой остановку в G 1 . Клеточное старение может сделать потомство клетки нежизнеспособным; часто это биохимическая альтернатива самоуничтожению такой поврежденной клетки путем апоптоза .
Интерфаза представляет собой фазу между двумя последовательными фазами М. Интерфаза — это ряд изменений, которые происходят в новообразованной клетке и ее ядре, прежде чем она снова станет способной к делению. Ее также называют подготовительной фазой или интермитозом. Обычно интерфаза длится не менее 91% от общего времени, необходимого для клеточного цикла.
Интерфаза протекает в три стадии: G 1 , S и G 2 , за которыми следует цикл митоза и цитокинеза. Содержание ядерной ДНК клетки дублируется во время фазы S.

Первая фаза в интерфазе, от конца предыдущей фазы M до начала синтеза ДНК, называется G 1 (G указывает на разрыв ). Она также называется фазой роста. Во время этой фазы биосинтетическая активность клетки, которая значительно замедляется во время фазы M, возобновляется с высокой скоростью. Продолжительность G 1 сильно варьируется, даже среди разных клеток одного вида. [4] В этой фазе клетка увеличивает свой запас белков, увеличивает количество органелл (таких как митохондрии, рибосомы) и увеличивается в размерах. В фазе G 1 у клетки есть три варианта.
Решающая точка называется контрольной точкой ( точка рестрикции ). Эта контрольная точка называется точкой рестрикции или СТАРТ и регулируется циклинами G 1 /S, которые вызывают переход из фазы G 1 в фазу S. Прохождение через контрольную точку G 1 обязывает клетку к делению.
Последующая S-фаза начинается, когда начинается синтез ДНК ; когда она завершается, все хромосомы реплицируются, т. е. каждая хромосома состоит из двух сестринских хроматид . Таким образом, во время этой фазы количество ДНК в клетке удваивается, хотя плоидность и число хромосом остаются неизменными. Скорости транскрипции РНК и синтеза белка во время этой фазы очень низкие. Исключением является продукция гистонов , большая часть которой происходит во время S-фазы. [5] [6] [7]
Фаза G 2 наступает после репликации ДНК и является периодом синтеза белка и быстрого роста клеток для подготовки клетки к митозу. Во время этой фазы микротрубочки начинают реорганизовываться, образуя веретено (препрофаза). Перед тем, как перейти к митотической фазе , клетки должны быть проверены в контрольной точке G 2 на предмет наличия повреждений ДНК в хромосомах. Контрольная точка G 2 в основном регулируется опухолевым белком p53 . Если ДНК повреждена, p53 либо восстановит ДНК, либо запустит апоптоз клетки. Если p53 дисфункционален или мутировал, клетки с поврежденной ДНК могут продолжать клеточный цикл, что приводит к развитию рака.
Относительно короткая фаза М состоит из ядерного деления ( кариокинез ) и деления цитоплазмы ( цитокинез ). Это относительно короткий период клеточного цикла. Фаза М сложна и строго регулируется. Последовательность событий делится на фазы, соответствующие завершению одного набора действий и началу следующего. Эти фазы последовательно известны как:

Митоз — это процесс, при котором эукариотическая клетка разделяет хромосомы в своем ядре на два идентичных набора в двух ядрах. [8] В процессе митоза пары хромосом конденсируются и прикрепляются к микротрубочкам , которые тянут сестринские хроматиды к противоположным сторонам клетки. [9]
Митоз происходит исключительно в эукариотических клетках, но происходит по-разному у разных видов. Например, клетки животных подвергаются «открытому» митозу, когда ядерная оболочка распадается до того, как хромосомы разделяются, в то время как грибы, такие как Aspergillus nidulans и Saccharomyces cerevisiae ( дрожжи ), подвергаются «закрытому» митозу, когда хромосомы делятся внутри неповрежденного клеточного ядра . [10]
За митозом сразу следует цитокинез , который делит ядра, цитоплазму , органеллы и клеточную мембрану на две клетки, содержащие примерно равные доли этих клеточных компонентов. Цитокинез происходит по-разному в растительных и животных клетках. В то время как клеточная мембрана образует бороздку, которая постепенно углубляется, чтобы отделить цитоплазму в животных клетках, в растительных клетках образуется клеточная пластинка , чтобы отделить ее. Положение клеточной пластинки определяется положением препрофазной полосы микротрубочек и актиновых филаментов. Митоз и цитокинез вместе определяют деление родительской клетки на две дочерние клетки, генетически идентичные друг другу и своей родительской клетке. Это составляет примерно 10% клеточного цикла.
Поскольку цитокинез обычно происходит вместе с митозом, «митоз» часто используется взаимозаменяемо с «М-фазой». Однако существует много клеток, в которых митоз и цитокинез происходят отдельно, образуя отдельные клетки с несколькими ядрами в процессе, называемом эндорепликацией . Это происходит чаще всего среди грибов и слизистых плесеней , но встречается и в других группах. Даже у животных цитокинез и митоз могут происходить независимо, например, на определенных стадиях эмбрионального развития плодовой мушки . [11] Ошибки в митозе могут привести к гибели клеток через апоптоз или вызвать мутации , которые могут привести к раку .

Регулирование клеточного цикла включает в себя процессы, имеющие решающее значение для выживания клетки, включая обнаружение и исправление генетических повреждений, а также предотвращение неконтролируемого деления клеток. Молекулярные события, которые контролируют клеточный цикл, упорядочены и направлены; то есть каждый процесс происходит последовательно, и невозможно «обратить» цикл.
Два ключевых класса регуляторных молекул, циклины и циклин-зависимые киназы (CDK), определяют прогресс клетки через клеточный цикл. [12] Леланд Х. Хартвелл , Р. Тимоти Хант и Пол М. Нерс получили Нобелевскую премию по физиологии и медицине 2001 года за открытие этих центральных молекул. [13] Многие из генов, кодирующих циклины и CDK, сохраняются среди всех эукариот, но в целом более сложные организмы имеют более сложные системы контроля клеточного цикла, которые включают больше индивидуальных компонентов. Многие из соответствующих генов были впервые идентифицированы при изучении дрожжей, особенно Saccharomyces cerevisiae ; [14] генетическая номенклатура дрожжей дублирует многие из этих генов cdc (от «цикла деления клетки») с последующим идентификационным номером, например cdc25 или cdc20 .
Циклины образуют регуляторные субъединицы, а CDK — каталитические субъединицы активированного гетеродимера ; циклины не обладают каталитической активностью, а CDK неактивны в отсутствие партнерского циклина. При активации связанным циклином CDK выполняют обычную биохимическую реакцию, называемую фосфорилированием , которая активирует или инактивирует целевые белки для организации скоординированного входа в следующую фазу клеточного цикла. Различные комбинации циклин-CDK определяют целевые белки ниже по течению. CDK постоянно экспрессируются в клетках, тогда как циклины синтезируются на определенных стадиях клеточного цикла в ответ на различные молекулярные сигналы. [15]
Получив промитотический внеклеточный сигнал, комплексы циклин-CDK G 1 активизируются, чтобы подготовить клетку к S-фазе, способствуя экспрессии факторов транскрипции , которые в свою очередь способствуют экспрессии S-циклинов и ферментов, необходимых для репликации ДНК . Комплексы циклин-CDK G 1 также способствуют деградации молекул, которые функционируют как ингибиторы S-фазы, направляя их на убиквитинирование . После того, как белок убиквитинирован, он направляется на протеолитическую деградацию протеасомой . Однако результаты недавнего исследования динамики транскрипции E2F на уровне отдельных клеток утверждают, что роль активности циклин-CDK G1, в частности циклина D-CDK4/6, заключается в настройке времени, а не в приверженности входу в клеточный цикл. [16]
Активные комплексы S циклин-CDK фосфорилируют белки, которые составляют комплексы пререпликации, собранные во время фазы G 1 на началах репликации ДНК . Фосфорилирование служит двум целям: активировать каждый уже собранный комплекс пререпликации и предотвратить образование новых комплексов. Это гарантирует, что каждая часть генома клетки будет реплицирована один и только один раз. Причина предотвращения пробелов в репликации довольно ясна, поскольку дочерние клетки, в которых отсутствуют все или часть важных генов, погибнут. Однако по причинам, связанным с эффектами числа копий генов , наличие дополнительных копий определенных генов также вредно для дочерних клеток.
Комплексы митотического циклина-CDK, которые синтезируются, но инактивируются во время фаз S и G 2 , способствуют инициации митоза , стимулируя нисходящие белки, участвующие в конденсации хромосом и сборке митотического веретена . Критический комплекс, активируемый во время этого процесса, — это убиквитинлигаза , известная как комплекс, способствующий анафазе (APC), который способствует деградации структурных белков, связанных с хромосомным кинетохором . APC также нацелен на митотические циклины для деградации, гарантируя, что телофаза и цитокинез могут продолжаться. [17]
Циклин D является первым циклином, который вырабатывается в клетках, вступающих в клеточный цикл, в ответ на внеклеточные сигналы (например, факторы роста ). Уровни циклина D остаются низкими в покоящихся клетках, которые не пролиферируют. Кроме того, CDK4/6 и CDK2 также неактивны, поскольку CDK4/6 связаны с членами семейства INK4 (например, p16), ограничивая активность киназы. Между тем, комплексы CDK2 ингибируются белками CIP/KIP, такими как p21 и p27, [18]. Когда клетке пора вступать в клеточный цикл, который запускается митогенным стимулом, уровни циклина D увеличиваются. В ответ на этот триггер циклин D связывается с существующим CDK4 /6, образуя активный комплекс циклин D-CDK4/6. Комплексы циклин D-CDK4/6, в свою очередь, монофосфорилируют белок восприимчивости к ретинобластоме ( Rb ) до pRb. Нефосфорилированный супрессор опухолей Rb функционирует, вызывая выход из клеточного цикла и поддерживая остановку G0 (старение). [19]
В последние несколько десятилетий широкое распространение получила модель, согласно которой белки pRB инактивируются фосфорилированием, опосредованным циклином D-Cdk4/6. Rb имеет более 14 потенциальных участков фосфорилирования. Циклин D-Cdk 4/6 постепенно фосфорилирует Rb до гиперфосфорилированного состояния, что запускает диссоциацию комплексов pRB– E2F , тем самым индуцируя экспрессию генов клеточного цикла G1/S и переход в фазу S. [20]
Однако научные наблюдения недавнего исследования показывают, что Rb присутствует в трех типах изоформ: (1) нефосфорилированный Rb в состоянии G0; (2) монофосфорилированный Rb, также называемый «гипофосфорилированным» или «частично» фосфорилированным Rb в раннем состоянии G1; и (3) неактивный гиперфосфорилированный Rb в позднем состоянии G1. [21] [22] [23] В ранних клетках G1 монофосфорилированный Rb существует в виде 14 различных изоформ, каждая из которых имеет различную аффинность связывания E2F . [23] Было обнаружено, что Rb ассоциируется с сотнями различных белков [24], и идея о том, что различные монофосфорилированные изоформы Rb имеют различных белковых партнеров, была очень привлекательной. [25] Недавний отчет подтвердил, что монофосфорилирование контролирует ассоциацию Rb с другими белками и генерирует функциональные различные формы Rb. [26] Все различные монофосфорилированные изоформы Rb ингибируют программу транскрипции E2F и способны останавливать клетки в фазе G1. Важно, что различные монофосфорилированные формы Rb имеют различные транскрипционные выходы которые выходят за рамки регулирования E2F. [26]
В целом, связывание pRb с E2F ингибирует экспрессию целевого гена E2F определенных генов перехода G1/S и S, включая циклины типа E. Частичное фосфорилирование Rb снимает подавление экспрессии целевого гена E2F, опосредованное Rb, и запускает экспрессию циклина E. Молекулярный механизм, который заставляет клетку переключаться на активацию циклина E, в настоящее время неизвестен, но по мере повышения уровня циклина E образуется активный комплекс циклин E-CDK2, в результате чего Rb инактивируется путем гиперфосфорилирования. [23] Гиперфосфорилированный Rb полностью диссоциирует от E2F, что позволяет дальнейшей экспрессии широкого спектра целевых генов E2F, необходимых для перехода клеток в фазу S [1]. Недавно было установлено, что циклин D-Cdk4/6 связывается с C-концевой альфа-спиральной областью Rb, которая различима только для циклина D, а не для других циклинов, циклина E , A и B. [27] Это наблюдение, основанное на структурном анализе фосфорилирования Rb, подтверждает, что Rb фосфорилируется на другом уровне через множественные комплексы циклин-Cdk . Это также делает возможной текущую модель одновременной инактивации всех монофосфорилированных изоформ Rb по типу переключателя через один тип механизма гиперфосфорилирования Rb. Кроме того, мутационный анализ специфической для циклина D-Cdk 4/6 C-концевой спирали Rb показывает, что нарушения связывания циклина D-Cdk 4/6 с Rb предотвращают фосфорилирование Rb, останавливают клетки в G1 и усиливают функции Rb в супрессоре опухолей. [27] Этот циклин-Cdk-управляемый механизм перехода клеточного цикла управляет клеткой, приверженной клеточному циклу, который позволяет клеткам пролиферировать. Раковый рост клеток часто сопровождается дерегуляцией активности циклина D-Cdk 4/6.
Гиперфосфорилированный Rb диссоциирует от комплекса E2F/DP1/Rb (который был связан с генами, чувствительными к E2F , эффективно «блокируя» их транскрипцию), активируя E2F. Активация E2F приводит к транскрипции различных генов, таких как циклин E , циклин A , ДНК-полимераза , тимидинкиназа и т. д. Образованный таким образом циклин E связывается с CDK2 , образуя комплекс циклин E-CDK2, который переводит клетку из фазы G 1 в фазу S (G 1 /S, который инициирует переход G 2 /M). [28] Активация комплекса циклин B -cdk1 вызывает разрушение ядерной оболочки и инициацию профазы , а затем его дезактивация заставляет клетку выйти из митоза. [15] Количественное исследование динамики транскрипции E2F на уровне отдельных клеток с использованием сконструированных флуоресцентных репортерных клеток предоставило количественную основу для понимания логики контроля входа в клеточный цикл, бросая вызов канонической модели учебника. Гены, которые регулируют амплитуду накопления E2F, такие как Myc, определяют приверженность клеточному циклу и вход в S-фазу. Активности циклина-CDK G1 не являются движущей силой входа в клеточный цикл. Вместо этого они в первую очередь настраивают время увеличения E2F, тем самым модулируя темп прогрессирования клеточного цикла. [16]

Два семейства генов, семейство cip/kip ( CDK- взаимодействующий белок/протеин-ингибитор киназы) и семейство INK4a/ARF (ингибитор киназы 4/альтернативная рамка считывания ) , предотвращают прогрессирование клеточного цикла . Поскольку эти гены играют важную роль в предотвращении образования опухолей , их называют супрессорами опухолей .
Семейство cip/kip включает гены p21 , p27 и p57 . Они останавливают клеточный цикл в фазе G 1 , связываясь с комплексами циклин-CDK и инактивируя их. p21 активируется p53 (который, в свою очередь, активируется повреждением ДНК , например, из-за радиации). p27 активируется трансформирующим фактором роста β ( TGF β ), ингибитором роста.
Семейство INK4a/ARF включает p16 INK4a , который связывается с CDK4 и останавливает клеточный цикл в фазе G1 , и p14 ARF , который предотвращает деградацию p53.
Синтетические ингибиторы Cdc25 также могут быть полезны для остановки клеточного цикла и, следовательно, могут быть полезны в качестве противоопухолевых и противораковых средств. [29]
Многие виды рака у человека обладают гиперактивированной активностью Cdk 4/6. [30] Учитывая наблюдения за функциями циклина D-Cdk 4/6, ингибирование Cdk 4/6 должно приводить к предотвращению распространения злокачественной опухоли. Следовательно, ученые попытались изобрести синтетический ингибитор Cdk4/6, поскольку Cdk4/6 был охарактеризован как терапевтическая мишень для противоопухолевой эффективности. Три ингибитора Cdk4/6 – палбоциклиб , рибоциклиб и абемациклиб – в настоящее время получили одобрение FDA для клинического использования для лечения рака молочной железы на поздней стадии или метастатического , гормон-рецептор-положительного (HR-положительного, HR+), HER2-отрицательного (HER2-) рака молочной железы. [31] [32] Например, палбоциклиб является перорально активным ингибитором CDK4/6, который продемонстрировал улучшенные результаты при ER-положительном/HER2-отрицательном распространенном раке молочной железы. Основным побочным эффектом является нейтропения , которую можно контролировать путем снижения дозы. [33]
Терапия таргетирования Cdk4/6 будет лечить только те типы рака, где экспрессируется Rb. Раковые клетки с потерей Rb имеют первичную резистентность к ингибиторам Cdk4/6.
Текущие данные свидетельствуют о том, что полуавтономная транскрипционная сеть действует совместно с механизмом CDK-циклина для регулирования клеточного цикла. Несколько исследований экспрессии генов в Saccharomyces cerevisiae выявили 800–1200 генов, которые изменяют экспрессию в течение клеточного цикла. [14] [34] [35] Они транскрибируются на высоких уровнях в определенных точках клеточного цикла и остаются на более низких уровнях в течение остальной части цикла. Хотя набор идентифицированных генов различается между исследованиями из-за вычислительных методов и критериев, используемых для их идентификации, каждое исследование показывает, что большая часть генов дрожжей регулируется во времени. [36]
Многие периодически экспрессируемые гены управляются факторами транскрипции , которые также периодически экспрессируются. Один скрининг нокаутов одного гена идентифицировал 48 факторов транскрипции (около 20% всех несущественных факторов транскрипции), которые показывают дефекты прогрессии клеточного цикла. [37] Исследования по всему геному с использованием высокопроизводительных технологий идентифицировали факторы транскрипции, которые связываются с промоторами генов дрожжей, и корреляция этих результатов с временными паттернами экспрессии позволила идентифицировать факторы транскрипции, которые управляют экспрессией генов, специфичной для определенной фазы. [34] [38] Профили экспрессии этих факторов транскрипции управляются факторами транскрипции, которые достигают пика в предыдущей фазе, и вычислительные модели показали, что CDK-автономная сеть этих факторов транскрипции достаточна для создания устойчивых колебаний в экспрессии генов. [35] [39]
Экспериментальные данные также свидетельствуют о том, что экспрессия генов может колебаться с периодом, наблюдаемым при делении клеток дикого типа, независимо от механизма CDK. Орландо и др. использовали микрочипы для измерения экспрессии набора из 1271 гена, которые они идентифицировали как периодические как в клетках дикого типа, так и в клетках, лишенных всех циклинов S-фазы и митотических циклинов ( clb1,2,3,4,5,6 ). Из 1271 проанализированных генов 882 продолжали экспрессироваться в клетках с дефицитом циклина в то же время, что и в клетках дикого типа, несмотря на то, что клетки с дефицитом циклина останавливались на границе между фазами G 1 и S. Однако 833 проанализированных гена изменили поведение между клетками дикого типа и мутантными клетками, что указывает на то, что эти гены, вероятно, напрямую или косвенно регулируются механизмом CDK-циклина. Некоторые гены, которые продолжали экспрессироваться вовремя в мутантных клетках, также были экспрессированы на разных уровнях в мутантных и диких клетках. Эти результаты показывают, что, хотя транскрипционная сеть может колебаться независимо от осциллятора CDK-циклин, они связаны таким образом, что требуют обоих для обеспечения правильного времени событий клеточного цикла. [35] Другие работы показывают, что фосфорилирование , посттрансляционная модификация факторов транскрипции клеточного цикла с помощью Cdk1, может изменять локализацию или активность факторов транскрипции, чтобы строго контролировать время целевых генов. [37] [40] [41]
В то время как колебательная транскрипция играет ключевую роль в прогрессировании клеточного цикла дрожжей, механизм CDK-циклин действует независимо в раннем эмбриональном клеточном цикле. До перехода в среднюю бластулы зиготическая транскрипция не происходит, и все необходимые белки, такие как циклины B-типа, транслируются с загруженной матерью мРНК . [42]
Анализ синхронизированных культур Saccharomyces cerevisiae в условиях, которые предотвращают инициацию репликации ДНК, не задерживая прогрессирование клеточного цикла, показал, что лицензирование ориджинов снижает экспрессию генов с ориджинами вблизи их 3'-концов, показывая, что нисходящие ориджины могут регулировать экспрессию восходящих генов. [43] Это подтверждает предыдущие предсказания, сделанные на основе математического моделирования глобальной причинно-следственной координации между активностью ориджинов репликации ДНК и экспрессией мРНК, [44] [45] [46] и показывает, что математическое моделирование данных ДНК-микрочипов может быть использовано для правильного прогнозирования ранее неизвестных биологических режимов регуляции.
Контрольные точки клеточного цикла используются клеткой для мониторинга и регулирования хода клеточного цикла. [47] Контрольные точки предотвращают прогрессирование клеточного цикла в определенных точках, позволяя проверять необходимые фазовые процессы и восстанавливать повреждения ДНК . Клетка не может перейти к следующей фазе, пока не будут выполнены требования контрольных точек. Контрольные точки обычно состоят из сети регуляторных белков, которые отслеживают и диктуют прогрессирование клетки через различные стадии клеточного цикла.
Подсчитано, что в нормальных клетках человека около 1% одноцепочечных повреждений ДНК преобразуются примерно в 50 эндогенных двухцепочечных разрывов ДНК на клетку за клеточный цикл. [48] Хотя такие двухцепочечные разрывы обычно восстанавливаются с высокой точностью, ошибки в их восстановлении считаются вносящими значительный вклад в частоту возникновения рака у людей. [48]
Существует несколько контрольных точек, гарантирующих, что поврежденная или неполная ДНК не будет передана дочерним клеткам. Существуют три основные контрольные точки: контрольная точка G 1 /S, контрольная точка G 2 /M и контрольная точка метафазы (митотическая). Еще одна контрольная точка — контрольная точка Go, в которой клетки проверяются на зрелость. Если клетки не проходят эту контрольную точку, будучи еще не готовыми, они будут отброшены из деления.
Переход G 1 / S является этапом, ограничивающим скорость в клеточном цикле, и также известен как точка рестрикции . [15] Здесь клетка проверяет, достаточно ли у нее сырья для полной репликации ДНК (нуклеотидные основания, ДНК-синтаза, хроматин и т. д.). Нездоровая или истощенная клетка застрянет на этой контрольной точке.
Контрольная точка G 2 /M — это место, где клетка проверяет, что у нее достаточно цитоплазмы и фосфолипидов для двух дочерних клеток. Но иногда, что еще важнее, она проверяет, настало ли подходящее время для репликации. Существуют некоторые ситуации, когда многим клеткам необходимо реплицироваться одновременно (например, растущий эмбрион должен иметь симметричное распределение клеток, пока не достигнет перехода в середину бластулы). Это делается путем контроля контрольной точки G 2 /M.
Метафазная контрольная точка является довольно незначительной контрольной точкой, поскольку, как только клетка находится в метафазе, она обязуется пройти митоз. Однако это не значит, что это неважно. В этой контрольной точке клетка проверяет, сформировалось ли веретено и все ли хромосомы выровнены по экватору веретена, прежде чем начнется анафаза. [49]
Хотя это три «главных» контрольных точки, не все клетки должны проходить через каждую из этих контрольных точек в этом порядке для репликации. Многие типы рака вызваны мутациями, которые позволяют клеткам быстро проходить через различные контрольные точки или даже пропускать их вообще. Переход от фазы S к фазе M к фазе S почти последовательно. Поскольку эти клетки утратили свои контрольные точки, любые мутации ДНК, которые могли произойти, игнорируются и передаются дочерним клеткам. Это одна из причин, по которой раковые клетки имеют тенденцию к экспоненциальному приобретению мутаций. Помимо раковых клеток, многие полностью дифференцированные типы клеток больше не реплицируются, поэтому они выходят из клеточного цикла и остаются в G 0 до своей смерти. Таким образом, устраняется необходимость в клеточных контрольных точках. Также была предложена альтернативная модель ответа клеточного цикла на повреждение ДНК, известная как контрольная точка после репликации .
Регуляция контрольных точек играет важную роль в развитии организма. При половом размножении, когда происходит оплодотворение яйцеклетки, когда сперматозоид связывается с яйцеклеткой, он высвобождает сигнальные факторы, которые уведомляют яйцеклетку о том, что она оплодотворена. Помимо прочего, это побуждает теперь оплодотворенную яйцеклетку вернуться из своего ранее спящего состояния, G 0 , обратно в клеточный цикл и перейти к митотической репликации и делению.
p53 играет важную роль в запуске механизмов контроля как в контрольных точках G 1 /S, так и в контрольных точках G 2 /M. Помимо p53, регуляторы контрольных точек активно изучаются на предмет их роли в росте и пролиферации рака.

Новаторская работа Ацуши Мияваки и его коллег разработали флуоресцентный индикатор клеточного цикла на основе убиквитинирования (FUCCI), который позволяет проводить флуоресцентную визуализацию клеточного цикла. Первоначально зеленый флуоресцентный белок mAG был слит с hGem(1/110), а оранжевый флуоресцентный белок (mKO 2 ) был слит с hCdt1(30/120). Обратите внимание, что эти слияния представляют собой фрагменты, которые содержат сигнал ядерной локализации и сайты убиквитинирования для деградации , но не являются функциональными белками. Зеленый флуоресцентный белок производится во время фазы S, G 2 или M и деградирует во время фазы G 0 или G 1 , в то время как оранжевый флуоресцентный белок производится во время фазы G 0 или G 1 и разрушается во время фазы S, G 2 или M. [50] FUCCI в дальнем красном и ближнем инфракрасном диапазонах был разработан с использованием флуоресцентного белка, полученного из цианобактерий ( smURFP ), и флуоресцентного белка, полученного из бактериофитохрома (фильм можно найти по этой ссылке). [51] В исходную систему FUCCI было внесено несколько изменений для улучшения ее применимости в нескольких системах in vitro и модельных организмах. Эти усовершенствования повысили чувствительность и точность определения фазы клеточного цикла, что позволило проводить более точную оценку клеточной пролиферации [52]
Нарушение регуляции компонентов клеточного цикла может привести к образованию опухоли . [53] Как упоминалось выше, когда некоторые гены, такие как ингибиторы клеточного цикла, RB , p53 и т. д. мутируют, они могут привести к неконтролируемому размножению клеток, образуя опухоль. Хотя продолжительность клеточного цикла в опухолевых клетках равна или превышает продолжительность нормального клеточного цикла, доля клеток, находящихся в активном клеточном делении (по сравнению с покоящимися клетками в фазе G 0 ) в опухолях намного выше, чем в нормальной ткани. [54] Таким образом, происходит чистое увеличение числа клеток, поскольку число клеток, которые умирают в результате апоптоза или старения, остается прежним.
Клетки, которые активно проходят клеточный цикл, являются мишенью в терапии рака, поскольку ДНК относительно открыта во время деления клеток и, следовательно, восприимчива к повреждению препаратами или радиацией . Этот факт используется в лечении рака; с помощью процесса, известного как удаление массы , удаляется значительная масса опухоли, что выталкивает значительное количество оставшихся опухолевых клеток из фазы G 0 в фазу G 1 (из-за повышенной доступности питательных веществ, кислорода, факторов роста и т. д.). Радиация или химиотерапия после процедуры удаления массы убивают эти клетки, которые недавно вошли в клеточный цикл. [15]
Самые быстроциклирующие клетки млекопитающих в культуре, клетки крипт в эпителии кишечника, имеют время цикла всего от 9 до 10 часов. Стволовые клетки в коже покоящихся мышей могут иметь время цикла более 200 часов. Большая часть этой разницы обусловлена различной продолжительностью G 1 , самой изменчивой фазы цикла. M и S не сильно различаются.
В целом, клетки наиболее радиочувствительны в поздних фазах M и G 2 и наиболее устойчивы в поздней фазе S. Для клеток с более длительным временем клеточного цикла и значительно более длительной фазой G 1 наблюдается второй пик устойчивости в конце G 1 . Характер устойчивости и чувствительности коррелирует с уровнем сульфгидрильных соединений в клетке. Сульфгидрилы — это природные вещества, которые защищают клетки от радиационного повреждения и, как правило, находятся на самом высоком уровне в S и на самом низком вблизи митоза.
Гомологичная рекомбинация (HR) — это точный процесс восстановления двухцепочечных разрывов ДНК . HR практически отсутствует в фазе G1 , наиболее активен в фазе S и снижается в фазе G2 / M. [55] Негомологичное соединение концов , менее точный и более мутагенный процесс восстановления двухцепочечных разрывов, активен на протяжении всего клеточного цикла.
Клеточный цикл должен дублировать все клеточные компоненты и равномерно разделять их на две дочерние клетки. Многие компоненты, такие как белки и рибосомы , производятся непрерывно на протяжении всего клеточного цикла (за исключением фазы М ). Однако хромосомы и другие связанные элементы, такие как MTOC , дублируются только один раз на протяжении клеточного цикла. Центральным компонентом клеточного цикла является его способность координировать непрерывные и периодические дупликации различных клеточных элементов, которые эволюционировали с образованием генома.
Доклеточная среда содержала функциональные и самовоспроизводящиеся РНК . [56] Все концентрации РНК зависели от концентраций других РНК, которые могли помогать или мешать сбору ресурсов. В этой среде рост был просто непрерывным производством РНК. Эти доклеточные структуры должны были бороться с паразитическими РНК, проблемами наследования и контролем числа копий определенных РНК. [56] [57]
Разделение «геномной» РНК от «функциональной» РНК помогло решить эти проблемы. [58] Слияние нескольких РНК в геном дало шаблон, из которого расщеплялись функциональные РНК. Теперь паразитическим РНК пришлось бы встраиваться в геном, что было гораздо большим барьером, чтобы выжить. Контроль числа копий геномной РНК также позволил определить концентрацию РНК через скорости синтеза и периоды полураспада РНК, а не через конкуренцию. [56] Разделение дупликации геномных РНК от генерации функциональных РНК позволило добиться гораздо большей точности дупликации геномных РНК без ущерба для производства функциональных РНК. Наконец, замена геномной РНК на ДНК , которая является более стабильной молекулой, позволила создавать более крупные геномы. Переход от синтеза ферментов с помощью самокатализа к синтезу ферментов, направленному на геном, был критическим шагом в эволюции клеток и имел долгосрочные последствия для клеточного цикла, который должен регулировать функциональный синтез и геномную дупликацию совершенно разными способами. [56]
Прогресс клеточного цикла контролируется колеблющимися концентрациями различных циклинов и возникающими молекулярными взаимодействиями различных циклин-зависимых киназ (CDK). У дрожжей только одна CDK (Cdc28 у S. cerevisiae и Cdc2 у S. pombe ) контролирует клеточный цикл. [59] Однако у животных эволюционировали целые семейства CDK. [60] [61] Cdk1 контролирует вступление в митоз, а Cdk2, Cdk4 и Cdk6 регулируют вступление в S-фазу. Несмотря на эволюцию семейства CDK у животных, эти белки имеют родственные или избыточные функции. [62] [63] [64] Например, мышиные клетки с тройным нокаутом cdk2 cdk4 cdk6 все еще могут проходить через основной клеточный цикл. [65] Нокауты cdk1 летальны, что предполагает наличие предковой киназы типа CDK1, в конечном итоге контролирующей клеточный цикл. [65]
Arabidopsis thaliana имеет гомолог Cdk1, называемый CDKA;1, однако мутанты cdka;1 A. thaliana все еще жизнеспособны, [66] что противоречит опистоконтной схеме киназ типа CDK1 как основных регуляторов, контролирующих клеточный цикл. [67] Растения также имеют уникальную группу CDK типа B, функции которых могут варьироваться от функций, специфичных для развития, до основных участников регуляции митоза. [68] [69]

Контрольная точка G1 /S — это точка, в которой клетка совершает деление через клеточный цикл. Сложные регуляторные сети приводят к решению о переходе G1/S. У опистоконтов есть как сильно различающиеся белковые последовательности, так и поразительно похожие топологии сетей. [67] [70]
Вход в S-фазу как у дрожжей, так и у животных контролируется уровнями двух противоположных регуляторов. [67] Сети, регулирующие эти факторы транскрипции, представляют собой петли двойной отрицательной обратной связи и петли положительной обратной связи как у дрожжей, так и у животных. [67] [70] [71] Дополнительная регуляция регуляторной сети для контрольной точки G1/S у дрожжей и животных включает фосфорилирование /дефосфорилирование комплексов CDK-циклин. Сумма этих регуляторных сетей создает гистерезисную и бистабильную схему, несмотря на то, что специфические белки сильно различаются. [72] [73] Для дрожжей Whi5 должен быть подавлен фосфорилированием Cln3 для экспрессии SBF, [74] в то время как у животных Rb должен быть подавлен комплексом Cdk4/6-циклин D для экспрессии E2F . [75] Как Rb, так и Whi5 ингибируют транскрипт посредством привлечения белков гистондеацетилазы к промоторам. [76] [77] Оба белка дополнительно имеют несколько участков фосфорилирования CDK, через которые они ингибируются. [78] [75] Однако эти белки не имеют сходства последовательностей.
Исследования A. thaliana расширяют наши знания о переходе G1/S по всем эукариотам в целом. Растения также разделяют ряд консервативных сетевых характеристик с опистоконтами, и многие растительные регуляторы имеют прямых животных гомологов. [79] Например, растениям также необходимо подавлять Rb для трансляции E2F в сети. [80] Эти консервативные элементы циклов растительных и животных клеток могут быть предковыми у эукариот. В то время как дрожжи разделяют консервативную топологию сети с растениями и животными, сильно различающаяся природа регуляторов дрожжей предполагает возможную быструю эволюцию вдоль линии дрожжей. [67]