Норэтистерон , также известный как норэтиндрон и продаваемый под многими торговыми марками, представляет собой прогестиновый препарат, используемый в противозачаточных таблетках , менопаузальной гормональной терапии и для лечения гинекологических заболеваний . [3] [5] Лекарство доступно как в низких, так и в высоких дозах, а также как отдельно, так и в сочетании с эстрогеном . [5] [6] Его применяют перорально или, как энантат норэтистерона , путем инъекции в мышцу . [3] [5] [7]
Побочные эффекты норэтистерона включают нарушения менструального цикла , головные боли , тошноту , болезненность молочных желез , изменения настроения , прыщи , усиленный рост волос . [8] [9] Норэтистерон представляет собой прогестин или синтетический прогестаген и, следовательно, является агонистом рецептора прогестерона , биологической мишени прогестагенов, таких как прогестерон . [3] [5] Он обладает слабой андрогенной и эстрогенной активностью, в основном в высоких дозах, и не имеет другой важной гормональной активности. [3] [10]
Норэтистерон был открыт в 1951 году и стал одним из первых разработанных прогестинов. [11] [12] [13] Впервые он был представлен для медицинского использования отдельно в 1957 году и был введен в сочетании с эстрогеном для использования в качестве противозачаточных таблеток в 1963 году. [13] [14] Его иногда называют как прогестин «первого поколения». [15] [16] Наряду с дезогестрелом , это один из немногих прогестинов, который широко доступен в виде «мини-таблеток», содержащих только прогестаген, для контроля над рождаемостью. [17] [18] Норэтистерон широко продается во всем мире. [19] Он доступен в виде непатентованного лекарства . [20] В 2020 году это было 137-е место среди наиболее часто назначаемых лекарств в США: на него было выписано более 4 миллионов рецептов. [21] [22] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [23]
Норэтистерон используется в качестве гормонального контрацептива в сочетании с эстрогеном – обычно этинилэстрадиолом (ЭЭ) – в комбинированных пероральных контрацептивах и отдельно в таблетках, содержащих только прогестаген .
Другое медицинское применение норэтистерона – облегчение боли, связанной с эндометриозом . Фактически, 50% пациенток, получивших медикаментозное или хирургическое лечение боли в области таза, связанной с эндометриозом, получили пользу от терапии прогестином . Это может быть связано с тем, что норэтистерон индуцирует пролиферацию эндометрия во время секреторной фазы, что, как было показано, облегчает жалобы на боль в эндометрии. Другой способ, которым норэтистерон может уменьшать боль в эндометрии, — это подавление овуляции . Боль и дискомфорт при эндометриозе усиливаются во время овуляции. [24]
Высокие дозы (10 мг/день) норэтистерона были связаны с веноокклюзионными заболеваниями печени , и из-за этого побочного эффекта норэтистерон не следует назначать пациентам, перенесшим аллогенную трансплантацию костного мозга , поскольку он связан со значительно более низким уровнем вено-окклюзионной болезни печени. год выживаемости после трансплантации. [29] : 217 [30]
В противозачаточных и гормонально-заместительных дозах (от 0,35 до 1 мг/день) норэтистерон оказывает только существенно прогестагенное побочное действие . В большинстве клинических исследований норэтистерона для контрацепции или менопаузальной гормональной терапии препарат комбинировался с эстрогеном, и по этой причине трудно определить, какие из побочных эффектов были вызваны норэтистероном, а какие из них были вызваны эстрогеном. такое исследование. Однако NETE, пролекарство норэтистерона, вводимое внутримышечно и используемое в качестве контрацептива длительного действия, используется без эстрогена и, следовательно, может использоваться в качестве заменителя норэтистерона с точки зрения понимания его эффектов и переносимости . В клинических исследованиях наиболее частым побочным эффектом NETE были нарушения менструального цикла , включая длительные кровотечения или кровянистые выделения и аменорея . [29] : 253 Другие побочные эффекты включают периодическое вздутие живота и болезненность молочных желез , оба из которых, как полагают, вызваны задержкой воды и могут быть уменьшены с помощью диуретиков . [29] : 253 Никакой связи с увеличением веса не выявлено , артериальное давление , свертываемость крови и толерантность к глюкозе остались нормальными. [29] : 253 Однако наблюдалось снижение уровня холестерина ЛПВП . [29] : 253
В высоких дозах (от 5 до 60 мг/день), например, при лечении гинекологических заболеваний, норэтистерон может вызывать гипогонадизм из-за его антигонадотропного действия и может иметь эстрогенные и слабые андрогенные побочные эффекты.
Высокие дозы НЕТА (10 мг/день) были связаны с отклонениями показателей функции печени , включая значительное повышение уровня печеночных ферментов . [31] [32] [33] Эти ферменты печени включали лактатдегидрогеназу и глутаматпируваттрансаминазу . [33] Хотя они были описаны как не имеющие клинического значения, [33] повышенный уровень ферментов печени, связанный с НЕТА, возможно, препятствовал его дальнейшему развитию в качестве мужской гормональной контрацепции. [31] [32]
Из-за своей слабой андрогенной активности норэтистерон при высоких дозах (например, от 10 до 40 мг/день) может вызывать андрогенные побочные эффекты , такие как прыщи , гирсутизм и изменения голоса небольшой степени тяжести у некоторых женщин. [9] Однако это не относится к комбинированным пероральным контрацептивам , содержащим норэтистерон и ЭЭ. [10] Такие составы содержат низкие дозы норэтистерона (от 0,35 до 1 мг/день) [10] в сочетании с эстрогеном и фактически связаны с улучшением симптомов акне. [34] [35] В соответствии с этим они фактически одобрены FDA .для лечения прыщей у женщин в США. [34] [35] Считается, что улучшение симптомов акне происходит за счет 2-3-кратного увеличения уровня глобулина, связывающего половые гормоны (ГСПГ), и последующего снижения уровня свободного тестостерона , вызванного ЭЭ, что приводит к общее снижение андрогенной сигнализации в организме. [36]
Сальные железы высокочувствительны к андрогенам, а их размер и активность являются потенциальными маркерами андрогенного эффекта. [37] Было обнаружено, что высокие дозы норэтистерона или НЕТА в дозе 20 мг/день значительно стимулируют сальные железы, тогда как более низкие дозы норэтистерона и НЕТА в дозе 5 мг/день и 2,5 мг/день и НЕТА, соответственно, существенно не стимулируют выработку кожного сала и следовательно, считались лишенными значительной андрогенности. [37] И наоборот, было обнаружено, что дозы норэтистерона от 0,5 до 3 мг/день дозозависимо снижают уровень ГСПГ (и, следовательно, подавляют выработку ГСПГ в печени), что является еще одним высокочувствительным маркером андрогенности. [38]
Крупное клиническое исследование пероральных высоких и очень высоких доз норэтистерона (от 10 до 40 мг/день), принимаемых в течение длительных периодов времени (от 4 до 35 недель) для предотвращения выкидыша у беременных , показало, что у 5,5% женщин наблюдались легкие андрогенные побочные эффекты. такие эффекты, как легкие изменения голоса ( хрипота ), прыщи и гирсутизм , а также то, что у 18,3% младенцев женского пола, рожденных от матерей, наблюдалась, в большинстве случаев лишь незначительная , вирилизация гениталий . [9] Андрогенные симптомы у матери чаще всего возникали у женщин, получавших норэтистерон в дозе 30 мг/день или более в течение 15 недель или дольше. [9] У младенцев женского пола, у которых наблюдалась вирилизация гениталий, единственным проявлением в 86,7% случаев было различное, но почти всегда незначительное увеличение клитора. [9] В остальных 13,3% случаев наблюдалось заметное увеличение клитора и частичное сращение лабиоскротальных складок . [9] Дозировки, используемые в этих случаях, составляли от 20 до 40 мг/день. [9]
В письме редактору по поводу вирилизации, вызванной высокими дозами НЕТА у женщин, врач заявил, что они не наблюдали «ни малейших признаков вирилизации» и что «определенно не было ни гирсутизма, ни каких-либо изменений голоса» у женщин. 55 женщин с распространенным раком молочной железы, которых лечили норэтистероном в дозе 30–60 мг/день в течение шести месяцев. [39]
Высокие дозы норэтистерона использовались для подавления менструации у женщин с тяжелой умственной отсталостью , которые были неспособны справиться с собственными менструациями. [40] [41] Исследование 118 нерожавших женщин, получавших норэтистерон в дозе 5 мг/день в течение периода от 2 до 30 месяцев, показало, что препарат эффективен в возникновении аменореи у 86% женщин, при этом у остальных наблюдаются прорывные кровотечения . 14%. [40] Побочные эффекты, включая увеличение веса , гирсутизм , прыщи , головную боль , тошноту и рвоту , не увеличились в частоте, и ни у одной из женщин не было отмечено никаких «тревожных побочных эффектов». [40] [41] Другое исследование норэтистерона в дозе 5 мг/день у 132 женщин также не выявило андрогенных побочных эффектов. [42] Эти данные свидетельствуют о незначительном или полном отсутствии риска андрогенных побочных эффектов при приеме норэтистерона в дозе 5 мг/день. [40] [41] В исследовании с участием 194 женщин, получавших от 5 до 15 мг/день НЕТА в течение средней продолжительности терапии 13 месяцев для подавления симптомов эндометриоза, не наблюдалось побочных эффектов у 55,2% пациенток, увеличения веса у 16,1%, прыщи - у 9,9%, лабильность настроения - у 8,9%, приливы - у 8,3% и огрубление голоса - у двух женщин (1,0%). [43]
Норэтистерон обладает слабым эстрогенным действием (за счет превращения в его метаболит ЭЭ), и по этой причине было обнаружено, что в высоких дозах он связан с высокой частотой эстрогенных побочных эффектов, таких как увеличение груди у женщин и гинекомастия у мужчин, а также с улучшением состояния. Симптомы менопаузы у женщин в постменопаузе. [44] Было высказано предположение, что очень высокие дозы (например, 40 мг/день, которые иногда используются в клинической практике по различным показаниям) НЕТА (и, как следствие, норэтистерона) могут привести к повышенному риску венозной тромбоэмболии (ВТЭ). аналогично высоким дозировкам (более 50 мкг/день) ЭЭ, и что даже дозы НЕТА от 10 до 20 мг, которые соответствуют дозам ЭЭ примерно от 20 до 30 мкг/день, могут у некоторых женщин быть связаны с повышенным риском. [45] [46] Исследование также показало, что этинилэстрадиол и норэтистерон оказывали большее влияние на факторы свертывания крови, когда доза норэтистерона составляла 3 или 4 мг, чем когда она составляла 1 мг. [47] Это могло быть связано с добавлением этинилэстрадиола, вырабатываемого более высокими дозами норэтистерона. [47]
Сообщений о серьезных побочных эффектах при передозировке норэтистерона не поступало , даже у маленьких детей. [48] Таким образом, передозировка обычно не требует лечения. [48] Высокие дозы норэтистерона (до 60 мг/день) изучались при длительном лечении без описанных серьезных побочных эффектов. [39]
5α-редуктаза играет важную роль в метаболизме норэтистерона, а ингибиторы 5α-редуктазы, такие как финастерид и дутастерид , могут ингибировать его метаболизм. [ нужна цитация ] Норэтистерон частично метаболизируется посредством гидроксилирования CYP3A4 , а ингибиторы и индукторы CYP3A4 могут значительно изменять циркулирующие уровни норэтистерона. [4] Например, было обнаружено, что индукторы CYP3A4 рифампицин и бозентан снижают воздействие норэтистерона на 42% и 23% соответственно, а индукторы CYP3A4 карбамазепин и зверобой также ускоряют клиренс норэтистерона. [4]
Норэтистерон является мощным прогестагеном и слабым андрогеном и эстрогеном . [3] То есть это мощный агонист рецептора прогестерона (PR) и слабый агонист рецептора андрогена (AR) и рецептора эстрогена (ER). [3] Норэтистерон сам по себе имеет незначительное сродство к ЭР; его эстрогенная активность обусловлена активным метаболитом , который образуется в очень небольших количествах, этинилэстрадиолом (ЭЭ), который является очень мощным эстрогеном. [3] Норэтистерон и его метаболиты имеют незначительное сродство к глюкокортикоидным рецепторам (GR) и минералокортикоидным рецепторам (MR) и, следовательно, не обладают глюкокортикоидной , антиглюкокортикоидной , минералокортикоидной или антиминералокортикоидной активностью. [3]
Норэтистерон является мощным прогестагеном и связывается с PR примерно со 150 % сродством прогестерона . [3] Напротив, его исходные соединения, тестостерон , нандролон (19-нортестостерон) и этистерон (17α-этинилтестостерон), имеют 2%, 22% и 44% относительного сродства связывания прогестерона с PR. [49] В отличие от норэтистерона, его основной активный метаболит 5α-дигидронорэтистерон (5α-DHNET), образующийся при трансформации посредством 5α-редуктазы , обладает как прогестагенной, так и выраженной антипрогестагенной активностью, [50] хотя его сродство к PR значительно снижается по сравнению с норэтистероном и составляет всего 25% от уровня прогестерона. [3] Норэтистерон вызывает аналогичные изменения в эндометрии и влагалище , такие как трансформация эндометрия , и обладает аналогичным антигонадотропным действием , ингибированием овуляции и термогенностью у женщин по сравнению с прогестероном, что соответствует его прогестагенной активности. [51] [49] [52]
Норэтистерон имеет примерно 15% сродства анаболически-андрогенного стероида (ААС) метриболона (R-1881) к АР и, соответственно, является слабоандрогенным. [3] В отличие от норэтистерона, 5α-DHNET, основной метаболит норэтистерона, демонстрирует более высокое сродство к АР, примерно 27% от сродства метриболона. [3] Однако, хотя 5α-DHNET имеет более высокое сродство к AR, чем норэтистерон, в биоанализах на грызунах он значительно снизил и фактически почти полностью устранил андрогенную активность по сравнению с норэтистероном . [53] [54] Аналогичные результаты наблюдались для этистерона (17α-этинилтестостерона) и его 5α-восстановленного метаболита, тогда как 5α-восстановление увеличивало как сродство к AR, так и андрогенную активность тестостерона и нандролона ( 19-нортестостерона) в биоанализах на грызунах. [54] Таким образом, очевидно, что этинильная группа норэтистерона в положении C17α ответственна за потерю андрогенности при 5α-восстановлении. [54]
Было обнаружено, что норэтистерон (0,5–3 мг/день) дозозависимо снижает уровень циркулирующего ГСПГ, что является общим свойством андрогенов и обусловлено АР-опосредованным подавлением выработки ГСПГ в печени. [38] Препарат также обладает эстрогенной активностью, а эстрогены, как известно, увеличивают выработку ГСПГ в печени и уровни циркулирующей крови, поэтому может показаться, что андрогенная активность норэтистерона в этом отношении превосходит его эстрогенную активность. [38]
Норэтистерон в значительной степени (36%) связывается с ГСПГ в кровотоке. [3] Хотя он имеет более низкое сродство к ГСПГ, чем эндогенные андрогены и эстрогены, [55] Норэтистерон может вытеснять тестостерон из ГСПГ и тем самым повышать уровень свободного тестостерона, и это действие может способствовать его слабому андрогенному эффекту. [56]

Норэтистерон связывается с ER, ERα и ERβ с относительной аффинностью связывания эстрадиола 0,07% и 0,01% . [57] Из-за такого очень низкого относительного сродства он сам по себе практически неактивен в качестве лиганда ER в клинических концентрациях. [3] Однако было обнаружено, что норэтистерон является субстратом ароматазы и в небольшой степени (0,35%) превращается в печени в высокоактивный эстроген этинилэстрадиол (EE), и по этой причине, в отличие от большинства других прогестинов, норэтистерон обладает некоторой эстрогенной активностью. [3] Однако при типичных дозах норэтистерона, используемого в пероральных контрацептивах (от 0,5 до 1 мг), уровни вырабатываемого ЭЭ низкие, и было сказано, что они, вероятно, не имеют клинического значения. [3] И наоборот, дозы норэтистерона 5 и 10 мг, которые используются при лечении гинекологических заболеваний , конвертируются со скоростью 0,7% и 1,0% и производят уровни ЭЭ, соответствующие уровням, производимым дозами 30 и 60 мкг. ЭЭ соответственно. [1] [3] Уровни ЭЭ, образующиеся при приеме 0,5 и 1 мг норэтистерона, были оценены на основе более высоких дозировок, соответствующих дозам ЭЭ 2 и 10 мкг соответственно. [1] В высоких дозах норэтистерон может увеличить риск венозной тромбоэмболии из-за метаболизма в ЭЭ. [58]
Подобно прогестерону и тестостерону , норэтистерон метаболизируется до 3,5- тетрагидрометаболитов . [59] Взаимодействуют ли эти метаболиты норэтистерона с рецептором ГАМК А аналогично 3,5-тетрагидрометаболитам прогестерона и тестостерона, таким как аллопрегнанолон и 3α-андростандиол соответственно, является темой, которая, по-видимому, не изучалась и, следовательно, требует разъяснение. [59]
Норэтистерон является субстратом и, как известно, является ингибитором 5α-редуктазы с ингибированием 4,4% и 20,1% при 0,1 и 1 мкМ соответственно. [3] Однако терапевтические концентрации норэтистерона находятся в низком наномолярном диапазоне, поэтому это действие может не иметь клинического значения при типичных дозировках. [3]
Было обнаружено, что норэтистерон и его основной активный метаболит 5α-DHNET действуют как необратимые ингибиторы ароматазы (K i = 1,7 мкМ и 9,0 мкМ соответственно). [60] Однако, как и в случае с 5α-редуктазой, необходимые концентрации, вероятно, слишком высоки, чтобы быть клинически значимыми при типичных дозировках. [3] 5α-DHNET был тщательно исследован и оказался селективным в ингибировании ароматазы и не влияет на фермент расщепления боковой цепи холестерина (P450scc), 17α-гидроксилазу / 17,20-лиазу , 21-гидроксилазу или 11β-гидроксилаза . [60] Поскольку он не ароматизируется (и, следовательно, не может трансформироваться в эстрогенный метаболит), в отличие от норэтистерона, 5α-DHNET был предложен в качестве потенциального терапевтического агента при лечении ER-положительного рака молочной железы . [60]
Норэтистерон является очень слабым ингибитором CYP2C9 и CYP3A4 ( IC 50 = 46 мкМ и 51 мкМ соответственно), но эти действия требуют очень высоких концентраций норэтистерона, которые намного превышают терапевтические уровни циркулирующей крови (которые находятся в наномолярном диапазоне) и, следовательно, вероятно, не имеет клинического значения. [3]
Было обнаружено, что норэтистерон и некоторые из его 5α-восстановленных метаболитов оказывают сосудорасширяющее действие у животных, которое не зависит от рецепторов половых стероидов и, следовательно, по-видимому, имеет негеномный механизм. [61]
Норэтистерон стимулирует пролиферацию клеток рака молочной железы MCF -7 in vitro , действие, которое не зависит от классических PR и вместо этого опосредовано через мембранный компонент-1 рецептора прогестерона (PGRMC1). [62] Некоторые другие прогестины действуют в этом анализе аналогичным образом, тогда как прогестерон действует нейтрально. [62] Неясно, могут ли эти результаты объяснить различные риски рака молочной железы, наблюдаемые при применении прогестерона и прогестинов в клинических исследованиях . [63]
Благодаря своей прогестагенной активности норэтистерон подавляет ось гипоталамус-гипофиз-гонады (ось HPG) и, следовательно, оказывает антигонадотропное действие. [3] [49] Ожидается, что эстрогенная активность норэтистерона в высоких дозах также будет способствовать его антигонадотропному эффекту. [64] Благодаря своим антигонадотропным эффектам норэтистерон подавляет выработку половых гормонов половыми железами , подавляет овуляцию у женщин и подавляет сперматогенез у мужчин. [3] [49] [65]
Ингибирующая овуляцию доза как перорального норэтистерона, так и перорального НЕТА составляет около 0,5 мг/день для женщин . [3] [66] [67] Однако существуют некоторые противоречивые данные, предполагающие, что для полного подавления овуляции могут потребоваться более высокие дозы. [68] Было обнаружено, что внутримышечная инъекция 200 мг NETE предотвращает овуляцию и подавляет уровни эстрадиола , прогестерона , лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) у женщин. [69] [70] [71] [72]
Ранние исследования перорального применения норэтистерона у мужчин, применявших дозы от 20 до 50 мг/день, выявили подавление экскреции 17-кетостероидов , повышенную экскрецию эстрогена (из-за превращения в этинилэстрадиол ), подавление сперматогенеза, либидо и эректильной функции , а также частоту гинекомастии . [73] [74] [75] [44] [76] Сообщалось, что пероральный прием норэтистерона в дозе 25 мг/день в течение 3 недель у мужчин подавляет уровень тестостерона примерно на 70%, до 100–200 нг/дл. в течение 4 или 5 дней, а также для подавления количества сперматозоидов и отсутствия влияния на либидо или эректильную функцию в течение этого короткого периода времени. [77] [78] У здоровых молодых мужчин НЭТА в дозе от 5 до 10 мг/день перорально в течение 2 недель подавлял уровень тестостерона с ~527 нг/дл до ~231 нг/дл (–56%). [79]

Было обнаружено , что однократная внутримышечная инъекция NETE в дозе 200 мг отдельно или в сочетании с валератом эстрадиола в дозе 2 мг вызывает быстрое, сильное и устойчивое снижение уровней гонадотропина и тестостерона на срок до одного месяца у мужчин. [65] [81] [82] Также было обнаружено, что внутримышечные инъекции 200 мг NETE один раз в 3 недели подавляют сперматогенез у мужчин. [73] [83] Аналогично, было обнаружено, что однократная внутримышечная инъекция 50 мг NETE в сочетании с 5 мг валерата эстрадиола сильно подавляет уровень тестостерона у мужчин. [80] Уровни тестостерона снизились с ~503 нг/дл в исходном состоянии до ~30 нг/дл в самой низкой точке (–94%), которая произошла на 7-й день после инъекции. [80]
Фармакокинетика норэтистерона была рассмотрена. [3] [84]
Биодоступность норэтистерона при пероральном приеме составляет от 47 до 73%, при этом средняя биодоступность при пероральном приеме составляет 64 % . [1] [2] Было обнаружено, что микронизация значительно улучшает пероральную биодоступность норэтистерона за счет увеличения кишечной абсорбции и снижения кишечного метаболизма . [3] [85] Было обнаружено, что однократная пероральная доза норэтистерона в дозе 2 мг приводит к достижению пиковых уровней препарата в крови 12 нг/мл (40 нмоль/л), тогда как однократная пероральная доза норэтистерона в дозе 1 мг в сочетании с Прием 2 мг эстрадиола приводил к пиковому уровню норэтистерона 8,5 нг/мл (29 нмоль/л) через час после приема. [3]
Связывание норэтистерона с белками плазмы составляет 97%. [3] На 61% он связан с альбумином и на 36% — с ГСПГ. [3]
Период полувыведения норэтистерона составляет от 5,2 до 12,8 часов, средний период полувыведения составляет 8,0 часов. [1] Метаболизм норэтистерона очень похож на метаболизм тестостерона (и нандролона) и происходит главным образом за счет восстановления двойной связи Δ4 до 5α- и 5β- дигидронорэтистерона , за которым следует восстановление кетогруппы C3 до четыре изомера 3,5-тетрагидронорэтистерона. [3] Эти трансформации катализируются 5α- и 5β-редуктазой и 3α- и 3β-гидроксистероиддегидрогеназой как в печени , так и во внепеченочных тканях, таких как гипофиз , матка , предстательная железа , влагалище и молочная железа . [95] За исключением 3α,5α- и 3β,5α-тетрагидронорэтистерона, которые обладают значительным сродством к ЭР и в некоторой степени являются эстрогенными, 3,5-тетрагидрометаболиты норэтистерона неактивны с точки зрения сродства к половым стероидам. рецепторы (в частности, PR, AR и ER). [96] [97] [98] Небольшое количество норэтистерона также преобразуется ароматазой в ЭЭ. [1] [3] [45] Норэтистерон также метаболизируется в печени посредством гидроксилирования , главным образом с помощью CYP3A4 . [4] Некоторая конъюгация (включая глюкуронидацию и сульфатирование ) [95] [99] норэтистерона и его метаболитов происходит, несмотря на стерические препятствия со стороны этинильной группы при C17α. [3] Этинильная группа норэтистерона сохраняется примерно в 90% всех его метаболитов. [3]
Норэтистерон используется в противозачаточных таблетках, в отличие от самого прогестерона, поскольку при пероральном приеме он не метаболизируется так быстро, как прогестерон. При пероральном приеме прогестерон быстро метаболизируется в желудочно-кишечном тракте и печени и расщепляется на множество различных метаболитов. Принимая во внимание, что норэтистерон не так быстро метаболизируется, что позволяет норэтистерону присутствовать в более высоких количествах, что позволяет ему более эффективно конкурировать за сайты связывания рецепторов прогестерона. [3]
Норэтистерон выводится от 33 до 81% с мочой и от 35 до 43% с калом . [100]
Норэтистерон, также известный как 17α-этинил-19-нортестостерон или как 17α-этинилестра-4-ен-17β-ол-3-он, представляет собой синтетический стероид эстран и производное тестостерона . [101] [27] В частности, это производное тестостерона, в котором этинильная группа была добавлена в положении C17α, а метильная группа в положении C19 удалена; следовательно, это комбинированное производное этистерона (17α-этинилтестостерон) и нандролона (19-нортестостерон). [101] [27] Эти модификации приводят к увеличению прогестагенной активности и пероральной биодоступности , а также к снижению андрогенной / анаболической активности. [102]
Норэтистерон (NET) является исходным соединением большой группы прогестинов, в которую входит большинство прогестинов, известных как производные 19-нортестостерона. [103] Эта группа делится по химической структуре на эстраны (производные норэтистерона) и гонаны (18-метилгонаны или 13β-этилэстраны; производные левоноргестрела ) и включает следующие имеющиеся в продаже препараты: [104]
Некоторые из них действуют как пролекарства норэтистерона, включая НЕТА, NETE, диацетат этинодиола , линестренол и ацетат квингестанола . [105] [106] [107] Норэтинодрел также может быть пролекарством норэтистерона. [3] [1] NETA принимается внутрь так же, как норэтистерон, тогда как NETE вводится путем инъекции в мышцу . [10]
19-нортестостероновые (19-NT) прогестины, которые технически не являются производными норэтистерона (поскольку они не имеют этинильной группы C17α ), но все же тесно связаны (с другими заменами в положениях C17α и/или C16β), включают следующие имеющиеся в продаже лекарства. : [101] [27]
Многие анаболические стероиды семейства 19-нортестостерона, такие как норэтандролон и этилэстренол , также являются мощными прогестагенами, но никогда не продавались как таковые.
Опубликованы результаты химического синтеза норэтистерона. [101] [84]

3-метиловый эфир эстрадиола ( 1 , EME) частично восстанавливается до 1,5-диена ( 2 ), что также происходит на первой стадии синтеза нандролона. Затем окисление Оппенауэра преобразует гидроксильную группу C17β в кетоновую функциональную группу ( 3 ). Затем его подвергают реакции с ацетилидом металла с образованием соответствующего этинильного соединения C17α ( 4 ). Гидролиз эфира енола в мягких условиях приводит непосредственно к ( 5 ), [108] который, по-видимому, представляет собой норэтинодрел (хотя Леднисер в своей книге утверждает, что это «этинодрел» (который может быть синонимом этинодиола ); этинодрел связан с хлором присоединенный атом), перорально активный прогестин. Это прогестагенный компонент первого орального контрацептива , поступившего в продажу (т.е. Эновида). Обработка эфира этиниленола сильной кислотой приводит к образованию норэтистерона ( 6 ). [11]
На практике эти и все другие комбинированные пероральные контрацептивы представляют собой смеси 1–2% ЭЭ или местранола и перорального прогестина . Было высказано предположение, что открытие необходимости использования эстрогена в дополнение к прогестину для обеспечения контрацептивной эффективности связано с наличием небольшого количества невосстановленного ЭМЕ ( 1 ) в ранних партиях из 2 препаратов . При окислении и этинилировании это , конечно, приведет к образованию местранола ( 3 ). В любом случае необходимость присутствия эстрогена в смеси в настоящее время хорошо установлена экспериментально.
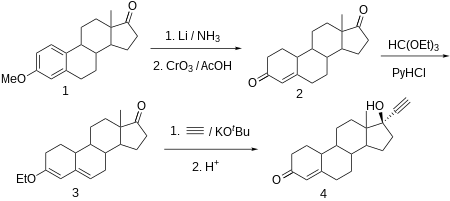
Норэтистерон производится из эстр-4-ен-3,17-диона (боландиона), который, в свою очередь, синтезируется путем частичного восстановления ароматической области 3-О-метилового эфира эстрона литием в жидком аммиаке и одновременно кетогруппа при C17α превращается в гидроксильную группу, которая затем снова окисляется до кетогруппы триоксидом хрома в уксусной кислоте . Сопряженный олефин C4-C5 и карбонильную группу при C3 затем преобразуют в этиловый эфир диенола с использованием этилортоформиата . Полученный продукт этинилируют ацетиленом в присутствии трет-бутоксида калия . После гидрохлоридного гидролиза образовавшегося О-производного калия, в ходе которого гидролизуется и еноловый эфир, а оставшаяся двойная связь сдвигается, получается искомый норэтистерон.
Норэтистерон был впервые синтезирован химиками Луисом Мирамонтесом , Карлом Джерасси и Джорджем Розенкранцем в компании Syntex в Мехико в 1951 году . сравнение. [ нужна ссылка ] Норэтистерон был первым высокоактивным пероральным прогестагеном , который был синтезирован, и ему предшествовали (как прогестаген) прогестерон (1934), этистерон (1938), 19-норпрогестерон (1944) и 17α-метилпрогестерон (1949). а также нандролона (1950), тогда как норэтинодрел (1952) и норэтандролон (1953) следовали за синтезом норэтистерона. [12] [13] Препарат был представлен под названием Норлютин в США в 1957 году. [14] Впоследствии норэтистерон был объединен с местранолом и поступил на рынок в США под названием Орто-Новум в 1963 году. Это был второй прогестин после норэтинодрела в США. 1960 г., для использования в составе пероральных контрацептивов . [13] В 1964 году в США появились на рынке дополнительные противозачаточные препараты, содержащие норэтистерон в сочетании с местранолом или ЭЭ, такие как норлестрин и норинил . [13]
Норэтистерон – МННи БАНпрепарата, в то время как норэтиндрон является его USAN. [101] [27]
Норэтистерон доступен в Бангладеш под торговыми марками Menogia (ACI), Normens (Renata) и т. д. Норэтистерон (NET), в том числе как NETA и NETE, продается под многими торговыми марками по всему миру. [27] [19]
Ранее норэтистерон был доступен в США отдельно в таблетках по 5 мг под торговой маркой Норлютин, но с тех пор этот препарат был снят с производства в этой стране. [26] Однако НЕТА по-прежнему доступен в США в виде таблеток по 5 мг под торговой маркой Айгестин. [26] Это один из немногих неконтрацептивных препаратов, содержащих только прогестаген, который остается доступным в Соединенных Штатах. [26] Другие включают прогестерон , медроксипрогестерона ацетат , мегестрола ацетат и гидроксипрогестерон капроат , а также атипичный агент даназол . [26]
И норэтистерон, и НЕТА также доступны в США в качестве противозачаточных средств. [26] Норэтистерон доступен как отдельно (торговые марки Camila, Errin, Heather, Micronor, Nor-QD и другие), так и в сочетании с ЭЭ (Norinyl, Ortho-Novum, другие) или местранолом (Norinyl, Ortho-Novum и другие). , тогда как НЭТА доступен только в сочетании с ЭЭ (Норлестрин и др.). [26] NETE не доступен в США ни в какой форме. [26] [114] [115]
Норэтистерон, как NETA и NETE, изучался на предмет использования в качестве потенциального мужского гормонального контрацептива в сочетании с тестостероном у мужчин. [116] [117]
Микросферы норэтистерона длительного действия для внутримышечных инъекций изучались на предмет потенциального использования в качестве противозачаточных средств. [118]
Норэтистерон и его ацетатные и энантатные эфиры являются прогестагенами, обладающими слабыми эстрогенными и андрогенными свойствами.
Многие синтетические стероиды с высокой миотрофической активностью проявляют миотрофно-андрогенную диссоциацию, поскольку из-за изменений, вносимых в структуру кольца А, они, вероятно, не будут субстратами для 5α-редуктаз [85]. 5α-редукция не всегда усиливает андрогенную активность, несмотря на высокую RBA андрогенов к АР. Так обстоит дело с норэтистероном (рис. 1, 34), синтетическим производным 19-нор-17α-этинилтестостерона, который также подвергается ферментативно-опосредованному 5α-восстановлению и оказывает мощное андрогенное действие на органы-мишени. 5α-восстановленный норэтистерон демонстрирует более высокое связывание AR, но демонстрирует значительно более низкую андрогенную активность, чем неизмененный норэтистерон [102,103].
Норэтистерон связывается с ГСПГ с меньшим сродством, чем эндогенные андрогены и эстрогены [...]
{{cite book}}: |journal=игнорируется ( помощь )[...] несколько моно- и дисульфатированных, а также моно- и диглюкуронидированных метаболитов NET были обнаружены в моче женщин, получавших NET [16,17]. В неконъюгированной форме эти метаболиты NET (или MeNET) представлены 5α- и 5β-восстановленными NET (5α-NET или 5β-NET), а также 3α- и 3β-гидрированными 5α-NET и 5β-NET, что приводит к образованию 3α,5α-NET. -NET, 3β,5α-NET, 3α,5β-NET и 3β,5β-NET или их соответствующие метаболиты MeNET (рис. 1 и 2). Эти стероидные преобразования NET или MeNET могут происходить в печени, а также в гипофизе, эндометрии, предстательной железе, влагалище и молочной железе. Ферментами, участвующими в этих метаболических процессах, являются 5α- и 5β-редуктаза, а также 3α- и 3β-гидроксистероиддегидрогеназа (HSD).
Аналогичным андрогенным потенциалом обладает норэтистерон и его пролекарства (норэтистерона ацетат, этинодиола диацетат, линестренол, норэтинодрел, квингестанол [ацетат]).