Рак яичников — это раковая опухоль яичника . [10] Он может возникать в самом яичнике или, что более распространено, в сообщающихся близлежащих структурах, таких как фаллопиевы трубы или внутренняя оболочка брюшной полости . [3] [11] Яичник состоит из трех различных типов клеток, включая эпителиальные клетки, зародышевые клетки и стромальные клетки. [ 12] Когда эти клетки становятся ненормальными, они обладают способностью делиться и образовывать опухоли. Эти клетки также могут проникать или распространяться на другие части тела. [13] Когда этот процесс начинается, симптомы могут отсутствовать или проявляться лишь неопределенно. [1] Симптомы становятся более заметными по мере прогрессирования рака. [1] [14] Эти симптомы могут включать вздутие живота , вагинальное кровотечение, боль в области таза , отек живота , запор и потерю аппетита , среди прочего. [1] Обычные области, на которые может распространяться рак, включают оболочку брюшной полости , лимфатические узлы , легкие и печень . [15]
Риск рака яичников увеличивается с возрастом. Большинство случаев рака яичников развиваются после менопаузы. [16] Он также чаще встречается у женщин, у которых в течение жизни было больше овуляций . [17] Сюда входят те, у кого никогда не было детей , те, у кого овуляция началась в более молодом возрасте, и те, у кого менопауза наступила в более старшем возрасте. [5] Другие факторы риска включают гормональную терапию после менопаузы , лекарства от бесплодия и ожирение . [4] [6] Факторы, снижающие риск, включают гормональную контрацепцию , перевязку маточных труб , беременность и кормление грудью . [6] Около 10% случаев связаны с наследственным генетическим риском; женщины с мутациями в генах BRCA1 или BRCA2 имеют около 50% вероятности развития этого заболевания. [5] Некоторые семейные онкологические синдромы, такие как наследственный неполипозный рак толстой кишки и синдром Пейтца-Егерса, также увеличивают риск развития рака яичников. [16] Эпителиальная карцинома яичников является наиболее распространенным типом рака яичников, охватывая более 95% случаев. [5] Существует пять основных подтипов карциномы яичников, из которых наиболее распространенной является высокозлокачественная серозная карцинома (HGSC). [5] Менее распространенные типы рака яичников включают опухоли зародышевых клеток [18] и стромальные опухоли полового тяжа . [5] Диагноз рака яичников подтверждается с помощью биопсии ткани, обычно удаляемой во время операции. [1]
Скрининг не рекомендуется женщинам со средним риском, поскольку доказательства не подтверждают снижение смертности, а высокий уровень ложноположительных тестов может привести к ненужной операции, которая сопровождается собственными рисками. [19] У тех, кто находится в очень высоком риске, яичники могут быть удалены в качестве профилактической меры. [4] При обнаружении и лечении на ранней стадии рак яичников часто излечим. [1] Лечение обычно включает комбинацию хирургического вмешательства, лучевой терапии и химиотерапии . [1] Результаты зависят от степени заболевания, подтипа имеющегося рака и других медицинских состояний. [5] [20] Общий пятилетний показатель выживаемости в Соединенных Штатах составляет 49%. [7] Результаты хуже в развивающихся странах. [5]
В 2020 году новые случаи произошли примерно у 313 000 женщин. [21] В 2019 году это привело к 13 445 смертям в Соединенных Штатах. [22] Смертность от рака яичников увеличилась во всем мире в период с 1990 по 2017 год на 84,2%. [23] Рак яичников является вторым по распространенности гинекологическим раком в Соединенных Штатах. Он вызывает больше смертей, чем любой другой рак женской репродуктивной системы. [24] Среди женщин он занимает пятое место по смертности, связанной с раком. [25] Типичный возраст постановки диагноза — 63 года . [2] Смерть от рака яичников чаще встречается в Северной Америке и Европе, чем в Африке и Азии. [5] В Соединенных Штатах он чаще встречается у белых и латиноамериканских женщин, чем у чернокожих или американских индейцев. [22]

Ранние признаки и симптомы рака яичников могут отсутствовать или быть едва заметными. В большинстве случаев симптомы существуют в течение нескольких месяцев, прежде чем их распознают и диагностируют . [26] [27] Симптомы часто могут быть ошибочно диагностированы как синдром раздраженного кишечника . [28] Ранние стадии рака яичников, как правило, безболезненны, что затрудняет его раннее обнаружение. Симптомы могут различаться в зависимости от подтипа. [26] Пограничные опухоли яичников , также известные как опухоли яичников с низким злокачественным потенциалом (LMP), не вызывают повышения уровня CA125 и не определяются с помощью УЗИ. Типичные симптомы опухоли LMP могут включать вздутие живота или боль в области таза. Особенно большие массы, как правило, доброкачественные или пограничные. [29] [26]
Наиболее типичные симптомы рака яичников включают вздутие живота , боли или дискомфорт в области живота или таза, боли в спине, нерегулярные менструации или постменопаузальные вагинальные кровотечения, боль или кровотечение после или во время полового акта , потерю аппетита , усталость , диарею , расстройство желудка , изжогу , запор , тошноту , чувство переполнения и, возможно, мочевые симптомы (включая частое мочеиспускание и неотложные позывы к мочеиспусканию ). [27]

Более поздние симптомы рака яичников возникают из-за растущей массы, вызывающей боль при надавливании на другие органы брюшной полости и малого таза, или из-за метастазов. [26] [30] [31] Из-за анатомического расположения яичников глубоко в тазу большинство масс большие и прогрессирующие на момент постановки диагноза. [14] Растущая масса может вызывать боль, если развивается перекрут яичников . Если эти симптомы начинают возникать чаще или сильнее, чем обычно, особенно после отсутствия значительной истории таких симптомов, рассматривается рак яичников. [26] [29] Метастазы могут вызывать узелок сестры Марии Джозеф . [31] Редко тератомы могут вызывать синдром растущей тератомы или перитонеальный глиоматоз. [31] Некоторые испытывают менометроррагию и аномальное вагинальное кровотечение после менопаузы в большинстве случаев. Другие распространенные симптомы включают гирсутизм , боль в животе, вирилизацию и массу придатков . [32]
У подростков или детей с опухолями яичников симптомы могут включать сильную боль в животе, раздражение брюшины или кровотечение . [33] Опухоли стромы полового тяжа вырабатывают гормоны, которые могут привести к преждевременному развитию вторичных половых признаков. Опухоли стромы полового тяжа у детей препубертатного возраста могут проявляться признаками раннего полового созревания ; также распространены боли в животе и вздутие живота. У подростков с опухолями стромы полового тяжа может наблюдаться аменорея . По мере того, как рак становится более запущенным, он может вызывать накопление жидкости в брюшной полости и приводить к вздутию живота. Если злокачественное новообразование не было диагностировано к тому времени, когда оно вызывает асцит, его обычно диагностируют вскоре после этого. [26] Рак на поздней стадии может также вызывать абдоминальные массы, массы лимфатических узлов или плевральный выпот . [31]
Существует множество известных факторов риска, которые могут увеличить риск развития рака яичников у женщины. Риск развития рака яичников связан с количеством времени, которое женщина тратит на овуляцию. [34] Факторы, которые увеличивают количество овуляторных циклов у женщины, могут увеличить риск развития рака яичников. [34] Во время овуляции клетки стимулируются к делению. Если это деление регулируется ненормально, могут образовываться опухоли, которые могут быть злокачественными. Раннее менархе и поздняя менопауза увеличивают количество овуляторных циклов у женщины в течение жизни и, таким образом, увеличивают риск развития рака яичников. [29] [34] [35] Поскольку овуляция подавляется во время беременности, отсутствие детей также увеличивает риск рака яичников. [35] Таким образом, женщины, которые не рожали детей, подвергаются в два раза большему риску рака яичников, чем те, у кого они были. [26] И ожирение, и заместительная гормональная терапия также повышают риск. [26]
Риск развития рака яичников ниже у женщин, у которых меньше менструальных циклов, нет менструальных циклов, кормящих грудью , принимающих оральные контрацептивы, имеющих многоплодную беременность и беременность в раннем возрасте. Риск развития рака яичников ниже у женщин, у которых была перевязка маточных труб (в просторечии известная как «перевязка труб»), оба яичника удалены или гистерэктомия (операция, при которой удаляется матка). [27] Возраст также является фактором риска. [26] [20] Негенетические факторы, такие как сахарный диабет, высокий индекс массы тела и употребление табака, также являются факторами риска развития рака яичников. [23]
Использование лекарств от бесплодия может способствовать образованию пограничных опухолей яичников , но связь между ними оспаривается и ее трудно изучить. [28] Препараты от бесплодия могут быть связаны с более высоким риском пограничных опухолей. [31] Те, кто лечился от бесплодия, но не рожал, подвергаются более высокому риску эпителиального рака яичников из-за гормонального воздействия, которое может привести к пролиферации клеток. Однако те, кто успешно лечится от бесплодия и впоследствии рожает, не подвергаются более высокому риску. Это может быть связано с выделением предраковых клеток во время беременности, но причина остается неясной. [29] Фактором риска может быть само бесплодие, а не лечение. [34]
Гормональные состояния, такие как синдром поликистозных яичников и эндометриоз, связаны с раком яичников, но эта связь не полностью подтверждена. [28] Постменопаузальная заместительная гормональная терапия (ЗГТ) с эстрогеном, вероятно, увеличивает риск рака яичников. Связь не была подтверждена в крупномасштабном исследовании, [29] [36] но известные исследования, включая исследование миллиона женщин, подтвердили эту связь. Постменопаузальная ЗГТ с комбинированным эстрогеном и прогестероном может увеличить одновременный риск, если используется более 5 лет, но этот риск возвращается к норме после прекращения терапии. [34] Эстрогенная ЗГТ с прогестинами или без них увеличивает риск эндометриоидных и серозных опухолей, но снижает риск муцинозных опухолей. Более высокие дозы эстрогена увеличивают этот риск. [31] Эндометриоз является еще одним фактором риска рака яичников, [34] как и боль при менструации. Эндометриоз связан с подтипами светлоклеточного и эндометриоидного рака, серозными опухолями низкой степени злокачественности, опухолями I и II стадии, опухолями 1 степени злокачественности и более низкой смертностью. [31]
До менопаузы ожирение может увеличить риск рака яичников у человека, но этот риск отсутствует после менопаузы. Этот риск также актуален для тех, кто страдает ожирением и никогда не использовал ЗГТ. Похожая связь с раком яичников появляется у более высоких женщин. [34]
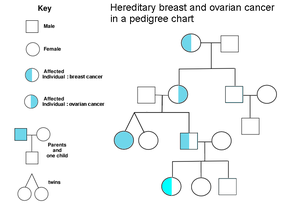
Семейный анамнез рака яичников является фактором риска рака яичников. Женщины с наследственным неполипозным раком толстой кишки (синдром Линча), а также женщины с генетическими аномалиями BRCA-1 и BRCA-2 подвержены повышенному риску.
Основным генетическим фактором риска рака яичников является мутация в генах BRCA1 или BRCA2 , или в генах репарации несоответствий ДНК , которая присутствует в 10% случаев рака яичников. Достаточно мутировать только один аллель , чтобы человек оказался в группе высокого риска. Ген может быть унаследован как по материнской, так и по отцовской линии, но имеет различную пенетрантность . [26] [29] Хотя мутации в этих генах обычно связаны с повышенным риском рака груди, они также несут в себе существенный пожизненный риск рака яичников, который достигает пика в возрасте 40–50 лет. Самый низкий риск составляет 30%, а самый высокий — 60%. [28] [26] [29] Мутации в BRCA1 имеют пожизненный риск развития рака яичников 15–45%. [31] Мутации в BRCA2 менее опасны, чем мутации в BRCA1 , с пожизненным риском от 10% (самый низкий риск) до 40% (самый высокий риск). [26] [31] В среднем рак, связанный с BRCA, развивается на 15 лет раньше своих спорадических аналогов, потому что людям, которые наследуют мутации в одной копии своего гена, нужна только одна мутация, чтобы начать процесс канцерогенеза, тогда как людям с двумя нормальными генами нужно будет приобрести две мутации. [29]
В Соединенных Штатах пять из 100 женщин, у которых есть родственник первой степени родства с раком яичников, в конечном итоге сами заболеют раком яичников, что ставит тех, у кого есть затронутые члены семьи, под тройной риск по сравнению с женщинами, у которых есть не затронутые члены семьи. Семь из 100 женщин, у которых двое или более родственников с раком яичников, в конечном итоге заболеют раком яичников. [29] [37] В целом, 5–10% случаев рака яичников имеют генетическую причину. [29] Мутации BRCA связаны с серозным немуцинозным эпителиальным раком яичников высокой степени злокачественности. [31]

Сильный семейный анамнез рака эндометрия , рака толстой кишки или других видов рака желудочно-кишечного тракта может указывать на наличие синдрома, известного как наследственный неполипозный колоректальный рак (также известный как синдром Линча), который обусловливает более высокий риск развития ряда видов рака, включая рак яичников. Синдром Линча вызывается мутациями в генах репарации несоответствий, включая MSH2 , MLH1 , MLH6, PMS1 и PMS2 . [26] Риск рака яичников для человека с синдромом Линча составляет от 10 до 12 процентов. [26] [29] Женщины исландского происхождения , европейского еврейского происхождения / ашкеназского еврейского происхождения и венгерского происхождения подвержены более высокому риску эпителиального рака яичников. [29] Ген рецептора эстрогена бета ( ESR2 ), по-видимому, является ключом к патогенезу и ответу на терапию. [38] Другие гены, которые связаны с раком яичников, это BRIP1 , MSH6 , RAD51C и RAD51D . [39] CDH1 , CHEK2 , PALB2 и RAD50 также связаны с раком яичников. [40]
Несколько редких генетических нарушений связаны с определенными подтипами рака яичников. Синдром Пейтца-Егерса , редкое генетическое нарушение, также предрасполагает женщин к опухолям полового канатика с кольцевыми канальцами . [28] [26] Болезнь Олье и синдром Маффуччи связаны с опухолями из гранулезных клеток у детей и также могут быть связаны с опухолями Сертоли-Лейдига. Доброкачественные фибромы связаны с синдромом невоидной базальноклеточной карциномы . [26]
Потребление алкоголя , по-видимому, не связано с раком яичников. [31] [41]
Американское онкологическое общество рекомендует здоровый режим питания, включающий большое количество фруктов, овощей, цельного зерна и диету, которая избегает или ограничивает употребление красного и обработанного мяса и обработанного сахара. [42] Высокое потребление общих, насыщенных и трансжиров увеличивает риск рака яичников. [43] Обзор 2021 года показал, что потребление кофе, яиц и жиров значительно увеличивает риск рака яичников. [44] Существуют неоднозначные данные исследований риска рака яичников и потребления молочных продуктов . [45] [46]
В индустриально развитых странах, за исключением Японии, высокие показатели эпителиального рака яичников, что может быть связано с диетой в этих странах. Белые женщины подвержены на 30–40% более высокому риску рака яичников по сравнению с чернокожими и латиноамериканскими женщинами, вероятно, из-за социально-экономических факторов; белые женщины, как правило, имеют меньше детей и разные показатели гинекологических операций, которые влияют на риск рака яичников. [29]
Предварительные данные свидетельствуют о том, что тальк , пестициды и гербициды увеличивают риск рака яичников. [47] Американское онкологическое общество отмечает, что на данный момент ни одно исследование не смогло точно связать какое-либо отдельное химическое вещество в окружающей среде или в рационе человека напрямую с мутациями, вызывающими рак яичников. [48]
Другие исследованные факторы, такие как курение , низкий уровень витамина D в крови, [49] наличие включений кист яичников и инфицирование вирусом папилломы человека (причина некоторых случаев рака шейки матки ), были опровергнуты как факторы риска рака яичников. [28] [31] Канцерогенность промежностного талька является спорной, поскольку он может действовать как раздражитель, если он проходит через репродуктивный тракт к яичникам. [31] [29] [34] Исследования случай-контроль показали, что использование промежностного талька действительно увеличивает риск рака яичников, но более частое использование талька не создает большего риска. [31] Использование талька в других местах тела не связано с раком яичников. [34] Регулярное сидение в течение длительного времени связано с более высокой смертностью от эпителиального рака яичников. Риск не отменяется регулярными физическими упражнениями, хотя он и снижается. [50]
Повышенный возраст (до 70 лет) является фактором риска эпителиального рака яичников, поскольку больше мутаций в клетках могут накапливаться и в конечном итоге вызывать рак. Те, кому за 80, подвержены несколько меньшему риску. [29]
Курение табака связано с более высоким риском муцинозного рака яичников ; после прекращения курения риск в конечном итоге возвращается к норме. Более высокие уровни С-реактивного белка связаны с более высоким риском развития рака яичников. [31]
Подавление овуляции, которое в противном случае привело бы к повреждению эпителия яичников и, следовательно, воспалению , обычно является защитным. Этот эффект может быть достигнут за счет рождения детей , приема комбинированных оральных контрацептивов и грудного вскармливания , все из которых являются защитными факторами. [26] Более длительный период грудного вскармливания коррелирует с большим снижением риска рака яичников. [34] Каждое рождение снижает риск рака яичников больше, и этот эффект наблюдается при пяти родах. Комбинированные оральные контрацептивы снижают риск рака яичников до 50%, а защитный эффект комбинированных оральных контрацептивов может длиться 25–30 лет после их прекращения. [29] [34] Регулярный прием аспирина ( исследование MALOVA (MALignant OVArian cancer)) [51] [52] или ацетаминофена (парацетамола) может быть связан с более низким риском рака яичников; Другие НПВП , по-видимому, не оказывают подобного защитного эффекта. [31]
Перевязка маточных труб является защитной мерой, поскольку канцерогены не могут достичь яичника и фимбрии через влагалище, матку и фаллопиевы трубы. [26] Перевязка маточных труб также является защитной мерой у женщин с мутацией BRCA1, но не с мутацией BRCA2. [31] Гистерэктомия снижает риск, а удаление как маточных труб, так и яичников (двусторонняя сальпингоофорэктомия ) значительно снижает риск не только рака яичников, но и рака молочной железы. [28] Это все еще является темой исследований, поскольку связь между гистерэктомией и более низким риском рака яичников является спорной. Причины, по которым гистерэктомия может быть защитной мерой, не были выяснены по состоянию на 2015 год. [34]
Диета, включающая большое количество каротина , клетчатки и витаминов с низким содержанием жира, в частности, диета с некрахмалистыми овощами (например, брокколи и луком ), может быть защитной. [29] Пищевые волокна связаны со значительным снижением риска рака яичников. [53] Обзор 2021 года показал, что зеленые листовые овощи, овощи лука, клетчатка, флаваноиды и потребление зеленого чая могут значительно снизить риск рака яичников. [54]
Рак яичников образуется, когда происходят ошибки в нормальном росте клеток яичников . Обычно, когда клетки стареют или повреждаются, они умирают , и новые клетки занимают их место. Рак начинается, когда новые клетки образуются ненужными, а старые или поврежденные клетки не умирают так, как должны. Накопление дополнительных клеток часто образует массу ткани, называемую опухолью или опухолью яичников . Эти аномальные раковые клетки имеют множество генетических аномалий , которые заставляют их чрезмерно расти. [56] Когда яичник выпускает яйцеклетку , яйцеклетка лопается и становится желтым телом . Эту структуру необходимо восстановить путем деления клеток в яичнике. [34] Непрерывная овуляция в течение длительного времени означает большее восстановление яичника путем деления клеток, которые могут приобретать мутации при каждом делении. [29]
В целом, наиболее распространенные мутации генов при раке яичников происходят в NF1 , BRCA1, BRCA2 и CDK12 . Рак яичников I типа, который, как правило, менее агрессивен, как правило, имеет микросателлитную нестабильность в нескольких генах, включая как онкогены (в первую очередь BRAF и KRAS ), так и супрессоры опухолей (в первую очередь PTEN ). [28] Наиболее распространенными мутациями при раке I типа являются KRAS, BRAF, ERBB2, PTEN, PIK3CA и ARID1A. [31] Рак II типа, более агрессивный тип, имеет различные мутировавшие гены, включая p53 , BRCA1 и BRCA2 . [28] Рак низкой степени злокачественности, как правило, имеет мутации в KRAS, тогда как рак любой степени злокачественности, который развивается из опухолей с низким злокачественным потенциалом, как правило, имеет мутации в p53. [29] Рак типа I, как правило, развивается из предшествующих поражений, тогда как рак типа II может развиваться из серозной трубной интраэпителиальной карциномы. [31] Серозные раки , имеющие мутации BRCA, также неизбежно имеют мутации p53, что указывает на то, что удаление обоих функциональных генов важно для развития рака. [29]
В 50% случаев серозного рака высокой степени тяжести гомологичная рекомбинационная репарация ДНК дисфункциональна, как и сигнальные пути notch и FOXM1 . Они также почти всегда имеют мутации p53. Помимо этого, мутации в серозной карциноме высокой степени тяжести трудно охарактеризовать, за исключением их высокой степени геномной нестабильности . BRCA1 и BRCA2 необходимы для репарации ДНК гомологичной рекомбинации, и мутации зародышевой линии в этих генах обнаруживаются примерно у 15% женщин с раком яичников. [28] Наиболее распространенными мутациями в BRCA1 и BRCA2 являются мутации со сдвигом рамки считывания , которые возникли в небольшой популяции основателей -ашкенази. [29]
Почти 100% редких муцинозных карцином имеют мутации в KRAS и амплификации ERBB2 (также известного как Her2/neu ). [28] В целом, 20% случаев рака яичников имеют мутации в Her2/neu . [26]
Серозные карциномы могут развиваться из серозной трубной интраэпителиальной карциномы, а не развиваться спонтанно из ткани яичника. Другие карциномы развиваются из кортикальных кист включения, которые представляют собой группы эпителиальных клеток яичника внутри стромы . [29]


Диагностика рака яичников начинается с физического осмотра (включая тазовый осмотр ), анализа крови (на CA-125 и иногда другие маркеры) и трансвагинального ультразвукового исследования . [26] [57] Иногда ректовагинальное исследование используется для планирования операции. [29] Диагноз должен быть подтвержден хирургическим вмешательством для осмотра брюшной полости , взятия биопсии (образцов тканей для микроскопического анализа ) и поиска раковых клеток в брюшной жидкости. Это помогает определить, является ли опухоль яичника доброкачественной или злокачественной. [26]
Ранние стадии рака яичников (I/II) трудно диагностировать, поскольку большинство симптомов неспецифичны и, таким образом, малопригодны для диагностики; в результате, он редко диагностируется, пока не распространится и не перейдет на более поздние стадии (III/IV). [58] Кроме того, симптомы рака яичников могут показаться похожими на синдром раздраженного кишечника . У женщин, у которых возможна беременность, уровень BHCG может быть измерен в процессе диагностики. Сывороточный альфа-фетопротеин , нейрон-специфическую энолазу и лактатдегидрогеназу можно измерить у молодых девушек и подростков с подозрением на опухоли яичников , поскольку у молодых женщин с раком яичников более вероятно наличие злокачественных опухолей зародышевых клеток. [26] [31]
Физическое обследование, включая тазовое обследование, и ультразвуковое исследование органов малого таза (трансвагинальное или иное) необходимы для диагностики: физическое обследование может выявить увеличенный объем живота и/или асцит (жидкость в брюшной полости), в то время как тазовое обследование может выявить опухоль яичников или брюшной полости. [28] Масса придатков является важным признаком, который часто указывает на рак яичников, особенно если она фиксированная, узловатая, нерегулярная, твердая и/или двусторонняя. 13–21% масс придатков вызваны злокачественными новообразованиями; Однако существуют и другие доброкачественные причины придаточных масс, включая фолликулярную кисту яичника , лейомиому , эндометриоз , внематочную беременность , гидросальпинкс , тубоовариальный абсцесс, перекрут яичника , дермоидную кисту , цистаденому (серозную или муцинозную), дивертикулярный или аппендикулярный абсцесс, опухоль оболочки нерва , тазовую почку , дивертикул мочеточника или мочевого пузыря , доброкачественную кистозную мезотелиому брюшины, туберкулез брюшины или параовариальную кисту . Яичники, которые можно прощупать, также являются признаком рака яичников у женщин в постменопаузе. Другие части физического обследования при подозрении на рак яичников могут включать обследование груди и пальцевое ректальное исследование . Пальпация надключичных , подмышечных и паховых лимфатических узлов может выявить лимфаденопатию , которая может указывать на метастазы. Другим показателем может быть наличие плеврального выпота , который можно заметить при аускультации . [31]
Когда злокачественное новообразование яичников включено в список диагностических возможностей, показано ограниченное количество лабораторных тестов. Обычно проводится общий анализ крови и анализ сывороточных электролитов; [59] когда присутствует рак яичников, эти тесты часто показывают высокое количество тромбоцитов (20–25% пациентов) и низкий уровень натрия в крови из-за химических сигналов, выделяемых опухолью. [29] Положительный тест на ингибин А и ингибин В может указывать на опухоль из гранулезных клеток. [31]
Анализ крови на маркерную молекулу, называемую CA-125, полезен для дифференциальной диагностики и наблюдения за заболеванием, но сам по себе он не показал себя эффективным методом скрининга рака яичников на ранней стадии из-за его неприемлемо низкой чувствительности и специфичности. [59] Уровни CA-125 у женщин в пременопаузе более 200 Ед/мл могут указывать на рак яичников, как и любое повышение уровня CA-125 выше 35 Ед/мл у женщин в постменопаузе. Уровни CA-125 не являются точными при ранней стадии рака яичников, так как у половины пациентов с раком яичников I стадии уровень CA-125 нормальный. [31] [29] CA-125 также может быть повышен при доброкачественных (нераковых) состояниях, включая эндометриоз , беременность , фибромиому матки , менструацию , кисты яичников , системную красную волчанку , заболевания печени , воспалительные заболевания кишечника , воспалительные заболевания органов малого таза и лейомиому . [31] [60] HE4 является еще одним кандидатом для тестирования на рак яичников, хотя он не был широко исследован. Другие опухолевые маркеры рака яичников включают CA19-9 , CA72-4, CA15-3 , иммуносупрессивный кислый белок, гаптоглобин-альфа, OVX1, мезотелин , лизофосфатидную кислоту , остеопонтин и фактор роста фибробластов 23. [ 31]
Использование панелей анализа крови может помочь в диагностике. [31] [59] Панель OVA1 включает CA-125, бета-2 микроглобулин , трансферрин , аполипопротеин A1 и транстиретин . OVA1 выше 5,0 у женщин в пременопаузе и 4,4 у женщин в постменопаузе указывает на высокий риск рака. [29] Другой набор лабораторных тестов используется для обнаружения опухолей стромы полового тяжа. Высокие уровни тестостерона или дегидроэпиандростерона сульфата в сочетании с другими симптомами и высокими уровнями ингибина A и ингибина B могут указывать на SCST любого типа. [32]
Текущие исследования изучают способы рассмотрения протеомики опухолевых маркеров в сочетании с другими показателями заболевания (например, рентгенологией и/или симптомами) для повышения точности диагностики. Проблема такого подхода заключается в том, что неравномерная распространенность рака яичников означает, что даже тестирование с очень высокой чувствительностью и специфичностью все равно приведет к ряду ложноположительных результатов, что, в свою очередь, может привести к таким проблемам, как выполнение хирургических процедур, при которых рак не обнаруживается интраоперационно. [ необходима цитата ] Геномные подходы еще не разработаны для рака яичников. [31]
КТ-сканирование предпочтительнее для оценки степени опухоли в брюшно-тазовой полости, хотя также можно использовать магнитно-резонансную томографию . [28] КТ-сканирование также может быть полезно для обнаружения спекания сальника или дифференциации жидкости от солидной опухоли в брюшной полости, особенно при опухолях с низким злокачественным потенциалом. Однако оно может не обнаружить меньшие опухоли. Иногда рентген грудной клетки используется для обнаружения метастазов в грудной клетке или плеврального выпота . Другим тестом на метастатическое заболевание, хотя и нечасто используемым, является бариевая клизма , которая может показать, вовлечена ли в заболевание ректосигмоидная кишка. Позитронно-эмиссионная томография , сканирование костей и парацентез имеют ограниченное применение; на самом деле парацентез может вызвать образование метастазов в месте введения иглы и может не дать полезных результатов. [29] Однако парацентез можно использовать в случаях, когда нет тазовой массы, а асцит все еще присутствует. [29] Врач, подозревающий рак яичников, может также выполнить маммографию или биопсию эндометрия (в случае аномального кровотечения), чтобы оценить вероятность злокачественных новообразований молочной железы и эндометрия соответственно. Вагинальное УЗИ часто является первым визуальным исследованием, проводимым при обнаружении придаточной массы. Несколько характеристик придаточной массы указывают на злокачественность яичников; они обычно твердые, нерегулярные, многокамерные и/или большие; и они обычно имеют папиллярные особенности, центральные сосуды и/или нерегулярные внутренние перегородки. [31] Однако SCST не имеет определенных характеристик при рентгенологическом исследовании. [32]
Для окончательной диагностики рака яичников требуется хирургическая процедура для осмотра брюшной полости. Это может быть открытая процедура ( лапаротомия , разрез через брюшную стенку ) или операция через замочную скважину ( лапароскопия ). Во время этой процедуры подозрительная ткань удаляется и отправляется на микроскопический анализ . Обычно это включает в себя одностороннюю сальпингоофорэктомию , удаление одного пораженного яичника и фаллопиевой трубы. Жидкость из брюшной полости также может быть проанализирована на наличие раковых клеток . Если рак обнаружен, эта процедура также может быть использована для определения степени его распространения (что является формой стадирования опухоли ). [26]
Пафолацианин показан к применению у взрослых с раком яичников для выявления раковых поражений во время операции. [61] Это диагностическое средство, которое вводится в виде внутривенной инъекции перед операцией. [61]
Широко признанным методом оценки риска злокачественного рака яичников является индекс риска злокачественности (ИРМ), рассчитываемый на основе первоначального обследования . [28] [62] Индекс ИРМ более 200 или 250 обычно считается показателем высокого риска рака яичников. [28] [31]
RMI рассчитывается следующим образом:
Для определения ультразвукового показателя и показателя менопаузы можно использовать два метода, при этом полученные результаты обозначаются как RMI 1 и RMI 2 соответственно, в зависимости от используемого метода.
Другим методом количественной оценки риска рака яичников является алгоритм риска рака яичников (ROCA), который наблюдает за уровнями с течением времени и определяет, достаточно ли быстро они увеличиваются, чтобы оправдать трансвагинальное ультразвуковое исследование. [29] Алгоритм риска злокачественности яичников использует уровни CA-125 и уровни HE4 для расчета риска рака яичников; он может быть более эффективным, чем RMI. Модели IOTA можно использовать для оценки вероятности того, что опухоль придатков является злокачественной. [64] Они включают модель риска LR2, расчет риска по простым правилам (SRrisk) и модель оценки различных неоплазий в придатках (ADNEX), которая может использоваться для оценки риска злокачественности в массе придатков на основе ее характеристик и факторов риска. Алгоритм QCancer (Ovary) используется для прогнозирования вероятности рака яичников на основе факторов риска. [31]
Система отчетности и данных о яичниках и придатках (ORADS) — это стандартизированная система, разработанная Американским колледжем радиологии для улучшения управления и диагностики масс яичников и придатков. Она обеспечивает последовательную структуру для интерпретации результатов визуализации, в частности, ультразвукового исследования, и назначает категории стратификации риска, которые направляют принятие клинических решений. Используя четкий набор критериев и терминологии, ORADS стремится улучшить коммуникацию между поставщиками медицинских услуг, повысить точность диагностики и в конечном итоге улучшить результаты лечения пациентов при оценке патологий яичников и придатков. Кроме того, доступен специализированный калькулятор ORADS для упрощения отчетности, помогая рентгенологам и клиницистам быстро и точно классифицировать результаты в соответствии с руководящими принципами системы. [65]

Рак яичников классифицируется в соответствии с микроскопическим видом их структур ( гистология или гистопатология ). Гистология диктует многие аспекты клинического лечения, управления и прогноза . Общая патология рака яичников очень похожа независимо от гистологического типа: опухоли яичников имеют солидные и кистозные массы. [29] Согласно SEER , типы рака яичников у женщин в возрасте 20 лет и старше следующие: [66]
Рак яичников гистологически и генетически делится на тип I или тип II. Рак типа I имеет низкую гистологическую степень и включает эндометриоидную, муцинозную и светлоклеточную карциному. Рак типа II имеет более высокую гистологическую степень и включает серозную карциному и карциносаркому. [28]

Эпителиальный рак яичников обычно проявляется на поздней стадии и возникает в результате злокачественной трансформации эпителия поверхности яичников, брюшины или маточной трубы. [67] Это самая частая причина смерти от гинекологического рака. [67] Существуют различные типы эпителиального рака яичников, включая серозную опухоль, эндометриоидную опухоль, светлоклеточную опухоль, муцинозную опухоль и недифференцированные или неклассифицированные опухоли. [68] Ежегодно во всем мире диагностируется 230 000 женщин, и 150 000 умирают. [69] Его 5-летняя выживаемость после постановки диагноза составляет 46% из-за поздней стадии заболевания на момент постановки диагноза. [69] Обычно около 75% пациентов диагностируются как имеющие поздную стадию заболевания из-за бессимптомного характера его проявления. [69] Существует геномная предрасположенность к эпителиальному раку яичников, и было обнаружено, что гены BRCA1 и BRCA2 являются причинными генами в 65–75% случаев наследственного эпителиального рака яичников. [69]
.jpg/440px-Serous_carcinoma_(3061775966).jpg)
Серозный рак яичников является наиболее распространенным типом эпителиального рака яичников и составляет около двух третей случаев эпителиального рака яичников. [28] Серозная карцинома низкой степени злокачественности менее агрессивна, чем серозная карцинома высокой степени злокачественности, хотя она обычно плохо поддается химиотерапии или гормональному лечению. [28] Считается, что серозная карцинома начинается в фаллопиевой трубе . [70] [71] Серозная карцинома высокой степени злокачественности составляет 75% всего эпителиального рака яичников. [69] Около 15–20% серозной карциномы высокой степени злокачественности имеют мутации BRCA1 и BRCA2 зародышевой линии. [69] Гистологически характер роста серозной карциномы высокой степени злокачественности является гетерогенным и имеет некоторые папиллярные или солидные паттерны роста. [69] Опухолевые клетки атипичны с большими, нерегулярными ядрами. [69] Он имеет высокую скорость пролиферации. [69] В 50% случаев серозные карциномы являются двусторонними, и в 85% случаев они распространились за пределы яичника на момент постановки диагноза. [72]
Серозная трубная интраэпителиальная карцинома (STIC) в настоящее время считается предшественником большинства так называемых серозных карцином яичников высокой степени злокачественности. [72] STIC характеризуется

Мелкоклеточная карцинома яичников встречается редко и агрессивно, имеет два основных подтипа: гиперкальциемический и легочный. [73] Эта редкая злокачественная опухоль чаще всего поражает молодых женщин в возрасте от 14 месяцев до 58 лет. [73] Средний возраст постановки диагноза составляет 24 года. [73] Примерно у двух третей пациентов наблюдается паранеопластическая гиперкальциемия, что означает, что у них высокий уровень кальция в крови по неизвестной причине. [73] [74] Опухоль секретирует белок, связанный с паратиреоидным гормоном, который действует аналогично ПТГ и связывает рецепторы ПТГ в костях и почках, вызывая гиперкальциемию. [73] Недавние исследования обнаружили инактивирующую зародышевую и соматическую мутацию гена SMARCA4 . [73] [75] Гиперкальциемический подтип очень агрессивен и имеет общую выживаемость 16% с частотой рецидивов 65% у пациентов, получающих лечение. [73] Пациенты, у которых болезнь распространилась на другие части тела, как правило, умирают через 2 года после постановки диагноза. [73] Распространение за пределы яичников наблюдается в 50% случаев, а распространение на лимфатические узлы — в 55% случаев. [74] Наиболее распространенным начальным проявлением является быстрорастущая односторонняя тазовая масса со средним размером 15 см. [73] Гистологически она характеризуется множеством пластов мелких, круглых, плотно упакованных клеток с кластерами, гнездами и тяжами. [73] [74] Иммуногистохимия обычно положительна на виментин, цитокератин, CD10, p53 и WT-1. [73] [75]
Мелкоклеточная карцинома яичников легочного подтипа проявляется иначе, чем гиперкальциемический подтип. [73] Как правило, мелкоклеточная карцинома яичников легких обычно поражает оба яичника у пожилых женщин и выглядит как овсяноклеточная карцинома легких . [29] Средний возраст начала заболевания составляет 59 лет, и приблизительно 45% случаев являются двусторонними для легочного подтипа. [73] Кроме того, при легочном подтипе может быть повышен уровень нескольких гормонов, включая серотонин, соматостатин, инсулин, гастрин и кальцитонин. [73]
Первичные перитонеальные карциномы развиваются из брюшины , мембраны, которая покрывает брюшную полость и имеет то же эмбриональное происхождение, что и яичник. Их часто обсуждают и классифицируют с раком яичников, когда они поражают яичник. [70] [76] Они могут развиваться даже после удаления яичников и могут выглядеть как мезотелиома . [29]

Яичниковая светлоклеточная карцинома является редким подтипом эпителиального рака яичников. Пациенты с диагнозом яичниковая светлоклеточная карцинома обычно моложе в возрасте постановки диагноза и диагностируются на более ранних стадиях, чем другие подтипы эпителиального рака яичников. [77] [78] Самая высокая заболеваемость светлоклеточной карциномой яичников наблюдается среди молодых азиатских женщин, особенно кореянок, тайваньцев и японок. [77] [78] Эндометриоз связывают с тем, что он является основным фактором риска развития светлоклеточной карциномы яичников, и, как было обнаружено, присутствует у 50% женщин с диагнозом светлоклеточная карцинома яичников. [77] Сообщается, что развитие тромбов в ногах, таких как тромбоэмболия глубоких вен, или в легких с тромбоэмболией легочной артерии, на 40% выше у пациенток с светлоклеточной карциномой, чем с другими подтипами эпителиального рака яичников. [78] Было обнаружено, что мутации в молекулярных путях, таких как ARID1A, PIK3 и PIK3CA, связаны с прозрачноклеточной карциномой. [77] [78] Обычно они представляют собой большую одностороннюю массу со средним размером от 13 до 15 см. [77] 90% случаев являются односторонними. [77] Прозрачноклеточная карцинома яичников обычно плохо поддается химиотерапии из-за внутренней химиорезистентности, поэтому лечение обычно заключается в агрессивной циторедуктивной хирургии и химиотерапии на основе платины. [28] [77]

Светлоклеточные аденокарциномы гистопатологически похожи на другие светлоклеточные карциномы , с прозрачными клетками и клетками типа «сапожных гвоздей» . Они составляют примерно 5–10% эпителиальных раков яичников и связаны с эндометриозом в полости таза. Они, как правило, находятся на ранней стадии и, следовательно, излечиваются хирургическим путем, но прогрессирующие светлоклеточные аденокарциномы (примерно 20%) имеют плохой прогноз и часто устойчивы к платиновой химиотерапии. [29]
Эндометриоидные аденокарциномы составляют приблизительно 13–15% всех случаев рака яичников. [79] Поскольку они обычно являются низкозлокачественными, эндометриоидные аденокарциномы имеют хороший прогноз. [79] Средний возраст постановки диагноза составляет около 53 лет. [79] Эти опухоли часто встречаются вместе с эндометриозом или раком эндометрия. [29] [79] Уровни ракового антигена 125 обычно повышены, и семейный анамнез родственника первой степени с эндометриоидным раком яичников связан с повышенным риском развития эндометриоидного рака яичников. [79] Средний размер опухоли составляет более 10 см. [79]
Смешанные мюллеровы опухоли составляют менее 1% рака яичников. Они имеют видимые эпителиальные и мезенхимальные клетки и, как правило, имеют плохой прогноз. [29]
Муцинозные опухоли включают муцинозную аденокарциному и муцинозную цистаденокарциному. [29]
Муцинозные аденокарциномы составляют 5–10% эпителиальных раков яичников. Гистологически они похожи на аденокарциномы кишечника или шейки матки и часто являются метастазами рака аппендикса или толстой кишки . Прогрессирующие муцинозные аденокарциномы имеют плохой прогноз, как правило, хуже, чем серозные опухоли, и часто устойчивы к платиновой химиотерапии, хотя они редки. [29]

Pseudomyxoma peritonei относится к скоплению инкапсулированной слизи или желатинозного материала в брюшно-тазовой полости, что очень редко вызывается первичной муцинозной опухолью яичников. Чаще всего это связано с метастазами рака кишечника в яичники. [29]
Недифференцированные раковые опухоли — те, где невозможно определить тип клеток — составляют около 10% эпителиальных раковых опухолей яичников и имеют сравнительно плохой прогноз. [29] [70] При исследовании под микроскопом эти опухоли имеют очень аномальные клетки, которые расположены в скоплениях или пластах. Обычно внутри опухоли имеются узнаваемые скопления серозных клеток. [29]

Злокачественные опухоли Бреннера встречаются редко. Гистологически они имеют плотную фиброзную строму с участками переходного эпителия и некоторой плоскоклеточной дифференцировкой. Чтобы классифицироваться как злокачественная опухоль Бреннера, она должна иметь очаги опухоли Бреннера и переходно-клеточную карциному. Компонент переходно-клеточной карциномы обычно плохо дифференцирован и напоминает рак мочевыводящих путей. [29]
Переходно-клеточные карциномы составляют менее 5% случаев рака яичников. Гистологически они выглядят похожими на карциному мочевого пузыря . Прогноз промежуточный — лучше, чем у большинства эпителиальных раков, но хуже, чем у злокачественных опухолей Бреннера. [29]
Опухоль стромы полового канатика , включая опухоль гранулезных клеток , продуцирующих эстроген , доброкачественную текому и вирилизирующую опухоль клеток Сертоли-Лейдига или арренобластому , составляет 7% случаев рака яичников. Чаще всего они встречаются у женщин в возрасте от 50 до 69 лет, но могут встречаться у женщин любого возраста, включая молодых девушек. Обычно они не агрессивны и, как правило, односторонние; [26] поэтому их обычно лечат только хирургическим путем. Опухоли стромы полового канатика являются основными гормонопродуцирующими опухолями яичников. [32]
Несколько различных клеток из мезенхимы могут дать начало опухолям полового тяжа или стромальным опухолям. К ним относятся фибробласты и эндокринные клетки. Симптомы опухолей полового тяжа или стромальных опухолей яичников могут отличаться от других типов рака яичников. Общие признаки и симптомы включают перекрут яичника , кровотечение из опухоли или ее разрыв, брюшную массу и гормональные нарушения. У детей может наблюдаться изосексуальное преждевременное псевдопубертатное развитие при опухолях из гранулезных клеток, поскольку они вырабатывают эстроген. Эти опухоли вызывают нарушения менструального цикла ( чрезмерное кровотечение , редкие менструации или отсутствие менструаций ) или постменопаузальное кровотечение. Поскольку эти опухоли вырабатывают эстроген, они могут вызывать или возникать одновременно с раком эндометрия или раком молочной железы . Другие опухоли полового тяжа/стромальные опухоли проявляются отчетливыми симптомами. Опухоли из клеток Сертоли-Лейдига вызывают вирилизацию и чрезмерный рост волос из-за выработки тестостерона и андростендиона , что также может вызывать синдром Кушинга в редких случаях. Также встречаются стромальные опухоли полового канатика, которые не вызывают гормонального дисбаланса, включая доброкачественные фибромы, которые вызывают асцит и гидроторакс . [26] При опухолях из зародышевых клеток стромальные опухоли полового канатика являются наиболее распространенным раком яичников, диагностируемым у женщин моложе 20 лет. [32]
Гранулезоклеточные опухоли являются наиболее распространенными опухолями стромы полового тяжа, составляя 70% случаев, и делятся на два гистологических подтипа: гранулезоклеточные опухоли взрослых, которые развиваются у женщин старше 50 лет, и ювенильные гранулезоклеточные опухоли, которые развиваются до полового созревания или до 30 лет. Оба типа развиваются в фолликуле яичника из популяции клеток, которая окружает зародышевые клетки. [32]
Гранулезоклеточные опухоли у взрослых характеризуются более поздним началом (30+ лет, в среднем 50). Эти опухоли вырабатывают высокие уровни эстрогена, что вызывает их характерные симптомы: менометроррагию ; гиперплазию эндометрия ; болезненные , увеличенные груди ; постменопаузальное кровотечение ; и вторичную аменорею . Масса опухоли может вызывать другие симптомы, включая боль в животе и вздутие или симптомы, похожие на внематочную беременность, если опухоль кровоточит и разрывается. [32]
Опухоли Сертоли-Лейдига чаще всего встречаются у женщин в возрасте до 30 лет, и особенно часто встречаются до наступления половой зрелости. [32]
Склерозирующие стромальные опухоли обычно возникают у девочек до полового созревания или у женщин до 30 лет. [32]
Герминогенные опухоли яичников развиваются из герминогенных клеток яичников . [70] Герминогенные опухоли составляют около 30% опухолей яичников, но только 5% случаев рака яичников, поскольку большинство герминогенных опухолей являются тератомами , а большинство тератом являются доброкачественными. Злокачественные тератомы, как правило, возникают у пожилых женщин, когда один из зародышевых слоев опухоли развивается в плоскоклеточную карциному . [26] Герминогенные опухоли, как правило, возникают у молодых женщин (20–30 лет) и девочек, составляя 70% случаев рака яичников, наблюдаемых в этой возрастной группе. [33] Герминогенные опухоли могут включать дисгерминомы, тератомы, опухоли желточного мешка/опухоли эндодермального синуса и хориокарциномы, когда они возникают в яичнике. Некоторые опухоли зародышевых клеток имеют изохромосому 12, где одно плечо хромосомы 12 удалено и заменено дубликатом другого. [26] Большинство раковых заболеваний зародышевых клеток имеют лучший прогноз, чем другие подтипы, и более чувствительны к химиотерапии. Они с большей вероятностью будут на стадии I при постановке диагноза. [32] В целом, они метастазируют чаще, чем эпителиальный рак яичников. Кроме того, используемые маркеры рака различаются в зависимости от типа опухоли: хориокарциномы контролируются с помощью бета-ХГЧ , а опухоли эндодермального синуса — с помощью альфа-фетопротеина . [26]
Герминогенные опухоли обычно обнаруживаются, когда они становятся большими, пальпируемыми массами. Однако, как и опухоли полового канатика, они могут вызывать перекрут яичников или кровоизлияние, а у детей — изосексуальное преждевременное половое созревание. Они часто метастазируют в близлежащие лимфатические узлы, особенно парааортальные и тазовые лимфатические узлы. [26] Наиболее распространенным симптомом герминогенных опухолей является подострая боль в животе, вызванная кровотечением опухоли, некротизацией или растяжением капсулы яичника. Если опухоль разрывается, вызывает значительное кровотечение или перекручивает яичник, это может вызвать острую боль в животе , которая возникает менее чем у 10% пациентов с герминогенными опухолями. Они также могут секретировать гормоны, которые изменяют менструальный цикл . В 25% герминогенных опухолей рак обнаруживается во время планового обследования и не вызывает симптомов. [32]
Диагностика опухолей зародышевых клеток может быть затруднена, поскольку нормальный менструальный цикл и половое созревание могут вызывать боль и тазовые симптомы, и молодая женщина может даже считать эти симптомы симптомами беременности и не обращаться за лечением из-за стигмы подростковой беременности . Анализы крови на альфа-фетопротеин, кариотип , хорионический гонадотропин человека и функцию печени используются для диагностики опухоли зародышевых клеток и потенциальной сопутствующей дисгенезии гонад. Опухоль зародышевых клеток может быть изначально ошибочно принята за доброкачественную кисту яичника . [32]

Дисгерминома составляет 35% случаев рака яичников у молодых женщин и является наиболее вероятной опухолью зародышевых клеток, метастазирующей в лимфатические узлы; метастазы в лимфоузлы возникают в 25–30% случаев. [33] [32] Эти опухоли могут иметь мутации в гене KIT , мутации, известной своей ролью в желудочно-кишечной стромальной опухоли . Люди с кариотипом XY и яичниками ( дисгенезия гонад ) или кариотипом X,0 и яичниками ( синдром Тернера ), у которых развивается односторонняя дисгерминома, подвержены риску гонадобластомы в другом яичнике, и в этом случае оба яичника обычно удаляют, когда обнаруживается односторонняя дисгерминома, чтобы избежать риска возникновения другой злокачественной опухоли. Гонадобластомы у людей с синдромом Суайера или Тернера становятся злокачественными примерно в 40% случаев. Однако в целом дисгерминомы бывают двусторонними в 10–20% случаев. [26] [32]

Они состоят из клеток, которые не могут дифференцироваться дальше и развиваются непосредственно из половых клеток или из гонадобластом. Дисгерминомы содержат синцитиотрофобласты примерно в 5% случаев и, следовательно, могут вызывать повышенный уровень ХГЧ. На макроскопическом уровне дисгерминомы обычно имеют цвет от розового до желтовато-коричневого, имеют несколько долей и являются твердыми. Микроскопически они выглядят идентичными семиномам и очень близки к эмбриональным первичным половым клеткам , имея большие, многогранные, округлые прозрачные клетки . Ядра однородные и круглые или квадратные с выступающими ядрышками , а цитоплазма имеет высокий уровень гликогена . Воспаление является еще одной заметной гистологической особенностью дисгермином. [32]
Хориокарцинома может возникнуть как первичная опухоль яичников, развивающаяся из зародышевой клетки, хотя обычно это гестационная болезнь, которая метастазирует в яичник. Первичная хориокарцинома яичников имеет плохой прогноз и может возникнуть без беременности. Они производят высокие уровни ХГЧ и могут вызвать раннее половое созревание у детей или менометроррагию (нерегулярные, обильные менструации) после менархе. [32]
.jpg/440px-Mature_Cystic_Teratoma_of_the_Ovary_(5560431170).jpg)
Незрелые, или твердые, тератомы являются наиболее распространенным типом опухолей яичников из зародышевых клеток, составляя 40–50% случаев. Тератомы характеризуются наличием дезорганизованных тканей, возникающих из всех трех эмбриональных зародышевых слоев : эктодермы , мезодермы и энтодермы ; незрелые тератомы также имеют недифференцированные стволовые клетки , что делает их более злокачественными, чем зрелые тератомы (дермоидные кисты). Различные ткани видны при макроскопической патологии и часто включают кости, хрящи, волосы, слизь или кожное сало , но эти ткани не видны снаружи, которая выглядит как твердая масса с долями и кистами. Гистологически они имеют большое количество нейроэктодермы, организованной в листы и трубочки вместе с глией ; количество нервной ткани определяет гистологическую степень. Незрелые тератомы обычно поражают только один яичник (10% сочетаются с дермоидными кистами) и обычно метастазируют по всей брюшине. Они также могут вызывать рост зрелых имплантатов тератомы по всему животу при заболевании, называемом синдромом растущей тератомы ; они обычно доброкачественные, но продолжают расти во время химиотерапии и часто требуют дальнейшего хирургического вмешательства. В отличие от зрелых тератом, незрелые тератомы образуют много спаек , что делает их менее склонными вызывать перекрут яичников. Специфического маркера для незрелых тератом нет, но карциноэмбриональный антиген (CEA), CA-125, CA19-9 или AFP иногда могут указывать на незрелую тератому. [32]
Тератомы I стадии составляют большинство (75%) случаев и имеют наилучший прогноз: 98% пациентов выживают в течение пяти лет; если опухоль I стадии также имеет степень 1, ее можно лечить только односторонней хирургией. Опухоли II–IV стадии составляют оставшуюся четверть случаев и имеют худший прогноз: 73–88% пациентов выживают в течение пяти лет. [32]
Зрелые тератомы, или дермоидные кисты, являются редкими опухолями, состоящими в основном из доброкачественной ткани, которые развиваются после менопаузы. Опухоли состоят из дезорганизованной ткани с узелками злокачественной ткани, которые могут быть разных типов. Наиболее распространенной злокачественной опухолью является плоскоклеточный рак , но аденокарцинома , базальноклеточный рак , карциноидная опухоль , нейроэктодермальная опухоль , злокачественная меланома , саркома , сальная опухоль и struma ovarii также могут быть частью дермоидной кисты. Их лечат хирургическим путем и адъювантной платиновой химиотерапией или лучевой терапией. [32]
Опухоли желточного мешка , ранее называвшиеся опухолями эндодермального синуса, составляют примерно 10–20% злокачественных опухолей зародышевых клеток яичников и имеют наихудший прогноз из всех опухолей зародышевых клеток яичников . Они возникают как до менархе (в одной трети случаев), так и после менархе (остальные две трети случаев). У половины людей с опухолями желточного мешка диагностируется стадия I. Как правило, они являются односторонними до метастазов, которые возникают в брюшной полости и через кровоток в легкие. Опухоли желточного мешка быстро растут и легко рецидивируют, и их нелегко лечить после рецидива. Опухоли желточного мешка стадии I хорошо поддаются лечению, с 5-летней безрецидивной выживаемостью 93%, но опухоли стадии II-IV хуже поддаются лечению, с выживаемостью 64–91%. [32]
Их внешний вид твердый, рыхлый и желтый, с некротическими и геморрагическими участками. Они также часто содержат кисты, которые могут дегенерировать или разорваться. Гистологически опухоли желточного мешка характеризуются наличием телец Шиллера-Дюваля (которые являются патогномоничными для опухолей желточного мешка) и ретикулярным рисунком. Опухоли желточного мешка обычно секретируют альфа-фетопротеин и могут быть иммуногистохимически окрашены на его наличие; уровень альфа-фетопротеина в крови является полезным маркером рецидива. [32]
Эмбриональные карциномы, редкий тип опухоли, обычно встречающийся в смешанных опухолях, развиваются непосредственно из зародышевых клеток, но не являются окончательно дифференцированными; в редких случаях они могут развиваться в дисгенетических гонадах. Они могут далее развиваться в ряд других новообразований, включая хориокарциному, опухоль желточного мешка и тератому. Они возникают у молодых людей, средний возраст постановки диагноза составляет 14 лет, и секретируют как альфа-фетопротеин (в 75% случаев), так и ХГЧ. [32]
Гистологически эмбриональная карцинома похожа на эмбриональный диск , состоящий из эпителиальных анапластических клеток в неорганизованных пластах, с железоподобными пространствами и папиллярными структурами. [32]
Полиэмбриомы, наиболее незрелая форма тератомы и очень редкие опухоли яичников, гистологически характеризуются наличием нескольких эмбрионоподобных тел со структурами, напоминающими зародышевый диск, желточный мешок и амниотический мешок . Гигантские клетки синцитиотрофобласта также встречаются в полиэмбриомах. [32]
Первичные плоскоклеточные карциномы яичников встречаются редко и имеют плохой прогноз при прогрессировании. Чаще всего плоскоклеточные карциномы яичников являются метастазами шейки матки, областями дифференциации в эндометриоидной опухоли или происходят из зрелой тератомы. [29]
Смешанные опухоли содержат элементы более чем одного из вышеперечисленных классов гистологии опухолей. Чтобы классифицироваться как смешанная опухоль, минорный тип должен составлять более 10% опухоли. [31] Хотя смешанные карциномы могут иметь любую комбинацию типов клеток, смешанные раки яичников обычно серозные/эндометриоидные или светлоклеточные/эндометриоидные. [29] Смешанные герминогенные опухоли составляют приблизительно 25–30% всех герминогенных раков яичников с комбинациями дисгерминомы, опухоли желточного мешка и/или незрелой тератомы. Прогноз и лечение различаются в зависимости от типов клеток-компонентов. [32]
Рак яичников также может быть вторичным раком, результатом метастазирования первичного рака в другом месте тела. [26] Около 5–30% случаев рака яичников вызваны метастазами, в то время как остальные являются первичными раками. [80] Распространенными первичными раками являются рак молочной железы , рак толстой кишки , рак аппендикса и рак желудка (первичный рак желудка, который метастазирует в яичник, называется опухолями Крукенберга ). [26] Опухоли Крукенберга имеют перстневидные клетки и муцинозные клетки. [29] Рак эндометрия и лимфомы также могут метастазировать в яичник. [81]
Пограничные опухоли яичников , иногда называемые опухолями яичников с низким злокачественным потенциалом (LMP), имеют некоторые доброкачественные и некоторые злокачественные признаки. [29] Опухоли LMP составляют приблизительно 10–15% всех опухолей яичников. [31] [70] Они развиваются раньше, чем эпителиальный рак яичников, примерно в возрасте 40–49 лет. Обычно они не имеют обширной инвазии; 10% опухолей LMP имеют области стромальной микроинвазии (<3 мм, <5% опухоли). Опухоли LMP имеют другие аномальные признаки, включая повышенный митоз, изменения размера клеток или размера ядра , аномальные ядра , стратификацию клеток и небольшие выступы на клетках (папиллярные выступы). Серозные и/или муцинозные характеристики можно увидеть при гистологическом исследовании, и серозная гистология составляет подавляющее большинство распространенных опухолей LMP. Более 80% опухолей LMP находятся на стадии I; 15% имеют стадию II и III и менее 5% имеют стадию IV. [29] Имплантация опухолей LMP часто неинвазивна. [70]
Рак яичников стадируется с использованием системы стадирования FIGO и использует информацию, полученную после операции, которая может включать полную абдоминальную гистерэктомию через срединную лапаротомию , удаление (обычно) обоих яичников и маточных труб , (обычно) сальника , тазовых (перитонеальных) промываний , оценку забрюшинных лимфатических узлов (включая тазовые и парааортальные лимфатические узлы ), аппендэктомию при подозрении на муцинозные опухоли и тазовую/перитонеальную биопсию для цитопатологии . [28] [26] [31] [82] Около 30% случаев рака яичников, которые кажутся ограниченными яичником, имеют микроскопические метастазы, поэтому даже рак стадии I должен быть полностью стадирован. [26] У 22% случаев рака, предположительно относящихся к стадии I, наблюдаются лимфатические метастазы. [31] Стадия AJCC такая же, как и стадия FIGO. Система стадирования AJCC описывает распространенность первичной опухоли (T), отсутствие или наличие метастазов в близлежащие лимфатические узлы (N) и отсутствие или наличие отдаленных метастазов (M). [83] Наиболее распространенной стадией при диагностике является стадия IIIc, на которую приходится более 70% диагнозов. [26]

Система стадирования AJCC/TNM указывает, где развилась опухоль, распространилась на лимфатические узлы и появились метастазы. [31]
Стадии AJCC/TNM можно соотнести со стадиями FIGO: [31]
Опухоли 1-й степени имеют хорошо дифференцированные клетки (выглядят очень похоже на нормальную ткань) и являются опухолями с наилучшим прогнозом. Опухоли 2-й степени также называются умеренно хорошо дифференцированными, и они состоят из клеток, которые напоминают нормальную ткань. Опухоли 3-й степени имеют худший прогноз, и их клетки являются аномальными, называются плохо дифференцированными. [84]
Метастазы при раке яичников очень распространены в брюшной полости и возникают путем отслоения, когда раковые клетки прорываются через капсулу яичника и могут свободно перемещаться по брюшной полости. Метастазы рака яичников обычно растут на поверхности органов, а не внутри; они также распространены на сальнике и брюшной оболочке. Раковые клетки также могут перемещаться по лимфатической системе и метастазировать в лимфатические узлы, соединенные с яичниками через кровеносные сосуды; то есть лимфатические узлы вдоль инфундибулотазовой связки , широкой связки и круглой связки . Наиболее часто поражаемые группы включают парааортальные , гипогастральные, наружные подвздошные , запирательные и паховые лимфатические узлы . Обычно рак яичников не метастазирует в печень, легкие, мозг или почки, если только это не рецидивирующее заболевание; это отличает рак яичников от многих других форм рака. [29]
Женщины с высоким генетическим риском рака яичников могут рассмотреть хирургическое удаление яичников в качестве профилактической меры. Это часто делается после завершения детородного возраста. Это снижает вероятность развития как рака груди (примерно на 50%), так и рака яичников (примерно на 96%) у женщин с высоким риском. Женщинам с мутациями гена BRCA обычно одновременно удаляют маточные трубы (сальпингоофорэктомия), поскольку у них также повышен риск рака маточных труб . Однако эта статистика может переоценивать снижение риска из-за того, как они были изучены. [26] [85]
Поскольку большая часть рака яичников возникает в фаллопиевых трубах, [86] Альянс по исследованию рака яичников и Общество гинекологической онкологии теперь рекомендуют женщинам, которые не планируют иметь еще детей и которым предстоит хирургическая операция, такая как перевязка маточных труб (перевязка «труб»), проводить оппортунистическую сальпингоофорэктомию — то есть одновременное удаление маточных труб. [87] OVCARE — многопрофильная исследовательская группа BC Cancer , занимающаяся исследованием яичников, — начала рекомендовать сальпингэктомию во время гистерэктомии и вместо перевязки маточных труб в 2010 году. [88]
Женщины со значительным семейным анамнезом рака яичников часто направляются к генетическому консультанту , чтобы узнать, будет ли полезным тестирование на мутации BRCA. [29] Использование оральных контрацептивов, отсутствие «менструаций» во время менструального цикла и перевязка маточных труб снижают риск. [89] Может быть связь между развитием рака яичников и стимуляцией яичников во время лечения бесплодия. Эндометриоз был связан с раком яичников. Инфекция вируса папилломы человека , курение и тальк не были идентифицированы как повышающие риск развития рака яичников. [28]
Не существует простого и надежного способа проверки на рак яичников у женщин, у которых нет никаких признаков или симптомов. Скрининг не рекомендуется женщинам со средним риском, поскольку доказательства не подтверждают снижение смертности, а высокий уровень ложноположительных тестов может привести к ненужной операции, которая сопровождается своими собственными рисками. [19] Женщины с высоким риском рака яичников, которые в настоящее время идентифицируются на основе семейного анамнеза и генетического тестирования, могут получить пользу от скрининга. [90] Тест Папаниколау не проверяет рак яичников. [27]
Рак яичников обычно пальпируется только на поздних стадиях. [29] Эта группа высокого риска выиграла от более раннего обнаружения. [28] [26] [85] Скрининг с использованием измерений CA-125 , уровней HE4 , ультразвука или пальпации придатков не рекомендуется у женщин со средним риском. В настоящее время в Великобритании нет национальной программы скрининга на рак яичников. Можно использовать CA125 и трансвагинальное ультразвуковое исследование, но есть минимальные доказательства того, что это снижает смертность. Совсем недавно было показано, что алгоритм риска рака яичников (ROMA) обнаруживает более ранние формы рака с использованием CA125 и возраста, но опять же не обеспечивает надежной меры для снижения смертности в настоящее время. [91]
Рак яичников имеет низкую распространенность, даже в группе высокого риска женщин в возрасте от 50 до 60 лет (примерно одна на 2000 год), и скрининг женщин со средним риском с большей вероятностью даст неоднозначные результаты, чем выявит проблему, требующую лечения. Поскольку неоднозначные результаты более вероятны, чем обнаружение излечимой проблемы, и поскольку обычной реакцией на неоднозначные результаты являются инвазивные вмешательства, у женщин со средним риском потенциальный вред от скрининга без показаний перевешивает потенциальную пользу. Цель скрининга — диагностировать рак яичников на ранней стадии, когда его с большей вероятностью можно успешно вылечить. [26] [85]
Скрининг с помощью трансвагинального УЗИ , тазового обследования и уровня CA-125 может использоваться вместо профилактической хирургии у женщин с мутациями BRCA1 или BRCA2. Эта стратегия показала определенный успех. [29]
В крупномасштабном исследовании, проведенном в Великобритании, было показано, что скрининг на CA125, химическое вещество, выделяемое опухолями яичников, с последующим контролем с помощью ультразвука неэффективен в снижении смертности. [92]
Были проведены некоторые скрининговые исследования, в которых для определения целевых групп населения для скрининга использовались возраст, семейный анамнез рака яичников и статус мутации. [90]
После того, как будет установлено, что присутствует рак яичников, фаллопиевых труб или первичный рак брюшины, гинеколог-онколог (врач, обученный лечить рак женской репродуктивной системы) назначает лечение. Гинеколог-онколог может проводить хирургические операции и проводить химиотерапию женщинам с раком яичников. Разрабатывается план лечения. [93]
Лечение обычно включает хирургическое вмешательство и химиотерапию , а иногда и лучевую терапию , независимо от подтипа рака яичников. [70] [94] Хирургическое лечение может быть достаточным для хорошо дифференцированных злокачественных опухолей и ограниченных яичником. Добавление химиотерапии может потребоваться для более агрессивных опухолей, ограниченных яичником. Для пациентов с запущенным заболеванием стандартным является сочетание хирургического уменьшения с комбинированным режимом химиотерапии. С 1980 года препараты на основе платины играют важную роль в лечении рака яичников. [ необходима цитата ] Пограничные опухоли , даже после распространения за пределы яичника, хорошо поддаются хирургическому вмешательству, и химиотерапия не считается полезной. [95] Повторная операция и поддерживающая химиотерапия не показали своей пользы. [29]
Хирургия была стандартом лечения в течение десятилетий и может быть необходима для получения образца для диагностики . Хирургия зависит от степени инвазии других тканей раком на момент его диагностики. Эта степень рака описывается путем присвоения ему стадии, предполагаемого типа и степени злокачественности. Гинекологический хирург может удалить один (односторонняя овариэктомия) или оба яичника (двусторонняя овариэктомия). Фаллопиевы трубы (сальпингэктомия), матка (гистерэктомия) и сальник ( оментэктомия) также могут быть удалены. Как правило, удаляются все эти органы. [96]
Для тех, у кого положительный результат теста на дефектные гены BRCA1 или BRCA2, операция по снижению риска является вариантом. Все больше женщин выбирают этот вариант. В то же время среднее время ожидания процедуры составляет два года, что намного дольше рекомендуемого. [97] [98]
При низкодифференцированном одностороннем раке стадии IA удаляются только пораженный яичник (который не должен быть разорван) и фаллопиева труба. Это можно сделать, особенно у молодых людей, желающих сохранить свою фертильность. Однако существует риск микроскопических метастазов, и стадирование должно быть завершено. [28] Если обнаружены какие-либо метастазы, необходима вторая операция по удалению оставшегося яичника и матки. [95] Транексамовая кислота может быть введена до операции, чтобы уменьшить необходимость в переливании крови из-за потери крови во время операции. [31]
Если опухоль у женщины в пременопаузе определяется как опухоль с низким злокачественным потенциалом во время операции, и это явно рак I стадии, удаляется только пораженный яичник. Для женщин в постменопаузе с опухолями с низким злокачественным потенциалом гистерэктомия с двусторонней сальпингоофорэктомией по-прежнему является предпочтительным вариантом. Во время стадирования можно осмотреть или удалить аппендикс. Это особенно важно при муцинозных опухолях. [29] У детей или подростков с раком яичников хирурги обычно пытаются сохранить один яичник, чтобы обеспечить завершение полового созревания , но если рак распространился, это не всегда возможно. Дисгерминомы, в частности, имеют тенденцию поражать оба яичника: 8–15% дисгермином присутствуют в обоих яичниках. [33] Людей с опухолями низкой степени злокачественности (хорошо дифференцированными) обычно лечат только хирургическим путем, [26] что часто приводит к излечению. [70] В целом, опухоли зародышевых клеток можно лечить односторонней хирургией, если только рак не распространен или фертильность не является фактором. [32] Исследования показывают, что у женщин с хирургически стадированным распространенным эпителиальным раком яичников (стадии III и IV) следует приложить все усилия для достижения полной циторедукции (хирургические усилия по удалению основной массы опухоли). [99]
При запущенных формах рака, когда полное удаление невозможно, удаляется как можно больше опухоли в ходе процедуры, называемой циторедуктивной хирургией. Эта операция не всегда успешна и с меньшей вероятностью будет успешной у женщин с обширными метастазами в брюшину, заболеванием IV стадии, раком поперечной щели печени , брыжейки или диафрагмы и большими областями асцита. Цифродуктивная хирургия обычно проводилась только один раз [28], но недавнее исследование показало более длительную общую выживаемость при рецидивирующем раке яичников, когда операция проводилась в сочетании с химиотерапией по сравнению с лечением только химиотерапией. [100] Компьютерная томография (КТ брюшной полости) часто используется для оценки возможности проведения первичной циторедуктивной хирургии, но доказательства с низкой степенью достоверности также предполагают, что ПЭТ/КТ с фтордезоксиглюкозой-18 (ФДГ) и МРТ могут быть полезны в качестве дополнения для оценки макроскопической неполной циторедукции. [101] Более полное удаление опухоли связано с лучшими результатами: женщины без макроскопических признаков заболевания после удаления опухоли имеют медианную выживаемость 39 месяцев, в отличие от 17 месяцев при менее полной операции. [26] При удалении метастазов удаляются многие клетки, устойчивые к химиотерапии, а также удаляются любые скопления погибших клеток. Это позволяет химиотерапии лучше достигать оставшихся раковых клеток, которые с большей вероятностью будут быстрорастущими и, следовательно, химиочувствительными. [29]
Другим используемым протоколом является интервальная циторедукция, при которой назначается неоадъювантная химиотерапия, выполняется циторедукция и химиотерапия завершается после циторедукции. [95] Хотя окончательные исследования не были завершены, было показано, что она примерно эквивалентна первичной циторедукции с точки зрения выживаемости и показывает немного более низкую заболеваемость. [29] Предыдущие исследования показали разные результаты первичной циторедукции по сравнению с интервальной циторедукцией. Текущее исследование TRUST может прояснить критерии выбора для каждого хирургического подхода. [102]
Существует несколько различных хирургических процедур, которые могут быть использованы для лечения рака яичников. Для рака I и II стадии может быть использована лапароскопическая (через замочную скважину) операция, но метастазы могут быть не обнаружены. Для запущенного рака лапароскопия не используется, так как удаление метастазов требует доступа ко всей брюшной полости. В зависимости от степени рака процедуры могут включать двустороннюю сальпингоофорэктомию, биопсию по всей брюшине и брюшной лимфатической системе, резекцию большого сальника , спленэктомию , резекцию кишечника , удаление или резекцию диафрагмы, аппендэктомию или даже заднюю тазовую экзентерацию . [29]
Для полной стадии рака яичников лимфаденэктомия может быть включена в операцию. Однако она не обеспечивает преимуществ с точки зрения выживаемости ни при HGSOC [103] , ни при LGSOC. [104] Это особенно важно при опухолях зародышевых клеток, поскольку они часто метастазируют в близлежащие лимфатические узлы. [26]
Если рак яичников рецидивирует, вторичная операция иногда является вариантом лечения. Это зависит от того, насколько легко опухоль может быть удалена, сколько жидкости накопилось в брюшной полости и общего состояния здоровья. [28] Эффективность этой операции зависит от хирургической техники, полноты циторедукции и степени заболевания. [105] Она также может быть полезна людям, которым первую операцию делал врач-терапевт, и при эпителиальном раке яичников. [31] Вторичная операция может быть эффективна при дисгерминомах и незрелых тератомах. [32] Данные свидетельствуют о том, что операция при рецидивирующем эпителиальном раке яичников может быть связана с продлением жизни у некоторых женщин с заболеванием, чувствительным к платине. [106]
Основным побочным эффектом овариэктомии у молодых женщин является ранняя менопауза , которая может вызвать остеопороз . После операции можно рассмотреть заместительную гормональную терапию, особенно у молодых женщин. Эта терапия может состоять из комбинации эстрогена и прогестерона или только эстрогена. Один эстроген безопасен после гистерэктомии; когда матка все еще присутствует, не встречающий сопротивления эстроген резко повышает риск рака эндометрия . [28] Терапия эстрогеном после операции не изменяет показатели выживаемости. [31] Люди, перенесшие операцию по удалению рака яичников, обычно госпитализируются после этого на 3–4 дня и проводят около месяца, восстанавливаясь дома. [107] Результаты операции лучше всего в больницах, которые проводят большое количество операций по удалению рака яичников. [29]
Неясно, что лучше или хуже — лапароскопия или лапаротомия при раке яичников на стадии I по FIGO. [108] Также нет очевидной разницы между тотальной абдоминальной гистерэктомией и супрацервикальной гистерэктомией при поздних стадиях рака. Примерно 2,8% людей, перенесших первую операцию по поводу позднего рака яичников, умирают в течение двух недель после операции (2,8% периоперационной смертности ). [31] Более агрессивные операции связаны с лучшими результатами при поздних стадиях (стадия III или IV) рака яичников. [29]
Химиотерапия была общим стандартом лечения рака яичников в течение десятилетий, хотя и с различными протоколами. Химиотерапия используется после операции для лечения любого остаточного заболевания, если это уместно. В некоторых случаях может быть причина сначала провести химиотерапию, а затем операцию. Это называется «неоадъювантная химиотерапия» и распространено, когда опухоль не может быть полностью удалена или оптимально уменьшена с помощью хирургического вмешательства. Хотя не было показано, что она увеличивает выживаемость, она может снизить риск осложнений после операции. Если выполняется односторонняя сальпингоофорэктомия или другая операция, может быть назначена дополнительная химиотерапия, называемая «адъювантной химиотерапией». [28] [31] Адъювантная химиотерапия используется при раке 1 стадии, как правило, если опухоль имеет высокую гистологическую степень (степень 3) или самую высокую подстадию (стадия 1c), при условии, что рак был оптимально стадирован во время операции. [31] [95] Бевацизумаб может использоваться в качестве адъювантной химиотерапии, если опухоль не была полностью удалена во время операции или если рак находится на стадии IV; он может продлить выживаемость без прогрессирования, но не было показано, что он продлевает общую выживаемость. [31] Химиотерапия излечивает приблизительно 20% случаев рака яичников на поздней стадии; [29] она чаще излечивает злокачественные опухоли зародышевых клеток, чем эпителиальные опухоли. [32] Было обнаружено, что адъювантная химиотерапия улучшает выживаемость и снижает риск рецидива рака яичников по сравнению с отсутствием адъювантной терапии у женщин с эпителиальным раком яичников на ранней стадии. [109]
Химиотерапия при раке яичников обычно состоит из платин , группы препаратов на основе платины , в сочетании с неплатинами. [110] Препараты на основе платины используются с 1980 года. Обычные методы лечения могут включать паклитаксел , цисплатин , топотекан , доксорубицин, эпирубицин и гемцитабин . Карбоплатин обычно назначается в сочетании либо с паклитакселом , либо с доцетакселом ; типичная комбинация — карбоплатин с паклитакселом. [28] [31] Карбоплатин превосходит цисплатин тем, что он менее токсичен и имеет меньше побочных эффектов, что, как правило, позволяет улучшить качество жизни по сравнению, хотя оба препарата одинаково эффективны. [31] Схемы из трех препаратов не оказались более эффективными, [28] а платины по отдельности или неплатины по отдельности менее эффективны, чем платины и неплатины в комбинации. [31] Существует небольшое преимущество в химиотерапии на основе платины по сравнению с неплатиновой терапией. [111] Комбинации платины могут обеспечить улучшенную выживаемость по сравнению с одной платиной. У людей с рецидивирующим раком яичников, данные свидетельствуют о том, что топотекан оказывает такое же влияние на общую выживаемость, как паклитаксел и топотекан плюс талидомид, в то время как он превосходит треосульфан и не так эффективен, как пегилированный липосомальный доксорубицин у людей, чувствительных к платине. [112]
Химиотерапию можно вводить внутривенно или в брюшную полость . [26] Хотя внутрибрюшинная химиотерапия связана с более длительной выживаемостью без прогрессирования и общей выживаемостью, она также вызывает больше неблагоприятных побочных эффектов, чем внутривенная химиотерапия. [31] Она в основном используется, когда рак был оптимально удален. Внутрибрюшинная химиотерапия может быть очень эффективной, поскольку рак яичников в основном распространяется внутри брюшной полости, и более высокие дозы препаратов могут достигать опухолей таким образом. [29]
Химиотерапия может вызвать анемию ; было обнаружено, что внутривенное железо более эффективно, чем пероральные добавки железа , в снижении потребности в переливании крови . [31] Типичные циклы лечения включают одно лечение каждые 3 недели, повторяющееся в течение 6 недель или более. [113] Менее 6 недель (циклов) лечения менее эффективны, чем 6 недель или более. [31] Злокачественные новообразования зародышевых клеток лечатся иначе, чем другие виды рака яичников — используется режим блеомицина , этопозида и цисплатина (BEP) с 5 днями химиотерапии, назначаемой каждые 3 недели в течение 3-4 циклов. [26] [32] Химиотерапия опухолей зародышевых клеток не вызывает аменорею , бесплодие, врожденные дефекты или выкидыш . [32] Поддерживающая химиотерапия не показала своей эффективности. [31]
У людей с мутациями BRCA платиновая химиотерапия более эффективна. [28] Опухоли зародышевых клеток и злокачественные опухоли полового тяжа/стромы лечатся химиотерапией, хотя дисгерминомы и опухоли полового тяжа обычно не очень поддаются лечению. [26] [33]
Если рак яичников рецидивирует, он считается частично чувствительным к платине или резистентным к платине, в зависимости от времени с момента последнего рецидива, леченного платиной: частично чувствительные к платине раки рецидивируют через 6–12 месяцев после последнего лечения, а раки, резистентные к платине, имеют интервал менее 6 месяцев. Химиотерапию второй линии можно проводить после того, как рак становится симптоматичным, поскольку не наблюдается разницы в выживаемости между лечением бессимптомных (повышенный уровень CA-125) и симптоматических рецидивов. [ медицинская цитата необходима ]
Для опухолей, чувствительных к платине, платины являются препаратами выбора для химиотерапии второй линии в сочетании с другими цитотоксическими агентами. Режимы включают карбоплатин в сочетании с пегилированным липосомальным доксорубицином , гемцитабином или паклитакселом . [26] Карбоплатин-дублетную терапию можно комбинировать с паклитакселом для повышения эффективности в некоторых случаях. Другой потенциальной адъювантной терапией для рецидивов, чувствительных к платине, является олапариб , который может улучшить выживаемость без прогрессирования , но не было показано, что он улучшает общую выживаемость . [31] ( Олапариб , ингибитор PARP , был одобрен FDA США для использования при раке яичников, связанном с BRCA, который ранее лечился химиотерапией. [114] [115] ) Для рецидивирующих опухолей зародышевых клеток дополнительные 4 цикла химиотерапии BEP являются лечением первой линии для тех, кто лечился хирургическим путем или платинами.
Если опухоль определена как резистентная к платине, в качестве терапии второй линии можно использовать винкристин , дактиномицин и циклофосфамид (VAC) или некоторую комбинацию паклитаксела, гемцитабина и оксалиплатина . [32]
Для опухолей, резистентных к платине, нет высокоэффективных вариантов химиотерапии. Схемы с одним препаратом (доксорубицин или топотекан ) не имеют высоких показателей ответа, [28] но схемы с одним препаратом топотекан, пегилированный липосомальный доксорубицин или гемцитабин используются в некоторых случаях. [26] [31] Топотекан нельзя использовать у людей с кишечной непроходимостью. Паклитаксел, используемый отдельно, является другим возможным режимом, или его можно комбинировать с липосомальным доксорубицином, гемцитабином, цисплатином, топотеканом, этопозидом или циклофосфамидом . [113] (См. также Паллиативный уход ниже.)
Разрабатываются новые агенты для подавления развития новых кровеносных сосудов (ангиогенеза) у женщин с раком яичников, у которых развивается резистентность к химиотерапевтическим препаратам. По состоянию на 2023 год, по-видимому, будет иметь место роль этих методов лечения, но из-за дополнительной нагрузки на лечение и стоимости поддерживающей терапии риск и польза требуют тщательного рассмотрения. [116]
Novocure спонсировала исследование фазы 2, доказывающее эффективность полей для лечения опухолей при рецидивирующей платинорезистентной карциноме яичников в сочетании с еженедельной химиотерапией паклитакселом. [45]
Дисгерминомы наиболее эффективно лечатся с помощью облучения, [33] хотя это может привести к бесплодию и постепенно заменяется химиотерапией. [26] Лучевая терапия не улучшает выживаемость у людей с хорошо дифференцированными опухолями. [26]
При раке стадии 1c и 2 лучевая терапия применяется после операции, если есть вероятность остаточного заболевания в области таза, но брюшная полость свободна от рака. Лучевая терапия также может использоваться при паллиативном лечении запущенных форм рака. Типичный курс лучевой терапии при раке яичников составляет 5 дней в неделю в течение 3–4 недель.
Распространенные побочные эффекты лучевой терапии включают диарею, запор и частое мочеиспускание. [117] Поздние эффекты лучевой терапии (и частота их возникновения) включают остеонекроз (8-20%), язву мочевого пузыря (<3%), стеноз влагалища (>2,5%) и необратимую пояснично-крестцовую плексопатию . [118]
Несмотря на то, что 60% опухолей яичников имеют рецепторы эстрогена , рак яичников редко реагирует на гормональное лечение. Обзор Cochrane обнаружил отсутствие доказательств относительно эффектов тамоксифена у людей с рецидивирующим раком яичников. [119] Эстроген сам по себе не оказывает влияния на рак, а тамоксифен и летрозол редко бывают эффективными. [28] «Некоторые женщины с пограничным злокачественным раком яичников и стромальным раком яичников могут получать гормональную терапию». [96]
Иммунотерапия является темой текущих исследований рака яичников. В некоторых случаях препарат антитела бевацизумаб , хотя все еще является темой активных исследований, используется для лечения распространенного рака вместе с химиотерапией. [95] Он был одобрен для этого использования в Европейском союзе. [120]
Конкретное последующее наблюдение зависит, например, от типа и стадии рака яичников, лечения и наличия каких-либо симптомов. Обычно контрольный прием назначается каждые 2–3 месяца изначально, затем дважды в год в течение 5 лет. [121] Для эпителиального рака яичников наиболее распространенным тестом при последующем наблюдении является уровень CA-125. Однако лечение, основанное только на повышенном уровне CA-125, а не на каких-либо симптомах, может усилить побочные эффекты без какого-либо продления жизни, поэтому значение результата теста CA-125 можно обсудить до его проведения. [122] Рекомендация по состоянию на 2014 год заключается в том, что рецидив рака может присутствовать, если уровень CA-125 в два раза превышает норму. [28] Лечение рецидива, обнаруженного с помощью CA-125, не улучшает выживаемость. [31]
Для женщин с опухолями зародышевых клеток последующие тесты обычно включают альфа-фетопротеин (АФП) и/или хорионический гонадотропин человека . Для женщин со стромальными раками иногда полезны тесты на гормоны, такие как эстроген, тестостерон и ингибин . [122] Ингибин также может быть полезен для мониторинга прогрессирования опухолей полового канатика, наряду с мюллеровым ингибирующим веществом . АФП также может использоваться для мониторинга опухолей Сертоли-Лейдига. [26] При дисгерминомах лактатдегидрогеназа и два ее изофермента (ЛДГ-1 и ЛДГ-2) используются для проверки на рецидив. [32]
Женщинам с раком яичников может не потребоваться рутинная контрольная визуализация для мониторинга рака, если только не появятся новые симптомы или не начнут расти опухолевые маркеры . [123] Визуализация без этих показаний не рекомендуется, поскольку она вряд ли обнаружит рецидив, улучшит выживаемость и имеет свои собственные затраты и побочные эффекты. [123] Однако при желании можно использовать КТ, хотя это не распространено. [28] Если опухоль легко визуализируется, визуализацию можно использовать для мониторинга хода лечения. [124]
Паллиативная помощь направлена на облегчение симптомов и повышение или поддержание качества жизни. Целью этого типа лечения является не излечение рака, а обеспечение большего комфорта для женщины, живущей с раком, который не может быть вылечен. Она была рекомендована как часть плана лечения для любого человека с запущенным раком яичников или пациентов с выраженными симптомами. [125] В случаях платинорезистентности и платинорезистентности основным лечением является другая паллиативная химиотерапия. [29] [96]
Паллиативная помощь может включать лечение симптомов и осложнений рака, включая боль, тошноту, запор, асцит, непроходимость кишечника , отек , плевральный выпот и мукозит . Особенно если рак прогрессирует и становится неизлечимым, лечение симптомов становится одной из основных целей терапии. Паллиативная помощь может также включать помощь в принятии решений, например, о том, подходит ли или когда подходит хосписная помощь , и предпочтительном месте для пациента в конце жизни. [31]
Кишечную непроходимость можно лечить с помощью паллиативной хирургии ( колостомия , илеостомия или внутренний обходной анастомоз) или лекарств, но было показано, что хирургия увеличивает время выживания. [28] [31] Паллиативная хирургия может привести к синдрому короткой кишки , энтерокутантному свищу или повторной непроходимости; или может быть невозможной из-за степени непроходимости. [29] Другие методы лечения осложнений могут включать полное парентеральное питание , диету с низким содержанием остатков , паллиативную гастростомию и адекватный контроль боли. [28] Кишечную непроходимость также можно лечить октреотидом , когда паллиативная хирургия невозможна. Рак также может блокировать мочеточники , что можно устранить с помощью нефростомии или мочеточникового стента . Асцит можно устранить с помощью повторного парацентеза или установки дренажа для повышения комфорта. [126] Плевральные выпоты можно лечить аналогичным образом, с помощью повторного торакоцентеза , плевродеза или установки дренажа. [29]
Лучевая терапия может использоваться как часть паллиативного лечения рака яичников на поздних стадиях, поскольку она может помочь уменьшить опухоли, вызывающие симптомы. [96] Паллиативная лучевая терапия обычно длится всего несколько сеансов, что намного короче курса терапии, чем непаллиативная лучевая терапия. [117] Она также используется для паллиативного лечения резистентных к химиотерапии опухолей зародышевых клеток. [32]
Рак яичников оказывает значительное влияние на качество жизни , психологическое здоровье и благополучие. Доступны вмешательства, помогающие с потребностями и социальной поддержкой. Многие выжившие после рака яичников сообщают о хорошем качестве жизни и оптимизме . Другие сообщали о «духовном изменении», которое помогло им найти смысл во время их опыта. Другие описывали свою потерю веры после постановки диагноза рака яичников. Те, кто прошел лечение, иногда испытывают социальную изоляцию , но получают пользу от отношений с другими выжившими. Некоторые, кто выразил свою неспособность заботиться о своей семье, описывали разочарование и чувство вины . [127]
Изменения самооценки и образа тела могут возникнуть из-за потери волос , удаления яичников и других репродуктивных структур, а также шрамов . После того, как волосы отрастут, наступает некоторое улучшение. Могут возникнуть сексуальные проблемы. Удаление яичников приводит к хирургически вызванной менопаузе , которая может привести к болезненному половому акту , сухости влагалища, потере сексуального желания и усталости. Хотя прогноз лучше для более молодых выживших, влияние на сексуальность все еще может быть существенным. [127]
Тревога , депрессия и стресс присутствуют у тех, кто перенес рак яичников, в более высоких показателях, чем в общей популяции. [127] [128] Те же психосоциальные проблемы могут развиться у членов семьи. Эмоциональные эффекты могут включать страх смерти , грусть , проблемы с памятью и трудности с концентрацией внимания. Когда оптимизм был принят теми, кто начал свое лечение, у них было меньше шансов развить стресс. Те, кто боится рецидива рака, могут испытывать трудности с выражением радости, даже когда они не больны. Чем больше видов лечения проходит женщина, тем больше вероятность потери надежды . Женщины часто могут справиться и уменьшить негативные психосоциальные эффекты с помощью ряда стратегий. Такие действия, как путешествия, проведение дополнительного времени с семьей и друзьями, игнорирование статистики , ведение дневника и усиление участия в духовных мероприятиях, являются адаптивными. [127]
Женщины с раком яичников также могут испытывать трудности с диетой и подвергаться риску недоедания. [129]

Рак яичников обычно имеет относительно плохой прогноз . Он непропорционально смертелен, поскольку не имеет четкого раннего обнаружения или скринингового теста, что означает, что большинство случаев не диагностируются, пока они не достигнут поздних стадий. [123] [28]
Рак яичников метастазирует на ранней стадии своего развития, часто до того, как его диагностируют. Высокозлокачественные опухоли метастазируют легче, чем низкозлокачественные опухоли. Как правило, опухолевые клетки начинают метастазировать, разрастаясь в брюшной полости. [26] Более 60% женщин, страдающих раком яичников, имеют рак III или IV стадии, когда он уже распространился за пределы яичников. Рак яичников выделяет клетки в естественную жидкость в брюшной полости. Затем эти клетки могут имплантироваться в другие брюшные (брюшинные) структуры, включая матку, мочевой пузырь , кишечник , выстилку стенки кишечника и сальник , образуя новые опухолевые разрастания еще до того, как возникнет подозрение на рак.
Пятилетняя выживаемость для всех стадий рака яичников составляет 46%; одногодичная выживаемость составляет 72%, а десятилетняя выживаемость составляет 35%. [131] В случаях, когда диагноз ставится на ранней стадии заболевания, когда рак все еще ограничен первичным местом, пятилетняя выживаемость составляет 92,7%. [132] Около 70% женщин с запущенным заболеванием реагируют на первоначальное лечение, большинство из них достигают полной ремиссии, но у половины этих женщин наблюдается рецидив через 1–4 года после лечения. [26] Метастазы в мозг чаще встречаются при раке стадии III/IV, но все еще могут возникать при раке на стадии I/II. Люди с метастазами в мозг выживают в среднем за 8,2 месяца, хотя хирургическое вмешательство, химиотерапия и лучевая терапия всего мозга могут улучшить выживаемость. [31]
Выживаемость при раке яичников значительно варьируется в зависимости от подтипа. Дисгерминомы имеют очень благоприятный прогноз. На ранних стадиях их пятилетняя выживаемость составляет 96,9%. [33] Около двух третей дисгермином диагностируются на стадии I. [32] Дисгерминомы III стадии имеют пятилетнюю выживаемость 61%; при лечении химиотерапией BEP после неполного хирургического удаления дисгерминомы имеют двухлетнюю выживаемость 95%. Злокачественные опухоли стромы полового канатика также имеют благоприятный прогноз; поскольку они медленно растут, даже те, у кого метастатическое заболевание, могут прожить десятилетие или больше. [26] Опухоли с низким злокачественным потенциалом обычно имеют плохой прогноз только в том случае, если в брюшной полости обнаружены инвазивные опухолевые имплантаты. [29]
Осложнения рака яичников могут включать распространение рака на другие органы, прогрессирующую потерю функций различных органов, асцит и кишечную непроходимость, которая может быть фатальной. Кишечная непроходимость в нескольких местах является наиболее распространенной непосредственной причиной смерти. [28] Кишечная непроходимость при раке яичников может быть либо истинной непроходимостью, когда опухоль блокирует просвет кишечника , либо псевдонепроходимостью, когда опухоль препятствует нормальной перистальтике . [133] Постоянное накопление асцита можно лечить путем установки дренажа, который может дренироваться самостоятельно. [28]
Существует ряд прогностических факторов при раке яичников. Положительные прогностические факторы — те, которые указывают на лучшие шансы на выживание — включают отсутствие остаточной болезни после операции (стадия III/IV), полную макроскопическую резекцию (стадия IV), мутации BRCA2, молодой возраст (до 45 лет), несерозный тип, низкую гистологическую степень, раннюю стадию, сопутствующее возникновение с раком эндометрия и низкие уровни CA-125. Существуют противоречивые данные о BRCA1 как прогностическом факторе. Напротив, отрицательные прогностические факторы — те, которые указывают на худшие шансы на выживание — включают разрыв капсулы яичника во время операции, пожилой возраст (старше 45 лет), муцинозный тип, стадия IV, высокую гистологическую степень, светлоклеточный тип, поражение верхней части живота, высокие уровни CA-125, наличие опухолевых клеток в крови и повышенный уровень циклооксигеназы-2 . [31]
Экспрессия различных мРНК также может быть прогностическим фактором для рака яичников. Высокие уровни Drosha и Dicer связаны с улучшенной выживаемостью, тогда как высокие уровни let-7b, HIF1A , EphA1 и поли(АДФ-рибоза) полимеразы связаны с худшей выживаемостью. Рак, положительный по WT1, имеет худший прогноз; рак, положительный по эстрогеновым рецепторам, имеет лучший прогноз. [31]
Ниже представлены общие показатели пятилетней выживаемости для всех типов рака яичников по стадии и гистологической степени: [26]
Ниже приведены показатели выживаемости для различных типов рака яичников, согласно Американскому онкологическому обществу . [130] Они предоставлены Национальным институтом рака , SEER , и основаны на данных пациентов, которым был поставлен диагноз с 2004 по 2010 год.
Рак яичников часто рецидивирует после лечения. В целом, за 5-летний период рецидивируют 20% случаев рака I и II стадии. Большинство рецидивов происходит в брюшной полости. [29] Если рецидив происходит на поздней стадии заболевания, он обычно происходит в течение 18 месяцев после первоначального лечения ( выживаемость без прогрессирования 18 месяцев ). Рецидивы можно лечить, но безрецидивный интервал имеет тенденцию к сокращению, а химиорезистентность увеличивается с каждым рецидивом. [28] Когда рецидивирует дисгерминома, она, скорее всего, рецидивирует в течение года после постановки диагноза, а другие злокачественные опухоли зародышевых клеток рецидивируют в течение 2 лет в 90% случаев. Опухоли зародышевых клеток, отличные от дисгермином, имеют плохой прогноз при рецидиве с показателем долгосрочной выживаемости 10%. [32] Опухоли с низким злокачественным потенциалом редко рецидивируют, даже если щадящая фертильность операция является методом выбора. 15% опухолей LMP рецидивируют после односторонней операции на ранее непораженном яичнике, и они, как правило, легко поддаются хирургическому лечению. Более запущенные опухоли могут рецидивировать в течение 20 лет, если они вообще рецидивируют, и лечатся только хирургическим путем, если опухоль не изменила свои гистологические характеристики или не выросла очень быстро. В этих случаях, а также при наличии значительного асцита, также может использоваться химиотерапия. Рецидив обычно указывает на повышение уровня CA-125, а затем прогрессирует до симптоматического рецидива в течение 2–6 месяцев. [29] Рецидивирующие опухоли стромы полового тяжа, как правило, не поддаются лечению, но не агрессивны. [32]
Это самый смертоносный гинекологический рак. [29]
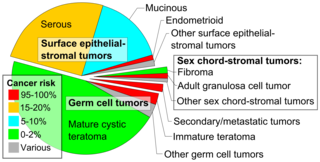
В 2018 году во всем мире заболеваемость раком яичников составила 6,6 на 100 000, а смертность — 3,9. [136] В 2010 году во всем мире от рака яичников умерло около 160 000 человек. Это больше, чем 113 000 в 1990 году. [137] Число новых случаев в год в Европе составляет примерно 5–15 на 100 000 женщин. [31] В Европе самые высокие показатели заболеваемости раком яичников наблюдаются в Литве , Латвии , Ирландии , Словакии и Чешской Республике , тогда как самые низкие — в Португалии и на Кипре . [31] В 2008 году пятилетняя выживаемость составляла 44%. Этот показатель увеличился с 1977 года, когда выживаемость составляла 36%. [127]


В 2022 году в Соединенных Штатах было диагностировано около 19 880 новых случаев, и 12 810 женщин умерли от рака яичников. [139] Пятилетняя относительная выживаемость составляет 49,7%. [140] Около 57% случаев на момент постановки диагноза имели метастазы. [140]
В 2014 году ежегодно ставилось более 220 000 диагнозов эпителиального рака яичников. [28] Общий риск в течение жизни в США составляет около 1,6% [26] [31] В США рак яичников поражает 1,3–1,4% и является причиной смерти около 1% женщин. [29] [141] В Соединенных Штатах это также пятый по распространенности вид рака у женщин, но четвертая по распространенности причина смерти от рака. [31] Это снижение сделало его девятым по распространенности видом рака у женщин. [29]
Риски развития определенных типов рака яичников различаются. Опухоли герминогенных клеток и опухоли стромы полового канатика встречаются реже, чем эпителиальные опухоли. Количество новых случаев в год в США составляет 0,4 на 100 000 женщин и 0,2 на 100 000 женщин соответственно. У молодых людей опухоли стромы полового канатика и опухоли герминогенных клеток составляют 1% от общего числа случаев рака яичников. [32] Рак яичников составляет примерно 4% от всех случаев рака, диагностированных у женщин. [31]
Это пятый по частоте вид рака у женщин в Великобритании (в 2011 году было диагностировано около 7100 случаев) и пятая по частоте причина смерти от рака у женщин (в 2012 году умерло около 4300 человек). [142] [31] [34] Уровень заболеваемости среди всего населения Великобритании составляет 21,6 на 100 000 человек.
По состоянию на 2014 год в Великобритании ежегодно диагностировалось около 7000–7100 случаев заболевания, из которых 4200 закончились смертью. [28] [34] В статье The Times за 2022 год говорится, что в Великобритании ежегодно регистрируется 7500 новых случаев. [143] Ранние симптомы часто ошибочно принимают за такие распространенные заболевания, как цистит или синдром раздраженного кишечника, и около 40 процентов женщин в Великобритании ошибочно полагают, что скрининг шейки матки выявляет рак яичников, что на 30 процентов больше, чем в 2016 году. [143] Женщины -ашкенази из числа евреев являются носителями мутировавших аллелей BRCA в пять раз чаще, чем остальная часть населения, что повышает для них риск развития рака яичников. [28]
У чернокожих женщин риск опухолей стромы полового канатика в два раза выше, чем у нечернокожих женщин. [32] Самая высокая распространенность наблюдается у белых и латиноамериканских женщин, за которыми следуют афроамериканки и азиатки. [136] Самая высокая смертность от рака яичников наблюдается у афроамериканок. [136]
В США уровень заболеваемости среди женщин старше 50 лет составляет приблизительно 33 на 100 000. [144] Уровень заболеваемости раком яичников в период с 1993 по 2008 год снизился у женщин в возрастной группе 40–49 лет и в возрастной группе 50–64 лет. [28] Рак яичников чаще всего диагностируется после менопаузы, [34] в возрасте от 60 до 64 лет. Девяносто процентов случаев рака яичников возникает у женщин старше 45 лет и 80% у женщин старше 50 лет. [31] У пожилых женщин чаще встречается запущенный рак яичников. [20]
Злокачественные опухоли зародышевых клеток — это тип рака яичников, который чаще всего возникает во время беременности . Обычно их диагностируют, когда при обследовании обнаруживается масса придатков (в 1–2% всех беременностей), опухоль видна на УЗИ или у родителей повышен уровень альфа-фетопротеина. Дермоидные кисты и дисгерминомы — самые распространенные опухоли зародышевых клеток во время беременности. Опухоли зародышевых клеток, диагностированные во время беременности, вряд ли дадут метастазы и могут быть вылечены хирургическим путем, а в некоторых случаях и химиотерапией, которая несет риск врожденных дефектов. Опухоли желточного мешка и незрелые тератомы растут особенно быстро и обычно лечатся химиотерапией даже во время беременности; однако дисгерминомы, которые были оптимально удалены, можно лечить после родов. [32]
Опухоли яичников были зарегистрированы у кобыл . Сообщаемые типы опухолей включают тератому, [145] [146] цистаденокарциному , [147] и особенно гранулезоклеточную опухоль . [148] [149] [150] [ 151] [152] [ чрезмерное цитирование ]
Разрабатывается скрининг с помощью гистероскопии для получения образцов клеток для гистологического исследования. Это похоже на текущий мазок Папаниколау, который используется для выявления рака шейки матки. [153] Совместное исследование Великобритании по скринингу рака яичников тестирует метод скрининга, который сочетает анализы крови на CA-125 с трансвагинальным УЗИ. [28] Другие исследования предполагают, что эта процедура скрининга может быть эффективной. [120] Хотя результаты, опубликованные в 2015 году, не были окончательными, были некоторые доказательства того, что скрининг может спасти жизни в долгосрочной перспективе. [154] В результате исследование было продлено, и окончательные результаты будут опубликованы в конце 2019 года. Одной из основных проблем скрининга является отсутствие четкого прогрессирования заболевания от стадии I (неинвазивной) до стадии III (инвазивной), и может быть невозможно обнаружить рак до того, как он достигнет стадии III. Другая проблема заключается в том, что методы скрининга, как правило, обнаруживают слишком много подозрительных поражений, большинство из которых не являются раком, но злокачественность можно оценить только с помощью хирургического вмешательства. [28] Метод ROCA в сочетании с трансвагинальной ультрасонографией изучается у женщин с высоким риском, чтобы определить, является ли он жизнеспособным методом скрининга. Он также изучается у женщин с нормальным риском, поскольку он показал себя многообещающим в более широкой популяции. [29] Также ведутся исследования, чтобы определить, помогает ли скрининг выявлять рак на ранней стадии у людей с мутациями BRCA. [120]
Исследователи из BGI Genomics и Университета Фудань обнаружили важные результаты в отношении рака яичников (OV) у китайских пациентов, выявив уникальный вариант RAD51D, который может служить терапевтической мишенью. [12] Опубликованное в JCO Global Oncology исследование выявило обогащенный вариант RAD51D, связанный с стимуляцией роста опухоли. В частности, было обнаружено, что вариант RAD51D K91fs повышает чувствительность к ингибиторам PARP, таким как олапариб и нирапариб, что открывает новые возможности лечения.
Исследования различных прогностических факторов рака яичников также продолжаются. Недавние исследования показывают, что тромбоцитоз предсказывает более низкую выживаемость и более высокую стадию рака. [28] Текущие исследования также изучают преимущества хирургического вмешательства при рецидивирующем раке яичников. [120]
Хотя это активная область исследований, по состоянию на 2018 год нет убедительных доказательств того, что иммунотерапия эффективна при раке яичников. [155] Однако испытания антитела и ингибитора VEGF бевацизумаба , который может замедлить рост новых кровеносных сосудов в раковой опухоли, показали многообещающие результаты, особенно в сочетании с пазопанибом , который также замедляет процесс роста кровеносных сосудов. Бевацизумаб был особенно эффективен в предварительных исследованиях рака III и IV стадии [28] и упоминался как имеющий по крайней мере 15%-ный уровень ответа. [26] Он изучается, в частности, при муцинозном раке яичников. [120]
Ингибиторы mTOR были высоко исследованным потенциальным лечением в 2000-х и 2010-х годах, но побочные эффекты этих препаратов (особенно гипергликемия и гиперлипидемия ) плохо переносились, а преимущество в выживании не было подтверждено. Ингибиторы киназы PI3 представляли интерес, но они, как правило, очень токсичны и вызывают диарею . Другим исследованным препаратом является селуметиниб , ингибитор MAPK . Он улучшил выживаемость, но не коррелировал с какими-либо мутациями, обнаруженными в опухолях. [28]
Бевацизумаб также можно сочетать с платиновой химиотерапией, комбинация, которая имела положительные предварительные результаты в PFS, но неоднозначные результаты в отношении общей выживаемости. Одним из недостатков этих методов лечения является профиль побочных эффектов, который включает высокое кровяное давление и протеинурию . Препарат также может усугубить заболевание кишечника, что приводит к свищам или перфорации кишечника . Винтафолид , который состоит из антифолата, конъюгированного с винбластином , также проходит клинические испытания; он может оказаться полезным, поскольку фолатные рецепторы сверхэкспрессируются при многих видах рака яичников. [28] Другой потенциальной иммунотерапией является трастузумаб , который активен против опухолей, положительных по мутациям Her2/neu. [26] Другие ингибиторы ангиогенеза также исследуются в качестве потенциальных методов лечения рака яичников. Комбретастатин и пазопаниб исследуются в комбинации для рецидивирующего рака яичников. Требананиб и тасквинимод являются другими исследуемыми ингибиторами ангиогенеза. Моноклональное антитело фарлетузумаб исследуется как адъювант к традиционной химиотерапии. Другой тип иммунотерапии включает вакцины , включая TroVax . [120]
Альтернатива химиотерапии BEP, схема из 3 циклов карбоплатина и этопозида , является актуальной темой исследований злокачественных новообразований зародышевых клеток. [32]
Внутрибрюшинная химиотерапия также изучалась в 2000-х и 2010-х годах на предмет ее потенциала для доставки более высоких доз цитотоксического агента к опухолям. Предварительные испытания с цисплатином и паклитакселом показали, что он плохо переносится, но улучшает выживаемость, и изучаются более переносимые режимы. [28] Цисплатин и паклитаксел исследуются как внутрибрюшинные химиотерапевтические агенты. Также изучается специальный режим химиотерапии для редких видов рака прозрачных клеток: иринотекан в сочетании с цисплатином. [120]
Ингибиторы PARP также показали многообещающие результаты в ранних испытаниях, особенно у людей с мутациями гена BRCA , поскольку белок BRCA взаимодействует с путем PARP. Он также изучается при рецидивирующем раке яичников в целом, где предварительные исследования показали более длительную PFS. В частности, олапариб показал большую выживаемость по сравнению с доксорубицином, хотя это лечение все еще изучается. Пока не ясно, какие биомаркеры являются предикторами восприимчивости к ингибиторам PARP. [28] Рукапариб — еще один ингибитор PARP, исследуемый при BRCA-положительном и BRCA-отрицательном рецидивирующем прогрессирующем раке яичников. Нирапариб — ингибитор PARP, испытываемый при BRCA-положительном рецидивирующем раке яичников. [120]
Ингибиторы тирозинкиназы являются еще одним исследуемым классом препаратов, которые могут применяться при раке яичников. Ингибиторы ангиогенеза в группе ингибиторов рецепторной тирозинкиназы , включая пазопаниб , цедираниб и нинтеданиб , также, как было показано, увеличивают выживаемость без прогрессирования (PFS), но их польза для общей выживаемости не была исследована по состоянию на 2015 год. [28] Предварительные исследования показали, что цедираниб в сочетании с платинами при рецидивирующем раке яичников увеличивает время до второго рецидива на 3–4 месяца и увеличивает выживаемость на 3 месяца. [120] MK-1775 является ингибитором тирозинкиназы, который используется в сочетании с паклитакселом и карбоплатином при платиночувствительных раковых заболеваниях с мутациями p53. Нинтеданиб исследуется как потенциальная терапия в сочетании с циклофосфамидом для людей с рецидивами. [120]
Еще одной областью исследований являются ингибиторы гистондеацетилазы (HDACi).
Гормональная терапия является темой текущих исследований рака яичников, в частности, ценности определенных лекарств, используемых для лечения рака груди. К ним относятся тамоксифен , летрозол и анастрозол . Предварительные исследования показали пользу тамоксифена у небольшого числа людей с прогрессирующим раком яичников. Летрозол может помочь замедлить или остановить рост рака яичников с положительным рецептором эстрогена . Анастрозол исследуется у людей в постменопаузе с раком с положительным рецептором эстрогена. [120]
Исследования по смягчению побочных эффектов лечения рака яичников также продолжаются. Лучевой фиброз, образование рубцовой ткани в области, обработанной радиацией, может быть облегчен с помощью гипербарической оксигенотерапии , но исследования в этой области не завершены. Лечение рака яичников также может вызывать у людей психиатрические проблемы, включая депрессию . Продолжаются исследования, чтобы определить, как консультирование и психотерапия могут помочь людям, у которых рак яичников во время лечения. [120]
Есть некоторые указания на то, что воспалительные заболевания органов малого таза могут быть связаны с раком яичников, особенно в не-западных странах. Это может быть связано с воспалительным процессом, присутствующим при воспалительных заболеваниях органов малого таза. [156]
Клинические испытания контролируются и финансируются правительственными организациями США для проверки вариантов лечения на предмет их безопасности и эффективности. К ним относятся NIH Clinical Research Trials и You ( Национальные институты здравоохранения ), [157] Learn About Clinical Trials ( Национальный институт рака ), [158] Search for Clinical Trials (Национальный институт рака), [159] ClinicalTrials.gov (Национальные институты здравоохранения). [160] [93] Клинические испытания также проводятся в Канаде. [161]
Недавние исследования показывают, что фимбриальная дистальная часть маточной трубы является наиболее вероятным источником HGSC. Это привело к разработке плана профилактики для населения в целом: оппортунистическая сальпингэктомия, удаление обеих маточных труб. ... Оппортунистическая сальпингэктомия обещает снизить риск OC и может быть безопасно внедрена в большинстве практик акушеров-гинекологов. Текущие исследования и долгосрочные последующие исследования имеют важное значение для полного понимания ее влияния на заболеваемость OC и оптимизации ее внедрения в клиническую практику.