Генная инженерия , также называемая генетической модификацией или генетическими манипуляциями , представляет собой модификацию и манипулирование генами организма с использованием технологий . Это набор технологий , используемых для изменения генетического состава клеток, включая перенос генов внутри видов и за их пределы для создания улучшенных или новых организмов . Новую ДНК получают либо путем выделения и копирования интересующего генетического материала с использованием методов рекомбинантной ДНК , либо путем искусственного синтеза ДНК. Обычно создается и используется конструкция для вставки этой ДНК в организм хозяина . Первую рекомбинантную молекулу ДНК создал Пол Берг в 1972 году путем объединения ДНК обезьяньего вируса SV40 с вирусом лямбда . Помимо вставки генов , этот процесс можно использовать для удаления или « выключения » генов. Новая ДНК может быть вставлена случайным образом или нацелена на определенную часть генома . [1]
Организм, созданный с помощью генной инженерии, считается генетически модифицированным (ГМ), а полученный объект представляет собой генетически модифицированный организм (ГМО). Первой ГМО была бактерия , созданная Гербертом Бойером и Стэнли Коэном в 1973 году. Рудольф Йениш создал первое ГМ-животное, когда в 1974 году ввел чужеродную ДНК в мышь . Первая компания, занимающаяся генной инженерией, Genentech , была основана в 1976 году и началось производство человеческих белков. Генно-инженерный человеческий инсулин был произведен в 1978 году, а инсулин-продуцирующие бактерии были коммерциализированы в 1982 году. Генетически модифицированные продукты питания продаются с 1994 года, с выпуском томатов Flavr Savr . Flavr Savr был разработан с расчетом на более длительный срок хранения, но большинство современных ГМ-культур модифицированы для повышения устойчивости к насекомым и гербицидам. GloFish , первый ГМО, созданный для домашних животных, был продан в США в декабре 2003 года. В 2016 году был продан лосось , модифицированный гормоном роста.
Генная инженерия применяется во многих областях, включая исследования, медицину, промышленную биотехнологию и сельское хозяйство. В исследованиях ГМО используются для изучения функции и экспрессии генов посредством потери функции, усиления функции, экспериментов по отслеживанию и экспрессии. Нокаутируя гены, ответственные за определенные состояния, можно создать на животных модельные организмы болезней человека. Помимо производства гормонов, вакцин и других лекарств, генная инженерия имеет потенциал для лечения генетических заболеваний с помощью генной терапии . Клетки яичника китайского хомячка (CHO) используются в промышленной генной инженерии. Кроме того, с помощью генной инженерии производятся мРНК-вакцины для лечения таких вирусов, как COVID-19 . Те же методы, которые используются для производства лекарств, также могут найти промышленное применение, например, при производстве ферментов для стиральных порошков, сыров и других продуктов.
Рост коммерциализации генетически модифицированных культур принёс экономическую выгоду фермерам во многих странах, но также стал источником большинства споров вокруг этой технологии. Это присутствовало с момента его раннего использования; первые полевые испытания были уничтожены активистами, выступающими против ГМ. Хотя существует научный консенсус в отношении того, что доступные в настоящее время продукты питания, полученные из ГМ-культур, не представляют большего риска для здоровья человека, чем обычные продукты питания, критики считают безопасность ГМ-продуктов главной проблемой. Поток генов , воздействие на нецелевые организмы, контроль над поставками продовольствия и права интеллектуальной собственности также были подняты в качестве потенциальных проблем. Эти опасения привели к разработке нормативной базы, которая началась в 1975 году. Это привело к международному договору, Картахенскому протоколу по биобезопасности , который был принят в 2000 году. Отдельные страны разработали свои собственные системы регулирования в отношении ГМО, включая Наиболее заметные различия происходят между США и Европой.
Генная инженерия : Процесс внедрения новой генетической информации в существующие клетки с целью модификации конкретного организма с целью изменения его характеристик.
Примечание : адаптировано из ссылки. [2] [3]
Генная инженерия — это процесс, который изменяет генетическую структуру организма путем удаления или введения ДНК или модификации существующего генетического материала in situ. В отличие от традиционной селекции животных и растений , которая включает в себя многократное скрещивание и последующий отбор организма с желаемым фенотипом , генная инженерия берет ген непосредственно из одного организма и доставляет его в другой. Это намного быстрее, может использоваться для вставки любых генов из любого организма (даже из разных доменов ) и предотвращает добавление других нежелательных генов. [4]
Генная инженерия потенциально может исправить серьезные генетические нарушения у людей, заменив дефектный ген функционирующим. [5] Это важный инструмент в исследованиях, который позволяет изучать функцию определенных генов. [6] Лекарства, вакцины и другие продукты были получены из организмов, созданных для их производства. [7] Были выведены сельскохозяйственные культуры , которые способствуют продовольственной безопасности за счет повышения урожайности, пищевой ценности и устойчивости к стрессам окружающей среды. [8]
ДНК может быть введена непосредственно в организм хозяина или в клетку, которая затем сливается или гибридизуется с хозяином. [9] Это основано на методах рекомбинантных нуклеиновых кислот для формирования новых комбинаций наследственного генетического материала с последующим включением этого материала либо косвенно через векторную систему, либо напрямую посредством микроинъекции , макроинъекции или микроинкапсуляции .
Генная инженерия обычно не включает традиционную селекцию, экстракорпоральное оплодотворение , индукцию полиплоидии , мутагенез и методы слияния клеток, в которых не используются рекомбинантные нуклеиновые кислоты или генетически модифицированный организм . [9] Однако некоторые широкие определения генной инженерии включают в себя селекцию . [10] Клонирование и исследование стволовых клеток , хотя и не считаются генной инженерией, [11] тесно связаны, и генная инженерия может использоваться в них. [12] Синтетическая биология — это новая дисциплина, которая продвигает генную инженерию на шаг дальше, вводя в организм искусственно синтезированный материал. [13]
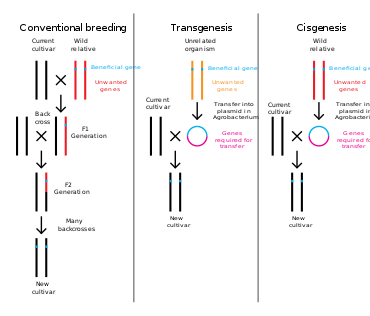
Растения, животные или микроорганизмы, измененные с помощью генной инженерии, называются генетически модифицированными организмами или ГМО. [14] Если к хозяину добавляется генетический материал другого вида, полученный организм называется трансгенным . Если используется генетический материал того же вида или вида, который может естественным образом скрещиваться с хозяином, полученный организм называется цисгенным . [15] Если генная инженерия используется для удаления генетического материала из целевого организма, полученный организм называется нокаутным организмом. [16] В Европе генетическая модификация является синонимом генной инженерии, тогда как в Соединенных Штатах Америки и Канаде генетическая модификация также может использоваться для обозначения более традиционных методов селекции. [17] [18] [19]
Люди изменяли геномы видов на протяжении тысячелетий посредством селекции или искусственного отбора [20] :1 [21] :1 в отличие от естественного отбора . Совсем недавно в мутационной селекции использовалось воздействие химических веществ или радиации для получения высокой частоты случайных мутаций в целях селекции. Генная инженерия как прямое манипулирование ДНК человеком без селекции и мутаций существует только с 1970-х годов. Термин «генная инженерия» был впервые введен генетиком российского происхождения Николаем Тимофеевым-Ресовским в его статье 1934 года «Экспериментальное производство мутаций», опубликованной в британском журнале Biological Reviews. [22] Джек Уильямсон использовал этот термин в своем научно-фантастическом романе «Остров Дракона», опубликованном в 1951 году [23] – за год до того, как роль ДНК в наследственности была подтверждена Альфредом Херши и Мартой Чейз , [24] и за два года до Джеймса Уотсона и Фрэнсиса. Крик показал, что молекула ДНК имеет структуру двойной спирали – хотя общая концепция прямых генетических манипуляций была исследована в рудиментарной форме в научно-фантастическом рассказе Стэнли Г. Вайнбаума 1936 года «Остров Протея» . [25] [26]

В 1972 году Пол Берг создал первые рекомбинантные молекулы ДНК, объединив ДНК обезьяньего вируса SV40 с ДНК вируса лямбда . [27] В 1973 году Герберт Бойер и Стэнли Коэн создали первый трансгенный организм , вставив гены устойчивости к антибиотикам в плазмиду бактерии Escherichia coli . [28] [29] Год спустя Рудольф Йениш создал трансгенную мышь , введя чужеродную ДНК в ее эмбрион, что сделало ее первым в мире трансгенным животным . [30] Эти достижения вызвали обеспокоенность в научном сообществе по поводу потенциальных рисков, связанных с генной инженерией, которая впервые подробно обсуждались на конференции Асиломар в 1975 году. Одной из основных рекомендаций этой встречи было установление государственного надзора за исследованиями рекомбинантной ДНК до тех пор, пока технология не будет признана безопасной. [31] [32]
В 1976 году Герберт Бойер и Роберт Суонсон основали Genentech, первую генно-инженерную компанию, а год спустя компания произвела человеческий белок ( соматостатин ) в E. coli . Компания Genentech объявила о производстве генно-инженерного человеческого инсулина в 1978 году. [33] В 1980 году Верховный суд США по делу Даймонд против Чакрабарти постановил, что генетически измененная жизнь может быть запатентована. [34] Инсулин , вырабатываемый бактериями, был одобрен к выпуску Управлением по контролю за продуктами и лекарствами (FDA) в 1982 году. [35]
В 1983 году биотехнологическая компания Advanced Genetic Sciences (AGS) подала заявку на разрешение правительства США на проведение полевых испытаний со штаммом Pseudomonas syringae без льда для защиты сельскохозяйственных культур от мороза, но группы защиты окружающей среды и протестующие отложили полевые испытания на четыре года из-за отсутствия льда. юридические проблемы. [36] В 1987 году штамм P. syringae без льда стал первым генетически модифицированным организмом (ГМО), выпущенным в окружающую среду [37] , когда им опрыскивали клубничное и картофельное поля в Калифорнии. [38] Оба испытательных поля подверглись нападению групп активистов в ночь перед проведением испытаний: «Первый в мире испытательный полигон привлек первого в мире полевого мусорщика». [37]
Первые полевые испытания генно-инженерных растений произошли во Франции и США в 1986 году. Табачные растения были созданы устойчивыми к гербицидам . [ 39] Китайская Народная Республика была первой страной, которая начала коммерциализировать трансгенные растения, представив устойчивый к вирусам табак в 1992 году . чтобы срок годности был больше. [41] В 1994 году Европейский Союз одобрил табак, созданный с учетом устойчивости к гербициду бромоксинилу , что сделало его первой генно-инженерной культурой, коммерциализированной в Европе. [42] В 1995 году Bt-картофель был признан безопасным Агентством по охране окружающей среды после одобрения FDA, что сделало его первой культурой, производящей пестициды, одобренной в США. [43] В 2009 году 11 трансгенных культур выращивались в коммерческих целях в 25 странах, крупнейшими из которых по площади выращивания были США, Бразилия, Аргентина, Индия, Канада, Китай, Парагвай и Южная Африка. [44]
В 2010 году ученые из Института Дж. Крейга Вентера создали первый синтетический геном и вставили его в пустую бактериальную клетку. Получившаяся в результате бактерия, получившая название Mycoplasma Laboratorium , смогла размножаться и производить белки. [45] [46] Четыре года спустя это было сделано еще дальше, когда была разработана бактерия, которая реплицировала плазмиду , содержащую уникальную пару оснований , создавая первый организм, созданный для использования расширенного генетического алфавита. [47] [48] В 2012 году Дженнифер Дудна и Эммануэль Шарпантье совместно разработали систему CRISPR/Cas9 , [49] [50] метод, который можно использовать для легкого и целенаправленного изменения генома практически любого организма. [51]

Создание ГМО — многоэтапный процесс. Генные инженеры должны сначала выбрать, какой ген они хотят вставить в организм. Это обусловлено целью создания полученного организма и основано на более ранних исследованиях. Можно провести генетический скрининг для определения потенциальных генов, а затем провести дальнейшие тесты для выявления лучших кандидатов. Развитие микрочипов , транскриптомики и секвенирования генома значительно облегчило поиск подходящих генов. [52] Удача также играет свою роль; Ген Roundup Ready был обнаружен после того, как ученые заметили, что бактерия процветает в присутствии гербицида. [53]
Следующим шагом является выделение гена-кандидата. Ячейку , содержащую ген, открывают и ДНК очищают. [54] Ген отделяют с помощью ферментов рестрикции для разрезания ДНК на фрагменты [55] или полимеразной цепной реакции (ПЦР) для амплификации сегмента гена. [56] Эти сегменты затем можно извлечь с помощью гель-электрофореза . Если выбранный ген или геном донорского организма хорошо изучен, он может быть уже доступен в генетической библиотеке . Если последовательность ДНК известна, но нет копий гена, его также можно синтезировать искусственно . [57] После выделения ген лигируется в плазмиду , которую затем встраивают в бактерию. Плазмида реплицируется при делении бактерий, обеспечивая доступность неограниченного количества копий гена. [58] Плазмида RK2 отличается своей способностью реплицироваться в самых разных одноклеточных организмах , что делает ее подходящей в качестве инструмента генной инженерии. [59]
Прежде чем ген будет внедрен в целевой организм, его необходимо объединить с другими генетическими элементами. К ним относятся промотор и терминаторная область, которые инициируют и завершают транскрипцию . Добавляется селектируемый маркерный ген, который в большинстве случаев придает устойчивость к антибиотикам , поэтому исследователи могут легко определить, какие клетки были успешно трансформированы. На этом этапе ген также можно модифицировать для лучшей экспрессии или эффективности. Эти манипуляции проводятся с использованием методов рекомбинантной ДНК , таких как рестриктазы , лигирование и молекулярное клонирование. [60]

Существует ряд методов, используемых для вставки генетического материала в геном хозяина. Некоторые бактерии могут естественным образом поглощать чужеродную ДНК . Эта способность может быть индуцирована у других бактерий посредством стресса (например, термического или электрического шока), который увеличивает проницаемость клеточной мембраны для ДНК; поглощенная ДНК может либо интегрироваться с геномом, либо существовать в виде внехромосомной ДНК . ДНК обычно вводят в клетки животных с помощью микроинъекций , при этом ее можно вводить через ядерную оболочку клетки непосредственно в ядро , или с помощью вирусных векторов . [61]
Геномы растений можно сконструировать физическими методами или с помощью Agrobacterium для доставки последовательностей, содержащихся в бинарных векторах Т-ДНК . В растения ДНК часто встраивают с помощью трансформации, опосредованной Agrobacterium , [ 62] с использованием последовательности Т-ДНК Agrobacterium , которая обеспечивает естественную вставку генетического материала в растительные клетки. [63] Другие методы включают биолистику , когда частицы золота или вольфрама покрывают ДНК и затем впрыскивают в молодые растительные клетки, [64] и электропорацию , которая включает использование электрического шока, чтобы сделать клеточную мембрану проницаемой для плазмидной ДНК.
Поскольку генетическим материалом трансформируется только одна клетка, организм должен быть регенерирован из этой единственной клетки. У растений это достигается за счет использования культуры тканей . [65] [66] У животных необходимо убедиться, что вставленная ДНК присутствует в эмбриональных стволовых клетках . [67] Бактерии состоят из одной клетки и размножаются клонально, поэтому регенерация не требуется. Селективные маркеры используются для облегчения дифференциации трансформированных клеток от нетрансформированных. Эти маркеры обычно присутствуют в трансгенном организме, хотя был разработан ряд стратегий, позволяющих удалить селектируемый маркер из зрелого трансгенного растения. [68]

Дальнейшее тестирование с использованием ПЦР, Саузерн-гибридизации и секвенирования ДНК проводится для подтверждения того, что организм содержит новый ген. [69] Эти тесты также могут подтвердить хромосомное расположение и количество копий вставленного гена. Наличие гена не гарантирует, что он будет экспрессироваться на соответствующих уровнях в ткани-мишени, поэтому также используются методы поиска и измерения продуктов гена (РНК и белка). К ним относятся нозерн-гибридизация , количественная ОТ-ПЦР , вестерн-блоттинг , иммунофлуоресценция , ИФА и фенотипический анализ. [70]
Новый генетический материал может быть случайным образом вставлен в геном хозяина или направлен в определенное место. Метод нацеливания на гены использует гомологичную рекомбинацию для внесения желаемых изменений в конкретный эндогенный ген. Это имеет тенденцию происходить с относительно низкой частотой у растений и животных и обычно требует использования селектируемых маркеров . Частоту нацеливания на гены можно значительно повысить за счет редактирования генома . Для редактирования генома используются искусственно созданные нуклеазы , которые создают специфические двухцепочечные разрывы в нужных местах генома и используют эндогенные механизмы клетки для восстановления индуцированного разрыва с помощью естественных процессов гомологичной рекомбинации и негомологичного соединения концов . Существует четыре семейства сконструированных нуклеаз: мегануклеазы , [71] [72] нуклеазы с цинковыми пальцами , [73] [74] эффекторные нуклеазы, подобные активаторам транскрипции (TALEN), [75] [76] и система Cas9-guideRNA (адаптированная из CRISPR ). [77] [78] TALEN и CRISPR являются двумя наиболее часто используемыми, и каждый из них имеет свои преимущества. [79] TALEN обладают большей целевой специфичностью, а CRISPR проще в разработке и более эффективен. [79] Помимо усиления нацеливания на гены, сконструированные нуклеазы можно использовать для введения мутаций в эндогенные гены, которые приводят к нокауту генов . [80] [81]
Генная инженерия находит применение в медицине, исследованиях, промышленности и сельском хозяйстве и может использоваться на широком спектре растений, животных и микроорганизмов. Бактерии , первые генетически модифицированные организмы, могут иметь встроенную плазмидную ДНК, содержащую новые гены, кодирующие лекарства, или ферменты, перерабатывающие пищу и другие субстраты . [82] [83] Растения были модифицированы для защиты от насекомых, устойчивости к гербицидам , устойчивости к вирусам, улучшения питания, устойчивости к давлению окружающей среды и производства съедобных вакцин . [84] Большинство коммерциализированных ГМО представляют собой сельскохозяйственные культуры, устойчивые к насекомым или гербицидам. [85] Генетически модифицированные животные использовались для исследований, модельных животных и производства сельскохозяйственной или фармацевтической продукции. К генетически модифицированным животным относятся животные с нокаутом генов , повышенной восприимчивостью к болезням , гормонами для дополнительного роста и способностью экспрессировать белки в молоке. [86]
Генная инженерия имеет множество применений в медицине, включая производство лекарств, создание моделей животных , имитирующих человеческие условия, и генную терапию . Одним из первых применений генной инженерии было массовое производство человеческого инсулина в бактериях. [33] В настоящее время эта заявка применяется к человеческим гормонам роста , фолликулостимулирующим гормонам (для лечения бесплодия), человеческому альбумину , моноклональным антителам , антигемофильным факторам , вакцинам и многим другим лекарствам. [87] [88] Мышиные гибридомы , клетки, слитые вместе для создания моноклональных антител , были адаптированы посредством генной инженерии для создания человеческих моноклональных антител. [89] Разрабатываются генно-инженерные вирусы , которые все еще могут обеспечивать иммунитет, но лишены инфекционных последовательностей . [90]
Генная инженерия также используется для создания животных моделей заболеваний человека. Генетически модифицированные мыши являются наиболее распространенной генетически модифицированной моделью животных. [91] Их использовали для изучения и моделирования рака ( онкомозных мышей ), ожирения, болезней сердца, диабета, артрита, злоупотребления психоактивными веществами, тревоги, старения и болезни Паркинсона. [92] Потенциальные методы лечения могут быть протестированы на этих моделях мышей.
Генная терапия — это генная инженерия человека , обычно заключающаяся в замене дефектных генов эффективными. Клинические исследования с использованием соматической генной терапии проводились при нескольких заболеваниях, включая Х-сцепленный ТКИД , [93] хронический лимфоцитарный лейкоз (ХЛЛ), [94] [95] и болезнь Паркинсона . [96] В 2012 году Alipogene typarvovec стал первым препаратом генной терапии, одобренным для клинического использования. [97] [98] В 2015 году вирус был использован для внедрения здорового гена в клетки кожи мальчика, страдающего редким заболеванием кожи, буллезным эпидермолизом , с целью роста, а затем пересадки здоровой кожи на 80 процентов кожи мальчика. Орган, пораженный болезнью. [99]
Генная терапия зародышевой линии приведет к тому, что любые изменения будут передаваться по наследству, что вызывает обеспокоенность в научном сообществе. [100] [101] В 2015 году CRISPR был использован для редактирования ДНК нежизнеспособных человеческих эмбрионов , [102] [103] ведущие учёные крупнейших мировых академий призвали к введению моратория на наследуемые правки генома человека. [104] Существуют также опасения, что эту технологию можно использовать не только для лечения, но и для улучшения, модификации или изменения внешнего вида, адаптируемости, интеллекта, характера или поведения человека. [105] Также может быть сложно провести различие между лечением и улучшением ситуации. [106] В ноябре 2018 года Хэ Цзянькуй объявил, что он отредактировал геномы двух человеческих эмбрионов, чтобы попытаться отключить ген CCR5 , который кодирует рецептор, который ВИЧ использует для проникновения в клетки. Работа была широко осуждена как неэтичная, опасная и преждевременная. [107] В настоящее время модификация зародышевой линии запрещена в 40 странах. Ученые, проводящие такого рода исследования, часто позволяют эмбрионам расти в течение нескольких дней, не позволяя им развиться в ребенка. [108]
Исследователи изменяют геном свиней, чтобы стимулировать рост человеческих органов, с целью повысить успешность трансплантации органов от свиней к человеку . [109] Ученые создают «генные драйвы», изменяя геномы комаров, чтобы сделать их невосприимчивыми к малярии, а затем стремятся распространить генетически измененные комары среди популяции комаров в надежде искоренить болезнь. [110]
Генная инженерия — важный инструмент для ученых-естествоиспытателей , а создание трансгенных организмов — один из важнейших инструментов анализа функции генов. [111] Гены и другая генетическая информация из широкого спектра организмов могут быть вставлены в бактерии для хранения и модификации, создавая в процессе генетически модифицированные бактерии . Бактерии дешевы, их легко выращивать, они клонируются , быстро размножаются, относительно легко трансформируются и могут храниться при температуре -80 °C практически неограниченное время. Как только ген выделен, он может храниться внутри бактерий, обеспечивая неограниченный запас для исследований. [112]
Организмы генетически модифицированы для обнаружения функций определенных генов. Это может быть влияние на фенотип организма, где экспрессируется ген или с какими другими генами он взаимодействует. Эти эксперименты обычно включают потерю функции, усиление функции, отслеживание и выражение.

Клетки организмов можно трансформировать с помощью гена, кодирующего полезный белок, например фермент, так что они будут сверхэкспрессировать желаемый белок. Массовые количества белка затем могут быть произведены путем выращивания трансформированного организма в биореакторном оборудовании с использованием промышленной ферментации и последующей очистки белка. [116] Некоторые гены плохо работают в бактериях, поэтому можно также использовать дрожжи, клетки насекомых или клетки млекопитающих. [117] Эти методы используются для производства лекарств, таких как инсулин , гормон роста человека и вакцин , добавок, таких как триптофан , вспомогательных средств в производстве продуктов питания ( химозин в производстве сыра) и топлива. [118] Другие применения генно-инженерных бактерий могут включать в себя выполнение ими задач, выходящих за рамки их естественного цикла, таких как производство биотоплива , [119] очистка разливов нефти, выбросов углекислого газа и других токсичных отходов [120] и обнаружение мышьяка в питьевой воде. [121] Некоторые генетически модифицированные микробы также могут использоваться в биодобыче и биоремедиации благодаря их способности извлекать тяжелые металлы из окружающей среды и включать их в соединения, которые легче восстановить. [122]
В материаловедении генетически модифицированный вирус был использован в исследовательской лаборатории в качестве основы для сборки более экологически чистой литий-ионной батареи . [123] [124] Бактерии также были созданы для функции сенсоров, экспрессируя флуоресцентный белок в определенных условиях окружающей среды. [125]

Одним из самых известных и противоречивых применений генной инженерии является создание и использование генетически модифицированных сельскохозяйственных культур или генетически модифицированного домашнего скота для производства генетически модифицированных продуктов питания . Культуры были разработаны для увеличения производства, повышения устойчивости к абиотическим стрессам , изменения состава продуктов питания или производства новых продуктов. [127]
Первые сельскохозяйственные культуры, которые были выпущены в продажу в больших масштабах, обеспечивали защиту от насекомых-вредителей и устойчивость к гербицидам . Также были разработаны или находятся в разработке устойчивые к грибкам и вирусам культуры. [128] [129] Это облегчает борьбу с насекомыми и сорняками на сельскохозяйственных культурах и может косвенно повысить урожайность сельскохозяйственных культур. [130] [131] ГМ-культуры, которые напрямую улучшают урожайность за счет ускорения роста или повышения выносливости растений (путем повышения устойчивости к соли, холоду или засухе), также находятся в стадии разработки. [132] В 2016 году лосось был генетически модифицирован гормонами роста, чтобы гораздо быстрее достичь нормального взрослого размера. [133]
Были разработаны ГМО, которые изменяют качество продукции, повышая пищевую ценность или обеспечивая более полезные для промышленности качества или количества. [132] Картофель «Амфлора» производит более полезную в промышленном отношении смесь крахмалов. Соевые бобы и канола были генетически модифицированы для производства более полезных масел. [134] [135] Первым коммерческим ГМ-продуктом был помидор , срок созревания которого был отсрочен, что увеличивало срок его хранения . [136]
Растения и животные были созданы для производства материалов, которые они обычно не производят. Фармирование использует сельскохозяйственные культуры и животных в качестве биореакторов для производства вакцин, промежуточных продуктов лекарств или самих лекарств; полезный продукт очищается от урожая и затем используется в стандартном процессе фармацевтического производства. [137] Коровы и козы были созданы для экспрессии лекарств и других белков в своем молоке, и в 2009 году FDA одобрило препарат, производимый из козьего молока. [138] [139]
Генная инженерия имеет потенциальное применение в охране природы и управлении природными территориями. Перенос генов через вирусные векторы был предложен как средство контроля инвазивных видов, а также вакцинации фауны, находящейся под угрозой исчезновения, от болезней. [140] Трансгенные деревья были предложены как способ придать устойчивость диким популяциям к патогенам. [141] В условиях растущего риска дезадаптации организмов в результате изменения климата и других возмущений, облегченная адаптация посредством настройки генов может стать одним из решений снижения риска вымирания. [142] Применение генной инженерии в сохранении природы пока носит в основном теоретический характер и еще не реализовано на практике.
Генная инженерия также используется для создания микробного искусства . [143] Некоторые бактерии были генетически модифицированы для создания черно-белых фотографий. [144] Такие новинки, как гвоздики лавандового цвета , [145] голубые розы , [146] и светящиеся рыбы [147] [148] также были созданы с помощью генной инженерии.
Регулирование генной инженерии касается подходов, применяемых правительствами для оценки и управления рисками, связанными с разработкой и выпуском ГМО. Разработка нормативной базы началась в 1975 году в Асиломаре , Калифорния. [149] Встреча в Асиломаре рекомендовала ряд добровольных рекомендаций относительно использования рекомбинантной технологии. [31] По мере совершенствования технологии в США был создан комитет при Управлении науки и технологий , [150] который передал нормативное одобрение ГМ-продуктов Министерству сельского хозяйства США, FDA и Агентству по охране окружающей среды. [151] Картахенский протокол по биобезопасности , международный договор, регулирующий передачу, обращение и использование ГМО, [152] был принят 29 января 2000 года . [153] Сто пятьдесят семь стран являются членами Протокола. и многие используют его в качестве отправной точки для своих собственных правил. [154]
Правовой и нормативный статус ГМ-продуктов варьируется в зависимости от страны: некоторые страны запрещают или ограничивают их, а другие разрешают их с совершенно разной степенью регулирования. [155] [156] [157] [158] Некоторые страны разрешают импорт ГМ-продуктов при наличии разрешения, но либо не разрешают их выращивание (Россия, Норвегия, Израиль), либо имеют условия для выращивания, хотя ГМ-продукты еще не производятся. (Япония, Южная Корея). Большинство стран, где не разрешено выращивание ГМО, разрешают исследования. [159] Некоторые из наиболее заметных различий наблюдаются между США и Европой. Политика США фокусируется на продукте (а не на процессе), рассматривает только поддающиеся проверке научные риски и использует концепцию существенной эквивалентности . [160] Европейский Союз, напротив, имеет, возможно, самые строгие правила в мире по ГМО. [161] Все ГМО, наряду с облученными продуктами питания , считаются «новыми продуктами питания» и подлежат тщательной, индивидуальной, научно обоснованной оценке пищевых продуктов Европейским управлением по безопасности пищевых продуктов . Критерии авторизации делятся на четыре широкие категории: «безопасность», «свобода выбора», «маркировка» и «отслеживаемость». [162] Уровень регулирования в других странах, выращивающих ГМО, находится между Европой и Соединенными Штатами.
Один из ключевых вопросов, волнующих регулирующих органов, заключается в том, следует ли маркировать ГМ-продукты. Европейская комиссия заявляет, что обязательная маркировка и отслеживание необходимы, чтобы обеспечить осознанный выбор, избежать потенциальной ложной рекламы [173] и облегчить отзыв продукции в случае обнаружения вредного воздействия на здоровье или окружающую среду. [174] Американская медицинская ассоциация [175] и Американская ассоциация содействия развитию науки [176] заявляют, что отсутствие научных доказательств вреда, даже добровольная маркировка, вводит в заблуждение и вызывает ложную тревогу у потребителей. Маркировка продуктов с ГМО на рынке требуется в 64 странах. [177] Маркировка может быть обязательной до достижения порогового уровня содержания ГМ (который варьируется в зависимости от страны) или добровольной. В Канаде и США маркировка ГМО-продуктов является добровольной, [178] тогда как в Европе все продукты питания (включая обработанные пищевые продукты ) или корма , которые содержат более 0,9% одобренных ГМО, должны быть маркированы. [161]
Критики возражали против использования генной инженерии по нескольким причинам, включая этические, экологические и экономические соображения. Многие из этих проблем связаны с ГМ-культурами, безопасностью продуктов питания, произведенных из них, и тем, какое влияние их выращивание окажет на окружающую среду. Эти разногласия привели к судебным разбирательствам, международным торговым спорам и протестам, а также к ограничительному регулированию коммерческой продукции в некоторых странах. [179]
С самого начала этой технологии приписывали обвинения в том, что ученые « играют в Бога » и другие религиозные вопросы . [180] Другие поднятые этические вопросы включают патентование жизни , [181] использование прав интеллектуальной собственности , [182] уровень маркировки продуктов, [183] [184] контроль поставок продуктов питания [185] и объективность. процесса регулирования. [186] Хотя были высказаны сомнения, [187] с экономической точки зрения большинство исследований показали, что выращивание ГМ-культур приносит пользу фермерам. [188] [189] [190]
Поток генов между ГМ-культурами и совместимыми растениями, наряду с более широким использованием селективных гербицидов , может увеличить риск развития « суперсорняков ». [191] Другие экологические проблемы включают потенциальное воздействие на нецелевые организмы, включая почвенные микробы , [192] и увеличение числа вторичных и устойчивых насекомых-вредителей. [193] [194] Для понимания многих последствий воздействия ГМ-культур на окружающую среду может потребоваться много лет, и они также очевидны в традиционных методах ведения сельского хозяйства. [192] [195] В связи с коммерциализацией генетически модифицированной рыбы возникают опасения по поводу того, какими будут экологические последствия в случае ее бегства. [196]
Существует три основных опасения по поводу безопасности генетически модифицированных продуктов питания: могут ли они спровоцировать аллергическую реакцию ; могут ли гены переноситься из пищи в клетки человека; и могут ли гены, не одобренные для потребления человеком, передаться другим культурам. [197] Существует научный консенсус [198] [199] [200] [201] о том, что доступные в настоящее время продукты питания, полученные из ГМ-культур, не представляют большего риска для здоровья человека, чем обычные продукты питания, [202] [203] [204] [205 ] ] [206] , но каждый ГМ-продукт перед внедрением необходимо тестировать в каждом конкретном случае. [207] [208] [209] Тем не менее, представители общественности менее склонны, чем ученые, воспринимать ГМ-продукты как безопасные. [210] [211] [212] [213]
Генная инженерия присутствует во многих научно-фантастических рассказах. [214] В романе Фрэнка Герберта «Белая чума» описывается преднамеренное использование генной инженерии для создания патогена , специально убивающего женщин. [214] Еще одно творение Герберта, серия романов «Дюна» , использует генную инженерию для создания могущественного Тлейлакса . [215] Лишь немногие фильмы информировали зрителей о генной инженерии, за исключением « Мальчиков из Бразилии» 1978 года и «Парка Юрского периода» 1993 года , в обоих из которых используются урок, демонстрация и отрывок из научного фильма. [216] [217] Методы генной инженерии слабо представлены в кино; Майкл Кларк, пишущий для Wellcome Trust , называет изображение генной инженерии и биотехнологии «серьезно искаженным» [217] в таких фильмах, как «Шестой день» . По мнению Кларка, биотехнологии обычно «придаются фантастические, но визуально захватывающие формы», в то время как наука либо отодвигается на второй план, либо выдумывается, чтобы удовлетворить молодую аудиторию. [217]
В видеоигре BioShock 2007 года генная инженерия играет важную роль в центральной сюжетной линии и вселенной. Действие игры происходит в вымышленной подводной антиутопии Rapture , жители которой обладают генетическими сверхчеловеческими способностями после инъекции себе «плазмид» — сыворотки, наделяющей такие способности. Также в городе Восторг есть «Маленькие сестры», маленькие девочки, созданные с помощью общей инженерии, а также побочный сюжет, в котором певица кабаре продает свой плод ученым-генетикам, которые имплантируют новорожденному ложные воспоминания и генетически модифицируют его, чтобы он рос. во взрослого.
Генная инженерия: манипулирование генетическими ресурсами организма путем введения или удаления определенных генов с помощью современных методов молекулярной биологии.
Широкое определение генной инженерии также включает в себя селекцию и другие средства искусственного отбора.
{{cite web}}: CS1 maint: bot: original URL status unknown (link){{cite journal}}: |author1=имеет общее имя ( справка ). Маркировка должна включать объективную информацию о том, что продукт питания или корм состоит из ГМО, содержит их или произведен из них.
Четкая маркировка, независимо от возможности обнаружения ДНК или белка, возникшего в результате генетической модификации конечного продукта, отвечает требованиям, выраженным в многочисленных опросах подавляющего большинства потребителей, облегчает осознанный выбор и исключает потенциальное введение потребителей в заблуждение относительно методов производства или производство.
(3) Требования к отслеживаемости ГМО должны способствовать как изъятию продуктов, в которых установлено непредвиденное неблагоприятное воздействие на здоровье человека, животных или окружающую среду, включая экосистемы, так и целенаправленному мониторингу для изучения потенциального воздействия, в частности, на окружающую среду. .
Прослеживаемость должна также способствовать осуществлению мер по управлению рисками в соответствии с принципом предосторожности.
(4) Должны быть установлены требования к отслеживаемости продуктов питания и кормов, произведенных из ГМО, чтобы облегчить точную маркировку таких продуктов.
Мы проанализировали научную литературу по безопасности ГМ-растений за последние 10 лет, которая отражает научный консенсус, сложившийся с тех пор, как ГМ-растения стали широко культивироваться во всем мире, и можем заключить, что научные исследования, проведенные до сих пор, не выявили каких-либо значительная опасность, напрямую связанная с использованием ГМ-культур.
Литература о биоразнообразии и потреблении ГМ-продуктов/кормов иногда приводила к оживленным дебатам относительно пригодности экспериментальных планов, выбора статистических методов или публичной доступности данных.
Такие дебаты, даже если они позитивны и являются частью естественного процесса рассмотрения научным сообществом, часто искажаются средствами массовой информации и часто используются политически и ненадлежащим образом в кампаниях против ГМ-культур.
Доступные в настоящее время трансгенные культуры и продукты, полученные из них, признаны безопасными для употребления в пищу, а методы, использованные для проверки их безопасности, признаны подходящими.
Эти выводы представляют собой консенсус научных данных, исследованных МСНС (2003 г.), и согласуются с мнением Всемирной организации здравоохранения (ВОЗ, 2002 г.).
Эти продукты питания были оценены на предмет повышенного риска для здоровья человека несколькими национальными регулирующими органами (в частности, Аргентиной, Бразилией, Канадой, Китаем, Великобританией и США) с использованием своих национальных процедур безопасности пищевых продуктов (ICSU).
На сегодняшний день нигде в мире не обнаружено никаких поддающихся проверке неблагоприятных токсических или вредных для питания последствий употребления продуктов, полученных из генетически модифицированных культур (GM Science Review Panel).
Многие миллионы людей потребляли продукты, полученные из ГМ-растений – в основном кукурузы, сои и рапса – без каких-либо побочных эффектов (ICSU).
Существует широкий научный консенсус в отношении того, что генетически модифицированные культуры, представленные в настоящее время на рынке, безопасны для употребления в пищу.
После 14 лет выращивания и общей засеянной площади в 2 миллиарда акров коммерциализация генно-инженерных культур не привела к каким-либо неблагоприятным последствиям для здоровья или окружающей среды (Совет по сельскому хозяйству и природным ресурсам, Комитет по воздействию на окружающую среду, связанному с коммерциализацией трансгенных растений, Национальное исследование). Совет и Отдел исследований Земли и жизни, 2002).
И Национальный исследовательский совет США, и Объединенный исследовательский центр (научно-техническая исследовательская лаборатория Европейского Союза и неотъемлемая часть Европейской комиссии) пришли к выводу, что существует всеобъемлющий массив знаний, который адекватно решает проблему безопасности пищевых продуктов, связанных с генетически модифицированными культурами. (Комитет по выявлению и оценке непреднамеренного воздействия генетически модифицированных продуктов питания на здоровье человека и Национальный исследовательский совет, 2004 г.; Объединенный исследовательский центр Европейской комиссии, 2008 г.).
В этих и других недавних отчетах делается вывод, что процессы генной инженерии и традиционной селекции ничем не отличаются с точки зрения непредвиденных последствий для здоровья человека и окружающей среды (Генеральный директорат по исследованиям и инновациям Европейской комиссии, 2010).
Несмотря на это, количество исследований, специально посвященных оценке безопасности ГМ-растений, по-прежнему ограничено.
Однако важно отметить, что впервые наблюдается определенное равновесие в количестве исследовательских групп, предполагающих на основе своих исследований, что ряд сортов ГМ-продуктов (в основном кукурузы и соевых бобов) столь же безопасны и питательны. как соответствующие обычные растения, не содержащие ГМО, так и растения, вызывающие по-прежнему серьезные опасения.
Более того, стоит отметить, что большинство исследований, демонстрирующих, что ГМ-продукты столь же питательны и безопасны, как и те, что получены путем традиционной селекции, были проведены биотехнологическими компаниями или их партнерами, которые также несут ответственность за коммерциализацию этих ГМ-растений.
В любом случае, это представляет собой заметный прогресс по сравнению с отсутствием исследований, опубликованных в последние годы в научных журналах этими компаниями.Крымский С (2015). «Иллюзорный консенсус по оценке здоровья ГМО» (PDF) . Наука, технологии и человеческие ценности . 40 (6): 883–914. дои : 10.1177/0162243915598381. S2CID 40855100. Архивировано из оригинала (PDF) 7 февраля 2016 года . Проверено 30 октября 2016 г.
Я начал эту статью с свидетельств уважаемых ученых о том, что фактически не существует научных разногласий по поводу воздействия ГМО на здоровье. Мое исследование научной литературы рассказывает другую историю.И контраст: Панчин А.Ю., Тужиков А.И. (март 2017). «Опубликованные исследования ГМО не обнаруживают никаких доказательств вреда с учетом множественных сравнений». Критические обзоры по биотехнологии . 37 (2): 213–217. дои : 10.3109/07388551.2015.1130684. PMID 26767435. S2CID 11786594.
Здесь мы показываем, что ряд статей, некоторые из которых сильно и негативно повлияли на общественное мнение о ГМ-культурах и даже спровоцировали политические действия, такие как эмбарго на ГМО, имеют общие недостатки в статистической оценке данных. .
Учтя эти недостатки, мы приходим к выводу, что данные, представленные в этих статьях, не предоставляют каких-либо существенных доказательств вреда ГМО.
Представленные статьи, предполагающие возможный вред ГМО, вызвали большой общественный резонанс.
Однако, несмотря на свои заявления, они фактически ослабляют доказательства вреда и отсутствия существенной эквивалентности изучаемых ГМО.
Мы подчеркиваем, что, учитывая более 1783 опубликованных статей о ГМО за последние 10 лет, ожидается, что некоторые из них должны были сообщать о нежелательных различиях между ГМО и обычными сельскохозяйственными культурами, даже если таких различий в действительности не существует.и Ян Ю.Т., Чен Б. (апрель 2016 г.). «Регулирование ГМО в США: наука, право и общественное здравоохранение». Журнал науки о продовольствии и сельском хозяйстве . 96 (6): 1851–5. Бибкод : 2016JSFA...96.1851Y. doi : 10.1002/jsfa.7523. PMID 26536836.
Поэтому неудивительно, что усилия по требованию маркировки и запрету ГМО стали растущей политической проблемой в США
(со ссылкой на Domingo and Bordonaba, 2011)
.
В целом, широкий научный консенсус заключается в том, что продаваемые в настоящее время ГМО-продукты не представляют большего риска, чем обычные продукты питания. рассмотрел литературу на сегодняшний день.
Несмотря на различные опасения, сегодня Американская ассоциация содействия развитию науки, Всемирная организация здравоохранения и многие независимые международные научные организации согласны с тем, что ГМО так же безопасны, как и другие продукты питания.
По сравнению с традиционными методами селекции генная инженерия гораздо более точна и в большинстве случаев с меньшей вероятностью приведет к неожиданному результату.
ЕС, например, инвестировал более 300 миллионов евро в исследования биобезопасности ГМО.
В его недавнем отчете говорится: «Основной вывод, который можно сделать на основе усилий более чем 130 исследовательских проектов, охватывающих период более 25 лет исследований и с участием более 500 независимых исследовательских групп, заключается в том, что биотехнология, и в частности ГМО, сами по себе не более рискованны, чем, например, традиционные технологии селекции растений».
Всемирная организация здравоохранения, Американская медицинская ассоциация, Национальная академия наук США, Британское королевское общество и все другие уважаемые организации, исследовавшие доказательства, пришли к одному и тому же выводу: употребление продуктов, содержащих ингредиенты, полученные из ГМ-культур, не является более рискованным. чем потреблять те же продукты, содержащие ингредиенты из сельскохозяйственных культур, модифицированных традиционными методами улучшения растений.Пинхолстер Дж. (25 октября 2012 г.). «Совет директоров AAAS: Законодательное введение маркировки ГМ-продуктов может «ввести в заблуждение и вызвать ложную тревогу потребителей»». Американская ассоциация содействия развитию науки . Проверено 8 февраля 2016 г.
В отчете, опубликованном научным советом Американской медицинской ассоциации (АМА), говорится, что не было обнаружено никаких долгосрочных последствий для здоровья от использования трансгенных культур и генетически модифицированных продуктов, и что эти продукты по существу эквивалентны своим традиционным аналогам.
(из онлайн-сводки, подготовленной
ISAAA
)
««Урожайные культуры и продукты питания, произведенные с использованием методов рекомбинантной ДНК, доступны менее 10 лет, и на сегодняшний день не обнаружено никаких долгосрочных последствий.
Эти продукты по существу эквивалентны своим обычным аналогам.
«Отчет 2 Совета по науке и общественному здравоохранению (A-12): Маркировка биоинженерных продуктов питания» (PDF) . Американская медицинская ассоциация. 2012. Архивировано из оригинала 7 сентября 2012 года . Проверено 19 марта 2016 г.
Биоинженерные продукты употребляются в пищу уже около 20 лет, и за это время в рецензируемой литературе не сообщалось и/или не подтверждалось никаких явных последствий для здоровья человека.
{{cite web}}: CS1 maint: bot: original URL status unknown (link)Несколько научных организаций в США опубликовали исследования или заявления относительно безопасности ГМО, указывающие на отсутствие доказательств того, что ГМО представляют собой уникальные риски для безопасности по сравнению с продуктами, выведенными традиционным способом.
К ним относятся Национальный исследовательский совет, Американская ассоциация содействия развитию науки и Американская медицинская ассоциация.
Группы в США, выступающие против ГМО, включают некоторые экологические организации, организации органического земледелия и организации потребителей.
Значительное количество ученых-юристов раскритиковали подход США к регулированию ГМО.
Общий вывод о предполагаемом неблагоприятном воздействии пищевых продуктов, полученных из ГМ-культур, на здоровье человека: На основе детального изучения сравнений коммерциализированных в настоящее время ГМ-продуктов с не-ГМ-продуктами при композиционном анализе, тестах на острую и хроническую токсичность на животных, долгосрочных данных о здоровье. среди животных, скармливаемых ГМ-продуктами, и эпидемиологических данных о людях, комитет не обнаружил различий, которые указывали бы на более высокий риск для здоровья человека от ГМ-продуктов, чем от их не-ГМ-продуктов.
Различные ГМ-организмы включают в себя разные гены, вставленные разными способами.
Это означает, что отдельные ГМ-продукты и их безопасность должны оцениваться в каждом конкретном случае и что невозможно сделать общие заявления о безопасности всех ГМ-продуктов.
ГМ-продукты, доступные в настоящее время на международном рынке, прошли оценку безопасности и вряд ли представляют риск для здоровья человека.
Кроме того, не было выявлено никакого воздействия на здоровье человека в результате потребления таких продуктов населением в странах, где они были одобрены.
Постоянное применение оценок безопасности, основанных на принципах Кодекса Алиментариус, и, при необходимости, адекватный постмаркетинговый мониторинг должны формировать основу для обеспечения безопасности ГМ-продуктов.
Эти принципы предписывают проводить предрыночную оценку в каждом конкретном случае, которая включает оценку как прямых, так и непреднамеренных последствий.
По нашему мнению, потенциальная возможность вредного воздействия ГМ-продуктов на здоровье очень мала, и многие из высказанных опасений в равной степени применимы и к продуктам, полученным традиционным способом.
Однако на основании имеющейся в настоящее время информации пока нельзя полностью игнорировать вопросы безопасности.
Стремясь оптимизировать баланс между выгодами и рисками, разумно проявлять осторожность и, прежде всего, учиться на накопленных знаниях и опыте.
Любая новая технология, такая как генетическая модификация, должна быть проверена на предмет возможных преимуществ и рисков для здоровья человека и окружающей среды.
Как и в случае со всеми новыми продуктами питания, оценка безопасности ГМ-продуктов должна проводиться в каждом конкретном случае.
Члены жюри проекта GM были проинформированы о различных аспектах генетической модификации разнообразной группой признанных экспертов в соответствующих областях.
ГМ-жюри пришло к выводу, что продажа имеющихся в настоящее время ГМ-продуктов должна быть остановлена и продлен мораторий на коммерческое выращивание ГМ-культур.
Эти выводы были основаны на принципе предосторожности и отсутствии доказательств какой-либо пользы.
Жюри выразило обеспокоенность по поводу воздействия ГМ-культур на сельское хозяйство, окружающую среду, безопасность пищевых продуктов и другие потенциальные последствия для здоровья.
Обзор Королевского общества (2002) пришел к выводу, что риски для здоровья человека, связанные с использованием специфических последовательностей вирусной ДНК в ГМ-растениях, незначительны, и, призывая к осторожности при внесении потенциальных аллергенов в продовольственные культуры, подчеркнул отсутствие доказательств того, что коммерчески доступные ГМ-продукты вызывают клинические аллергические проявления.
BMA разделяет мнение, что не существует убедительных доказательств того, что ГМ-продукты небезопасны, но мы поддерживаем призыв к дальнейшим исследованиям и надзору, чтобы предоставить убедительные доказательства безопасности и пользы.
Самые большие различия между общественностью и учеными AAAS обнаруживаются в убеждениях о безопасности употребления в пищу генетически модифицированных (ГМ) продуктов.
Почти девять из десяти (88%) ученых говорят, что употребление ГМ-продуктов в целом безопасно, по сравнению с 37% населения в целом, разница составляет 51 процентный пункт.