Нейросенсорная тугоухость ( СНСТ ) — это тип тугоухости , первопричина которой лежит во внутреннем ухе , органе чувств ( улитке и связанных с ним структурах) или преддверно-улитковом нерве ( VIII черепном нерве ). На СНХС приходится около 90% зарегистрированных случаев потери слуха. [ нужна цитация ] SNHL обычно является постоянным и может быть легкой, умеренной, тяжелой, глубокой или тотальной. В зависимости от формы аудиограммы могут использоваться различные другие дескрипторы , такие как высокочастотный, низкочастотный, U-образный, зубчатый, остроконечный или плоский.
Сенсорная потеря слуха часто возникает вследствие повреждения или недостаточности волосковых клеток улитки . [ оспаривается – обсуждается ] Волосковые клетки могут быть аномальными при рождении или повреждены в течение жизни человека. Существуют как внешние причины поражения, включая инфекции и ототоксичные препараты, так и внутренние причины, включая генетические мутации . Распространенной причиной или усугубляющим фактором СНСП является длительное воздействие шума окружающей среды или вызванная шумом потеря слуха . Воздействие одного очень громкого шума, такого как выстрел или взрыв бомбы, может вызвать потерю слуха, вызванную шумом. Использование наушников на высокой громкости в течение длительного времени или регулярное пребывание в шумных местах, например, на шумном рабочем месте, на спортивных мероприятиях, концертах и использовании шумных машин, также может быть риском потери слуха, вызванной шумом.
Нервная , или «ретрокохлеарная», потеря слуха возникает из-за повреждения улиткового нерва (CVIII). Это повреждение может повлиять на возникновение нервного импульса в улитковом нерве или на передачу нервного импульса по нерву в ствол мозга .
В большинстве случаев СНСП проявляется постепенным ухудшением порога слышимости, происходящим в течение многих лет или десятилетий. В некоторых случаях потери могут в конечном итоге затронуть большие части частотного диапазона . Это может сопровождаться другими симптомами, такими как звон в ушах ( тиннитус ) и головокружение или дурнота ( вертиго ). Наиболее распространенным видом нейросенсорной тугоухости является возрастная ( пресбиакузис ), за которой следует тугоухость, вызванная шумом (NIHL).
Частыми симптомами СНХЛ являются потеря остроты различения голосов на переднем плане на шумном фоне, трудности с пониманием по телефону, некоторые виды звуков кажутся чрезмерно громкими или пронзительными, трудности с пониманием некоторых частей речи ( фрикативных и шипящих ), потеря направленности звука ( особенно при звуках высокой частоты), восприятие того, что люди бормочут во время разговора, и трудности с пониманием речи. Подобные симптомы связаны и с другими видами потери слуха; аудиометрия или другие диагностические тесты необходимы, чтобы отличить нейросенсорную тугоухость.
Выявление нейросенсорной тугоухости обычно производится путем проведения чистотональной аудиометрии (аудиограммы), при которой измеряются пороги костной проводимости. Могут быть полезны тимпанометрия и речевая аудиометрия . Тестирование проводит врач-сурдолог .
Не существует проверенного или рекомендуемого лечения СНХЛ; управление потерей слуха обычно осуществляется с помощью слуховых стратегий и слуховых аппаратов. В случаях глубокой или полной глухоты кохлеарный имплантат представляет собой специализированное устройство, которое может восстановить функциональный уровень слуха. SNHL, по крайней мере, частично можно предотвратить, избегая шума окружающей среды, ототоксичных химикатов и лекарств, травм головы, а также леча или прививки от определенных провоцирующих заболеваний и состояний, таких как менингит .
Поскольку внутреннее ухо не имеет прямого доступа к инструментам, идентификация осуществляется по отчету пациента о симптомах и аудиометрическому тестированию. Из тех, кто обращается к врачу с нейросенсорной тугоухостью, 90% сообщают о снижении слуха, 57% сообщают о чувстве заложенности в ушах и 49% сообщают о звоне в ушах ( тиннитусе ). Около половины сообщают о вестибулярных проблемах (головокружении). [ нужна цитата ]
Для детального описания симптомов, полезных для скрининга, Американская академия отоларингологии разработала анкету самооценки , названную «Опросник нарушений слуха для взрослых» (HHIA). Это опрос из 25 вопросов о субъективных симптомах. [1]
Нейросенсорная тугоухость может быть генетической или приобретенной (т.е. вследствие заболевания, шума, травмы и т. д.). У людей может быть потеря слуха с рождения ( врожденная ) или потеря слуха может возникнуть позже. Многие случаи связаны со старостью (возрастными). [ нужна цитата ]
Потеря слуха может передаваться по наследству. В возникновении глухоты участвуют более 40 генов. [2] Существует 300 синдромов, связанных с потерей слуха, и каждый синдром может иметь причинные гены. [ нужна цитата ]
Рецессивные , доминантные , Х-сцепленные или митохондриальные генетические мутации могут влиять на структуру или метаболизм внутреннего уха. Некоторые из них могут быть единичными точечными мутациями , тогда как другие возникают из-за хромосомных аномалий . Некоторые генетические причины вызывают позднюю потерю слуха. Митохондриальные мутации могут вызывать SNHL iem1555A>G, что делает человека чувствительным к ототоксическим эффектам аминогликозидных антибиотиков .
Прогрессирующая возрастная потеря остроты или чувствительности слуха может начаться уже в 18 лет, в первую очередь затрагивая высокие частоты, причем чаще у мужчин, чем у женщин. [6] Такие потери могут стать очевидными только в более позднем возрасте. Пресбиакузис на сегодняшний день является доминирующей причиной нейросенсорной тугоухости в промышленно развитых странах. Исследование, проведенное в Судане, где население не подвергается воздействию громкого шума, обнаружило значительно меньше случаев потери слуха по сравнению со случаями того же возраста в промышленно развитой стране. [7] Аналогичные результаты были получены в ходе исследования, проведенного среди населения острова Пасхи, которое сообщило об ухудшении слуха среди тех, кто проводил время в промышленно развитых странах, по сравнению с теми, кто никогда не покидал остров. [8] Исследователи утверждают, что такие результаты, возможно, также способствовали и другим факторам, помимо различий в воздействии шума, например, генетическому составу. [9] Потеря слуха, которая ухудшается с возрастом, но вызвана факторами, отличными от нормального старения, такими как потеря слуха, вызванная шумом, не является пресбиакузисом, хотя дифференциация индивидуальных эффектов множественных причин потери слуха может быть затруднена. Каждый третий человек к 65 годам страдает значительной потерей слуха; к 75 годам — каждый второй. Возрастную потерю слуха невозможно предотвратить и обратить вспять.
Большинство людей, живущих в современном обществе, имеют некоторую степень прогрессирующей нейросенсорной (то есть постоянной) тугоухости, вызванной шумом (NIHL), возникающей в результате перегрузки и повреждения сенсорного или нервного аппарата слуха во внутреннем ухе. [ нужна цитация ] NIHL обычно представляет собой выпадение или вырез с центром на частоте 4000 Гц. Как интенсивность (SPL), так и продолжительность воздействия, а также повторяющееся воздействие небезопасных уровней шума способствуют повреждению улитки, которое приводит к потере слуха. Чем громче шум, тем короче безопасное время воздействия. NIHL может быть постоянным или временным, называемым сдвигом порога. Небезопасный уровень шума может составлять всего 70 дБ (примерно в два раза громче обычного разговора) при длительном (24 часа) или непрерывном воздействии. 125 дБ (громкий рок-концерт ~120 дБ) — уровень боли; звуки выше этого уровня вызывают мгновенное и необратимое повреждение ушей. [ нужна цитата ]
Шум и старение являются основными причинами пресбиакузиса , или возрастной потери слуха, наиболее распространенного вида потери слуха в индустриальном обществе. [10] [ нужна ссылка ] Опасность воздействия экологического и профессионального шума широко признана. Многочисленные национальные и международные организации установили стандарты безопасного уровня воздействия шума в промышленности, окружающей среде, военной сфере, на транспорте, в сельском хозяйстве, горнодобывающей промышленности и других областях. [Примечание 1] Интенсивность звука или уровень звукового давления (SPL) измеряется в децибелах (дБ). Для справки:
Увеличение на 6 дБ представляет собой удвоение уровня звукового давления или энергии звуковой волны и, следовательно, ее склонности вызывать повреждение ушей. Поскольку человеческие уши слышат логарифмически, а не линейно, требуется увеличение на 10 дБ, чтобы звук воспринимался вдвое громче. Повреждение ушей из-за шума пропорционально интенсивности звука, а не воспринимаемой громкости, поэтому ошибочно полагаться на субъективное восприятие громкости как на показатель риска для слуха, т. е. можно существенно недооценивать опасность.
Хотя стандарты умеренно различаются по уровням интенсивности и продолжительности воздействия, которые считаются безопасными, можно вывести некоторые рекомендации. [Заметка 2]
Безопасная величина воздействия снижается в 2 раза при каждом повышении уровня звукового давления (3 дБ для стандарта NIOSH или 5 дБ для стандарта OSHA ). Например, безопасное ежедневное воздействие при уровне 85 дБ (90 дБ для OSHA) составляет 8 часов, тогда как безопасное воздействие при 94 дБ(А) (уровень ночного клуба) составляет всего 1 час. Шумовая травма также может вызвать обратимую потерю слуха, называемую временным сдвигом порога. Обычно это происходит у людей, которые подвергаются стрельбе или петардам и после этого слышат звон в ушах ( тиннитус ).
Некоторые лекарства, отпускаемые без рецепта, а также лекарства, отпускаемые по рецепту, и некоторые промышленные химикаты ототоксичны. Воздействие этих веществ может привести к временной или постоянной потере слуха.
Некоторые лекарства вызывают необратимое повреждение уха, и по этой причине их применение ограничено. Наиболее важной группой являются аминогликозиды (основной представитель гентамицин ). Редкая митохондриальная мутация m.1555A>G может повысить восприимчивость человека к ототоксическому эффекту аминогликозидов. Известно, что длительное злоупотребление гидрокодоном (викодином) вызывает быстро прогрессирующую нейросенсорную тугоухость, обычно без вестибулярных симптомов. Метотрексат , химиотерапевтический агент, также известен как причина потери слуха. В большинстве случаев потеря слуха не восстанавливается после прекращения приема препарата. Парадоксально, но метотрексат также используется для лечения воспалительной тугоухости, вызванной аутоиммунными заболеваниями. [ нужна цитата ]
Различные другие лекарства могут обратимо ухудшить слух. Сюда входят петлевые диуретики , силденафил (Виагра), высокие или продолжительные дозы НПВП ( аспирин , ибупрофен , напроксен и различные рецептурные препараты: целекоксиб и др.), хинин и макролидные антибиотики ( эритромицин и др.). Цитотоксические агенты, такие как карбоплатина, используемые для лечения злокачественных новообразований, могут вызывать дозозависимую СНХЛ, равно как и такие лекарства, как десферриоксамин, используемые при гематологических заболеваниях, таких как талассемия; пациентам, которым назначены эти препараты, необходимо контролировать слух. [ нужна цитата ]
Длительное или повторяющееся воздействие ототоксичных химических веществ в окружающей среде или на работе также может привести к нейросенсорной тугоухости. Некоторые из этих химикатов:
Может быть повреждено либо само ухо, либо центральные слуховые пути, которые обрабатывают информацию, передаваемую ушами. Люди, получившие травму головы, подвержены потере слуха или шуму в ушах, как временному, так и постоянному. Контактные виды спорта, такие как футбол (НФЛ США), хоккей и крикет, часто приводят к травмам головы (сотрясениям мозга). В одном опросе вышедших на пенсию игроков НФЛ, каждый из которых сообщил об одном или нескольких сотрясениях мозга за свою игровую карьеру, у 25% была потеря слуха, а у 50% - шум в ушах. [ нужна цитата ]
Они гораздо чаще встречаются у недоношенных детей, особенно у детей с массой тела менее 1500 г при рождении. Преждевременные роды могут быть связаны с проблемами, которые приводят к нейросенсорной потере слуха, такими как аноксия или гипоксия (низкий уровень кислорода), желтуха, внутричерепные кровоизлияния, менингит. Сообщается, что фетальный алкогольный синдром вызывает потерю слуха у до 64% младенцев, рожденных от матерей- алкоголичек , из-за ототоксического воздействия на развивающийся плод, а также недостаточного питания во время беременности из-за чрезмерного потребления алкоголя .
Дефицит йода и эндемический гипотиреоз связаны с потерей слуха. [12] Если беременная мать получает недостаточное потребление йода во время беременности, это влияет на развитие внутреннего уха плода, что приводит к нейросенсорной глухоте. Это происходит в некоторых регионах мира, например в Гималаях, где в почве и, следовательно, в рационе питания наблюдается дефицит йода. В этих районах высока заболеваемость эндемическим зобом. Эту причину глухоты можно предотвратить добавлением йода в соль.
Мозговой инсульт в области, влияющей на слуховую функцию, например, при инфаркте заднего кровообращения, связан с глухотой.
Сенсорная тугоухость вызвана аномальной структурой или функцией волосковых клеток кортиева органа улитки . [ оспаривается – обсуждается ] Нейронные нарушения слуха возникают в результате повреждения восьмого черепного нерва ( преддверно-улиткового нерва ) или слуховых путей ствола мозга . Если поражаются более высокие уровни слухового тракта, это называется центральной глухотой. Центральная глухота может проявляться как нейросенсорная глухота, но ее следует отличать от анамнеза и аудиологического тестирования.
Нарушение слуха может быть связано с повреждением волосковых клеток улитки. Иногда может наблюдаться полная потеря функции внутренних волосковых клеток (ВВК) в определенном участке улитки; это называется «мертвая область». Область может быть определена как диапазон характеристических частот (CF) IHC и/или нейронов, непосредственно прилегающих к мертвой области.

Наружные волосковые клетки (OHC) участвуют в структуре кортиева органа , который расположен между базилярной мембраной и текториальной мембраной внутри улитки (см. рисунок 3). Кортиев туннель, проходящий через кортиев орган, разделяет НВК и внутренние волосковые клетки (ВВК). OHC связаны с ретикулярными ламинарными клетками и клетками Дейтерса. В каждом человеческом ухе примерно двенадцать тысяч OHC, расположенных в пять рядов. Каждый OHC имеет небольшие пучки «волосков» или ресничек на верхней поверхности, известные как стереоцилии , и они также расположены в ряды, расположенные по высоте. На каждой OHC имеется около 140 стереоцилий. [13]
Фундаментальная роль OHC и IHC заключается в том, что они функционируют как сенсорные рецепторы . Основная функция ВВК — передача звуковой информации через афферентные нейроны . Они делают это путем преобразования механических движений или сигналов в нейронную активность. При стимуляции стереоцилии на IHC перемещаются, заставляя поток электрического тока проходить через волосковые клетки. Этот электрический ток создает потенциалы действия внутри связанных афферентных нейронов.
OHC отличаются тем, что они фактически участвуют в активном механизме улитки. Они делают это, получая механические сигналы или вибрации вдоль базилярной мембраны и преобразуя их в электрохимические сигналы. Стереоцилии, обнаруженные на OHC, контактируют с текториальной мембраной. Поэтому при движении базилярной мембраны за счет вибраций стереоцилии изгибаются. Направление, в котором они изгибаются, определяет частоту срабатывания слуховых нейронов, связанных с OHC. [14]
Изгиб стереоцилий к базальному тельцу НГК вызывает возбуждение волосковой клетки. Таким образом, происходит увеличение частоты срабатывания слуховых нейронов, связанных с волосковой клеткой. С другой стороны, отклонение стереоцилий от базального тела OHC вызывает торможение волосковой клетки. Таким образом, происходит снижение частоты срабатывания слуховых нейронов, связанных с волосковой клеткой. OHC уникальны тем, что способны сокращаться и расширяться (электроподвижность). Следовательно, в ответ на электрическую стимуляцию, обеспечиваемую эфферентным нервом, они могут изменять длину, форму и жесткость. Эти изменения влияют на реакцию базилярной мембраны на звук. [13] [14] Таким образом, очевидно, что OHCs играют важную роль в активных процессах улитки. [13] Основная функция активного механизма — тонкая настройка базилярной мембраны и придание ей высокой чувствительности к тихим звукам. Активный механизм зависит от хорошего физиологического состояния улитки. Однако улитка очень подвержена повреждениям. [14]
SNHL чаще всего вызывается повреждением OHC и IHC. [ оспаривается – обсуждается ] Есть два способа, которыми они могут быть повреждены. Во-первых, может погибнуть вся волосковая клетка. Во-вторых, стереоцилии могут деформироваться или разрушиться. Повреждение улитки может произойти несколькими способами, например, в результате вирусной инфекции, воздействия ототоксичных химических веществ и интенсивного шума. Повреждение OHC приводит либо к менее эффективному активному механизму, либо к тому, что он может вообще не функционировать. OHC способствуют обеспечению высокой чувствительности к тихим звукам в определенном диапазоне частот (примерно 2–4 кГц). Таким образом, повреждение НГК приводит к снижению чувствительности базилярной мембраны к слабым звукам. Поэтому необходимо усиление этих звуков, чтобы базилярная мембрана могла эффективно реагировать. IHC менее подвержены повреждениям по сравнению с OHC. Однако если они повредятся, это приведет к общей потере чувствительности. [14]
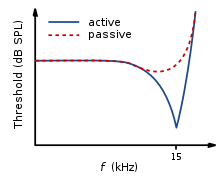
Бегущая волна вдоль базилярной мембраны достигает максимума в разных местах ее, в зависимости от того, является ли звук низкой или высокой частотой. Из-за массы и жесткости базилярной мембраны пик низкочастотных волн приходится на верхушку, а высокочастотные звуки достигаются в базальном конце улитки. [13] Таким образом, каждая позиция вдоль базилярной мембраны точно настроена на определенную частоту. Эти специально настроенные частоты называются характеристическими частотами (CF). [14]
Если звук, поступающий в ухо, отклоняется от характеристической частоты, то сила ответа базилярной мембраны будет постепенно уменьшаться. Точная настройка базилярной мембраны осуществляется за счет двух отдельных механизмов. Первый механизм представляет собой линейный пассивный механизм, который зависит от механической структуры базилярной мембраны и окружающих ее структур. Второй механизм представляет собой нелинейный активный механизм, который зависит, прежде всего, от функционирования НГК, а также от общего физиологического состояния самой улитки. Основание и вершина базилярной мембраны различаются по жесткости и ширине, из-за чего базилярная мембрана по-разному реагирует на различные частоты по своей длине. Основание базилярной мембраны узкое и жесткое, поэтому оно лучше всего реагирует на звуки высокой частоты. Вершина базилярной мембраны шире и гораздо менее жесткая по сравнению с основанием, благодаря чему она лучше реагирует на низкие частоты. [14]
Эту избирательность к определенным частотам можно проиллюстрировать кривыми настройки нейронов. Они демонстрируют частоты, на которые реагирует волокно, показывая пороговые уровни (дБ SPL) волокон слухового нерва как функцию различных частот. Это демонстрирует, что волокна слухового нерва реагируют лучше всего и, следовательно, имеют лучшие пороги на характерной частоте волокна и частотах, непосредственно окружающих его. Говорят, что базилярная мембрана «точно настроена» из-за острой V-образной кривой, «кончик» которой сосредоточен на характерной частоте слуховых волокон. Эта форма показывает, на какое количество частот реагирует волокно. Если бы он имел более широкую V-образную форму, он бы реагировал на большее количество частот (см. рисунок 4). [13]

Нормальная кривая настройки нейронов характеризуется широко настроенным низкочастотным «хвостом» и точно настроенным «кончиком» средних частот. Однако при частичном или полном повреждении OHC, но при неповрежденных IHC, результирующая кривая настройки будет показывать снижение чувствительности на тихие звуки. Т.е. там, где кривая настройки нейронов обычно наиболее чувствительна (на «конце») (см. рисунок 5). [14]
Если повреждены как OHC, так и IHC, результирующая кривая настройки нейронов покажет отсутствие чувствительности на «конце». Однако из-за повреждения IHC вся кривая настройки поднимается, что приводит к потере чувствительности на всех частотах (см. рисунок 6). Достаточно повредить только первый ряд OHC, чтобы произошло устранение точно настроенной «наконечности». Это подтверждает идею о том, что частота повреждений OHC и, следовательно, потеря чувствительности к тихим звукам происходит чаще, чем потеря IHC. [14]
Когда IHC или часть базилярной мембраны повреждаются или разрушаются, так что они больше не функционируют как преобразователи, результатом является «мертвая область». Мертвые области можно определить с точки зрения характеристических частот IHC, связанных с конкретным местом на базилярной мембране, где возникает мертвая область. Предполагается, что не произошло сдвига характерных частот, относящихся к определенным участкам базилярной мембраны, вследствие повреждения НГК. Это часто происходит при повреждении IHC. Мертвые области также можно определить по анатомическому месту нефункционирующей ВГК (например, «апикальная мертвая область») или по характерным частотам ВВК, прилегающих к мертвой зоне. [15]
Мертвые зоны влияют на аудиометрические результаты, но, возможно, не так, как ожидалось. Например, можно ожидать, что пороговые значения не будут получены на частотах внутри мертвой зоны, а будут получены на частотах, прилегающих к мертвой зоне. Следовательно, если предположить, что вокруг мертвой зоны существует нормальный слух, аудиограмма будет иметь резко крутой наклон между частотой, на которой достигается порог, и частотой, на которой порог не может быть получен из-за мертвой зоны. [15]


Однако, похоже, это не так. Мертвые области невозможно четко обнаружить с помощью аудиограмм ОТА . Это может быть связано с тем, что нейроны, иннервирующие мертвую область, не могут реагировать на вибрацию на своей характерной частоте. Если вибрация базилярной мембраны достаточно велика, нейроны, настроенные на разные характеристические частоты, например те, которые находятся рядом с мертвой областью, будут стимулироваться из-за распространения возбуждения. Таким образом, будет получен ответ пациента на тестовой частоте. Это называется «прослушиванием вне места» и также известно как «прослушивание вне частоты». Это приведет к обнаружению ложного порога. Таким образом, создается впечатление, что у человека слух лучше, чем на самом деле, в результате чего мертвая зона упускается из виду. Поэтому, используя только ПТА, невозможно определить степень мертвой зоны (см. рисунки 7 и 8). [15]
Следовательно, насколько сильно на аудиометрический порог влияет тон, частота которого находится в мертвой зоне? Это зависит от местоположения мертвой области. Пороговые значения в мертвых зонах низких частот более неточны, чем пороговые значения в мертвых зонах более высоких частот. Это объясняется тем, что возбуждение, вызванное вибрацией базилярной мембраны, распространяется вверх от апикальных областей базилярной мембраны в большей степени, чем возбуждение распространяется вниз от более высокочастотных базальных областей улитки. Такая закономерность распространения возбуждения аналогична феномену «распространения маскировки вверх». Если тон достаточно громкий, чтобы вызвать достаточное возбуждение в нормально функционирующей области улитки и находится выше порога этой области. Тон будет обнаружен из-за прослушивания вне частоты, что приводит к вводящему в заблуждение порогу. [15]
Чтобы решить проблему, связанную с тем, что PTA создает неточные пороговые значения в мертвых областях, можно использовать маскирование стимулируемой области за пределами мертвой области. Это означает, что порог реагирующей области достаточно повышен, чтобы она не могла обнаружить распространение возбуждения от тона. Этот метод привел к предположению, что мертвая зона низких частот может быть связана с потерями в 40–50 дБ. [16] [17] Однако, поскольку одной из целей PTA является определение наличия или отсутствия мертвой зоны, может быть сложно оценить, какие частоты маскировать без использования других тестов. [15]
На основании исследований было высказано предположение, что мертвая зона на низких частотах может привести к относительно ровным потерям или к очень плавным потерям в сторону более высоких частот. Поскольку мертвая зона будет менее заметной из-за распространения возбуждения вверх. Принимая во внимание, что могут быть более очевидные крутые потери на высоких частотах для высокочастотной мертвой зоны. Хотя вполне вероятно, что наклон представляет собой менее выраженное распространение возбуждения вниз, а не точные пороги для тех частот с нефункционирующими волосковыми клетками. Мертвые зоны средних частот с небольшим диапазоном, по-видимому, оказывают меньшее влияние на способность пациента слышать в повседневной жизни и могут привести к снижению порогов ЧТА. [15] Хотя понятно, что ПТА — не лучший тест для выявления мертвой области. [18]
Хотя некоторые дебаты относительно надежности таких тестов продолжаются, [19] было высказано предположение [ ласковые слова ] , что кривые психоакустической настройки (PTC) и результаты выравнивания порогового шума (TEN) могут быть полезны для обнаружения мертвых зон, а не PTA. PTC похожи на кривые настройки нейронов. Они иллюстрируют уровень тона маскера (дБ SPL) на пороге как функцию отклонения от центральной частоты (Гц). [13] Они измеряются путем представления фиксированного чистого тона низкой интенсивности, а также узкополосного маскера с изменяющейся центральной частотой. Уровень маскера варьируется, так что уровень маскера, необходимый только для маскировки тестового сигнала, определяется для маскера на каждой центральной частоте. На кончике PTC уровень маскера, необходимый для маскировки тестового сигнала, является самым низким. Для людей с нормальным слухом это когда центральная частота маскера наиболее близка к частоте тестового сигнала (см. рисунок 9). [18]
В случае мертвых зон, когда тестовый сигнал лежит в границах мертвой зоны, кончик ПТК будет смещен к краю мертвой зоны, в область, которая еще функционирует и обнаруживает распространение возбуждения от сигнал. В случае низкочастотной мертвой зоны кончик смещается вверх, указывая на низкочастотную мертвую зону, начинающуюся с кончика кривой. Для высокочастотной мертвой зоны наконечник смещается вниз от частоты сигнала к рабочей зоне ниже мертвой зоны. [18] Однако традиционный метод получения PTC непрактичен для клинического использования, и утверждалось [ ласковые слова ] , что TEN недостаточно точны. [18] [19] Был разработан быстрый метод поиска PTC, который может обеспечить решение. Однако необходимы дополнительные исследования для проверки этого метода, прежде чем он сможет быть принят клинически.
Конфигурации аудиограммы не являются хорошим индикатором того, как мертвая область повлияет на человека функционально, главным образом из-за индивидуальных различий. [14] Например, наклонная аудиограмма часто имеет мертвую зону из-за распространения возбуждения. Однако на человека вполне может повлиять иначе, чем на человека с соответствующей наклонной аудиограммой, вызванной частичным повреждением волосковых клеток, а не мертвой областью. Они будут воспринимать звуки по-разному, однако аудиограмма показывает, что степень потери у них одинаковая. Хасс и Мур исследовали, как пациенты с нарушением слуха воспринимают чистые звуки, и обнаружили, что они воспринимают звуки как шумные и искаженные, в большей степени (в среднем), чем люди без нарушений слуха. Однако они также обнаружили, что восприятие тонов как шума не было напрямую связано с частотами внутри мертвых областей и, следовательно, не было индикатором мертвой области. Таким образом, это говорит о том, что аудиограммы и плохое представление мертвых областей на них являются неточными показателями восприятия пациентом качества чистого тона. [20]
Исследования Клюка и Мура показали, что мертвые области также могут влиять на восприятие пациентом частот за пределами мертвых областей. Улучшилась способность различать тоны, которые очень незначительно отличаются по частоте, в областях сразу за мертвыми областями по сравнению с тонами, расположенными дальше. Объяснением этому может быть то, что произошло перекартирование коры. При этом нейроны, которые обычно стимулировались бы мертвой областью, были переназначены для реагирования на функционирующие области рядом с ней. Это приводит к чрезмерному представлению этих областей, что приводит к повышенной перцептивной чувствительности к небольшим различиям частот тонов. [21]
Перед обследованием история болезни дает представление о контексте потери слуха.
Прямой осмотр наружного канала и барабанной перепонки (барабанной перепонки) с помощью отоскопа — медицинского устройства, вставленного в слуховой проход, которое с помощью света исследует состояние наружного уха и барабанной перепонки, а также среднего уха через полупрозрачную перепонку.
Дифференциальное тестирование наиболее полезно при односторонней потере слуха и позволяет отличить кондуктивную потерю слуха от нейросенсорной. Они проводятся с помощью низкочастотного камертона, обычно 512 Гц, и измерения контраста передачи звука по воздуху и кости.
Таблица 1 . Таблица, сравнивающая нейросенсорную и кондуктивную тугоухость
Для различения различных типов потери слуха необходимы другие, более сложные тесты слуховой функции. Пороги костной проводимости позволяют отличить нейросенсорную тугоухость от кондуктивной тугоухости. Другие тесты, такие как отоакустическая эмиссия, акустические стременные рефлексы, речевая аудиометрия и аудиометрия вызванных реакций, необходимы для выявления нарушений слуха, связанных с сенсорной, нервной и слуховой обработкой.
Тимпанограмма – это результат исследования с помощью тимпанометра. Он проверяет функцию среднего уха и подвижность барабанной перепонки. Это может помочь идентифицировать кондуктивную тугоухость, вызванную заболеванием среднего уха или барабанной перепонки, от других видов тугоухости, включая SNHL.
Аудиограмма – это результат проверки слуха. Наиболее распространенным типом проверки слуха является чистотональная аудиометрия (ЧТА). Он отображает пороги слуховой чувствительности при выборе стандартных частот от 250 до 8000 Гц. Существует также высокочастотная аудиометрия чистого тона, при которой проверяются частоты от 8000 до 20 000 Гц. ОТА можно использовать для дифференциации кондуктивной тугоухости, нейросенсорной тугоухости и смешанной тугоухости. Потеря слуха может быть описана по ее степени (т.е. легкая, умеренная, тяжелая или глубокая) или по ее форме (т.е. высокочастотная или наклонная, низкочастотная или восходящая, зазубренная, U-образная или «кусок печенья», остроконечная или плоская).
Существуют также другие виды аудиометрии, предназначенные для проверки остроты слуха, а не чувствительности (речевая аудиометрия), или для проверки передачи слуховых нервных путей (аудиометрия вызванного ответа).
МРТ-сканирование можно использовать для выявления грубых структурных причин потери слуха. Они используются при врожденной потере слуха, когда изменения формы внутреннего уха или слухового нерва могут помочь в диагностике причины потери слуха. Они также полезны в случаях подозрения на опухоль или для определения степени повреждения слуха, вызванного бактериальной инфекцией или аутоиммунным заболеванием. Сканирование не имеет значения при возрастной глухоте.
Пресбиакузис является основной причиной SNHL, он прогрессирует и не поддается профилактике, и в настоящее время у нас нет ни соматической, ни генной терапии для борьбы с наследственной SNHL. Но другие причины приобретенной СНХЛ в значительной степени предотвратимы, особенно причины типа нозокузиса. Это предполагает отказ от шума окружающей среды и травмирующего шума, такого как рок-концерты и ночные клубы с громкой музыкой. Альтернативой является использование мер по снижению шума, таких как беруши , а также изучение уровней шума, которому человек подвергается. В настоящее время существует несколько приложений для точного измерения уровня звука. Сокращение времени воздействия также может помочь снизить риск, связанный с громким воздействием.

Методы лечения делятся на три категории: фармакологические, хирургические и управленческие. Поскольку СНХЛ представляет собой физиологическую деградацию и считается постоянной, на данный момент не существует утвержденных или рекомендуемых методов лечения.
Были достигнуты значительные успехи в идентификации генов глухоты человека и выяснении их клеточных механизмов, а также их физиологических функций у мышей. [22] [23] Тем не менее, варианты фармакологического лечения очень ограничены и клинически не доказаны. [24] Применяемые фармацевтические методы лечения являются скорее паллиативными, чем лечебными, и направлены на основную причину, если таковая может быть идентифицирована, чтобы предотвратить прогрессирующее повреждение.
Глубокую или полную потерю слуха можно лечить с помощью кохлеарных имплантатов , которые напрямую стимулируют окончания улиткового нерва . Кохлеарный имплантат — это хирургическая имплантация электронного медицинского устройства с батарейным питанием во внутреннее ухо. В отличие от слуховых аппаратов , которые делают звуки громче, кохлеарные импланты выполняют работу поврежденных частей внутреннего уха (улитки), передавая звуковые сигналы в мозг. Они состоят как из внутренних имплантированных электродов и магнитов, так и из внешних компонентов. [25] Качество звука отличается от естественного слуха, но может помочь получателю лучше распознавать речь и звуки окружающей среды. Из-за риска и затрат такая операция предназначена только для случаев тяжелого и инвалидизирующего нарушения слуха.
Лечение нейросенсорной тугоухости включает использование стратегий поддержки существующего слуха, таких как чтение по губам, улучшенное общение и т. д., а также усиление с помощью слуховых аппаратов . Слуховые аппараты специально настраиваются с учетом индивидуальной потери слуха, чтобы обеспечить максимальную пользу.
Регенерация волосковых клеток с использованием стволовых клеток и генной терапии еще не станет клинически осуществимой через годы или десятилетия. [28] Однако в настоящее время исследования по этому вопросу продолжаются, и первое одобренное FDA исследование начнется в феврале 2012 года. [29]
Внезапная нейросенсорная потеря слуха (ВНСС или ВСПС), широко известная как внезапная глухота, возникает как необъяснимая быстрая потеря слуха — обычно на одно ухо — либо сразу, либо в течение нескольких дней. Девять из десяти человек с SSHL теряют слух только на одно ухо. Это следует рассматривать как неотложную медицинскую помощь. Задержка диагностики и лечения может сделать лечение менее эффективным или неэффективным.
По оценкам экспертов, SSHL поражает одного человека из 100 каждый год, обычно это взрослые в возрасте от 40 до 50 лет. Фактическое количество новых случаев SSHL каждый год может быть намного выше, поскольку это заболевание часто остается недиагностированным.
Многие люди замечают, что у них есть SSHL, когда просыпаются утром. Другие впервые замечают это, когда пытаются использовать глухое ухо, например, когда пользуются телефоном. Третьи замечают громкий тревожный хлопок непосредственно перед тем, как у них пропадает слух. У людей с внезапной глухотой часто кружится голова, появляется звон в ушах (тиннитус) или и то, и другое.
SSHL диагностируется с помощью чистотональной аудиометрии. Если тест показывает потерю слуха не менее 30 дБ на трех соседних частотах, диагностируется потеря слуха как SSHL. Например, потеря слуха на 30 дБ сделает разговорную речь более похожей на шепот.
Только от 10 до 15 процентов случаев с диагнозом SSHL имеют поддающуюся определению причину. Большинство случаев классифицируются как идиопатические , также называемые внезапной идиопатической потерей слуха ( SIHL) и идиопатической внезапной сенсоневральной тугоухостью (ISSHL или ISSNHL) . распространенная причина ВСПС.
Потеря слуха полностью восстанавливается примерно у 35–39% пациентов с ВСПС, обычно в течение одной-двух недель от начала заболевания. [34] Восемьдесят пять процентов тех, кто проходит лечение у отоларинголога (иногда его называют ЛОР-хирургом), частично восстанавливают слух.
Общая потеря слуха затрагивает около 10% населения мира. [41] Ожидается, что только в Соединенных Штатах 13,5 миллионов американцев страдают нейросенсорной тугоухостью. Примерно 50% людей с нейросенсорной тугоухостью имеют врожденную связь. Остальные 50% обусловлены инфекциями матери или плода, послеродовыми инфекциями, вирусными инфекциями, вызванными краснухой или цитомегаловирусом , приемом ототоксических препаратов [42] , воздействием громких звуков, тяжелыми травмами головы и преждевременными родами [43].
Из генетически связанных случаев нейросенсорной тугоухости 75% являются аутосомно-рецессивными , 15-20% аутосомно-доминантными и 1-3% сцепленными с полом. Хотя конкретный ген и белок до сих пор неизвестны, считается, что мутации в гене коннексина 26 рядом с локусом DFNB1 хромосомы 13 [44] ответственны за большую часть аутосомно-рецессивной генетически обусловленной сенсоневральной тугоухости [43]
Не менее 8,5 из 1000 детей в возрасте до 18 лет страдают нейросенсорной тугоухостью. Общая потеря слуха пропорционально зависит от возраста. По меньшей мере 314 из 1000 человек старше 65 лет страдают потерей слуха. За последнее десятилетие было изучено несколько факторов риска нейросенсорной тугоухости. Остеопороз, стапедэктомия , пневмококковые вакцинации, пользователи мобильных телефонов и гипербилирубинемия при рождении относятся к числу некоторых известных факторов риска.
{{cite book}}: |journal=игнорируется ( помощь )Пресбиакузис (или пресбиакузис) — это общий термин, который относится к потере слуха у пожилых людей и, как таковой, отражает последствия повреждений слуховой системы в течение всей жизни. Среди них главными факторами являются старение и шумовое повреждение, а также генетическая предрасположенность, отологические расстройства и воздействие ототоксических агентов.
{{cite journal}}: Требуется цитировать журнал |journal=( помощь )38. Газави Х., Каргошаи А.А., Джамшиди-Кохсари М., «Исследование уровней витамина D у пациентов с внезапной сенсорно-нейронной потерей слуха и ее влияние на лечение», Американский журнал отоларингологии, медицины головы и шеи и хирургии, ноябрь 2019 г. https ://doi.org/10.1016/j.amjoto.2019.102327