Скелетная мышца (обычно называемая мышцей ) является одним из трех типов мышечной ткани позвоночных , другими являются сердечная мышца и гладкая мышца . Они являются частью произвольной мышечной системы [1] и обычно прикрепляются сухожилиями к костям скелета . [2] [3] Клетки скелетных мышц намного длиннее, чем в других типах мышечной ткани, и также известны как мышечные волокна . [ 4 ] Ткань скелетных мышц поперечно-полосатая — имеет полосатый вид из-за расположения саркомеров .
Скелетная мышца содержит несколько пучков мышечных волокон. Каждое отдельное волокно и каждая мышца окружены соединительнотканным слоем фасции . Мышечные волокна образуются из слияния развивающихся миобластов в процессе, известном как миогенез, в результате чего образуются длинные многоядерные клетки. В этих клетках ядра , называемые миоядрами , расположены вдоль внутренней стороны клеточной мембраны . Мышечные волокна также имеют несколько митохондрий для удовлетворения энергетических потребностей.
Мышечные волокна, в свою очередь, состоят из миофибрилл . Миофибриллы состоят из актиновых и миозиновых нитей, называемых миофиламентами , повторяющихся в единицах, называемых саркомерами, которые являются основными функциональными, сократительными единицами мышечного волокна, необходимыми для сокращения мышц . [5] Мышцы в основном питаются за счет окисления жиров и углеводов , но также используются анаэробные химические реакции, особенно быстро сокращающимися волокнами. Эти химические реакции производят молекулы аденозинтрифосфата (АТФ), которые используются для питания движения головок миозина . [6]
Скелетные мышцы составляют около 35% веса тела человека. [7] Функции скелетных мышц включают в себя создание движения, поддержание осанки тела, контроль температуры тела и стабилизацию суставов. [8] Скелетные мышцы также являются эндокринным органом . [9] [10] [11] При различных физиологических условиях в секретоме скелетных мышц обнаруживаются подмножества 654 различных белков, а также липидов, аминокислот, метаболитов и малых РНК . [12]
Скелетные мышцы в основном состоят из многоядерных сократительных мышечных волокон (миоцитов). Однако в скелетных мышцах также присутствует значительное количество резидентных и инфильтрирующих мононуклеарных клеток. [13] С точки зрения объема миоциты составляют большую часть скелетных мышц. Миоциты скелетных мышц обычно очень большие, около 2–3 см в длину и 100 мкм в диаметре. [14] Для сравнения, мононуклеарные клетки в мышцах намного меньше. Некоторые из мононуклеарных клеток в мышцах [15] являются эндотелиальными клетками (которые имеют длину около 50–70 мкм, ширину 10–30 мкм и толщину 0,1–10 мкм), [16] макрофагами (диаметром 21 мкм) и нейтрофилами (диаметром 12–15 мкм). [17] Однако, с точки зрения ядер, присутствующих в скелетных мышцах, ядра миоцитов могут составлять только половину присутствующих ядер, в то время как ядра резидентных и инфильтрирующих мононуклеарных клеток составляют другую половину. [13]
Значительное исследование скелетных мышц сосредоточено на клетках мышечных волокон, миоцитах, как подробно обсуждается в первых разделах ниже. Однако в последнее время интерес также сосредоточился на различных типах мононуклеарных клеток скелетных мышц, а также на эндокринных функциях мышц, описанных впоследствии ниже.
В человеческом теле насчитывается более 600 скелетных мышц, что составляет около 40% веса тела у здоровых молодых людей. [18] [19] [20] В западном населении у мужчин в среднем на 61% больше скелетных мышц, чем у женщин. [21] Большинство мышц расположены в билатерально расположенных парах, чтобы обслуживать обе стороны тела. Мышцы часто классифицируются как группы мышц , которые работают вместе для выполнения действия. В туловище есть несколько основных групп мышц , включая грудные и брюшные мышцы ; внутренние и внешние мышцы являются подразделениями групп мышц в руке , ноге , языке и наружных мышцах глаза . Мышцы также сгруппированы в отсеки, включая четыре группы в руке и четыре группы в ноге .
Помимо сократительной части мышцы, состоящей из ее волокон, мышца содержит несократительную часть плотной волокнистой соединительной ткани, которая образует сухожилия на каждом конце. Сухожилия прикрепляют мышцы к костям, обеспечивая скелетное движение. Длина мышцы включает сухожилия. Соединительная ткань присутствует во всех мышцах в виде глубокой фасции . Глубокая фасция специализируется внутри мышц, заключая каждое мышечное волокно в виде эндомизия ; каждый мышечный пучок в виде перимизия и каждую отдельную мышцу в виде эпимизия . Вместе эти слои называются мизией . Глубокая фасция также разделяет группы мышц на мышечные отсеки.
Два типа сенсорных рецепторов, обнаруженных в мышцах, — это мышечные веретена и сухожильные органы Гольджи . Мышечные веретена — это рецепторы растяжения, расположенные в брюшке мышцы. Сухожильные органы Гольджи — это проприоцепторы, расположенные в миотендинозном соединении , которые информируют о напряжении мышцы .
Клетки скелетных мышц представляют собой отдельные сократительные клетки внутри мышцы и часто называются мышечными волокнами . [3] Одна мышца, такая как бицепс у молодого взрослого мужчины, содержит около 253 000 мышечных волокон. [22]
Волокна скелетных мышц многоядерные , с ядрами , часто называемыми миоядрами . Это происходит во время миогенеза при слиянии миобластов, каждый из которых вносит свой вклад в ядро. [23] Слияние зависит от мышечно-специфических белков, известных как фузогены, называемые миомейкерами и миомергерами . [24]
Скелетной мышечной клетке необходимо много ядер для большого количества белков и ферментов, необходимых для нормального функционирования клетки. Одно мышечное волокно может содержать от сотен до тысяч ядер. [25] Например, мышечное волокно в бицепсе человека длиной 10 см может иметь до 3000 ядер. [25] В отличие от немышечной клетки , где ядро расположено в центре, миоядро удлинено и расположено близко к сарколемме . Миоядра довольно равномерно расположены вдоль волокна, причем каждое ядро имеет свой собственный миоядерный домен , где оно отвечает за поддержание объема цитоплазмы в этом конкретном участке миофибриллы. [24] [25]
Группа мышечных стволовых клеток, известных как клетки-миосателлиты , также сателлитные клетки , находятся между базальной мембраной и сарколеммой мышечных волокон. Эти клетки обычно находятся в состоянии покоя, но могут быть активированы упражнениями или патологией, чтобы обеспечить дополнительные миоядра для роста или восстановления мышц. [26]
Мышцы прикрепляются к сухожилиям в сложной области интерфейса, известной как мышечно-сухожильное соединение , также известное как миотендинозное соединение , область, специализированная для первичной передачи силы. [27] В области интерфейса мышца-сухожилие сила передается от саркомеров в мышечных клетках к сухожилию. [5] Мышцы и сухожилия развиваются в тесной связи, и после их соединения в миотендинозном соединении они представляют собой динамическую единицу для передачи силы от сокращения мышцы к скелетной системе. [27]

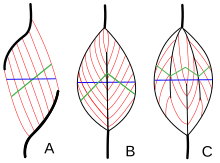
Архитектура мышц относится к расположению мышечных волокон относительно оси генерации силы , которая проходит от начала мышцы до ее прикрепления . Обычными расположениями являются типы параллельных и типы перистых мышц . В параллельных мышцах пучки идут параллельно оси генерации силы, но пучки могут различаться по своему отношению друг к другу и к своим сухожилиям. [28] Эти вариации наблюдаются в веретенообразных , ленточных и конвергентных мышцах . [4] Конвергентная мышца имеет треугольную или веерообразную форму, поскольку волокна сходятся в месте ее прикрепления и широко расходятся веером в начале. [28] Менее распространенным примером параллельной мышцы является круговая мышца, такая как круговая мышца глаза , в которой волокна расположены продольно, но создают круг от начала до прикрепления. [29] Эти различные архитектуры могут вызывать изменения в напряжении, которое мышца может создавать между своими сухожилиями.
Волокна в перистых мышцах идут под углом к оси генерации силы. [29] Этот угол перистости уменьшает эффективную силу любого отдельного волокна, поскольку оно эффективно тянет вне оси. Однако из-за этого угла больше волокон может быть упаковано в тот же объем мышцы, увеличивая физиологическую площадь поперечного сечения (PCSA). Этот эффект известен как упаковка волокон, и с точки зрения генерации силы он более чем преодолевает потерю эффективности внеосевой ориентации. Компромисс заключается в общей скорости сокращения мышцы и в общей экскурсии. Общая скорость сокращения мышцы уменьшается по сравнению со скоростью сокращения волокна, как и общее расстояние сокращения. [29] Все эти эффекты масштабируются с углом перистости; большие углы приводят к большей силе из-за повышенной упаковки волокна и PCSA, но с большими потерями в скорости сокращения и экскурсии. Типы перистых мышц: одноперистые , двуперистые и многоперистые . Одноперистые мышцы имеют волокна, расположенные под одинаковым углом, которые находятся на одной стороне сухожилия. Двуперистая мышца имеет волокна с двух сторон сухожилия. Многоперистые мышцы имеют волокна, которые ориентированы под несколькими углами вдоль оси, генерирующей силу, и это наиболее общая и наиболее распространенная архитектура. [29]
Мышечные волокна растут при тренировках и сокращаются, когда не используются. Это связано с тем, что упражнения стимулируют увеличение миофибрилл , которые увеличивают общий размер мышечных клеток. Хорошо тренированные мышцы могут не только увеличивать размер, но и развивать больше митохондрий , миоглобина , гликогена и более высокую плотность капилляров . Однако мышечные клетки не могут делиться, чтобы производить новые клетки, и в результате у взрослого человека меньше мышечных клеток, чем у новорожденного. [30]
Для наименования мышц используется ряд терминов, в том числе те, которые относятся к размеру, форме, действию, расположению, ориентации и количеству головок.
В целом существует два типа мышечных волокон: тип I , который является медленным, и тип II , который является быстрым. Тип II имеет два подразделения типа IIA (окислительный) и типа IIX (гликолитический), что дает три основных типа волокон. [33] Эти волокна имеют относительно различные метаболические, сократительные и двигательные свойства. Таблица ниже различает эти типы свойств. Эти типы свойств — хотя они частично зависят от свойств отдельных волокон — как правило, являются значимыми и измеряются на уровне двигательной единицы, а не отдельного волокна. [34]
Медленные окислительные волокна (тип I) сокращаются относительно медленно и используют аэробное дыхание для производства АТФ. Быстрые окислительные волокна (тип IIA) имеют быстрые сокращения и в основном используют аэробное дыхание, но поскольку они могут переключаться на анаэробное дыхание (гликолиз), могут утомляться быстрее, чем медленные окислительные волокна. Быстрые гликолитические волокна (тип IIX) имеют быстрые сокращения и в основном используют анаэробный гликолиз. Волокна FG утомляются быстрее, чем другие. Большинство скелетных мышц человека содержат все три типа, хотя и в разных пропорциях. [35]
Традиционно волокна классифицировались в зависимости от их цвета, который является отражением содержания миоглобина . Волокна типа I кажутся красными из-за высокого уровня миоглобина. Красные мышечные волокна, как правило, имеют больше митохондрий и большую локальную плотность капилляров. Эти волокна больше подходят для выносливости и медленно устают, поскольку они используют окислительный метаболизм для генерации АТФ ( аденозинтрифосфата ). Менее окислительные волокна типа II имеют белый цвет из-за относительно низкого уровня миоглобина и зависимости от гликолитических ферментов.
Волокна также можно классифицировать по их способности сокращаться, на быстро и медленно сокращающиеся. Эти черты в значительной степени, но не полностью, перекрывают классификации, основанные на цвете, АТФазе или MHC ( тяжелая цепь миозина ).
Некоторые авторы определяют быстро сокращающееся волокно как волокно, в котором миозин может очень быстро расщеплять АТФ. К ним в основном относятся волокна АТФазы типа II и MHC типа II. Однако быстро сокращающиеся волокна также демонстрируют более высокую способность к электрохимической передаче потенциалов действия и быстрый уровень высвобождения кальция и его поглощения саркоплазматическим ретикулумом. Быстро сокращающиеся волокна полагаются на хорошо развитую, анаэробную , краткосрочную, гликолитическую систему для передачи энергии и могут сокращаться и развивать напряжение в 2–3 раза быстрее, чем медленно сокращающиеся волокна. Быстро сокращающиеся мышцы гораздо лучше генерируют короткие всплески силы или скорости, чем медленные мышцы, и поэтому устают быстрее. [36]
Медленно сокращающиеся волокна генерируют энергию для повторного синтеза АТФ посредством долгосрочной системы аэробного переноса энергии. К ним в основном относятся волокна АТФазы типа I и MHC типа I. Они, как правило, имеют низкий уровень активности АТФазы, более медленную скорость сокращения с менее развитой гликолитической способностью. [36] Волокна, которые становятся медленно сокращающимися, развивают большее количество митохондрий и капилляров, что делает их более подходящими для длительной работы. [37]
Отдельные мышцы, как правило, представляют собой смесь различных типов волокон, но их пропорции варьируются в зависимости от действий этой мышцы. Например, у людей четырехглавые мышцы содержат ~52% волокон типа I, тогда как камбаловидная мышца содержит ~80% волокон типа I. [38] Круговая мышца глаза содержит только ~15% волокон типа I. [38] Однако двигательные единицы внутри мышцы имеют минимальные различия между волокнами этой единицы. Именно этот факт делает принцип размера рекрутирования двигательных единиц жизнеспособным.
Традиционно считалось, что общее количество волокон скелетных мышц не меняется. Считается, что нет половых или возрастных различий в распределении волокон; однако пропорции типов волокон значительно различаются от мышцы к мышце и от человека к человеку. [ необходима цитата ] Среди разных видов существует много различий в пропорциях типов мышечных волокон. [39]
У малоподвижных мужчин и женщин (а также у маленьких детей) 45% волокон типа II и 55% типа I. [ требуется ссылка ] Люди, занимающиеся любым видом спорта, как правило, демонстрируют закономерности распределения волокон, например, у выносливых спортсменов наблюдается более высокий уровень волокон типа I. С другой стороны, у спринтеров требуется большое количество волокон типа IIX. У спортсменов, занимающихся бегом на средние дистанции, наблюдается примерно равное распределение двух типов. Это также часто встречается у спортсменов силовых видов спорта, таких как метатели и прыгуны. Было высказано предположение, что различные типы упражнений могут вызывать изменения в волокнах скелетных мышц. [40]
Считается, что при выполнении упражнений на выносливость в течение длительного периода времени некоторые волокна типа IIX трансформируются в волокна типа IIA. Однако единого мнения по этому вопросу нет. [ необходима цитата ] Вполне возможно, что волокна типа IIX демонстрируют усиление окислительной способности после высокоинтенсивных тренировок на выносливость, что выводит их на уровень, на котором они способны выполнять окислительный метаболизм так же эффективно, как медленно сокращающиеся волокна нетренированных людей. Это может быть вызвано увеличением размера и количества митохондрий и связанными с этим изменениями, а не изменением типа волокна.

Существует множество методов, используемых для типирования волокон, и путаница между методами распространена среди неспециалистов. Два часто путаемых метода — это гистохимическое окрашивание для определения активности АТФазы миозина и иммуногистохимическое окрашивание для определения типа тяжелой цепи миозина (MHC). Активность АТФазы миозина обычно — и правильно — называют просто «типом волокна», и она является результатом прямого анализа активности АТФазы в различных условиях (например, pH ). [34] Окрашивание тяжелой цепи миозина точнее всего называть «типом волокна MHC», например, «волокнами MHC IIa», и оно является результатом определения различных изоформ MHC . [34] Эти методы тесно связаны физиологически, поскольку тип MHC является основным фактором, определяющим активность АТФазы. Однако ни один из этих методов типирования не является напрямую метаболическим по своей природе; они не рассматривают напрямую окислительную или гликолитическую способность волокна.
Когда волокна «типа I» или «типа II» упоминаются в общем виде, это наиболее точно относится к сумме числовых типов волокон (I против II), оцененных с помощью окрашивания активности миозиновой АТФазы (например, волокна «типа II» относятся к типу IIA + типу IIAX + типу IIXA ... и т. д.).
Ниже приведена таблица, показывающая связь между этими двумя методами, ограниченная типами волокон, обнаруженными у людей. Капитализация подтипов используется при типировании волокон против типирования MHC, и некоторые типы АТФазы на самом деле содержат несколько типов MHC. Кроме того, подтип B или b не экспрессируется у людей ни одним из методов . [41] Ранние исследователи считали, что люди экспрессируют MHC IIb, что привело к классификации АТФазы IIB. Однако более поздние исследования показали, что человеческий MHC IIb на самом деле был IIx, [41] указывая на то, что IIB лучше называть IIX. IIb экспрессируется у других млекопитающих, поэтому все еще точно встречается (наряду с IIB) в литературе. Нечеловеческие типы волокон включают истинные волокна IIb, IIc, IId и т. д.
Дальнейшие методы типирования волокон менее формально очерчены и существуют в большем спектре. Они, как правило, больше сосредоточены на метаболических и функциональных возможностях (т. е. окислительные против гликолитических , быстрое против медленного времени сокращения). Как отмечалось выше, типирование волокон по АТФазе или MHC напрямую не измеряет и не диктует эти параметры. Однако многие из различных методов механистически связаны, в то время как другие коррелируют in vivo . [44] [45] Например, тип волокна АТФазы связан со скоростью сокращения, поскольку высокая активность АТФазы обеспечивает более быструю циркуляцию поперечных мостиков . [34] Хотя активность АТФазы является лишь одним из компонентов скорости сокращения, волокна типа I являются «медленными», отчасти потому, что у них низкие скорости активности АТФазы по сравнению с волокнами типа II. Однако измерение скорости сокращения — это не то же самое, что типирование волокон АТФазы.
Почти все многоклеточные животные зависят от мышц для движения. [46] Как правило, мышечные системы большинства многоклеточных животных включают как медленно сокращающиеся, так и быстро сокращающиеся мышечные волокна, хотя пропорции каждого типа волокон могут различаться в зависимости от организма и среды. Способность изменять пропорции фенотипических типов волокон посредством тренировок и реагирования на окружающую среду хорошо послужила организмам, когда их помещали в изменяющиеся среды, требующие либо коротких взрывных движений (более высокая доля быстро сокращающихся), либо длительных движений (более высокая доля медленно сокращающихся) для выживания. [47] Бодибилдинг показал, что изменения в мышечной массе и выработке силы могут меняться в течение нескольких месяцев. [48] Некоторые примеры таких изменений описаны ниже. [49]
Американский омар , Homarus americanus , имеет три типа волокон, включая быстро сокращающиеся волокна, медленно сокращающиеся и медленно-тонические волокна. [50] Медленно-тонические — это медленно сокращающиеся волокна, которые могут выдерживать более длительные сокращения ( тонические ). [51] [52] У омаров мышцы в разных частях тела различаются по пропорциям типов мышечных волокон в зависимости от назначения мышечной группы. [50]
На раннем этапе развития эмбрионов позвоночных рост и формирование мышц происходит в последовательных волнах или фазах миогенеза . Изотип тяжелой цепи миозина является основным фактором, определяющим тип конкретного волокна. У эмбрионов данио-рерио первыми формируются мышечные волокна — медленно сокращающиеся волокна. Эти клетки будут мигрировать из своего первоначального местоположения, чтобы сформировать монослой медленно сокращающихся мышечных волокон. Эти мышечные волокна подвергаются дальнейшей дифференциации по мере созревания эмбриона. [53]
У более крупных животных различные группы мышц будут все больше требовать различных пропорций типов волокон в мышцах для различных целей. Черепахи , такие как Trachemys scripta elegans , имеют дополнительные мышцы в шее, которые показывают потенциальную обратную тенденцию процентного соотношения типов волокон (одна мышца имеет высокий процент быстро сокращающихся волокон, в то время как дополнительная мышца будет иметь более высокий процент медленно сокращающихся волокон). Дополнительные мышцы черепах имели схожие процентные соотношения типов волокон. [51]
Мышцы шимпанзе состоят из 67% быстро сокращающихся волокон и имеют максимальную динамическую силу и выходную мощность в 1,35 раза выше, чем у человеческих мышц аналогичного размера. Среди млекопитающих преобладают волокна типа II, использующие гликолитический метаболизм. Из-за разницы в быстро сокращающихся волокнах по сравнению с людьми шимпанзе превосходят людей в тестах, связанных с мощностью. Однако люди будут лучше справляться с упражнениями в аэробном диапазоне, требующими больших метаболических затрат, такими как ходьба (прямохождение). [54]
У разных видов определенные последовательности генов сохранились, но не всегда имеют одинаковое функциональное назначение. В эмбрионе данио-рерио ген Prdm1 подавляет образование новых медленно сокращающихся волокон через прямые и косвенные механизмы, такие как Sox6 (косвенный). У мышей ген Prdm1 присутствует, но не контролирует медленные мышечные гены у мышей через Sox6 . [55]
Помимо генетической основы, состав типов мышечных волокон является гибким и может меняться в зависимости от ряда различных факторов окружающей среды. Эта пластичность, возможно, является самым сильным эволюционным преимуществом среди организмов с мышцами.
У рыб разные типы волокон проявляются при разных температурах воды. [53] Холодные температуры требуют более эффективного метаболизма в мышцах, и устойчивость к усталости важна. В то время как в более тропических условиях быстрые мощные движения (из-за более высоких пропорций быстро сокращающихся мышц) могут оказаться более полезными в долгосрочной перспективе. [56]
У грызунов, таких как крысы, транзиторная природа их мышц весьма распространена. У них высокий процент гибридных мышечных волокон и до 60% в быстро-медленно трансформирующих мышцах. [48]
Влияние окружающей среды, такое как диета, физические упражнения и образ жизни, играет ключевую роль в пропорциях типов волокон у людей. Аэробные упражнения изменят пропорции в сторону медленно сокращающихся волокон, в то время как взрывной пауэрлифтинг и спринт переведут волокна в сторону быстро сокращающихся. [47] У животных «тренировка упражнений» будет больше похожа на потребность в длительных движениях или коротких взрывных движениях, чтобы спастись от хищников или поймать добычу. [57]


Скелетная мышца демонстрирует характерный рисунок полос при рассмотрении под микроскопом из-за расположения двух сократительных белков миозина и актина , которые являются двумя миофиламентами в миофибриллах . Миозин образует толстые нити, а актин образует тонкие нити, и организованы в повторяющиеся единицы, называемые саркомерами . Взаимодействие обоих белков приводит к сокращению мышцы.
Саркомер прикреплен к другим органеллам, таким как митохондрии, с помощью промежуточных филаментов в цитоскелете. Костамер прикрепляет саркомер к сарколемме. [5]
Каждая отдельная органелла и макромолекула мышечного волокна организованы так, чтобы обеспечить выполнение желаемых функций. Клеточная мембрана называется сарколеммой, а цитоплазма — саркоплазмой . В саркоплазме находятся миофибриллы. Миофибриллы — это длинные белковые пучки диаметром около одного микрометра. К внутренней стороне сарколеммы прижаты необычные сплющенные мионуклеусы. Между миофибриллами находятся митохондрии .
Хотя мышечное волокно не имеет гладких эндоплазматических цистерн, оно содержит саркоплазматический ретикулум . Саркоплазматический ретикулум окружает миофибриллы и содержит запас ионов кальция, необходимых для сокращения мышц. Периодически он имеет расширенные концевые мешочки, известные как терминальные цистерны . Они пересекают мышечное волокно с одной стороны на другую. Между двумя терминальными цистернами находится трубчатая складка, называемая поперечной трубочкой (Т-трубочкой). Т-трубочки являются путями для потенциалов действия, чтобы сигнализировать саркоплазматическому ретикулуму о высвобождении кальция, вызывая сокращение мышц. Вместе две терминальные цистерны и поперечная трубочка образуют триаду . [ 58]

Все мышцы происходят из параксиальной мезодермы . Во время эмбрионального развития в процессе сомитогенеза параксиальная мезодерма делится по длине эмбриона , образуя сомиты , что соответствует сегментации тела, наиболее наглядно наблюдаемой в позвоночном столбе . [59] Каждый сомит имеет три отдела: склеротом (который образует позвонки ), дерматом (который образует кожу) и миотом (который образует мышцы). Миотом делится на две части, эпимер и гипомер, которые образуют эпаксиальные и гипаксиальные мышцы соответственно. Единственными эпаксиальными мышцами у человека являются мышца, выпрямляющая позвоночник , и малые позвоночные мышцы, и они иннервируются дорсальными ветвями спинномозговых нервов . Все остальные мышцы, включая мышцы конечностей, являются гипаксиальными и иннервируются вентральными ветвями спинномозговых нервов. [59]
Во время развития миобласты (мышечные клетки-предшественники) либо остаются в сомитах, чтобы сформировать мышцы, связанные с позвоночным столбом, либо мигрируют в тело, чтобы сформировать все остальные мышцы. Миграции миобластов предшествует образование соединительнотканных каркасов, обычно образующихся из соматической боковой пластины мезодермы . Миобласты следуют химическим сигналам в соответствующие места, где они сливаются в удлиненные многоядерные клетки скелетных мышц. [59]
Между десятой и восемнадцатой неделями беременности все мышечные клетки имеют быстрые тяжелые цепи миозина; в развивающемся плоде различаются два типа миотрубочек — оба экспрессируют быстрые цепи, но один экспрессирует быстрые и медленные цепи. От 10 до 40 процентов волокон экспрессируют медленную цепь миозина. [60]
Типы волокон устанавливаются во время эмбрионального развития и ремоделируются позже у взрослого человека под воздействием нейронов и гормонов. [39] Популяция сателлитных клеток, присутствующих под базальной пластинкой, необходима для постнатального развития мышечных клеток. [61]
Основная функция мышц — сокращение . [3] После сокращения скелетные мышцы функционируют как эндокринный орган, секретируя миокины — широкий спектр цитокинов и других пептидов , которые действуют как сигнальные молекулы. [62] Миокины, в свою очередь, считаются посредниками в пользе для здоровья от упражнений . [63] Миокины секретируются в кровоток после сокращения мышц. Интерлейкин 6 (ИЛ-6) является наиболее изученным миокином, другие миокины, вызванные сокращением мышц, включают BDNF , FGF21 и SPARC . [64]
Мышцы также выполняют функцию выработки тепла тела. Сокращение мышц отвечает за выработку 85% тепла тела. [65] Это вырабатываемое тепло является побочным продуктом мышечной активности и в основном тратится впустую. В качестве гомеостатической реакции на сильный холод мышцы получают сигнал вызвать сокращения дрожи , чтобы выработать тепло. [66]



Сокращение достигается структурной единицей мышцы, мышечным волокном, и ее функциональной единицей, двигательной единицей . [4] Мышечные волокна являются возбудимыми клетками, стимулируемыми двигательными нейронами . Двигательная единица состоит из двигательного нейрона и множества волокон, с которыми он контактирует. Одна мышца стимулируется множеством двигательных единиц. Мышечные волокна подвергаются деполяризации нейромедиатором ацетилхолином , выделяемым двигательными нейронами в нервно-мышечных соединениях . [67]
В дополнение к актиновым и миозиновым миофиламентам в миофибриллах , которые составляют сократительные саркомеры , есть два других важных регуляторных белка — тропонин и тропомиозин , которые делают возможным сокращение мышц. Эти белки связаны с актином и кооперируются, чтобы предотвратить его взаимодействие с миозином. Как только клетка достаточно стимулируется, саркоплазматический ретикулум клетки высвобождает ионный кальций (Ca 2+ ), который затем взаимодействует с регуляторным белком тропонином. Связанный с кальцием тропонин претерпевает конформационное изменение, которое приводит к перемещению тропомиозина, впоследствии обнажая сайты связывания миозина на актине. Это позволяет миозину и актину АТФ-зависимо циклировать поперечные мостики и укорачивать мышцу.
Сопряжение возбуждения и сокращения — это процесс, при котором потенциал мышечного действия в мышечном волокне заставляет миофибриллы сокращаться. Этот процесс основан на прямом сопряжении между каналом высвобождения кальция саркоплазматического ретикулума RYR1 (рианодиновый рецептор 1) и потенциалзависимыми кальциевыми каналами L-типа (идентифицированными как дигидропиридиновые рецепторы, DHPR). DHPR расположены на сарколемме (которая включает поверхностную сарколемму и поперечные канальцы ), в то время как RyR находятся поперек мембраны SR. Тесное расположение поперечного канальца и двух областей SR, содержащих RyR, описывается как триада и преимущественно там, где происходит сопряжение возбуждения и сокращения. Сопряжение возбуждения и сокращения происходит, когда деполяризация клетки скелетной мышцы приводит к потенциалу действия мышцы, который распространяется по поверхности клетки и в сеть Т-трубочек мышечного волокна , тем самым деполяризуя внутреннюю часть мышечного волокна. Деполяризация внутренних частей активирует дигидропиридиновые рецепторы в терминальных цистернах, которые находятся близко к рианодиновым рецепторам в соседнем саркоплазматическом ретикулуме . Активированные дигидропиридиновые рецепторы физически взаимодействуют с рианодиновыми рецепторами, активируя их через ножные отростки (включая конформационные изменения, которые аллостерически активируют рианодиновые рецепторы). Когда рианодиновые рецепторы открываются, Ca2+
высвобождается из саркоплазматического ретикулума в локальное соединительное пространство и диффундирует в объем цитоплазмы, вызывая кальциевую искру . Саркоплазматический ретикулум обладает большой буферной емкостью кальция, частично благодаря связывающему кальций белку, называемому кальсеквестрином . Почти синхронная активация тысяч кальциевых искр потенциалом действия вызывает общеклеточное увеличение кальция, что приводит к подъему кальциевого транзита. Ca2+
высвобождается в цитозоль, связывается с тропонином С актиновыми филаментами , чтобы обеспечить цикличность поперечных мостиков, производя силу и, в некоторых ситуациях, движение. Кальциевая АТФаза сарко/эндоплазматического ретикулума (SERCA) активно перекачивает Ca2+
обратно в саркоплазматический ретикулум. Как Ca2+
снижается до уровня покоя, сила уменьшается и происходит расслабление. [68]
Эфферентная часть периферической нервной системы отвечает за передачу команд мышцам и железам и в конечном итоге отвечает за произвольное движение. Нервы приводят мышцы в движение в ответ на произвольные и автономные (непроизвольные) сигналы от мозга . Глубокие мышцы, поверхностные мышцы, мышцы лица и внутренние мышцы соответствуют выделенным областям в первичной двигательной коре мозга , непосредственно перед центральной бороздой, которая разделяет лобную и теменную доли.
Кроме того, мышцы реагируют на рефлекторные нервные стимулы, которые не всегда посылают сигналы в мозг. В этом случае сигнал от афферентного волокна не достигает мозга, но производит рефлекторное движение посредством прямых связей с эфферентными нервами в позвоночнике . Однако большая часть мышечной активности является произвольной и является результатом сложных взаимодействий между различными областями мозга.
Нервы, которые контролируют скелетные мышцы у млекопитающих, соответствуют группам нейронов вдоль первичной двигательной коры головного мозга . Команды направляются через базальные ганглии и модифицируются входными сигналами из мозжечка, прежде чем они будут переданы через пирамидальный тракт в спинной мозг и оттуда в двигательную концевую пластинку в мышцах. По пути обратная связь, например, экстрапирамидная система, вносит сигналы, влияющие на тонус мышц и реакцию.
Более глубокие мышцы, например, те, которые отвечают за осанку, часто контролируются ядрами ствола мозга и базальными ганглиями.
В скелетных мышцах мышечные веретена передают информацию о степени длины и растяжения мышц в центральную нервную систему, чтобы помочь в поддержании осанки и положения суставов. Ощущение того , где наши тела находятся в пространстве, называется проприоцепцией , восприятием осознания тела, «бессознательным» осознанием того, где находятся различные области тела в любой момент времени. Несколько областей в мозге координируют движение и положение с помощью информации обратной связи, полученной от проприоцепции. Мозжечок и красное ядро, в частности, постоянно отслеживают положение относительно движения и вносят незначительные коррективы для обеспечения плавного движения. [ необходима цитата ]

Мышечная активность составляет большую часть потребления энергии организмом . Все мышечные клетки вырабатывают молекулы аденозинтрифосфата (АТФ), которые используются для питания движения головок миозина . Мышцы имеют краткосрочный запас энергии в форме креатинфосфата , который генерируется из АТФ и может регенерировать АТФ при необходимости с помощью креатинкиназы . Мышцы также хранят форму хранения глюкозы в форме гликогена . Гликоген может быстро преобразовываться в глюкозу , когда требуется энергия для устойчивых, мощных сокращений. В произвольных скелетных мышцах молекула глюкозы может метаболизироваться анаэробно в процессе, называемом гликолизом, который производит две молекулы АТФ и две молекулы молочной кислоты в этом процессе (в аэробных условиях лактат не образуется; вместо этого образуется пируват и передается через цикл лимонной кислоты ). Мышечные клетки также содержат глобулы жира, которые используются для получения энергии во время аэробных упражнений . Аэробным энергетическим системам требуется больше времени для производства АТФ и достижения пиковой эффективности, и требуется гораздо больше биохимических этапов, но они производят значительно больше АТФ, чем анаэробный гликолиз. Сердечная мышца, с другой стороны, может легко потреблять любой из трех макронутриентов (белок, глюкоза и жир) аэробно без периода «разогрева» и всегда извлекает максимальный выход АТФ из любой задействованной молекулы. Сердце, печень и эритроциты также будут потреблять молочную кислоту, вырабатываемую и выделяемую скелетными мышцами во время упражнений.
Скелетная мышца потребляет больше калорий, чем другие органы. [69] В состоянии покоя она потребляет 54,4 кДж/кг (13,0 ккал/кг) в день. Это больше, чем жировая ткань (жир) — 18,8 кДж/кг (4,5 ккал/кг) и кость — 9,6 кДж/кг (2,3 ккал/кг). [70]
Эффективность человеческих мышц была измерена (в контексте гребли и езды на велосипеде ) на уровне от 18% до 26%. Эффективность определяется как отношение механической работы к общей метаболической стоимости, которую можно рассчитать по потреблению кислорода. Эта низкая эффективность является результатом около 40% эффективности генерации АТФ из пищевой энергии , потерь при преобразовании энергии из АТФ в механическую работу внутри мышцы и механических потерь внутри тела. Последние две потери зависят от типа упражнений и типа используемых мышечных волокон (быстро сокращающиеся или медленно сокращающиеся). Для общей эффективности в 20 процентов один ватт механической мощности эквивалентен 4,3 ккал в час. Например, один производитель гребного оборудования калибрует свой гребной эргометр для подсчета сожженных калорий как равных четырем фактической механической работе плюс 300 ккал в час, это составляет около 20 процентов эффективности при 250 ваттах механической мощности. Выход механической энергии циклического сокращения может зависеть от многих факторов, включая время активации, траекторию мышечной деформации и скорости нарастания и спада силы. Их можно синтезировать экспериментально с помощью анализа рабочего цикла .
Сила мышц является результатом трех перекрывающихся факторов: физиологической силы (размер мышцы, площадь поперечного сечения, доступные поперечные мостики, реакция на тренировку), неврологической силы (насколько силен или слаб сигнал, сообщающий мышце о сокращении) и механической силы (угол приложения силы мышцы к рычагу, длина плеча момента, возможности суставов). [ необходима ссылка ]
Мышца позвоночных обычно производит приблизительно 25–33 Н (5,6–7,4 фунт -сила ) силы на квадратный сантиметр площади поперечного сечения мышцы в изометрическом положении и при оптимальной длине. [71] Некоторые мышцы беспозвоночных , такие как клешни краба, имеют гораздо более длинные саркомеры , чем мышцы позвоночных, что приводит к гораздо большему количеству участков для связывания актина и миозина и, таким образом, к гораздо большей силе на квадратный сантиметр за счет гораздо более медленной скорости. Силу, создаваемую сокращением, можно измерить неинвазивно с помощью механомиографии или фономиографии , измерить in vivo с использованием деформации сухожилия (если присутствует выступающее сухожилие) или измерить напрямую с помощью более инвазивных методов.
Сила любой данной мышцы, с точки зрения силы, оказываемой на скелет, зависит от длины, скорости укорочения , площади поперечного сечения, перистости , длины саркомера , изоформ миозина и нейронной активации двигательных единиц . Значительное снижение мышечной силы может указывать на скрытую патологию, при этом диаграмма справа используется в качестве руководства.
Максимальное время удержания сокращенной мышцы зависит от запаса энергии и, согласно закону Ромерта, экспоненциально уменьшается с начала нагрузки.
Поскольку на мышечную силу одновременно влияют три фактора, а мышцы никогда не работают по отдельности, то сравнивать силу отдельных мышц и утверждать, что одна из них «самая сильная», — заблуждение. Но ниже приведены несколько мышц, сила которых заслуживает внимания по разным причинам.
Мышечная сила пропорциональна физиологической площади поперечного сечения (PCSA), а скорость мышц пропорциональна длине мышечных волокон. [72] Однако крутящий момент вокруг сустава определяется рядом биомеханических параметров, включая расстояние между прикреплениями мышц и точками поворота, размер мышц и архитектурное передаточное отношение . Мышцы обычно расположены в оппозиции, так что когда одна группа мышц сокращается, другая группа расслабляется или удлиняется. [73] Антагонизм в передаче нервных импульсов к мышцам означает, что невозможно полностью стимулировать сокращение двух антагонистических мышц в любой момент времени. Во время баллистических движений, таких как бросок, антагонистические мышцы действуют, чтобы «тормозить» агонистические мышцы на протяжении всего сокращения, особенно в конце движения. В примере с броском грудь и передняя часть плеча (передняя дельтовидная мышца) сокращаются, чтобы вытянуть руку вперед, в то время как мышцы сзади и сзади плеча (задняя дельтовидная мышца) также сокращаются и подвергаются эксцентрическому сокращению, чтобы замедлить движение и избежать травмы. Частью тренировочного процесса является обучение расслаблению мышц-антагонистов для увеличения усилия, прилагаемого к груди и передней части плеча.
Сокращающиеся мышцы производят вибрацию и звук. [74] Медленно сокращающиеся волокна производят от 10 до 30 сокращений в секунду (от 10 до 30 Гц). Быстро сокращающиеся волокна производят от 30 до 70 сокращений в секунду (от 30 до 70 Гц). [75] Вибрацию можно наблюдать и чувствовать, сильно напрягая мышцы, например, сжимая кулак. Звук можно услышать, прижав сильно напряженную мышцу к уху, опять же, хорошим примером является кулак. Звук обычно описывается как грохочущий звук. Некоторые люди могут намеренно производить этот грохочущий звук, сокращая мышцу, напрягающую барабанную перепонку среднего уха. Грохот также можно услышать, когда сильно напряжены мышцы шеи или челюсти. [ необходима цитата ]
Фенотип типа волокон скелетных мышц у взрослых животных регулируется несколькими независимыми сигнальными путями. К ним относятся пути, связанные с путем Ras /митоген-активируемой протеинкиназы ( MAPK ), кальциневрином, кальций/кальмодулин-зависимой протеинкиназой IV и коактиватором γ-пролифератора пероксисом 1 (PGC-1). Сигнальный путь Ras/MAPK связывает двигательные нейроны и сигнальные системы, связывая возбуждение и регуляцию транскрипции для содействия нервно-зависимой индукции медленной программы в регенерирующих мышцах. Кальциневрин , Ca 2+ / кальмодулин -активируемая фосфатаза, участвующая в спецификации типа волокон, зависящей от активности нервов в скелетных мышцах, напрямую контролирует состояние фосфорилирования фактора транскрипции NFAT , что позволяет ему перемещаться в ядро и приводит к активации медленных мышечных белков в сотрудничестве с белками фактора 2 усиления миоцитов ( MEF2 ) и другими регуляторными белками. Активность протеинкиназы, зависимой от Ca2+/кальмодулина, также повышается за счет активности медленных двигательных нейронов, возможно, потому, что она усиливает реакции, генерируемые кальциневрином медленного типа, стимулируя функции трансактиватора MEF2 и усиливая окислительную способность посредством стимуляции биогенеза митохондрий .
Изменения внутриклеточного кальция или активных форм кислорода, вызванные сокращением, передают сигналы различным путям, включающим MAPK, кальциневрин и кальций/кальмодулинзависимую протеинкиназу IV, для активации факторов транскрипции, которые регулируют экспрессию генов и активность ферментов в скелетных мышцах.

PGC1-α ( PPARGC1A ), транскрипционный коактиватор ядерных рецепторов, важный для регуляции ряда митохондриальных генов, участвующих в окислительном метаболизме, напрямую взаимодействует с MEF2 для синергической активации селективных генов медленно сокращающихся мышц (ST), а также служит мишенью для сигнализации кальциневрина. Транскрипционный путь, опосредованный рецептором, активируемым пролифератором пероксисом δ ( PPARδ ), участвует в регуляции фенотипа скелетных мышечных волокон. Мыши, которые несут активированную форму PPARδ, демонстрируют фенотип «выносливости» с координированным увеличением окислительных ферментов и митохондриального биогенеза , а также увеличенной долей волокон ST. Таким образом, с помощью функциональной геномики кальциневрин, кальмодулин-зависимая киназа, PGC-1α и активированный PPARδ формируют основу сигнальной сети, которая контролирует трансформацию типов волокон скелетных мышц и метаболические профили, защищающие от инсулинорезистентности и ожирения.
Переход от аэробного к анаэробному метаболизму во время интенсивной работы требует быстрой активации нескольких систем для обеспечения постоянного снабжения работающих мышц АТФ. К ним относятся переключение с топлива на основе жиров на топливо на основе углеводов, перераспределение кровотока от неработающих к работающим мышцам и удаление нескольких побочных продуктов анаэробного метаболизма, таких как углекислый газ и молочная кислота. Некоторые из этих реакций регулируются транскрипционным контролем гликолитического фенотипа быстрого сокращения (FT). Например, перепрограммирование скелетных мышц с гликолитического фенотипа ST на гликолитический фенотип FT включает комплекс Six1/Eya1, состоящий из членов семейства белков Six. Более того, гипоксия-индуцируемый фактор 1-α ( HIF1A ) был идентифицирован как главный регулятор экспрессии генов, участвующих в основных гипоксических реакциях, которые поддерживают уровни АТФ в клетках. Абляция HIF-1α в скелетных мышцах была связана с повышением активности ферментов, ограничивающих скорость митохондрий, что указывает на то, что цикл лимонной кислоты и повышенное окисление жирных кислот могут компенсировать снижение потока через гликолитический путь у этих животных. Однако гипоксически-опосредованные реакции HIF-1α также связаны с регулированием митохондриальной дисфункции посредством образования избыточных активных форм кислорода в митохондриях.
Другие пути также влияют на характер мышц взрослого человека. Например, физическая сила внутри мышечного волокна может высвободить фактор транскрипции фактора реакции сыворотки из структурного белка титина, что приводит к изменению роста мышц.

Физические упражнения часто рекомендуются как средство улучшения двигательных навыков , физической формы , силы мышц и костей, а также функции суставов. Упражнения оказывают несколько эффектов на мышцы, соединительную ткань , кости и нервы, которые стимулируют мышцы. Одним из таких эффектов является гипертрофия мышц , увеличение размера мышцы за счет увеличения количества мышечных волокон или площади поперечного сечения миофибрилл. [76] Изменения мышц зависят от типа используемых упражнений.
Как правило, существует два типа режимов упражнений: аэробные и анаэробные. Аэробные упражнения (например, марафоны) включают в себя действия низкой интенсивности, но большой продолжительности, во время которых задействованные мышцы находятся ниже своей максимальной силы сокращения. Аэробные упражнения основаны на аэробном дыхании (т. е. цикле лимонной кислоты и цепи переноса электронов) для получения метаболической энергии путем потребления жира, белка, углеводов и кислорода. Мышцы, участвующие в аэробных упражнениях, содержат более высокий процент мышечных волокон типа I (или медленно сокращающихся), которые в основном содержат митохондриальные и окислительные ферменты, связанные с аэробным дыханием. [77] [78] Напротив, анаэробные упражнения связаны с действиями высокой интенсивности, но короткой продолжительности, такими как спринт или поднятие тяжестей . Анаэробные действия преимущественно используют быстро сокращающиеся мышечные волокна типа II. [79] Мышечные волокна типа II полагаются на глюкогенез для получения энергии во время анаэробных упражнений. [80] Во время анаэробных упражнений волокна типа II потребляют мало кислорода, белка и жира, производят большое количество молочной кислоты и утомляются. Многие упражнения являются частично аэробными и анаэробными; например, футбол и скалолазание .
Присутствие молочной кислоты оказывает ингибирующее действие на генерацию АТФ в мышцах. Оно может даже остановить выработку АТФ, если внутриклеточная концентрация становится слишком высокой. Однако тренировки на выносливость смягчают накопление молочной кислоты за счет увеличения капилляризации и миоглобина. [81] Это увеличивает способность удалять отходы, такие как молочная кислота, из мышц, чтобы не нарушать мышечную функцию. После вывода из мышц молочная кислота может использоваться другими мышцами или тканями тела в качестве источника энергии или транспортироваться в печень, где она снова преобразуется в пируват . Помимо повышения уровня молочной кислоты, интенсивные упражнения приводят к потере ионов калия в мышцах. Это может способствовать восстановлению мышечной функции, защищая от усталости. [82]
Отсроченная болезненность мышц — это боль или дискомфорт, которые могут ощущаться через один-три дня после тренировки и обычно проходят через два-три дня. Ранее считалось, что это вызвано накоплением молочной кислоты, но более поздняя теория заключается в том, что это вызвано крошечными разрывами в мышечных волокнах, вызванными эксцентрическим сокращением или непривычными уровнями тренировок. Поскольку молочная кислота рассеивается довольно быстро, она не может объяснить боль, испытываемую через несколько дней после тренировки. [83]
Заболевания скелетных мышц называются миопатиями , а заболевания нервов называются невропатиями . Оба могут влиять на функцию мышц или вызывать мышечную боль и попадают под категорию нервно-мышечных заболеваний . Причиной многих миопатий являются мутации в различных связанных мышечных белках. [5] [84] Некоторые воспалительные миопатии включают полимиозит и миозит с тельцами включения.

Нервно-мышечные заболевания влияют на мышцы и их нервный контроль. В целом, проблемы с нервным контролем могут вызвать спастичность или паралич , в зависимости от местоположения и характера проблемы. Ряд двигательных расстройств вызван неврологическими расстройствами , такими как болезнь Паркинсона и болезнь Хантингтона , при которых наблюдается дисфункция центральной нервной системы. [85]
Симптомы мышечных заболеваний могут включать слабость , спастичность, миоклонус и миалгию . Диагностические процедуры, которые могут выявить мышечные нарушения, включают тестирование уровня креатинкиназы в крови и электромиографию (измерение электрической активности в мышцах). В некоторых случаях может быть сделана биопсия мышц для выявления миопатии , а также генетическое тестирование для выявления аномалий ДНК , связанных с определенными миопатиями и дистрофиями .
Неинвазивная техника эластографии , измеряющая мышечный шум, проходит экспериментальную проверку, чтобы обеспечить способ мониторинга нервно-мышечных заболеваний. Звук, производимый мышцей, возникает из-за сокращения актомиозиновых нитей вдоль оси мышцы. Во время сокращения мышца укорачивается по длине и расширяется по ширине, создавая вибрации на поверхности. [86]
Независимо от силы и показателей производительности, мышцы могут быть вызваны к росту под действием ряда факторов, включая гормональную сигнализацию, факторы развития, силовые тренировки и болезни. Вопреки распространенному мнению, количество мышечных волокон не может быть увеличено с помощью упражнений . Вместо этого мышцы увеличиваются за счет комбинации роста мышечных клеток, поскольку добавляются новые белковые нити вместе с дополнительной массой, обеспечиваемой недифференцированными сателлитными клетками наряду с существующими мышечными клетками. [87]
Биологические факторы, такие как возраст и уровень гормонов, могут влиять на гипертрофию мышц. В период полового созревания у мужчин гипертрофия происходит ускоренными темпами, поскольку уровни гормонов , стимулирующих рост, вырабатываемых организмом, увеличиваются. Естественная гипертрофия обычно останавливается при полном росте в конце подросткового возраста. Поскольку тестостерон является одним из основных гормонов роста организма, в среднем мужчинам гораздо легче достичь гипертрофии, чем женщинам. Прием дополнительного тестостерона или других анаболических стероидов увеличит гипертрофию мышц.
Мышечные, спинальные и нервные факторы влияют на наращивание мышечной массы. Иногда человек может заметить увеличение силы в определенной мышце, даже если только ее противоположность подвергалась тренировке, например, когда бодибилдер обнаруживает, что его левый бицепс стал сильнее после завершения программы, сосредоточенной только на правом бицепсе. Это явление называется перекрестным образованием . [ требуется цитата ]

Каждый день от одного до двух процентов мышц разрушаются и восстанавливаются. Бездеятельность , недоедание , болезни и старение могут усилить разрушение, что приводит к атрофии мышц или саркопении . Саркопения — это обычно возрастной процесс, который может вызвать слабость и ее последствия. [88] Уменьшение мышечной массы может сопровождаться меньшим количеством и размером мышечных клеток, а также более низким содержанием белка. [89]
Известно, что космические полеты человека , включающие длительные периоды иммобилизации и невесомости, приводят к ослаблению мышц и атрофии, что приводит к потере до 30% массы некоторых мышц. [90] [91] Подобные последствия также отмечаются у некоторых млекопитающих после спячки . [92]
Многие заболевания и состояния, включая рак , СПИД и сердечную недостаточность , могут вызывать потерю мышечной массы, известную как кахексия . [93]
Миопатии были смоделированы с помощью систем клеточных культур мышц из биопсий здоровых или больных тканей . Другим источником скелетных мышц и предшественников является направленная дифференциация плюрипотентных стволовых клеток . [94]
Исследования свойств скелетных мышц используют множество методов. Электрическая стимуляция мышц используется для определения силы и скорости сокращения на разных частотах, связанных с составом типа волокон и их сочетанием в пределах отдельной группы мышц. Тестирование мышц in vitro используется для более полной характеристики свойств мышц.
Электрическая активность, связанная с сокращением мышц, измеряется с помощью электромиографии (ЭМГ). Скелетные мышцы имеют две физиологические реакции: расслабление и сокращение. Механизмы, при которых происходят эти реакции, генерируют электрическую активность, измеряемую с помощью ЭМГ. В частности, ЭМГ может измерять потенциал действия скелетной мышцы, который возникает из-за гиперполяризации двигательных аксонов от нервных импульсов, посылаемых в мышцу. ЭМГ используется в исследованиях для определения того, активируется ли интересующая скелетная мышца, величины генерируемой силы и индикатора мышечной усталости . [95] Два типа ЭМГ — это внутримышечная ЭМГ и наиболее распространенная поверхностная ЭМГ. Сигналы ЭМГ намного сильнее, когда скелетная мышца сокращается, а не расслабляется. Однако для более мелких и глубоких скелетных мышц сигналы ЭМГ уменьшаются и поэтому рассматриваются как менее ценный метод измерения активации. [96] В исследованиях с использованием ЭМГ обычно выполняется максимальное произвольное сокращение (МПС) интересующей скелетной мышцы, чтобы иметь справочные данные для остальных записей ЭМГ во время основного экспериментального тестирования той же скелетной мышцы. [97]
Исследования по созданию искусственных мышц включают использование электроактивных полимеров .

Ядра, присутствующие в скелетных мышцах, представляют собой около 50% ядер миоцитов и 50% ядер мононуклеарных клеток. [13] Мононуклеарные клетки, обнаруженные в образцах скелетной мышечной ткани у мышей и людей [15] [99] [98], можно идентифицировать с помощью транскрипции РНК-мессенджера маркеров типа клеток. Кэмерон и др. [98] идентифицировали девять типов клеток. Они включают эндотелиальные клетки , выстилающие капилляры (45% клеток), фиброадипогенные предшественники (FAP) (20%), [100] перициты (14%) и эндотелиально-подобные перициты (4%). Еще 9% мононуклеарных клеток представляют собой мышечные стволовые клетки , прилегающие к клеткам мышечных волокон. Типы лимфоидных клеток (такие как В-клетки и Т-клетки) (3%) и миелоидные клетки, такие как макрофаги (2%), составили большую часть оставшихся мононуклеарных клеток скелетных мышц. [98] Кроме того, Кэмерон и др. [98] также идентифицировали два типа миоцитарных клеток, тип I и тип II. Было обнаружено, что каждый из различных типов клеток в скелетных мышцах экспрессирует различные наборы генов. Среднее число генов, экспрессируемых в каждом из девяти различных типов клеток, составило 1331 ген. Однако, когда биопсия берется из бедренной мышцы, биопсия содержит все различные типы клеток. В совокупности в биопсии скелетной мышцы бедра человека обнаруживается от 13 026 до 13 108 генов с обнаруженной экспрессией. [101] [102]
Как указано во Введении к этой статье, при различных физиологических условиях в секретоме скелетных мышц встречаются подмножества 654 различных белков, а также липидов, аминокислот, метаболитов и малых РНК . [12] Как описано в статье Википедии « Список эндокринных органов человека и их действия », скелетные мышцы определяются как эндокринный орган из-за секреции ими цитокинов и других пептидов, вырабатываемых скелетными мышцами в качестве сигнальных молекул. Иидзука и др. [9] указали, что скелетные мышцы являются эндокринным органом, поскольку они «синтезируют и секретируют множество факторов, и эти мышечные производные факторы оказывают благотворное влияние на периферические и отдаленные органы». Измененные секретомы после тренировок на выносливость или силовых тренировок, а также секретом малоподвижных мышц, по-видимому, оказывают множество эффектов на отдаленные ткани.
Исследование в Канаде проверило влияние мышечной массы на умственные функции во время старения. Ожидалось, что исследование будет заключаться в том, что эндокринные компоненты секретома, специфичные для скелетных мышц, могут защищать когнитивные функции. Масса скелетных мышц рук и ног 8279 канадцев старше 65 лет и со средним здоровьем была измерена на исходном уровне и через три года. [103] Из этих людей 1605 участников (19,4%) считались имеющими низкую массу скелетных мышц на исходном уровне, менее 7,30 кг/м 2 для мужчин и менее 5,42 кг/м 2 для женщин (уровни, определяемые как саркопения в Канаде).
Исполнительная умственная функция , память и психомоторная скорость измерялись на исходном уровне и через три года. Исполнительная умственная функция измерялась с помощью стандартных тестов, включая способность произнести последовательность 1-A, 2-B, 3-C…, чтобы назвать несколько животных за одну минуту, и с помощью теста Струпа . [103] Исследование показало, что у людей с более низкой массой скелетных мышц в начале исследования исполнительная умственная функция снизилась значительно резче, чем у людей с более высокой мышечной массой. С другой стороны, память, а также психомоторная скорость не коррелировали с массой скелетных мышц. [103] Таким образом, большая мышечная масса с сопутствующим большим секретомом, по-видимому, имела эндокринную функцию защиты исполнительной умственной функции у людей старше 65 лет.
Палух и др. [104] сравнили среднее количество шагов, пройденных в день, с риском смертности как для взрослых старше 60 лет, так и для взрослых моложе 60 лет. Исследование представляло собой метаанализ 15 исследований, которые в совокупности оценивали 47 471 взрослого человека в течение 7 лет. Индивидуумы были разделены на примерно равные квартили. Самый низкий квартиль в среднем составлял 3 553 шага/день, второй квартиль — 5 801 шаг/день, третий квартиль — 7 842 шага/день и четвертый квартиль — 10 901 шаг/день. Интенсивность ходьбы, скорректированная с учетом объема ходьбы, не влияла на смертность. Однако количество шагов/день было явно связано со смертностью. Когда риск смертности для лиц старше 60 лет был установлен на уровне 1,0 для самого низкого квартиля шагов/день, относительный риск смертности для второго, третьего и четвертого квартилей составил 0,56, 0,45 и 0,35 соответственно. Для лиц моложе 60 лет результаты были менее выраженными. Для лиц моложе 60 лет, когда риск смертности в первом квартиле был установлен на уровне 1,0, относительные риски смертности во втором, третьем и четвертом квартилях составили 0,57, 0,42 и 0,53 соответственно. Таким образом, использование скелетных мышц при ходьбе оказывает большое влияние, особенно среди пожилых людей, на смертность.
Уильямс и др. [102] получили биопсию скелетной мышцы бедра (широкая латеральная мышца бедра) восьми 23-летних, изначально малоподвижных, мужчин европеоидной расы. Биопсии брались как до, так и после шестинедельной программы тренировок на выносливость. Упражнение состояло в езде на велотренажере в течение одного часа, пять дней в неделю в течение шести недель.
Из 13 108 генов с обнаруженной экспрессией в мышечных биопсиях, 641 ген был повышен после тренировки на выносливость и 176 генов были понижены. Из 817 измененных генов, 531 были идентифицированы как находящиеся в секретоме либо Uniprot , либо Exocarta , либо исследованиями, изучающими секретом мышечных клеток. Поскольку многие из генов, регулируемых упражнениями, идентифицированы как секретируемые, это указывает на то, что большая часть эффекта упражнений имеет эндокринную, а не метаболическую функцию. [102] Основные пути, на которые, как было обнаружено, влияют секретируемые регулируемые упражнениями белки, были связаны с сердечной , когнитивной , почечной и тромбоцитарной функциями.
В период с 2012 по 2019 год по меньшей мере 25 отчетов указали на важную роль эпигенетических механизмов в реакциях скелетных мышц на физические упражнения. [105] Эпигенетические изменения часто происходят путем добавления метильных групп к цитозинам в ДНК или удаления метильных групп из цитозинов ДНК , особенно на участках CpG . Метилирование цитозинов может привести к уплотнению ДНК в гетерохроматин , тем самым препятствуя доступу других молекул к ДНК. [106] Эпигенетические изменения также часто происходят посредством ацетилирования или деацетилирования гистоновых хвостов в хроматине . ДНК в ядре обычно состоит из сегментов из 146 пар оснований ДНК, обернутых вокруг восьми плотно связанных гистонов (и каждый гистон также имеет свободный хвост) в структуре, называемой нуклеосомой , и один сегмент ДНК соединен с соседним сегментом ДНК на нуклеосоме с помощью линкерной ДНК . Ацетилирование гистоновых хвостов обычно приводит к ослаблению ДНК вокруг нуклеосомы, что приводит к повышению доступности ДНК.

Экспрессия генов в мышцах в значительной степени регулируется, как и в тканях в целом, регуляторными последовательностями ДНК , особенно энхансерами . Энхансеры — это некодирующие последовательности в геноме, которые активируют экспрессию удаленных целевых генов, [107] путем образования петель и взаимодействия с промоторами своих целевых генов [108] (см. рисунок «Регуляция транскрипции у млекопитающих»). Как сообщают Уильямс и др., [102] среднее расстояние в петле между связанными энхансерами и промоторами генов составляет 239 000 нуклеотидных оснований.
Тренировка выносливости мышц изменяет экспрессию мышечных генов посредством эпигенетического метилирования ДНК или деметилирования участков CpG в энхансерах. [109]
В исследовании Линдхольма и соавторов [109] двадцать три человека в возрасте около 27 лет, ведущие малоподвижный образ жизни, добровольно согласились тренироваться на выносливость только одной ноги в течение 3 месяцев. Другая нога использовалась в качестве нетренированной контрольной ноги. Тренировка состояла из тренировки разгибания колена одной ногой в течение 3 месяцев (45 мин, 4 сеанса в неделю). Биопсии скелетных мышц из латеральной широкой мышцы бедра (мышцы бедра) брались как до начала тренировки, так и через 24 часа после последней тренировки с каждой из ног. Нога, тренированная на выносливость, по сравнению с нетренированной ногой имела значительные изменения метилирования ДНК в 4919 участках по всему геному. Участки измененного метилирования ДНК находились преимущественно в энхансерах . Транскрипционный анализ с использованием секвенирования РНК идентифицировал 4076 дифференциально экспрессируемых генов.
Гены с транскрипционно повышенной регуляцией были связаны с энхансерами, которые имели значительное снижение метилирования ДНК , в то время как гены с транскрипционно пониженной регуляцией были связаны с энхансерами, которые имели повышенное метилирование ДНК. Повышенное метилирование было в основном связано с генами, участвующими в структурном ремоделировании мышц и метаболизме глюкозы. Энхансеры с пониженным метилированием были связаны с генами, функционирующими в воспалительных или иммунологических процессах и в регуляции транскрипции.

Как указано выше, после упражнений эпигенетические изменения в энхансерах изменяют долгосрочную экспрессию сотен мышечных генов. [102] Сюда входят гены, продуцирующие белки, секретируемые в системный кровоток, многие из которых могут действовать как эндокринные мессенджеры. [102] Шесть малоподвижных, около 23 лет, мужчин европеоидной расы сдали биопсию vastus lateralis (бедренной мышцы) перед началом программы упражнений (шесть недель 60-минутных сессий езды на стационарном велосипеде, пять дней в неделю). Через четыре дня после завершения этой программы упражнений экспрессия многих генов была постоянно эпигенетически изменена. Изменения изменили ацетилирование и деацетилирование гистоновых хвостов, расположенных в энхансерах, контролирующих гены с измененной экспрессией. [102]
Гены с повышенной регуляцией были связаны с эпигенетическими ацетилированиями, добавленными в гистоне 3 лизине 27 (H3K27ac) нуклеосом, расположенных в их энхансерах . Гены с пониженной регуляцией были связаны с удалением эпигенетических ацетилирований в H3K27 в нуклеосомах, расположенных в их энхансерах (см. рисунок « Нуклеосома с гистоновыми хвостами, установленными для транскрипционной активации»). Биопсии латеральной широкой мышцы бедра показали экспрессию 13 108 генов на исходном уровне до программы тренировок. Через четыре дня после завершения программы тренировок биопсии тех же мышц показали измененную экспрессию генов, при этом 641 ген был повышен, а 176 генов — понижен. [102] Уильямс и др. идентифицировали 599 взаимодействий гена-энхансера, охватывающих 491 энхансер и 268 генов (было обнаружено, что с некоторыми генами связано несколько энхансеров), где как энхансер, так и связанный с ним целевой ген координированно либо повышались, либо понижались после тренировки. [102]
{{cite web}}: CS1 maint: multiple names: authors list (link)