

Фотосинтез ( / ˌ f oʊ t ə ˈ s ɪ n θ ə s ɪ s / FOH -tə- SINTH -ə-sis ) [1] представляет собой систему биологических процессов , посредством которых фотосинтезирующие организмы , такие как большинство растений, водорослей и цианобактерий , преобразуют световую энергию , как правило, солнечного света, в химическую энергию, необходимую для питания их метаболизма . Фотосинтез обычно относится к оксигенному фотосинтезу , процессу, в котором вырабатывается кислород. Фотосинтезирующие организмы хранят химическую энергию, произведенную таким образом, во внутриклеточных органических соединениях (соединениях, содержащих углерод), таких как сахара, гликоген , целлюлоза и крахмалы . Чтобы использовать эту сохраненную химическую энергию, клетки организма метаболизируют органические соединения посредством клеточного дыхания . Фотосинтез играет решающую роль в производстве и поддержании содержания кислорода в атмосфере Земли, и он поставляет большую часть биологической энергии, необходимой для сложной жизни на Земле. [2]
Некоторые бактерии также выполняют аноксигенный фотосинтез , который использует бактериохлорофилл для расщепления сероводорода в качестве восстановителя вместо воды, производя серу вместо кислорода. Археи , такие как Halobacterium, также выполняют тип аноксигенного фотосинтеза без фиксации углерода , где более простой фотопигмент ретиналь и его микробные производные родопсин используются для поглощения зеленого света и питания протонных насосов для прямого синтеза аденозинтрифосфата (АТФ), «энергетической валюты» клеток. Такой архейный фотосинтез, возможно, был самой ранней формой фотосинтеза, которая развилась на Земле, еще в палеоархее , предшествовавшей цианобактериям (см. гипотезу Purple Earth ).
Хотя детали могут различаться между видами , процесс всегда начинается, когда световая энергия поглощается реакционными центрами , белками, содержащими фотосинтетические пигменты или хромофоры . У растений эти белки представляют собой хлорофиллы ( производное порфирина , которое поглощает красный и синий спектры света, таким образом отражая зеленый), содержащиеся внутри хлоропластов , в изобилии присутствующих в клетках листьев . У бактерий они встроены в плазматическую мембрану . В этих светозависимых реакциях часть энергии используется для отрыва электронов от подходящих веществ, таких как вода, с образованием газообразного кислорода. Водород, высвобождаемый при расщеплении воды, используется для создания двух важных молекул, которые участвуют в энергетических процессах: восстановленного никотинамидадениндинуклеотидфосфата (НАДФН) и АТФ.
В растениях, водорослях и цианобактериях сахара синтезируются посредством последовательной последовательности светонезависимых реакций, называемых циклом Кальвина . В этом процессе атмосферный углекислый газ включается в уже существующие органические соединения, такие как рибулозобисфосфат (РБФ). [3] Используя АТФ и НАДФН, полученные в результате светозависимых реакций, полученные соединения затем восстанавливаются и удаляются для образования дополнительных углеводов, таких как глюкоза . У других бактерий для достижения той же цели используются другие механизмы, такие как обратный цикл Кребса .
Первые фотосинтезирующие организмы, вероятно, появились на ранних этапах эволюционной истории жизни, используя в качестве источников электронов восстановители, такие как водород или сероводород, а не воду. [4] Цианобактерии появились позже; избыток кислорода, который они производили, напрямую способствовал оксигенации Земли , [5] что сделало возможной эволюцию сложной жизни. Средняя скорость получения энергии при мировом фотосинтезе составляет приблизительно 130 тераватт , [6] [7] [8] что примерно в восемь раз превышает общее потребление энергии человеческой цивилизацией . [9] Фотосинтезирующие организмы также преобразуют около 100–115 миллиардов тонн (91–104 Пг петаграммов , или миллиард метрических тонн) углерода в биомассу в год. [10] [11] Фотосинтез был открыт в 1779 году Яном Ингенхаузом . Он показал, что растениям нужен свет, а не только воздух, почва и вода.
Фотосинтез жизненно важен для климатических процессов, поскольку он захватывает углекислый газ из воздуха и связывает его в растениях, собранном урожае и почве. По оценкам, только зерновые культуры связывают 3825 Тг или 3,825 Пг углекислого газа каждый год, т. е. 3,825 млрд метрических тонн. [12]

Большинство фотосинтезирующих организмов являются фотоавтотрофами , что означает, что они способны синтезировать пищу непосредственно из углекислого газа и воды, используя энергию света. Однако не все организмы используют углекислый газ в качестве источника атомов углерода для осуществления фотосинтеза; фотогетеротрофы используют органические соединения, а не углекислый газ, в качестве источника углерода. [2]
У растений, водорослей и цианобактерий фотосинтез высвобождает кислород. Этот оксигенный фотосинтез является наиболее распространенным типом фотосинтеза, используемым живыми организмами. Некоторые тенелюбивые растения (сциофиты) вырабатывают настолько мало кислорода во время фотосинтеза, что используют его весь сами, а не выделяют в атмосферу. [13]
Хотя существуют некоторые различия между оксигенным фотосинтезом у растений , водорослей и цианобактерий , общий процесс у этих организмов довольно схож. Существует также много разновидностей аноксигенного фотосинтеза , используемых в основном бактериями, которые потребляют углекислый газ, но не выделяют кислород. [14] [15]
Углекислый газ преобразуется в сахара в процессе, называемом фиксацией углерода ; фотосинтез захватывает энергию солнечного света для преобразования углекислого газа в углеводы . Фиксация углерода является эндотермической окислительно-восстановительной реакцией. В общих чертах фотосинтез противоположен клеточному дыханию : в то время как фотосинтез представляет собой процесс восстановления углекислого газа до углеводов, клеточное дыхание представляет собой окисление углеводов или других питательных веществ до углекислого газа. Питательные вещества, используемые в клеточном дыхании, включают углеводы, аминокислоты и жирные кислоты. Эти питательные вещества окисляются с образованием углекислого газа и воды, а также с высвобождением химической энергии для управления метаболизмом организма .
Фотосинтез и клеточное дыхание являются различными процессами, поскольку они происходят посредством различных последовательностей химических реакций и в различных клеточных компартментах (клеточное дыхание в митохондриях ). [16] [17]
Общее уравнение фотосинтеза, впервые предложенное Корнелисом ван Нилом, выглядит следующим образом: [18]
Поскольку вода используется в качестве донора электронов в оксигенном фотосинтезе, уравнение этого процесса имеет вид:
Это уравнение подчеркивает, что вода является как реагентом в светозависимой реакции, так и продуктом светонезависимой реакции, но сокращение n молекул воды с каждой стороны дает чистое уравнение:
В других процессах вода заменяется другими соединениями (например, арсенитом ) в роли источника электронов; например, некоторые микробы используют солнечный свет для окисления арсенита до арсената : [19] Уравнение этой реакции следующее:
Фотосинтез происходит в два этапа. На первом этапе светозависимые реакции или световые реакции захватывают энергию света и используют ее для создания переносчика водорода НАДФН и молекулы-аккумулятора энергии АТФ . На втором этапе светонезависимые реакции используют эти продукты для захвата и восстановления углекислого газа.
Большинство организмов, использующих кислородный фотосинтез, используют видимый свет для светозависимых реакций, хотя по крайней мере три используют коротковолновое инфракрасное или, точнее, дальнее красное излучение. [21]
Некоторые организмы используют даже более радикальные варианты фотосинтеза. Некоторые археи используют более простой метод, который использует пигмент, похожий на тот, который используется для зрения у животных. Бактериородопсин меняет свою конфигурацию в ответ на солнечный свет, действуя как протонный насос. Это создает протонный градиент более непосредственно, который затем преобразуется в химическую энергию. Процесс не включает фиксацию углекислого газа и не выделяет кислород, и, по-видимому, эволюционировал отдельно от более распространенных типов фотосинтеза. [22]

У фотосинтезирующих бактерий белки, которые собирают свет для фотосинтеза, встроены в клеточные мембраны . В простейшей форме это касается мембраны, окружающей саму клетку. [23] Однако мембрана может быть плотно свернута в цилиндрические листы, называемые тилакоидами , [24] или собрана в круглые пузырьки, называемые интрацитоплазматическими мембранами . [25] Эти структуры могут заполнять большую часть внутренней части клетки, давая мембране очень большую площадь поверхности и, следовательно, увеличивая количество света, которое может поглощать бактерия. [24]
У растений и водорослей фотосинтез происходит в органеллах , называемых хлоропластами . Типичная растительная клетка содержит около 10-100 хлоропластов. Хлоропласт окружен мембраной. Эта мембрана состоит из фосфолипидной внутренней мембраны, фосфолипидной внешней мембраны и межмембранного пространства. Мембрана окружает водную жидкость, называемую стромой. Внутри стромы находятся стопки тилакоидов (граны), которые являются местом фотосинтеза. Тилакоиды выглядят как сплющенные диски. Сам тилакоид окружен тилакоидной мембраной, а внутри замкнутого объема находится просвет или тилакоидное пространство. В тилакоидную мембрану встроены интегральные и периферические мембранные белковые комплексы фотосинтетической системы.
Растения поглощают свет в основном с помощью пигмента хлорофилла . Зеленая часть светового спектра не поглощается, а отражается, что является причиной того, что большинство растений имеют зеленый цвет. Помимо хлорофилла, растения также используют пигменты, такие как каротины и ксантофиллы . [26] Водоросли также используют хлорофилл, но присутствуют и другие различные пигменты, такие как фикоцианин , каротины и ксантофиллы в зеленых водорослях , фикоэритрин в красных водорослях (родофитах) и фукоксантин в бурых водорослях и диатомовых водорослях , что приводит к широкому разнообразию цветов.
Эти пигменты встроены в растения и водоросли в комплексы, называемые антенными белками. В таких белках пигменты организованы так, чтобы работать вместе. Такая комбинация белков также называется комплексом сбора света . [27]
Хотя все клетки в зеленых частях растения имеют хлоропласты, большинство из них находятся в специально приспособленных структурах, называемых листьями . Некоторые виды, адаптированные к условиям сильного солнечного света и засушливости , такие как многие виды молочаев и кактусов , имеют свои основные фотосинтетические органы в своих стеблях. Клетки во внутренних тканях листа, называемые мезофиллом , могут содержать от 450 000 до 800 000 хлоропластов на каждый квадратный миллиметр листа. Поверхность листа покрыта водостойкой воскообразной кутикулой , которая защищает лист от чрезмерного испарения воды и уменьшает поглощение ультрафиолетового или синего света , чтобы минимизировать нагрев . Прозрачный слой эпидермиса позволяет свету проходить к клеткам палисадного мезофилла, где происходит большая часть фотосинтеза.

В реакциях, зависящих от света , одна молекула пигмента хлорофилла поглощает один фотон и теряет один электрон . Этот электрон захватывается модифицированной формой хлорофилла, называемой феофитином , которая передает электрон молекуле хинона , запуская поток электронов по цепи переноса электронов , что приводит к конечному восстановлению НАДФ до НАДФН . Кроме того, это создает протонный градиент (градиент энергии) через мембрану хлоропласта , который используется АТФ -синтазой в синтезе АТФ . Молекула хлорофилла в конечном итоге восстанавливает потерянный ею электрон, когда молекула воды расщепляется в процессе, называемом фотолизом , в результате которого выделяется кислород .
Общее уравнение светозависимых реакций в условиях нециклического потока электронов в зеленых растениях имеет вид: [28]
Не все длины волн света могут поддерживать фотосинтез. Спектр фотосинтетического действия зависит от типа присутствующих вспомогательных пигментов . Например, у зеленых растений спектр действия напоминает спектр поглощения хлорофиллов и каротиноидов с пиками поглощения в фиолетово-синем и красном свете. У красных водорослей спектр действия представляет собой сине-зеленый свет, что позволяет этим водорослям использовать синий конец спектра для роста в более глубоких водах, которые отфильтровывают более длинные волны (красный свет), используемые надземными зелеными растениями. Непоглощенная часть светового спектра — это то, что придает фотосинтезирующим организмам их цвет (например, зеленые растения, красные водоросли, пурпурные бактерии ) и является наименее эффективной для фотосинтеза в соответствующих организмах .
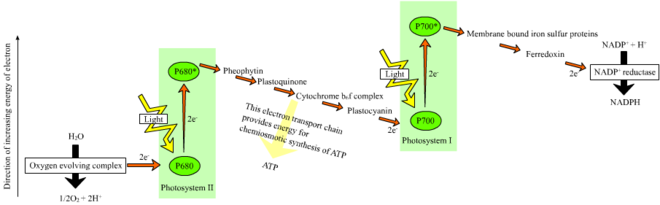
В растениях светозависимые реакции происходят в тилакоидных мембранах хлоропластов , где они управляют синтезом АТФ и НАДФН . Светозависимые реакции бывают двух форм: циклические и нециклические .
В нециклической реакции фотоны захватываются в светособирающих антенных комплексах фотосистемы II хлорофиллом и другими вспомогательными пигментами (см. схему справа). Поглощение фотона антенным комплексом высвобождает электрон с помощью процесса, называемого фотоиндуцированным разделением зарядов . Антенная система находится в ядре молекулы хлорофилла реакционного центра фотосистемы II. Этот высвобождаемый электрон захватывается первичной молекулой -акцептором электронов , феофитином . Поскольку электроны перемещаются по цепи переноса электронов (так называемая Z-схема , показанная на схеме), хемиосмотический потенциал генерируется путем перекачивания катионов протонов ( H + ) через мембрану в пространство тилакоидов . Фермент АТФ-синтаза использует этот хемиосмотический потенциал для производства АТФ во время фотофосфорилирования , тогда как НАДФН является продуктом конечной окислительно-восстановительной реакции в Z-схеме . Электрон входит в молекулу хлорофилла в фотосистеме I. Там он далее возбуждается светом, поглощенным этой фотосистемой . Затем электрон передается по цепи акцепторов электронов , которым он передает часть своей энергии . Энергия, доставленная акцепторам электронов, используется для перемещения ионов водорода через тилакоидную мембрану в просвет . В конечном итоге электрон используется для восстановления кофермента НАДФ с помощью H + до НАДФН (который выполняет функции в светонезависимой реакции); в этой точке путь этого электрона заканчивается.
Циклическая реакция похожа на нециклическую, но отличается тем, что она генерирует только АТФ, и не создает восстановленный НАДФ (НАДФН). Циклическая реакция происходит только в фотосистеме I. После того, как электрон вытеснен из фотосистемы, электрон передается вниз по молекулам-акцепторам электронов и возвращается в фотосистему I, откуда он был испущен, отсюда и название циклическая реакция .
Линейный перенос электронов через фотосистему оставит реакционный центр этой фотосистемы окисленным . Подъем другого электрона сначала потребует повторного восстановления реакционного центра. Возбужденные электроны, потерянные из реакционного центра ( P700 ) фотосистемы I, заменяются переносом от пластоцианина , электроны которого поступают из электронного транспорта через фотосистему II . Фотосистема II, как первый шаг Z-схемы , требует внешнего источника электронов для восстановления своего окисленного хлорофилла a реакционного центра. Источником электронов для фотосинтеза в зеленых растениях и цианобактериях является вода. Две молекулы воды окисляются энергией четырех последовательных реакций разделения зарядов фотосистемы II, образуя молекулу двухатомного кислорода и четыре иона водорода . Полученные электроны переносятся на окислительно-восстановительно-активный остаток тирозина , который окисляется энергией P680 + . Это сбрасывает способность P680 поглощать другой фотон и высвобождать другой фотодиссоциированный электрон. Окисление воды катализируется в фотосистеме II окислительно-восстановительной структурой, которая содержит четыре иона марганца и ион кальция ; этот комплекс, выделяющий кислород, связывает две молекулы воды и содержит четыре окислительных эквивалента, которые используются для управления реакцией окисления воды (диаграммы S-состояния Кока). Ионы водорода высвобождаются в просвете тилакоида и, следовательно, вносят вклад в трансмембранный хемиосмотический потенциал, который приводит к синтезу АТФ . Кислород является отходом светозависимых реакций, но большинство организмов на Земле используют кислород и его энергию для клеточного дыхания , включая фотосинтезирующие организмы . [29] [30]
В светонезависимых (или «темновых») реакциях фермент RuBisCO захватывает CO2 из атмосферы и в процессе , называемом циклом Кальвина , использует вновь образованный НАДФН и высвобождает трехуглеродные сахара , которые позже объединяются , образуя сахарозу и крахмал . Общее уравнение светонезависимых реакций в зеленых растениях выглядит следующим образом [28] : 128

Фиксация углерода производит промежуточный продукт из трехуглеродных сахаров , который затем преобразуется в конечные углеводные продукты. Простые углеродные сахара, которые производит фотосинтез, затем используются для образования других органических соединений , таких как строительный материал целлюлоза , предшественники биосинтеза липидов и аминокислот , или в качестве топлива в клеточном дыхании . Последнее происходит не только в растениях, но и в животных , когда углерод и энергия из растений передаются через пищевую цепь .
Фиксация или восстановление углекислого газа представляет собой процесс, в котором углекислый газ соединяется с пятиуглеродным сахаром , рибулозо - 1,5-бисфосфатом , с образованием двух молекул трехуглеродного соединения, глицерат-3-фосфата , также известного как 3-фосфоглицерат. Глицерат-3-фосфат в присутствии АТФ и НАДФН, образующихся на светозависимых стадиях, восстанавливается до глицеральдегид-3-фосфата . Этот продукт также называют 3-фосфоглицеральдегидом (PGAL) или, в более общем смысле, триозофосфатом . Большая часть (пять из шести молекул) полученного глицеральдегид-3-фосфата используется для регенерации рибулозо-1,5-бисфосфата, чтобы процесс мог продолжаться. Триозофосфаты, не «переработанные» таким образом, часто конденсируются с образованием гексозофосфатов , которые в конечном итоге дают сахарозу , крахмал и целлюлозу , а также глюкозу и фруктозу . Сахара , образующиеся в ходе метаболизма углерода, дают углеродные скелеты , которые могут использоваться для других метаболических реакций, таких как производство аминокислот и липидов .

В жарких и сухих условиях растения закрывают устьица , чтобы предотвратить потерю воды. В этих условиях уровень CO2 будет уменьшаться, а уровень кислорода , образующегося в результате световых реакций фотосинтеза, будет увеличиваться, что приведет к увеличению фотодыхания за счет оксигеназной активности рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы (RuBisCO) и снижению фиксации углерода. Некоторые растения выработали механизмы для увеличения концентрации CO2 в листьях в этих условиях. [31]
Растения, которые используют процесс фиксации углерода C4 , химически фиксируют углекислый газ в клетках мезофилла , добавляя его к трехуглеродной молекуле фосфоенолпирувата (PEP), реакция, катализируемая ферментом, называемым PEP -карбоксилазой , создавая четырехуглеродную органическую кислоту щавелевоуксусную кислоту . Щавелевоуксусная кислота или малат , синтезированные этим процессом, затем перемещаются в специализированные клетки обкладки пучка , где находятся фермент RuBisCO и другие ферменты цикла Кальвина, и где CO2, высвобождаемый путем декарбоксилирования четырехуглеродных кислот, затем фиксируется активностью RuBisCO в трехуглеродные 3-фосфоглицериновые кислоты . Физическое отделение RuBisCO от световых реакций, генерирующих кислород, снижает фотодыхание и увеличивает фиксацию CO2 и, таким образом, фотосинтетическую способность листа . [32] Растения C4 могут производить больше сахара , чем растения C3 в условиях высокой освещенности и температуры . Многие важные сельскохозяйственные культуры являются растениями C 4 , включая кукурузу , сорго , сахарный тростник и просо . Растения, которые не используют PEP-карбоксилазу для фиксации углерода, называются растениями C 3 , потому что первичная реакция карбоксилирования , катализируемая RuBisCO, производит трехуглеродные 3-фосфоглицериновые кислоты непосредственно в цикле Кальвина-Бенсона . Более 90% растений используют фиксацию углерода C 3 , по сравнению с 3%, которые используют фиксацию углерода C 4 ; [33] однако, эволюция C 4 в более чем шестидесяти растительных линиях делает его ярким примером конвергентной эволюции . [31] Фотосинтез C 2 , который включает концентрацию углерода путем избирательного расщепления фотодыхательного глицина, является как эволюционным предшественником C 4 , так и полезным механизмом концентрации углерода сам по себе. [34]
Ксерофиты , такие как кактусы и большинство суккулентов , также используют PEP-карбоксилазу для захвата углекислого газа в процессе, называемом метаболизмом крассуловой кислоты (CAM). В отличие от метаболизма C4 , который пространственно разделяет фиксацию CO2 в PEP от цикла Кальвина, CAM временно разделяет эти два процесса. Растения CAM имеют другую анатомию листьев , чем растения C3 , и фиксируют CO2 ночью , когда их устьица открыты. Растения CAM хранят CO2 в основном в форме яблочной кислоты посредством карбоксилирования фосфоенолпирувата в оксалоацетат , который затем восстанавливается до малата. Декарбоксилирование малата в течение дня высвобождает CO2 внутри листьев, таким образом позволяя фиксировать углерод в 3-фосфоглицерат с помощью RuBisCO. CAM используется 16 000 видов растений. [35]
Растения, накапливающие оксалат кальция , такие как Amaranthus hybridus и Colobanthus quitensis , демонстрируют разновидность фотосинтеза, в которой кристаллы оксалата кальция функционируют как динамические углеродные пулы , поставляя углекислый газ (CO2 ) фотосинтетическим клеткам, когда устьица частично или полностью закрыты. Этот процесс был назван фотосинтезом тревоги . В условиях стресса (например, дефицита воды ) оксалат , высвобождаемый из кристаллов оксалата кальция, преобразуется в CO2 ферментом оксалатоксидазой, и полученный CO2 может поддерживать реакции цикла Кальвина. Реактивная перекись водорода (H2O2), побочный продукт реакции оксалатоксидазы, может быть нейтрализована каталазой . Фотосинтез тревоги представляет собой фотосинтетический вариант , который следует добавить к хорошо известным путям C4 и CAM. Однако фотосинтез тревоги, в отличие от этих путей, действует как биохимический насос, который собирает углерод из внутренней части органа (или из почвы ) , а не из атмосферы. [36] [37]
Цианобактерии обладают карбоксисомами , которые увеличивают концентрацию CO 2 вокруг RuBisCO для увеличения скорости фотосинтеза. Фермент, карбоангидраза , расположенный внутри карбоксисомы, высвобождает CO 2 из растворенных гидрокарбонатных ионов (HCO−
3). Прежде чем CO 2 успеет диффундировать наружу, RuBisCO, сконцентрированный внутри карбоксисомы, быстро впитывает его. HCO−
3ионы производятся из CO 2 вне клетки другой карбоангидразой и активно закачиваются в клетку мембранным белком. Они не могут пересекать мембрану, поскольку они заряжены, и внутри цитозоля они очень медленно превращаются обратно в CO 2 без помощи карбоангидразы. Это вызывает HCO−
3ионы накапливаются внутри клетки, откуда они диффундируют в карбоксисомы. [38] Пиреноиды в водорослях и роголистниках также способствуют концентрации CO2 вокруг RuBisCO. [39]
Общий процесс фотосинтеза происходит в четыре этапа: [11]
Растения обычно преобразуют свет в химическую энергию с эффективностью фотосинтеза 3–6%. [40] [41] Поглощенный свет, который не преобразуется, рассеивается в основном в виде тепла , а небольшая часть (1–2%) переизлучается в виде флуоресценции хлорофилла на более длинных (красных) длинах волн . Этот факт позволяет измерять световую реакцию фотосинтеза с помощью хлорофилловых флуориметров . [42]
Фактическая эффективность фотосинтеза растений зависит от частоты преобразуемого света , интенсивности света , температуры и доли углекислого газа в атмосфере и может варьироваться от 0,1% до 8%. [43] Для сравнения, солнечные панели преобразуют свет в электрическую энергию с эффективностью приблизительно 6–20% для панелей массового производства и более 40% в лабораторных устройствах. Ученые изучают фотосинтез в надежде разработать растения с повышенной урожайностью . [41]
Эффективность как световых, так и темновых реакций может быть измерена, но взаимосвязь между ними может быть сложной. Например, световая реакция создает молекулы энергии АТФ и НАДФН , которые растения C3 могут использовать для фиксации углерода или фотодыхания . [44] Электроны также могут течь к другим поглотителям электронов. [45] [46] [47] По этой причине авторы нередко различают работу, выполненную в нефотодыхательных условиях и в фотодыхательных условиях . [48] [49] [50]
Флуоресценция хлорофилла фотосистемы II может измерять световую реакцию, а инфракрасные газоанализаторы могут измерять темновую реакцию . [51] Интегрированный хлорофилловый флуориметр и система газообмена могут исследовать как световые, так и темновые реакции, когда исследователи используют две отдельные системы вместе. [52] Инфракрасные газоанализаторы и некоторые датчики влажности достаточно чувствительны, чтобы измерять фотосинтетическую ассимиляцию CO2 и ΔH2O с использованием надежных методов . CO2 обычно измеряется в мкмоль /( м2 / с ) , частях на миллион или объеме на миллион; а H2O обычно измеряется в ммоль / (м2 / с) или в мбар . Измеряя ассимиляцию CO 2 , ΔH 2 O, температуру листьев, барометрическое давление , площадь листьев и фотосинтетически активную радиацию (ФАР), становится возможным оценить «A» или ассимиляцию углерода, «E» или транспирацию , «gs» или устьичную проводимость и «Ci» или внутриклеточный CO 2 . [53] Однако более распространено использование флуоресценции хлорофилла для измерения стресса растений , где это уместно, поскольку наиболее часто используемые параметры FV/FM и Y(II) или F/FM' можно измерить за несколько секунд, что позволяет исследовать более крупные популяции растений. [50]
Системы газообмена , которые обеспечивают контроль уровней CO2 выше и ниже окружающего , позволяют использовать обычную практику измерения кривых A/Ci при различных уровнях CO2 для характеристики фотосинтетической реакции растения. [53]
Интегрированный хлорофилловый флуориметр – системы газообмена позволяют более точно измерить фотосинтетическую реакцию и механизмы. [51] [52] В то время как стандартные системы газообмена фотосинтеза могут измерять Ci, или уровни CO 2 в подустьицах , добавление интегрированных измерений флуоресценции хлорофилла позволяет более точно измерить C C, оценку концентрации CO 2 в месте карбоксилирования в хлоропласте, чтобы заменить Ci. [52] [54] Концентрацию CO 2 в хлоропласте становится возможно оценить с помощью измерения проводимости мезофилла или g m с использованием интегрированной системы. [51] [52] [55]
Системы измерения фотосинтеза не предназначены для прямого измерения количества света, поглощаемого листом, но анализ флуоресценции хлорофилла , поглощения P700 и P515 и измерения газообмена раскрывают подробную информацию, например, о фотосистемах , квантовой эффективности и скорости ассимиляции CO 2. С помощью некоторых инструментов можно проанализировать даже зависимость фотосинтетической эффективности от длины волны . [56]
Явление , известное как квантовое блуждание, значительно увеличивает эффективность переноса энергии света. В фотосинтетической клетке водоросли , бактерии или растения есть светочувствительные молекулы, называемые хромофорами, расположенные в антеннообразной структуре, называемой фотокомплексом. Когда фотон поглощается хромофором, он преобразуется в квазичастицу , называемую экситоном , которая прыгает от хромофора к хромофору по направлению к реакционному центру фотокомплекса, набора молекул, который захватывает его энергию в химической форме, доступной для метаболизма клетки. Волновые свойства экситона позволяют ему охватывать более широкую область и одновременно пробовать несколько возможных путей, позволяя ему мгновенно «выбирать» наиболее эффективный маршрут, по которому он будет иметь наибольшую вероятность прибытия к месту назначения за минимально возможное время.
Поскольку квантовые прогулки происходят при температурах, намного превышающих температуры, при которых обычно происходят квантовые явления, они возможны только на очень коротких расстояниях. Препятствия в виде деструктивной интерференции заставляют частицу на мгновение терять свои волновые свойства, прежде чем она снова их обретает после освобождения из своего запертого положения посредством классического «прыжка». Движение электрона к фотоцентру, таким образом, охватывается серией обычных прыжков и квантовых прогулок. [57] [58] [59]
Окаменелости , которые, как полагают, являются нитевидными фотосинтезирующими организмами, датируются возрастом 3,4 миллиарда лет. [60] [61] Более поздние исследования также предполагают, что фотосинтез мог начаться около 3,4 миллиарда лет назад, [62] [63] хотя первое прямое доказательство фотосинтеза получено из тилакоидных мембран, сохранившихся в кремнях возрастом 1,75 миллиарда лет . [64]
Кислородный фотосинтез является основным источником кислорода в атмосфере Земли , и его самое раннее появление иногда называют кислородной катастрофой . Геологические данные свидетельствуют о том, что кислородный фотосинтез, такой как у цианобактерий , стал важным в палеопротерозойскую эру около двух миллиардов лет назад. Современный фотосинтез у растений и большинства фотосинтезирующих прокариот является кислородным, использующим воду в качестве донора электронов , который окисляется до молекулярного кислорода в фотосинтетическом реакционном центре .

Несколько групп животных сформировали симбиотические отношения с фотосинтезирующими водорослями . Они наиболее распространены у кораллов , губок и морских анемонов . Ученые предполагают, что это связано с особенно простым строением тела и большой площадью поверхности этих животных по сравнению с их объемами . [65] Кроме того, несколько морских моллюсков , таких как Elysia viridis и Elysia chlorotica , также поддерживают симбиотические отношения с хлоропластами, которые они захватывают из водорослей в своем рационе , а затем хранят в своих телах (см. Клептопластия ). Это позволяет моллюскам выживать исключительно за счет фотосинтеза в течение нескольких месяцев подряд. [66] [67] Некоторые гены из ядра растительной клетки были даже перенесены в слизней , так что хлоропласты могут быть снабжены белками, необходимыми им для выживания. [68]
Еще более близкая форма симбиоза может объяснить происхождение хлоропластов. Хлоропласты имеют много общего с фотосинтетическими бактериями , включая кольцевую хромосому , рибосому прокариотического типа и похожие белки в фотосинтетическом реакционном центре . [69] [70] Эндосимбиотическая теория предполагает, что фотосинтетические бактерии были приобретены (посредством эндоцитоза ) ранними эукариотическими клетками для формирования первых растительных клеток. Следовательно, хлоропласты могут быть фотосинтетическими бактериями, которые приспособились к жизни внутри растительных клеток. Подобно митохондриям , хлоропласты обладают собственной ДНК , отдельной от ядерной ДНК их растительных клеток-хозяев, и гены в этой хлоропластной ДНК напоминают те, что обнаружены у цианобактерий . [71] ДНК в хлоропластах кодирует окислительно -восстановительные белки, такие как те, которые обнаружены в фотосинтетических реакционных центрах. Гипотеза CoRR предполагает, что такое совместное расположение генов с их генными продуктами необходимо для окислительно-восстановительной регуляции экспрессии генов и объясняет сохранение ДНК в биоэнергетических органеллах . [72]
Исключены симбиотические и клептопластические организмы:
За исключением эвгленид, которые находятся в Excavata , все они принадлежат к Diaphoretickes . Archaeplastida и фотосинтетические Paulinella получили свои пластиды, которые окружены двумя мембранами, через первичный эндосимбиоз в двух отдельных событиях, поглощая цианобактерию. Пластиды во всех других группах имеют либо красное, либо зеленое водорослевое происхождение и называются «красными линиями» и «зелеными линиями». Единственным известным исключением является инфузория Pseudoblepharisma tenue , которая в дополнение к своим пластидам, которые произошли от зеленых водорослей, также имеет пурпурную серную бактерию в качестве симбионта. У динофлагеллят и эвгленид пластиды окружены тремя мембранами, а в остальных линиях — четырьмя. Нуклеоморф , остатки исходного ядра водоросли, расположенные между внутренней и внешней мембранами пластиды, присутствуют в криптофитах (из красной водоросли) и хлорарахниофитах (из зеленой водоросли). [73] Некоторые динофлагелляты, которые потеряли свою фотосинтетическую способность, позже восстановили ее снова через новые эндосимбиотические события с другими водорослями. Хотя они способны выполнять фотосинтез, многие из этих эукариотических групп являются миксотрофами и практикуют гетеротрофию в различной степени.
Ранние фотосинтетические системы, такие как в зеленых и пурпурных серных и зеленых и пурпурных несерных бактериях , как полагают, были аноксигенными и использовали различные другие молекулы, нежели вода, в качестве доноров электронов . Зеленые и пурпурные серные бактерии, как полагают, использовали водород и серу в качестве доноров электронов. Зеленые несерные бактерии использовали различные амино- и другие органические кислоты в качестве доноров электронов. Фиолетовые несерные бактерии использовали различные неспецифические органические молекулы. Использование этих молекул согласуется с геологическими доказательствами того, что ранняя атмосфера Земли была сильно восстановительной в то время . [74]
За возможным исключением Heimdallarchaeota , фотосинтез не обнаружен у архей . [75] Галоархеи фототрофны и могут поглощать энергию солнца, но не собирают углерод из атмосферы и, следовательно, не фотосинтезируют. [76] Вместо хлорофилла они используют родопсины, которые преобразуют световую энергию в ионные градиенты, но не могут опосредовать реакции переноса электронов. [77] [78]
У бактерий в настоящее время известно восемь фотосинтетических линий: [79] [80] [81] [82]
Биохимическая способность использовать воду в качестве источника электронов в фотосинтезе развилась однажды, у общего предка современных цианобактерий (ранее называвшихся сине-зелеными водорослями). Геологические данные указывают на то, что это преобразующее событие произошло на ранней стадии истории Земли, по крайней мере 2450–2320 миллионов лет назад (млн лет назад), и, как предполагается, гораздо раньше. [83] [84] Поскольку атмосфера Земли почти не содержала кислорода во время предполагаемого развития фотосинтеза, считается, что первые фотосинтетические цианобактерии не генерировали кислород. [85] Доступные свидетельства геобиологических исследований архейских ( >2500 млн лет назад) осадочных пород указывают на то, что жизнь существовала 3500 млн лет назад, но вопрос о том, когда развился оксигенный фотосинтез, до сих пор остается без ответа. Ясное палеонтологическое окно в эволюцию цианобактерий открылось около 2000 млн лет назад, выявив уже разнообразную биоту цианобактерий. Цианобактерии оставались основными первичными производителями кислорода на протяжении всего протерозоя (2500–543 млн лет назад), отчасти потому, что окислительно-восстановительная структура океанов благоприятствовала фотоавтотрофам, способным фиксировать азот . [86] [87] Зеленые водоросли присоединились к цианобактериям в качестве основных первичных производителей кислорода на континентальных шельфах ближе к концу протерозоя , но только с мезозойским (251–66 млн лет назад) излучением динофлагеллят, кокколитофорид и диатомовых водорослей первичное производство кислорода в морских шельфовых водах приняло современную форму. Цианобактерии остаются критически важными для морских экосистем как первичные производители кислорода в океанических круговоротах, как агенты биологической фиксации азота и, в измененной форме, как пластиды морских водорослей. [88]
Хотя некоторые этапы фотосинтеза до сих пор не полностью изучены, общее уравнение фотосинтеза известно с XIX века.

Ян ван Гельмонт начал исследование этого процесса в середине 17 века, когда он тщательно измерил массу почвы , которую использовало растение, и массу самого растения по мере его роста. Заметив, что масса почвы меняется очень мало, он выдвинул гипотезу , что масса растущего растения должна исходить из воды , единственного вещества, которое он добавлял в горшечное растение. Его гипотеза была частично верна — большая часть набранной массы исходит из углекислого газа, а также из воды. Однако это был сигнальный момент к идее о том, что основная часть биомассы растения исходит из вложений фотосинтеза, а не из самой почвы.
Джозеф Пристли , химик и министр , обнаружил, что когда он изолировал объем воздуха под перевернутой банкой и сжигал в ней свечу ( которая выделяла CO2 ), свеча сгорала очень быстро, задолго до того, как в ней заканчивался воск . Он также обнаружил, что мышь может аналогичным образом «повредить» воздух. Затем он показал, что растение может восстановить воздух, который свеча и мышь «повредили». [89]
В 1779 году Ян Ингенхауз повторил эксперименты Пристли . Он обнаружил, что именно воздействие солнечного света на растение может заставить его оживить мышь за считанные часы. [89] [90]
В 1796 году швейцарский пастор , ботаник и натуралист Жан Сенебье продемонстрировал , что зеленые растения потребляют углекислый газ и выделяют кислород под воздействием света . Вскоре после этого Николя-Теодор де Соссюр показал, что увеличение массы растения по мере его роста может быть обусловлено не только поглощением CO 2 , но и включением воды. Таким образом, была описана основная реакция , с помощью которой организмы используют фотосинтез для производства пищи (например, глюкозы ). [91]
Корнелис Ван Нил сделал ключевые открытия, объясняющие химию фотосинтеза. Изучая пурпурные серные бактерии и зеленые бактерии , он первым продемонстрировал, что фотосинтез — это светозависимая окислительно-восстановительная реакция , в которой водород восстанавливает (отдает свои атомы в виде электронов и протонов ) углекислый газ.
Роберт Эмерсон открыл две световые реакции, тестируя продуктивность растений с использованием различных длин волн света. При использовании только красного цвета световые реакции подавлялись. При объединении синего и красного цвета выход был гораздо более существенным. Таким образом, было две фотосистемы, одна поглощала длины волн до 600 нм, другая до 700 нм. Первая известна как ФСII, вторая — ФСI. ФСI содержит только хлорофилл «a», ФСII содержит в основном хлорофилл «a» с большей частью доступного хлорофилла «b», среди других пигментов. К ним относятся фикобилины, которые являются красными и синими пигментами красных и синих водорослей соответственно, и фукоксантол для бурых водорослей и диатомовых водорослей. Процесс наиболее продуктивен, когда поглощение квантов одинаково как в ФСII, так и в ФСI, гарантируя, что входная энергия из антенного комплекса делится между системами ФСI и ФСII, что, в свою очередь, питает фотохимию. [11]
Роберт Хилл считал, что комплекс реакций состоит из промежуточного продукта в цитохром b 6 (теперь пластохинон), а другой — из цитохрома f в шаг в механизмах генерации углеводов. Они связаны пластохиноном, который требует энергии для восстановления цитохрома f. Дальнейшие эксперименты, доказывающие, что кислород, вырабатываемый во время фотосинтеза зеленых растений, поступает из воды, были проведены Хиллом в 1937 и 1939 годах. Он показал, что изолированные хлоропласты выделяют кислород в присутствии неестественных восстановителей, таких как оксалат железа , феррицианид или бензохинон , после воздействия света. В реакции Хилла: [92]
A — это акцептор электронов. Поэтому на свету акцептор электронов восстанавливается и выделяется кислород. Сэмюэл Рубен и Мартин Камен использовали радиоактивные изотопы , чтобы определить, что кислород, высвобождаемый в процессе фотосинтеза, поступает из воды.

Мелвин Кэлвин и Эндрю Бенсон , вместе с Джеймсом Басшемом , выяснили путь усвоения углерода (фотосинтетический цикл восстановления углерода) в растениях. Цикл восстановления углерода известен как цикл Кальвина , но многие ученые называют его циклом Кальвина-Бенсона, Бенсона-Кальвина или даже циклом Кальвина-Бенсона-Басшема (или CBB).
Лауреат Нобелевской премии ученый Рудольф А. Маркус позднее смог открыть функцию и значение цепи переноса электронов.
Отто Генрих Варбург и Дин Берк открыли реакцию I-квантового фотосинтеза, которая расщепляет CO2 , активируемую дыханием. [93]
В 1950 году Отто Кандлер представил первые экспериментальные доказательства существования фотофосфорилирования in vivo, используя неповрежденные клетки Chlorella и интерпретируя свои открытия как светозависимое образование АТФ . [94] В 1954 году Дэниел И. Арнон и др. открыли фотофосфорилирование in vitro в изолированных хлоропластах с помощью P 32 . [95] [96]
Луи Н. М. Дуйсенс и Ян Амеш обнаружили, что хлорофилл «а» поглощает один свет, окисляет цитохром f, в то время как хлорофилл «а» (и другие пигменты) поглощает другой свет, но восстанавливает этот же окисленный цитохром, утверждая, что две световые реакции идут последовательно.
В 1893 году американский ботаник Чарльз Рид Барнс предложил два термина, фотосинтакс и фотосинтез , для биологического процесса синтеза сложных углеродных соединений из угольной кислоты в присутствии хлорофилла под воздействием света . Термин фотосинтез происходит от греческого phōs (φῶς, блеск) и sýnthesis (σύνθεσις, расположение вместе), [97] [98] [99], в то время как другое слово, которое он обозначил, было photosyntax , от sýntaxis (σύνταξις, конфигурация). Со временем термин фотосинтез вошел в общее употребление. Позднее открытие аноксигенных фотосинтезирующих бактерий и фотофосфорилирования потребовало переопределения термина. [100]
В конце 1940-х годов в Калифорнийском университете в Беркли химики Мелвин Кэлвин , Эндрю Бенсон, Джеймс Басшем и множество студентов и исследователей, использовавших методы изотопа углерода-14 и бумажной хроматографии, изучили детали фотосинтетического метаболизма углерода . [101] Путь фиксации CO2 водорослями Chlorella за доли секунды на свету привел к образованию трехуглеродной молекулы, называемой фосфоглицериновой кислотой (PGA). За эту оригинальную и новаторскую работу в 1961 году Мелвину Кальвину была присуждена Нобелевская премия по химии. Параллельно с этим физиологи растений изучали газообмен листьев, используя новый метод инфракрасного газового анализа и листовую камеру, где чистые скорости фотосинтеза составляли от 10 до 13 мкмоль CO2 · м −2 ·с −1 , и пришли к выводу, что все наземные растения обладают одинаковыми фотосинтетическими способностями, которые насыщаются светом при менее чем 50% солнечного света. [102] [103]
Позже в 1958–1963 годах в Корнелльском университете было сообщено , что выращенная в поле кукуруза имеет гораздо более высокую скорость фотосинтеза листьев 40 мкмоль CO2 · м −2 ·с −1 и не насыщается при почти полном солнечном свете. [104] [105] Эта более высокая скорость у кукурузы была почти вдвое больше, чем у других видов, таких как пшеница и соя, что указывает на то, что существуют большие различия в фотосинтезе среди высших растений. В Университете Аризоны подробное исследование газообмена более чем 15 видов однодольных и двудольных впервые показало, что различия в анатомии листьев являются решающими факторами в дифференциации фотосинтетических способностей среди видов. [106] [107] У тропических злаков, включая кукурузу, сорго, сахарный тростник, бермудскую траву и двудольный амарант, скорость фотосинтеза листьев составляла около 38–40 мкмоль CO2 · м −2 ·с −1 , и листья имеют два типа зеленых клеток, то есть внешний слой клеток мезофилла, окружающих плотно упакованные клетки оболочки хлорофиллового сосудистого пучка. Этот тип анатомии был назван анатомией Кранца в 19 веке ботаником Готлибом Хаберландтом при изучении анатомии листьев сахарного тростника. [108] Виды растений с самой высокой скоростью фотосинтеза и анатомией Кранца не показали видимого фотодыхания, очень низкую точку компенсации CO2 , высокую оптимальную температуру, высокое устьичное сопротивление и более низкое сопротивление мезофилла для диффузии газа, а также скорости, никогда не насыщаемые при полном солнечном свете. [109] Исследование в Аризоне было обозначено как Citation Classic в 1986 году. [107] Эти виды позже были названы растениями C4, поскольку первое стабильное соединение фиксации CO2 на свету имеет четыре углерода, такие как малат и аспартат. [110] [111] [112] Другие виды, у которых отсутствует анатомия Кранца, были названы типами C3, такими как хлопок и подсолнечник, поскольку первое стабильное соединение углерода - это трехуглеродный PGA. При 1000 ppm CO2 в измеряемом воздухе растения C3 и C4 имели схожие скорости фотосинтеза листьев около 60 мкмоль CO2 · м −2 ·с −1, что указывает на подавление фотодыхания у растений C3. [106] [107]

Существует четыре основных фактора, влияющих на фотосинтез, и несколько сопутствующих факторов. Четыре основных фактора: [113]
Общий фотосинтез ограничен рядом факторов окружающей среды. К ним относятся количество доступного света, площадь листа , которую растение должно захватить (затенение другими растениями является основным ограничением фотосинтеза), скорость, с которой углекислый газ может поступать в хлоропласты для поддержки фотосинтеза, доступность воды и наличие подходящих температур для проведения фотосинтеза. [114]

Процесс фотосинтеза обеспечивает основной приток свободной энергии в биосферу и является одним из четырех основных способов, посредством которых радиация важна для жизни растений. [115]
Радиационный климат в растительных сообществах чрезвычайно изменчив как во времени, так и в пространстве.
В начале 20 века Фредерик Блэкман и Габриэль Маттеи исследовали влияние интенсивности света ( освещения ) и температуры на скорость усвоения углерода.
Эти два эксперимента иллюстрируют несколько важных моментов: во-первых, известно, что в целом фотохимические реакции не зависят от температуры . Однако эти эксперименты ясно показывают, что температура влияет на скорость усвоения углерода, поэтому в полном процессе усвоения углерода должно быть два набора реакций. Это светозависимая «фотохимическая» температурно-независимая стадия и светонезависимая температурно-зависимая стадия. Во-вторых, эксперименты Блэкмана иллюстрируют концепцию ограничивающих факторов . Другим ограничивающим фактором является длина волны света. Цианобактерии, которые находятся на глубине нескольких метров под водой, не могут получать правильные длины волн, необходимые для того, чтобы вызвать фотоиндуцированное разделение зарядов в обычных фотосинтетических пигментах. Для борьбы с этой проблемой у цианобактерий есть светособирающий комплекс, называемый фикобилисомой . [116] Этот комплекс состоит из серии белков с различными пигментами, которые окружают реакционный центр.

По мере повышения концентрации углекислого газа скорость, с которой сахара производятся в светонезависимых реакциях, увеличивается до тех пор, пока не будет ограничена другими факторами. RuBisCO , фермент, который захватывает углекислый газ в светонезависимых реакциях, имеет связывающее сродство как к углекислому газу, так и к кислороду. Когда концентрация углекислого газа высока, RuBisCO будет фиксировать углекислый газ. Однако, если концентрация углекислого газа низкая, RuBisCO будет связывать кислород вместо углекислого газа. Этот процесс, называемый фотодыхание , использует энергию, но не производит сахара.
Активность оксигеназы РубисКО невыгодна для растений по нескольким причинам:
Путь утилизации продуктов оксигеназной активности РубисКО более известен как фотодыхание, поскольку он характеризуется светозависимым потреблением кислорода и выделением углекислого газа.
Это первоначальное включение углерода в органические соединения известно как фиксация углерода.
Предполагается, что фотосинтезирующие организмы удаляют100 × 10 15 граммов углерода/год, фиксируемых фотосинтезирующими организмами. Это эквивалентно4 × 10 18 кДж/год свободной энергии, запасенной в восстановленном углероде. (в Части 8: «Глобальный фотосинтез и атмосфера»)
Средняя глобальная скорость фотосинтеза составляет 130 ТВт.