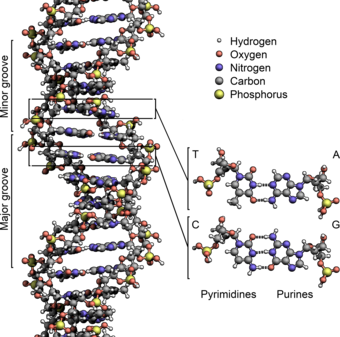

Дезоксирибонуклеиновая кислота ( / d iː ˈ ɒ k s ɪ ˌ r aɪ b oʊ nj uː ˌ k l iː ɪ k , - ˌ k l eɪ -/ ;[1] ДНК) представляет собойполимер, состоящий из двухполинуклеотидныхцепей, которые обвиваются друг вокруг друга, образуядвойную спираль. Полимер несетгенетическиеинструкции для развития, функционирования, роста иразмножениявсех известныхорганизмови многихвирусов. ДНК ирибонуклеиновая кислота(РНК) являютсянуклеиновыми кислотами. Наряду сбелками,липидамии сложными углеводами (полисахаридами), нуклеиновые кислоты являются одним из четырех основных типовмакромолекул, которые необходимы для всех известных формжизни.
Две нити ДНК известны как полинуклеотиды, поскольку они состоят из более простых мономерных единиц, называемых нуклеотидами . [2] [3] Каждый нуклеотид состоит из одного из четырех азотсодержащих нуклеиновых оснований ( цитозин [C], гуанин [G], аденин [A] или тимин [T]), сахара , называемого дезоксирибозой , и фосфатной группы . Нуклеотиды соединены друг с другом в цепь ковалентными связями (известными как фосфодиэфирная связь ) между сахаром одного нуклеотида и фосфатом следующего, в результате чего образуется чередующийся сахаро-фосфатный остов . Азотистые основания двух отдельных полинуклеотидных нитей связаны вместе в соответствии с правилами спаривания оснований (A с T и C с G) водородными связями , образуя двухцепочечную ДНК. Комплементарные азотистые основания делятся на две группы: однокольцевые пиримидины и двухкольцевые пурины . В ДНК пиримидины — это тимин и цитозин; пурины — это аденин и гуанин.
Обе нити двухцепочечной ДНК хранят одну и ту же биологическую информацию . Эта информация реплицируется , когда две нити разделяются. Большая часть ДНК (более 98% для людей) является некодирующей , что означает, что эти секции не служат шаблонами для последовательностей белков . Две нити ДНК идут в противоположных направлениях друг к другу и, таким образом, являются антипараллельными . К каждому сахару прикреплен один из четырех типов азотистых оснований (или оснований ). Именно последовательность этих четырех азотистых оснований вдоль остова кодирует генетическую информацию. Нити РНК создаются с использованием нитей ДНК в качестве шаблона в процессе, называемом транскрипцией , где основания ДНК обмениваются на соответствующие им основания, за исключением случая тимина (T), который РНК заменяет урацилом (U). [4] В соответствии с генетическим кодом эти нити РНК определяют последовательность аминокислот в белках в процессе, называемом трансляцией .
В эукариотических клетках ДНК организована в длинные структуры, называемые хромосомами . Перед типичным делением клетки эти хромосомы дублируются в процессе репликации ДНК, обеспечивая полный набор хромосом для каждой дочерней клетки. Эукариотические организмы ( животные , растения , грибы и простейшие ) хранят большую часть своей ДНК внутри клеточного ядра в виде ядерной ДНК , а некоторую часть в митохондриях в виде митохондриальной ДНК или в хлоропластах в виде хлоропластной ДНК . [5] Напротив, прокариоты ( бактерии и археи ) хранят свою ДНК только в цитоплазме , в кольцевых хромосомах . В эукариотических хромосомах белки хроматина , такие как гистоны , уплотняют и организуют ДНК. Эти уплотняющие структуры направляют взаимодействия между ДНК и другими белками, помогая контролировать, какие части ДНК транскрибируются.

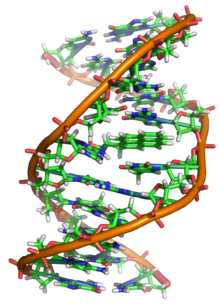
ДНК — это длинный полимер , состоящий из повторяющихся единиц, называемых нуклеотидами . [6] [7] Структура ДНК динамична по всей ее длине, будучи способной сворачиваться в плотные петли и другие формы. [8] У всех видов она состоит из двух спиральных цепей, связанных друг с другом водородными связями . Обе цепи свернуты вокруг одной и той же оси и имеют одинаковый шаг в 34 ангстрема (3,4 нм ). Пара цепей имеет радиус 10 Å (1,0 нм). [9] Согласно другому исследованию, при измерении в другом растворе ширина цепи ДНК составляла 22–26 Å (2,2–2,6 нм), а длина одной нуклеотидной единицы — 3,3 Å (0,33 нм). [10] Плавучая плотность большинства ДНК составляет 1,7 г/см 3 . [11]
ДНК обычно не существует в виде одной нити, а вместо этого в виде пары нитей, которые крепко держатся вместе. [9] [12] Эти две длинные нити обвиваются вокруг друг друга в форме двойной спирали . Нуклеотид содержит как сегмент остова молекулы (который удерживает цепь вместе), так и азотистое основание (которое взаимодействует с другой нитью ДНК в спирали). Азотистое основание, связанное с сахаром, называется нуклеозидом , а основание, связанное с сахаром и с одной или несколькими фосфатными группами, называется нуклеотидом . Биополимер , содержащий несколько связанных нуклеотидов (как в ДНК), называется полинуклеотидом . [13]
Основу цепи ДНК составляют чередующиеся фосфатные и сахарные группы. [14] Сахар в ДНК — это 2-дезоксирибоза , которая является пентозным (пятиуглеродным ) сахаром. Сахара соединены фосфатными группами, которые образуют фосфодиэфирные связи между третьим и пятым атомами углерода соседних сахарных колец. Они известны как 3′-конец (три основных конца) и 5′-конец (пять основных концов) атомов углерода, символ основного используется для того, чтобы отличать эти атомы углерода от атомов основания, с которыми дезоксирибоза образует гликозидную связь . [12]
Таким образом, любая цепь ДНК обычно имеет один конец, на котором имеется фосфатная группа, присоединенная к 5′ углероду рибозы (5′ фосфорил), и другой конец, на котором имеется свободная гидроксильная группа, присоединенная к 3′ углероду рибозы (3′ гидроксил). Ориентация 3′ и 5′ углеродов вдоль сахарофосфатного остова придает направленность (иногда называемую полярностью) каждой цепи ДНК. В двойной спирали нуклеиновой кислоты направление нуклеотидов в одной цепи противоположно их направлению в другой цепи: цепи антипараллельны . Говорят, что асимметричные концы цепей ДНК имеют направленность пяти основных концов (5′) и трех основных концов (3′), при этом 5′ конец имеет терминальную фосфатную группу, а 3′ конец — терминальную гидроксильную группу. Одним из основных различий между ДНК и РНК является сахар: 2-дезоксирибоза в ДНК заменена на родственный пентозный сахар рибозу в РНК. [12]
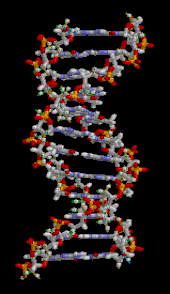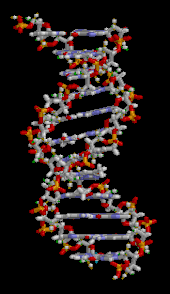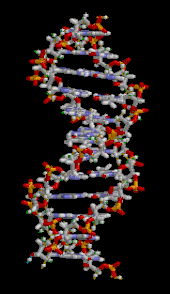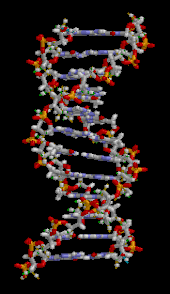
Двойная спираль ДНК стабилизируется в основном двумя силами: водородными связями между нуклеотидами и взаимодействиями между ароматическими азотистыми основаниями . [16] Четыре основания, обнаруженные в ДНК, — это аденин ( A ), цитозин ( C ), гуанин ( G ) и тимин ( T ). Эти четыре основания присоединяются к сахарофосфату, образуя полный нуклеотид, как показано для аденозинмонофосфата . Аденин образует пару с тимином, а гуанин — с цитозином, образуя пары оснований AT и GC . [17] [18]
Азотистые основания подразделяются на два типа: пурины , A и G , которые представляют собой слитые пяти- и шестичленные гетероциклические соединения , и пиримидины , шестичленные кольца C и T. [12] Пятое пиримидиновое азотистое основание, урацил ( U ), обычно занимает место тимина в РНК и отличается от тимина отсутствием метильной группы в своем кольце. В дополнение к РНК и ДНК , было создано много искусственных аналогов нуклеиновых кислот для изучения свойств нуклеиновых кислот или для использования в биотехнологии. [19]
Модифицированные основания встречаются в ДНК. Первым из них был 5-метилцитозин , который был обнаружен в геноме Mycobacterium tuberculosis в 1925 году. [20] Причина присутствия этих неканонических оснований в бактериальных вирусах ( бактериофагах ) заключается в том, чтобы избегать ферментов рестрикции, присутствующих в бактериях. Эта ферментная система действует, по крайней мере, частично как молекулярная иммунная система, защищающая бактерии от заражения вирусами. [21] Модификации оснований цитозина и аденина, наиболее распространенных и модифицированных оснований ДНК, играют жизненно важную роль в эпигенетическом контроле экспрессии генов у растений и животных. [22]
Известно, что в ДНК встречается ряд неканонических оснований. [23] Большинство из них представляют собой модификации канонических оснований плюс урацил.
Двойные спиральные нити образуют остов ДНК. Другая двойная спираль может быть обнаружена в пространствах или канавках между нитями. Эти пустоты примыкают к парам оснований и могут обеспечивать место связывания . Поскольку нити не расположены симметрично относительно друг друга, канавки имеют неравный размер. Большая канавка имеет ширину 22 ангстрема (2,2 нм), а малая канавка — 12 Å (1,2 нм). [24] Из-за большей ширины большой канавки края оснований более доступны в большой канавке, чем в малой. В результате белки, такие как факторы транскрипции , которые могут связываться со специфическими последовательностями в двухцепочечной ДНК, обычно контактируют со сторонами оснований, открытыми в большой канавке. [25] Эта ситуация варьируется в зависимости от необычных конформаций ДНК внутри клетки (см. ниже) , но большие и малые бороздки всегда называются так, чтобы отражать разницу в ширине, которая будет видна, если ДНК скрутить обратно в обычную форму B.
В двойной спирали ДНК каждый тип нуклеиновых оснований на одной нити связывается только с одним типом нуклеиновых оснований на другой нити. Это называется комплементарным спариванием оснований . Пурины образуют водородные связи с пиримидинами, при этом аденин связывается только с тимином двумя водородными связями, а цитозин связывается только с гуанином тремя водородными связями. Такое расположение двух нуклеотидов, связывающихся вместе по всей двойной спирали (от шестиуглеродного кольца до шестиуглеродного кольца), называется парой оснований Уотсона-Крика. ДНК с высоким содержанием GC более стабильна, чем ДНК с низким содержанием GC . Пара оснований Хугстина (водород, связывающий 6-углеродное кольцо с 5-углеродным кольцом) является редкой вариацией спаривания оснований. [26] Поскольку водородные связи не являются ковалентными , их можно разорвать и соединить заново относительно легко. Таким образом, две нити ДНК в двойной спирали можно разорвать, как застежку-молнию, либо с помощью механической силы, либо с помощью высокой температуры . [27] В результате этой комплементарности пар оснований вся информация в двухцепочечной последовательности спирали ДНК дублируется на каждой нити, что жизненно важно для репликации ДНК. Это обратимое и специфическое взаимодействие между комплементарными парами оснований имеет решающее значение для всех функций ДНК в организмах. [7]
Большинство молекул ДНК на самом деле представляют собой две полимерные нити, соединенные вместе спирально нековалентными связями; эта двухцепочечная (dsDNA) структура поддерживается в основном за счет внутрицепочечных оснований, которые наиболее сильны для стопок G,C . Две нити могут разделяться — процесс, известный как плавление — с образованием двух одноцепочечных молекул ДНК (ssDNA). Плавление происходит при высоких температурах, низкой соли и высоком pH (низкий pH также плавит ДНК, но поскольку ДНК нестабильна из-за кислотной депуринации, низкий pH используется редко).
Стабильность формы dsDNA зависит не только от содержания GC (% пар оснований G,C ), но и от последовательности (поскольку укладка зависит от последовательности), а также от длины (более длинные молекулы более стабильны). Стабильность можно измерить различными способами; распространенным способом является температура плавления (также называемая значением T m ), которая является температурой, при которой 50% двухцепочечных молекул преобразуются в одноцепочечные молекулы; температура плавления зависит от ионной силы и концентрации ДНК. В результате, как процент пар оснований GC , так и общая длина двойной спирали ДНК определяют прочность связи между двумя цепями ДНК. Длинные спирали ДНК с высоким содержанием GC имеют более сильно взаимодействующие цепи, в то время как короткие спирали с высоким содержанием AT имеют более слабо взаимодействующие цепи. [28] В биологии части двойной спирали ДНК, которые должны легко разделяться, такие как TATAAT Pribnow box в некоторых промоторах , как правило, имеют высокое содержание AT , что облегчает разделение цепей. [29]
В лаборатории силу этого взаимодействия можно измерить, найдя температуру плавления T m , необходимую для разрыва половины водородных связей. Когда все пары оснований в двойной спирали ДНК плавятся, нити разделяются и существуют в растворе как две совершенно независимые молекулы. Эти одноцепочечные молекулы ДНК не имеют единой общей формы, но некоторые конформации более стабильны, чем другие. [30]

У людей общий женский диплоидный ядерный геном на клетку простирается на 6,37 пар гигабаз (Гбн), имеет длину 208,23 см и весит 6,51 пикограмм (пг). [31] Мужские значения составляют 6,27 Гбн, 205,00 см, 6,41 пг. [31] Каждый полимер ДНК может содержать сотни миллионов нуклеотидов, например, в хромосоме 1. Хромосома 1 является самой большой человеческой хромосомой с приблизительно 220 миллионами пар оснований и будетДлина 85 мм в выпрямленном виде. [32]
У эукариот , в дополнение к ядерной ДНК , есть также митохондриальная ДНК (мтДНК), которая кодирует определенные белки, используемые митохондриями. МтДНК обычно относительно мала по сравнению с ядерной ДНК. Например, человеческая митохондриальная ДНК образует замкнутые кольцевые молекулы, каждая из которых содержит 16 569 [33] [34] пар оснований ДНК, [35] причем каждая такая молекула обычно содержит полный набор митохондриальных генов. Каждая человеческая митохондрия содержит в среднем около 5 таких молекул мтДНК. [35] Каждая клетка человека содержит приблизительно 100 митохондрий, что дает общее количество молекул мтДНК на клетку человека около 500. [35] Однако количество митохондрий на клетку также варьируется в зависимости от типа клеток, и яйцеклетка может содержать 100 000 митохондрий, что соответствует до 1 500 000 копий митохондриального генома (составляющего до 90% ДНК клетки). [36]
Последовательность ДНК называется «смысловой», если она совпадает с последовательностью копии информационной РНК , которая транслируется в белок. [37] Последовательность на противоположной нити называется «антисмысловой». И смысловая, и антисмысловая последовательности могут существовать в разных частях одной и той же нити ДНК (т. е. обе нити могут содержать как смысловые, так и антисмысловые последовательности). Как у прокариот, так и у эукариот образуются антисмысловые последовательности РНК, но функции этих РНК не совсем ясны. [38] Одно из предположений заключается в том, что антисмысловые РНК участвуют в регуляции экспрессии генов посредством спаривания оснований РНК-РНК. [39]
Несколько последовательностей ДНК у прокариот и эукариот, а также больше у плазмид и вирусов , стирают различие между смысловыми и антисмысловыми цепями, имея перекрывающиеся гены . [40] В этих случаях некоторые последовательности ДНК выполняют двойную функцию, кодируя один белок при чтении вдоль одной цепи и второй белок при чтении в противоположном направлении вдоль другой цепи. У бактерий это перекрытие может быть связано с регуляцией транскрипции генов, [41] в то время как у вирусов перекрывающиеся гены увеличивают объем информации, которая может быть закодирована в небольшом вирусном геноме. [42]
ДНК может быть скручена как веревка в процессе, называемом суперспирализацией ДНК . Когда ДНК находится в «расслабленном» состоянии, нить обычно обвивает ось двойной спирали один раз на каждые 10,4 пар оснований, но если ДНК скручена, нити становятся более плотно или более рыхло намотаны. [43] Если ДНК скручена в направлении спирали, это положительная суперспирализация, и основания удерживаются более плотно вместе. Если они скручены в противоположном направлении, это отрицательная суперспирализация, и основания легче разделяются. В природе большинство ДНК имеет небольшую отрицательную суперспирализацию, которая вводится ферментами, называемыми топоизомеразами . [ 44] Эти ферменты также необходимы для снятия скручивающих напряжений, вносимых в нити ДНК во время таких процессов, как транскрипция и репликация ДНК . [45]
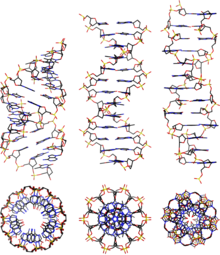
ДНК существует во многих возможных конформациях , которые включают формы A-ДНК , B-ДНК и Z-ДНК , хотя только B-ДНК и Z-ДНК были непосредственно обнаружены в функциональных организмах. [14] Конформация, которую принимает ДНК, зависит от уровня гидратации, последовательности ДНК, количества и направления суперспирализации, химических модификаций оснований, типа и концентрации ионов металлов и присутствия полиаминов в растворе. [46]
Первые опубликованные отчеты о картинах рентгеновской дифракции A-ДНК, а также B-ДНК, использовали анализы, основанные на функциях Паттерсона , которые предоставляли лишь ограниченное количество структурной информации для ориентированных волокон ДНК. [47] [48] Альтернативный анализ был предложен Уилкинсом и др. в 1953 году для картин рентгеновской дифракции-рассеивания in vivo B-ДНК высокогидратированных волокон ДНК в терминах квадратов функций Бесселя . [49] В том же журнале Джеймс Уотсон и Фрэнсис Крик представили свой молекулярный модельный анализ картин рентгеновской дифракции ДНК, чтобы предположить, что структура представляет собой двойную спираль. [9]
Хотя форма B-ДНК наиболее распространена в условиях, обнаруженных в клетках, [50] это не четко определенная конформация, а семейство родственных конформаций ДНК [51] , которые возникают при высоких уровнях гидратации, присутствующих в клетках. Их соответствующие рентгеновские дифракционные и рассеивающие картины характерны для молекулярных паракристаллов со значительной степенью беспорядка. [52] [53]
По сравнению с B-ДНК, форма A-ДНК представляет собой более широкую правостороннюю спираль с неглубокой, широкой малой бороздкой и более узкой, глубокой большой бороздкой. Форма A встречается в нефизиологических условиях в частично обезвоженных образцах ДНК, тогда как в клетке она может образовываться в гибридных парах цепей ДНК и РНК, а также в комплексах фермент-ДНК. [54] [55] Сегменты ДНК, где основания были химически модифицированы путем метилирования, могут претерпеть большее изменение конформации и принять форму Z. Здесь нити поворачиваются вокруг оси спирали в левосторонней спирали, что противоположно более распространенной форме B. [56] Эти необычные структуры могут быть распознаны специфическими связывающими белками Z-ДНК и могут участвовать в регуляции транскрипции. [57]
В течение многих лет экзобиологи предполагали существование теневой биосферы , постулируемой микробной биосферы Земли, которая использует радикально иные биохимические и молекулярные процессы, чем известная в настоящее время жизнь. Одним из предложений было существование форм жизни, которые используют мышьяк вместо фосфора в ДНК . В 2010 году был опубликован отчет о возможности существования бактерии GFAJ-1 , [58] [59] хотя исследование было оспорено, [59] [60] и данные свидетельствуют о том, что бактерия активно предотвращает включение мышьяка в остов ДНК и другие биомолекулы. [61]
На концах линейных хромосом находятся специализированные области ДНК, называемые теломерами . Основная функция этих областей — позволить клетке реплицировать концы хромосом с помощью фермента теломеразы , поскольку ферменты, которые обычно реплицируют ДНК, не могут копировать крайние 3′-концы хромосом. [63] Эти специализированные хромосомные колпачки также помогают защищать концы ДНК и не дают системам репарации ДНК в клетке рассматривать их как повреждения, подлежащие исправлению. [64] В клетках человека теломеры обычно представляют собой отрезки одноцепочечной ДНК, содержащие несколько тысяч повторов простой последовательности TTAGGG. [65]
Эти богатые гуанином последовательности могут стабилизировать концы хромосом, формируя структуры из сложенных наборов четырехосновных единиц, а не обычных пар оснований, встречающихся в других молекулах ДНК. Здесь четыре гуаниновых основания, известные как тетрада гуанина , образуют плоскую пластину. Затем эти плоские четырехосновные единицы накладываются друг на друга, образуя стабильную структуру G-квадруплекса . [66] Эти структуры стабилизируются водородными связями между краями оснований и хелатированием иона металла в центре каждой четырехосновной единицы. [67] Могут быть образованы и другие структуры, при этом центральный набор из четырех оснований исходит либо из одной нити, свернутой вокруг оснований, либо из нескольких различных параллельных нитей, каждая из которых вносит одно основание в центральную структуру.
В дополнение к этим сложенным структурам теломеры также образуют большие петлевые структуры, называемые теломерными петлями или Т-петлями. Здесь одноцепочечная ДНК скручивается в длинный круг, стабилизированный связывающими теломеру белками. [68] В самом конце Т-петли одноцепочечная теломера ДНК удерживается на участке двухцепочечной ДНК теломером, разрушающим двухспиральную ДНК и спаривание оснований с одной из двух нитей. Эта трехцепочечная структура называется петлей смещения или D-петлей . [66]
В ДНК изнашивание происходит, когда некомплементарные области существуют на конце в остальном комплементарной двойной цепи ДНК. Однако разветвленная ДНК может возникнуть, если введена третья цепь ДНК и содержит прилегающие области, способные гибридизироваться с изношенными областями уже существующей двойной цепи. Хотя простейший пример разветвленной ДНК включает только три цепи ДНК, возможны также комплексы, включающие дополнительные цепи и несколько ветвей. [69] Разветвленная ДНК может использоваться в нанотехнологиях для построения геометрических фигур, см. раздел об использовании в технологии ниже.
Несколько искусственных азотистых оснований были синтезированы и успешно включены в восьмиосновной аналог ДНК, названный Hachimoji DNA . Названные S, B, P и Z, эти искусственные основания способны связываться друг с другом предсказуемым образом (S–B и P–Z), поддерживать структуру двойной спирали ДНК и транскрибироваться в РНК. Их существование можно рассматривать как указание на то, что нет ничего особенного в четырех природных азотистых основаниях, которые эволюционировали на Земле. [70] [71] С другой стороны, ДНК тесно связана с РНК , которая не только действует как транскрипт ДНК, но и выполняет как молекулярные машины множество задач в клетках. Для этой цели она должна свернуть в структуру. Было показано, что для создания всех возможных структур требуется по крайней мере четыре основания для соответствующей РНК , [72] хотя возможно и большее количество, но это будет противоречить естественному принципу наименьших усилий .
Фосфатные группы ДНК придают ей кислотные свойства, схожие с фосфорной кислотой , и ее можно считать сильной кислотой . Она будет полностью ионизирована при нормальном клеточном pH, высвобождая протоны , которые оставляют отрицательные заряды на фосфатных группах. Эти отрицательные заряды защищают ДНК от разрушения гидролизом, отталкивая нуклеофилы , которые могли бы гидролизовать ее. [73]
.jpg/440px-Estrazione_DNA_(cropped).jpg)
Чистая ДНК, извлеченная из клеток, образует белые, тягучие комки. [74]
Экспрессия генов зависит от того, как ДНК упакована в хромосомах, в структуре, называемой хроматином . Модификации оснований могут быть вовлечены в упаковку, при этом регионы с низкой или нулевой экспрессией генов обычно содержат высокие уровни метилирования оснований цитозина . Упаковка ДНК и ее влияние на экспрессию генов могут также происходить путем ковалентных модификаций ядра гистонового белка, вокруг которого ДНК обернута в структуру хроматина, или же путем ремоделирования, осуществляемого комплексами ремоделирования хроматина (см. Ремоделирование хроматина ). Кроме того, существует перекрестное взаимодействие между метилированием ДНК и модификацией гистонов, поэтому они могут координированно влиять на хроматин и экспрессию генов. [75]
Например, метилирование цитозина производит 5-метилцитозин , который важен для X-инактивации хромосом. [76] Средний уровень метилирования варьируется между организмами — у червя Caenorhabditis elegans отсутствует метилирование цитозина, в то время как у позвоночных уровни выше, и до 1% их ДНК содержит 5-метилцитозин. [77] Несмотря на важность 5-метилцитозина, он может дезаминироваться , оставляя основание тимина, поэтому метилированные цитозины особенно подвержены мутациям . [78] Другие модификации оснований включают метилирование аденина у бактерий, наличие 5-гидроксиметилцитозина в мозге , [79] и гликозилирование урацила для получения «J-основания» в кинетопластидах . [80] [81]
ДНК может быть повреждена многими видами мутагенов , которые изменяют последовательность ДНК . Мутагены включают окислители , алкилирующие агенты , а также высокоэнергетическое электромагнитное излучение, такое как ультрафиолетовый свет и рентгеновские лучи . Тип повреждения ДНК зависит от типа мутагена. Например, ультрафиолетовый свет может повредить ДНК, производя димеры тимина , которые являются поперечными связями между пиримидиновыми основаниями. [83] С другой стороны, окислители, такие как свободные радикалы или перекись водорода, производят множественные формы повреждений, включая модификации оснований, особенно гуанозина, и двухцепочечные разрывы. [84] Типичная клетка человека содержит около 150 000 оснований, которые подверглись окислительному повреждению. [85] Из этих окислительных повреждений наиболее опасны двухцепочечные разрывы, поскольку их трудно восстановить, и они могут приводить к точечным мутациям , вставкам , делециям из последовательности ДНК и хромосомным транслокациям . [86] Эти мутации могут вызывать рак . Из-за присущих механизмам восстановления ДНК ограничений, если бы люди жили достаточно долго, у них всех в конечном итоге развился бы рак. [87] [88] Повреждения ДНК, которые происходят естественным образом из-за нормальных клеточных процессов, которые производят активные формы кислорода, гидролитической активности клеточной воды и т. д., также часто происходят. Хотя большинство этих повреждений восстанавливаются, в любой клетке некоторые повреждения ДНК могут оставаться, несмотря на действие процессов восстановления. Эти оставшиеся повреждения ДНК накапливаются с возрастом в постмитотических тканях млекопитающих. Это накопление, по-видимому, является важной основной причиной старения. [89] [90] [91]
Многие мутагены вписываются в пространство между двумя соседними парами оснований, это называется интеркаляцией . Большинство интеркаляторов являются ароматическими и плоскими молекулами; примерами являются бромистый этидий , акридины , дауномицин и доксорубицин . Чтобы интеркалятор вписался между парами оснований, основания должны разделиться, искажая цепи ДНК путем раскручивания двойной спирали. Это подавляет как транскрипцию, так и репликацию ДНК, вызывая токсичность и мутации. [92] В результате интеркаляторы ДНК могут быть канцерогенами , а в случае талидомида — тератогеном . [93] Другие, такие как бензо[ a ]пирендиолэпоксид и афлатоксин, образуют ДНК-аддукты, которые вызывают ошибки в репликации. [94] Тем не менее, из-за их способности ингибировать транскрипцию и репликацию ДНК, другие подобные токсины также используются в химиотерапии для ингибирования быстрорастущих раковых клеток. [95]

ДНК обычно встречается в виде линейных хромосом у эукариот и кольцевых хромосом у прокариот . Набор хромосом в клетке составляет ее геном ; человеческий геном имеет приблизительно 3 миллиарда пар оснований ДНК, организованных в 46 хромосом. [96] Информация, переносимая ДНК, хранится в последовательности фрагментов ДНК, называемых генами . Передача генетической информации в генах достигается посредством комплементарного спаривания оснований. Например, при транскрипции, когда клетка использует информацию в гене, последовательность ДНК копируется в комплементарную последовательность РНК посредством притяжения между ДНК и правильными нуклеотидами РНК. Обычно эта копия РНК затем используется для создания соответствующей последовательности белка в процессе, называемом трансляцией , который зависит от того же взаимодействия между нуклеотидами РНК. Альтернативным способом клетка может копировать свою генетическую информацию в процессе, называемом репликацией ДНК . Подробности этих функций рассматриваются в других статьях; здесь основное внимание уделяется взаимодействиям между ДНК и другими молекулами, которые опосредуют функцию генома.
Геномная ДНК плотно и упорядоченно упакована в процессе, называемом конденсацией ДНК , чтобы соответствовать небольшим доступным объемам клетки. У эукариот ДНК находится в ядре клетки , с небольшими количествами в митохондриях и хлоропластах . У прокариот ДНК удерживается внутри тела неправильной формы в цитоплазме, называемого нуклеоидом . [ 97] Генетическая информация в геноме удерживается внутри генов, и полный набор этой информации в организме называется его генотипом . Ген является единицей наследственности и представляет собой область ДНК, которая влияет на определенную характеристику в организме. Гены содержат открытую рамку считывания , которая может быть транскрибирована, и регуляторные последовательности , такие как промоторы и энхансеры , которые контролируют транскрипцию открытой рамки считывания.
У многих видов только небольшая часть общей последовательности генома кодирует белок. Например, только около 1,5% генома человека состоит из экзонов , кодирующих белок , а более 50% ДНК человека состоит из некодирующих повторяющихся последовательностей . [98] Причины присутствия такого большого количества некодирующей ДНК в геномах эукариот и необычайные различия в размере генома , или C-значении , среди видов представляют собой давнюю загадку, известную как « загадка C-значения ». [99] Однако некоторые последовательности ДНК, которые не кодируют белок, все еще могут кодировать функциональные некодирующие молекулы РНК, которые участвуют в регуляции экспрессии генов . [100]

Некоторые некодирующие последовательности ДНК играют структурную роль в хромосомах. Теломеры и центромеры обычно содержат немного генов, но важны для функционирования и стабильности хромосом. [64] [102] Распространенной формой некодирующей ДНК у людей являются псевдогены , которые являются копиями генов, которые были отключены мутацией. [103] Эти последовательности обычно представляют собой просто молекулярные ископаемые , хотя иногда они могут служить сырым генетическим материалом для создания новых генов посредством процесса дупликации и расхождения генов . [104]
Ген — это последовательность ДНК, которая содержит генетическую информацию и может влиять на фенотип организма. Внутри гена последовательность оснований вдоль цепи ДНК определяет последовательность информационной РНК , которая затем определяет одну или несколько последовательностей белков. Связь между последовательностями нуклеотидов генов и последовательностями аминокислот белков определяется правилами трансляции , которые в совокупности называются генетическим кодом . Генетический код состоит из трехбуквенных «слов», называемых кодонами , образованных из последовательности трех нуклеотидов (например, ACT, CAG, TTT).
В транскрипции кодоны гена копируются в РНК-носитель с помощью РНК-полимеразы . Затем эта копия РНК декодируется рибосомой , которая считывает последовательность РНК путем спаривания оснований РНК-носитель для переноса РНК , которая переносит аминокислоты. Поскольку в трехбуквенных комбинациях есть 4 основания, существует 64 возможных кодона (4 3 комбинации). Они кодируют двадцать стандартных аминокислот , что дает большинству аминокислот более одного возможного кодона. Также есть три «стоп-» или «бессмысленных» кодона, обозначающих конец кодирующей области; это кодоны TAG, TAA и TGA (UAG, UAA и UGA на мРНК).

Деление клеток необходимо для роста организма, но когда клетка делится, она должна реплицировать ДНК в своем геноме, чтобы две дочерние клетки имели ту же генетическую информацию, что и их родительская. Двухцепочечная структура ДНК обеспечивает простой механизм репликации ДНК . Здесь две цепи разделяются, а затем комплементарная последовательность ДНК каждой цепи воссоздается ферментом , называемым ДНК-полимеразой . Этот фермент создает комплементарную цепь, находя правильное основание посредством комплементарного спаривания оснований и связывая его с исходной цепью. Поскольку ДНК-полимеразы могут удлинять цепь ДНК только в направлении от 5' до 3', для копирования антипараллельных цепей двойной спирали используются различные механизмы. [105] Таким образом, основание на старой цепи диктует, какое основание появится на новой цепи, и клетка в итоге получает идеальную копию своей ДНК.
Голая внеклеточная ДНК (eDNA), большая часть которой высвобождается при гибели клеток, практически повсеместно встречается в окружающей среде. Ее концентрация в почве может достигать 2 мкг/л, а ее концентрация в естественной водной среде может достигать 88 мкг/л. [106] Для eDNA были предложены различные возможные функции: она может участвовать в горизонтальном переносе генов ; [107] она может обеспечивать питательные вещества; [108] и она может действовать как буфер для набора или титрования ионов или антибиотиков. [109] Внеклеточная ДНК действует как функциональный компонент внеклеточного матрикса в биопленках нескольких видов бактерий. Она может действовать как фактор распознавания для регулирования прикрепления и распространения определенных типов клеток в биопленке; [110] она может способствовать образованию биопленки; [111] и она может способствовать физической прочности биопленки и ее устойчивости к биологическому стрессу. [112]
Внеклеточная ДНК плода находится в крови матери и может быть секвенирована для получения большого объема информации о развивающемся плоде. [113]
Под названием «экологическая ДНК» eDNA все чаще используется в естественных науках в качестве инструмента для изучения экологии , мониторинга перемещений и присутствия видов в воде, воздухе или на суше, а также оценки биоразнообразия территории. [114] [115]
Нейтрофильные внеклеточные ловушки (НВЛ) представляют собой сети внеклеточных волокон, в основном состоящие из ДНК, которые позволяют нейтрофилам , типу белых кровяных клеток, убивать внеклеточные патогены, сводя к минимуму повреждение клеток хозяина.
Все функции ДНК зависят от взаимодействия с белками. Эти взаимодействия белков могут быть неспецифичными, или белок может связываться специфически с одной последовательностью ДНК. Ферменты также могут связываться с ДНК, и среди них полимеразы, которые копируют последовательность оснований ДНК при транскрипции и репликации ДНК, особенно важны.

Структурные белки, связывающие ДНК, являются хорошо изученными примерами неспецифических ДНК-белковых взаимодействий. Внутри хромосом ДНК удерживается в комплексах со структурными белками. Эти белки организуют ДНК в компактную структуру, называемую хроматином . У эукариот эта структура включает связывание ДНК с комплексом небольших основных белков, называемых гистонами , в то время как у прокариот задействовано несколько типов белков. [116] [117] Гистоны образуют дискообразный комплекс, называемый нуклеосомой , который содержит два полных витка двухцепочечной ДНК, обернутых вокруг его поверхности. Эти неспецифические взаимодействия формируются через основные остатки в гистонах, создавая ионные связи с кислым сахарофосфатным остовом ДНК, и, таким образом, в значительной степени независимы от последовательности оснований. [118] Химические модификации этих основных аминокислотных остатков включают метилирование , фосфорилирование и ацетилирование . [119] Эти химические изменения изменяют силу взаимодействия между ДНК и гистонами, делая ДНК более или менее доступной для факторов транскрипции и изменяя скорость транскрипции. [120] Другие неспецифические ДНК-связывающие белки в хроматине включают белки группы высокой подвижности, которые связываются с изогнутой или искаженной ДНК. [121] Эти белки важны для изгибания массивов нуклеосом и организации их в более крупные структуры, составляющие хромосомы. [122]
Отдельная группа ДНК-связывающих белков — это ДНК-связывающие белки, которые специфически связывают одноцепочечную ДНК. У людей репликационный белок A является наиболее изученным членом этого семейства и используется в процессах, где двойная спираль разделяется, включая репликацию ДНК, рекомбинацию и репарацию ДНК. [123] Эти связывающие белки, по-видимому, стабилизируют одноцепочечную ДНК и защищают ее от образования петель или деградации нуклеазами .

Напротив, другие белки эволюционировали, чтобы связываться с определенными последовательностями ДНК. Наиболее интенсивно изучаются из них различные факторы транскрипции , которые являются белками, которые регулируют транскрипцию. Каждый фактор транскрипции связывается с одним определенным набором последовательностей ДНК и активирует или ингибирует транскрипцию генов, которые имеют эти последовательности близко к своим промоторам. Факторы транскрипции делают это двумя способами. Во-первых, они могут связывать РНК-полимеразу, ответственную за транскрипцию, либо напрямую, либо через другие белки-медиаторы; это локализует полимеразу на промоторе и позволяет ей начать транскрипцию. [125] Альтернативно, факторы транскрипции могут связывать ферменты , которые модифицируют гистоны на промоторе. Это изменяет доступность ДНК-матрицы для полимеразы. [126]
Поскольку эти мишени ДНК могут встречаться по всему геному организма, изменения в активности одного типа фактора транскрипции могут влиять на тысячи генов. [127] Следовательно, эти белки часто являются мишенями процессов передачи сигнала , которые контролируют ответы на изменения окружающей среды или клеточную дифференциацию и развитие. Специфика взаимодействия этих факторов транскрипции с ДНК заключается в том, что белки устанавливают множественные контакты с краями оснований ДНК, что позволяет им «считывать» последовательность ДНК. Большинство этих взаимодействий оснований происходит в большой бороздке, где основания наиболее доступны. [25]
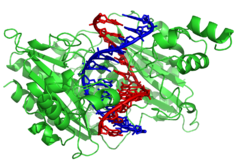
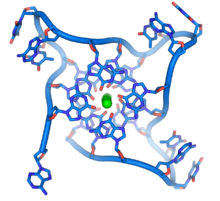
Нуклеазы — это ферменты , которые разрезают цепи ДНК, катализируя гидролиз фосфодиэфирных связей . Нуклеазы, которые гидролизуют нуклеотиды с концов цепей ДНК, называются экзонуклеазами , в то время как эндонуклеазы разрезают внутри цепей. Наиболее часто используемые нуклеазы в молекулярной биологии — это эндонуклеазы рестрикции , которые разрезают ДНК в определенных последовательностях. Например, фермент EcoRV, показанный слева, распознает последовательность из 6 оснований 5′-GATATC-3′ и делает разрез по горизонтальной линии. В природе эти ферменты защищают бактерии от фаговой инфекции, переваривая ДНК фага, когда она попадает в бактериальную клетку, действуя как часть системы модификации рестрикции . [129] В технологии эти специфичные для последовательности нуклеазы используются в молекулярном клонировании и ДНК-дактилоскопии .
Ферменты, называемые ДНК-лигазами, могут воссоединять разрезанные или разорванные нити ДНК. [130] Лигазы особенно важны в репликации отстающей нити ДНК, поскольку они соединяют короткие сегменты ДНК, произведенные в репликационной вилке , в полную копию шаблона ДНК. Они также используются в репарации ДНК и генетической рекомбинации . [130]
Топоизомеразы — это ферменты с активностью как нуклеазы, так и лигазы. Эти белки изменяют степень суперспирализации ДНК. Некоторые из этих ферментов работают, разрезая спираль ДНК и позволяя одной секции вращаться, тем самым снижая уровень ее суперспирализации; затем фермент запечатывает разрыв ДНК. [44] Другие типы этих ферментов способны разрезать одну спираль ДНК, а затем пропускать вторую цепь ДНК через этот разрыв, прежде чем снова соединить спираль. [131] Топоизомеразы необходимы для многих процессов, связанных с ДНК, таких как репликация и транскрипция ДНК. [45]
Хеликазы — это белки, которые являются типом молекулярного мотора . Они используют химическую энергию в нуклеозидтрифосфатах , преимущественно аденозинтрифосфате (АТФ), для разрыва водородных связей между основаниями и раскручивания двойной спирали ДНК на отдельные нити. [132] Эти ферменты необходимы для большинства процессов, где ферментам необходимо получить доступ к основаниям ДНК.
Полимеразы — это ферменты , которые синтезируют полинуклеотидные цепи из нуклеозидтрифосфатов . Последовательность их продуктов создается на основе существующих полинуклеотидных цепей, которые называются шаблонами . Эти ферменты функционируют путем многократного добавления нуклеотида к 3′ гидроксильной группе на конце растущей полинуклеотидной цепи. Как следствие, все полимеразы работают в направлении от 5′ к 3′. [133] В активном центре этих ферментов входящие нуклеозидтрифосфатные основания спариваются с шаблоном: это позволяет полимеразам точно синтезировать комплементарную цепь своего шаблона. Полимеразы классифицируются в соответствии с типом шаблона, который они используют.
При репликации ДНК ДНК-зависимые ДНК-полимеразы создают копии цепей полинуклеотидов ДНК. Для сохранения биологической информации важно, чтобы последовательность оснований в каждой копии была точно комплементарна последовательности оснований в цепи-шаблоне. Многие ДНК-полимеразы обладают корректирующей активностью. Здесь полимераза распознает случайные ошибки в реакции синтеза по отсутствию спаривания оснований между несовпадающими нуклеотидами. Если обнаружено несовпадение, активируется 3′-5′ экзонуклеазная активность и неправильное основание удаляется. [134] В большинстве организмов ДНК-полимеразы функционируют в большом комплексе, называемом реплисомой , который содержит несколько вспомогательных субъединиц, таких как зажим ДНК или геликазы . [135]
РНК-зависимые ДНК-полимеразы — это специализированный класс полимераз, которые копируют последовательность цепи РНК в ДНК. Они включают обратную транскриптазу , которая является вирусным ферментом, участвующим в инфицировании клеток ретровирусами , и теломеразу , которая необходима для репликации теломер. [63] [136] Например, обратная транскриптаза ВИЧ является ферментом для репликации вируса СПИДа. [136] Теломераза — необычная полимераза, поскольку она содержит собственную матрицу РНК как часть своей структуры. Она синтезирует теломеры на концах хромосом. Теломеры предотвращают слияние концов соседних хромосом и защищают концы хромосом от повреждения. [64]
Транскрипция осуществляется ДНК-зависимой РНК-полимеразой , которая копирует последовательность цепи ДНК в РНК. Чтобы начать транскрибировать ген, РНК-полимераза связывается с последовательностью ДНК, называемой промотором, и разделяет цепи ДНК. Затем она копирует последовательность гена в транскрипт информационной РНК, пока не достигнет области ДНК, называемой терминатором , где она останавливается и отсоединяется от ДНК. Как и в случае с ДНК-зависимыми ДНК-полимеразами человека, РНК-полимераза II , фермент, который транскрибирует большинство генов в геноме человека, действует как часть большого белкового комплекса с несколькими регуляторными и вспомогательными субъединицами. [137]

Спираль ДНК обычно не взаимодействует с другими сегментами ДНК, а в клетках человека различные хромосомы даже занимают отдельные области в ядре, называемые « хромосомными территориями ». [139] Это физическое разделение различных хромосом важно для способности ДНК функционировать как стабильное хранилище информации, поскольку один из немногих случаев взаимодействия хромосом — это хромосомный кроссинговер , который происходит во время полового размножения , когда происходит генетическая рекомбинация . Хромосомный кроссинговер — это когда две спирали ДНК разрываются, обмениваются участками, а затем снова соединяются.
Рекомбинация позволяет хромосомам обмениваться генетической информацией и производить новые комбинации генов, что повышает эффективность естественного отбора и может быть важно для быстрой эволюции новых белков. [140] Генетическая рекомбинация также может быть вовлечена в репарацию ДНК, особенно в реакцию клетки на двухцепочечные разрывы. [141]
Наиболее распространенной формой хромосомного кроссинговера является гомологичная рекомбинация , при которой две вовлеченные хромосомы имеют очень похожие последовательности. Негомологичная рекомбинация может быть разрушительной для клеток, поскольку она может приводить к хромосомным транслокациям и генетическим аномалиям. Реакция рекомбинации катализируется ферментами, известными как рекомбиназы , такими как RAD51 . [142] Первым шагом в рекомбинации является двухцепочечный разрыв, вызванный либо эндонуклеазой , либо повреждением ДНК. [143] Затем серия шагов, катализируемых частично рекомбиназой, приводит к соединению двух спиралей по крайней мере одним соединением Холлидея , в котором сегмент одной цепи в каждой спирали отжигается с комплементарной цепью в другой спирали. Соединение Холлидея представляет собой тетраэдрическую структуру соединения, которая может перемещаться вдоль пары хромосом, меняя одну цепь на другую. Реакция рекомбинации затем останавливается расщеплением соединения и повторным лигированием освобожденной ДНК. [144] Только нити одинаковой полярности обмениваются ДНК во время рекомбинации. Существует два типа расщепления: расщепление восток-запад и расщепление север-юг. Расщепление север-юг разрезает обе нити ДНК, в то время как расщепление восток-запад оставляет одну нить ДНК неповрежденной. Образование соединения Холлидея во время рекомбинации делает возможным генетическое разнообразие, обмен генами на хромосомах и экспрессию вирусных геномов дикого типа.
ДНК содержит генетическую информацию, которая позволяет всем формам жизни функционировать, расти и размножаться. Однако неясно, как долго в 4-миллиардной истории жизни ДНК выполняла эту функцию, поскольку было высказано предположение, что самые ранние формы жизни могли использовать РНК в качестве своего генетического материала. [145] [146] РНК могла выступать в качестве центральной части раннего клеточного метаболизма , поскольку она может как передавать генетическую информацию, так и осуществлять катализ в составе рибозимов . [147] Этот древний мир РНК , где нуклеиновая кислота использовалась как для катализа, так и для генетики, мог повлиять на эволюцию текущего генетического кода, основанного на четырех нуклеотидных основаниях. Это могло произойти, поскольку количество различных оснований в таком организме является компромиссом между небольшим количеством оснований, увеличивающим точность репликации, и большим количеством оснований, увеличивающим каталитическую эффективность рибозимов. [148] Однако прямых доказательств существования древних генетических систем нет, поскольку извлечение ДНК из большинства ископаемых невозможно, поскольку ДНК выживает в окружающей среде менее миллиона лет и медленно распадается на короткие фрагменты в растворе. [149] Были сделаны заявления о более древней ДНК, наиболее примечательным из которых является сообщение о выделении жизнеспособной бактерии из соляного кристалла возрастом 250 миллионов лет, [150] но эти заявления являются спорными. [151] [152]
Строительные блоки ДНК ( аденин , гуанин и родственные органические молекулы ) могли быть образованы внеземными путями в открытом космосе . [153] [154] [155] Сложные органические соединения ДНК и РНК , включая урацил , цитозин и тимин , также были образованы в лабораторных условиях в условиях, имитирующих условия открытого космоса , с использованием исходных химических веществ, таких как пиримидин , обнаруженный в метеоритах . Пиримидин, как и полициклические ароматические углеводороды (ПАУ), наиболее богатые углеродом химические вещества, обнаруженные во Вселенной , могли быть образованы в красных гигантах или в межзвездных космических пылевых и газовых облаках. [156]
Древняя ДНК была извлечена из древних организмов в масштабе времени, когда можно было напрямую наблюдать эволюцию генома, в том числе из вымерших организмов возрастом до миллионов лет, таких как шерстистый мамонт . [157] [158]
Были разработаны методы очистки ДНК из организмов, такие как экстракция фенолом-хлороформом , и для манипулирования ею в лабораторных условиях, такие как рестрикционные переваривания и полимеразная цепная реакция . Современная биология и биохимия интенсивно используют эти методы в технологии рекомбинантной ДНК. Рекомбинантная ДНК — это искусственная последовательность ДНК, которая была собрана из других последовательностей ДНК. Их можно трансформировать в организмы в форме плазмид или в соответствующем формате с помощью вирусного вектора . [159] Полученные генетически модифицированные организмы можно использовать для производства таких продуктов, как рекомбинантные белки , используемые в медицинских исследованиях , [160] или выращивать в сельском хозяйстве . [161] [162]
Судебные эксперты могут использовать ДНК в крови , сперме , коже , слюне или волосах , найденных на месте преступления , для идентификации соответствующей ДНК человека, например, преступника. [163] Этот процесс официально называется ДНК-профилированием , также называемым ДНК-дактилоскопией . При ДНК-профилировании длины переменных участков повторяющейся ДНК, таких как короткие тандемные повторы и минисателлиты , сравниваются между людьми. Этот метод обычно является чрезвычайно надежным методом для идентификации соответствующей ДНК. [164] Однако идентификация может быть затруднена, если место преступления загрязнено ДНК нескольких людей. [165] ДНК-профилирование было разработано в 1984 году британским генетиком сэром Алеком Джеффрисом , [166] и впервые использовано в судебной науке для осуждения Колина Питчфорка в деле об убийствах Эндерби 1988 года . [167]
Развитие судебной экспертизы и возможность теперь получать генетическое соответствие по мельчайшим образцам крови, кожи, слюны или волос привели к повторному рассмотрению многих дел. Теперь можно обнаружить доказательства, которые были научно невозможны во время первоначального исследования. В сочетании с отменой закона о двойной ответственности в некоторых местах, это может позволить возобновить дела, когда предыдущие судебные разбирательства не смогли предоставить достаточных доказательств, чтобы убедить присяжных. Людей, обвиняемых в тяжких преступлениях, могут обязать предоставить образец ДНК для целей сопоставления. Наиболее очевидной защитой от совпадений ДНК, полученных судебно-медицинским путем, является утверждение о том, что произошло перекрестное загрязнение доказательств. Это привело к скрупулезным строгим процедурам обработки новых дел о тяжких преступлениях.
ДНК-профилирование также успешно применяется для положительной идентификации жертв инцидентов с массовыми жертвами [168] , тел или частей тел в серьезных авариях, а также отдельных жертв в массовых военных захоронениях путем сопоставления с членами семьи.
ДНК-профилирование также используется в ДНК-тестировании на отцовство, чтобы определить, является ли кто-то биологическим родителем или бабушкой или дедушкой ребенка, при этом вероятность отцовства обычно составляет 99,99%, когда предполагаемый родитель биологически связан с ребенком. Обычные методы секвенирования ДНК применяются после рождения, но существуют новые методы проверки отцовства, когда мать все еще беременна. [169]
Дезоксирибозимы , также называемые ДНКзимами или каталитическими ДНК, были впервые обнаружены в 1994 году. [170] В основном это одноцепочечные последовательности ДНК, выделенные из большого пула случайных последовательностей ДНК с помощью комбинаторного подхода, называемого селекцией in vitro или систематической эволюцией лигандов путем экспоненциального обогащения (SELEX). ДНКзимы катализируют различные химические реакции, включая расщепление РНК-ДНК, лигирование РНК-ДНК, фосфорилирование-дефосфорилирование аминокислот, образование углерод-углеродной связи и т. д. ДНКзимы могут увеличивать каталитическую скорость химических реакций до 100 000 000 000 раз по сравнению с некатализируемой реакцией. [171] Наиболее широко изученным классом ДНКзимов являются типы, расщепляющие РНК, которые использовались для обнаружения различных ионов металлов и разработки терапевтических агентов. Было описано несколько ДНКзимов, специфичных для металлов, включая ДНКзим GR-5 (специфичный для свинца), [170] ДНКзимы CA1-3 (специфичные для меди), [172] ДНКзим 39E (специфичный для уранила) и ДНКзим NaA43 (специфичный для натрия). [173] ДНКзим NaA43, который, как сообщается, более чем в 10 000 раз селективен к натрию по сравнению с другими ионами металлов, использовался для создания сенсора натрия в реальном времени в клетках.
Биоинформатика включает в себя разработку методов хранения, добычи данных , поиска и манипулирования биологическими данными, включая данные о последовательностях нуклеиновых кислот ДНК . Это привело к широко применяемым достижениям в компьютерной науке , особенно алгоритмам поиска строк , машинному обучению и теории баз данных . [174] Алгоритмы поиска или сопоставления строк, которые находят вхождение последовательности букв внутри более крупной последовательности букв, были разработаны для поиска определенных последовательностей нуклеотидов. [175] Последовательность ДНК может быть выровнена с другими последовательностями ДНК для идентификации гомологичных последовательностей и обнаружения определенных мутаций , которые делают их различными. Эти методы, особенно множественное выравнивание последовательностей , используются при изучении филогенетических связей и функции белков. [176] Наборы данных, представляющие собой целые геномы последовательностей ДНК, такие как те, которые производятся в рамках проекта «Геном человека» , трудно использовать без аннотаций, которые идентифицируют расположение генов и регуляторных элементов на каждой хромосоме. Участки последовательности ДНК, имеющие характерные паттерны, связанные с генами, кодирующими белок или РНК, могут быть идентифицированы с помощью алгоритмов поиска генов , которые позволяют исследователям предсказывать наличие определенных продуктов генов и их возможные функции в организме еще до того, как они будут выделены экспериментально. [177] Также можно сравнивать целые геномы, что может пролить свет на эволюционную историю конкретного организма и позволить исследовать сложные эволюционные события.

ДНК-нанотехнология использует уникальные свойства молекулярного распознавания ДНК и других нуклеиновых кислот для создания самоорганизующихся разветвленных комплексов ДНК с полезными свойствами. [179] Таким образом, ДНК используется как структурный материал, а не как носитель биологической информации. Это привело к созданию двумерных периодических решеток (как на основе плиток, так и с использованием метода ДНК-оригами ) и трехмерных структур в форме многогранников . [ 180] Также были продемонстрированы наномеханические устройства и алгоритмическая самосборка , [181] и эти структуры ДНК использовались для шаблонизации расположения других молекул, таких как золотые наночастицы и белки стрептавидина . [182] ДНК и другие нуклеиновые кислоты являются основой аптамеров , синтетических олигонуклеотидных лигандов для специфических целевых молекул, используемых в ряде биотехнологических и биомедицинских приложений. [183]
Поскольку ДНК накапливает мутации с течением времени, которые затем наследуются, она содержит историческую информацию, и, сравнивая последовательности ДНК, генетики могут вывести эволюционную историю организмов, их филогению . [184] Эта область филогенетики является мощным инструментом в эволюционной биологии . Если сравнивать последовательности ДНК внутри вида, популяционные генетики могут узнать историю конкретных популяций. Это может быть использовано в исследованиях, начиная от экологической генетики и заканчивая антропологией .
ДНК как устройство хранения информации имеет огромный потенциал, поскольку имеет гораздо более высокую плотность хранения по сравнению с электронными устройствами. Однако высокая стоимость, медленное время чтения и записи ( задержка памяти ) и недостаточная надежность помешали ее практическому использованию. [185] [186]

ДНК впервые была выделена швейцарским врачом Фридрихом Мишером , который в 1869 году обнаружил микроскопическое вещество в гное из выброшенных хирургических повязок. Поскольку оно находилось в ядрах клеток, он назвал его «нуклеином». [187] [188] В 1878 году Альбрехт Коссель выделил небелковый компонент «нуклеина», нуклеиновую кислоту, а затем выделил ее пять первичных азотистых оснований . [189] [190]
В 1909 году Фебус Левин идентифицировал основание, сахар и фосфатную нуклеотидную единицу РНК (тогда названную «дрожжевой нуклеиновой кислотой»). [191] [192] [193] В 1929 году Левин идентифицировал дезоксирибозный сахар в «тимусной нуклеиновой кислоте» (ДНК). [194] Левин предположил, что ДНК состоит из цепочки из четырех нуклеотидных единиц, связанных вместе через фосфатные группы («тетрануклеотидная гипотеза»). Левин считал, что цепь короткая, а основания повторяются в фиксированном порядке. В 1927 году Николай Кольцов предположил, что наследуемые признаки будут наследоваться через «гигантскую наследственную молекулу», состоящую из «двух зеркальных нитей, которые будут реплицироваться полуконсервативным образом, используя каждую нить в качестве шаблона». [195] [196] В 1928 году Фредерик Гриффит в своем эксперименте обнаружил, что черты «гладкой» формы пневмококка могут быть переданы «шероховатой» форме тех же бактерий путем смешивания убитых «гладких» бактерий с живой «шероховатой» формой. [197] [198] Эта система дала первое четкое предположение о том, что ДНК несет генетическую информацию.
В 1933 году, изучая девственные яйца морского ежа , Жан Браше предположил, что ДНК находится в ядре клетки , а РНК присутствует исключительно в цитоплазме . В то время считалось, что «дрожжевая нуклеиновая кислота» (РНК) встречается только в растениях, а «тимусная нуклеиновая кислота» (ДНК) — только в животных. Последняя считалась тетрамером с функцией буферизации клеточного pH. [199] [200]
В 1937 году Уильям Эстбери получил первые рентгеновские дифракционные картины, которые показали, что ДНК имеет регулярную структуру. [201]
В 1943 году Освальд Эвери вместе с коллегами Колином Маклеодом и Маклином Маккарти определили ДНК как трансформирующий принцип , поддержав предположение Гриффита ( эксперимент Эвери–Маклеода–Маккарти ). [202] Эрвин Чаргафф разработал и опубликовал наблюдения, теперь известные как правила Чаргаффа , утверждающие, что в ДНК любого вида любого организма количество гуанина должно быть равно цитозину , а количество аденина должно быть равно тимину . [203] [204]

В конце 1951 года Фрэнсис Крик начал работать с Джеймсом Уотсоном в Кавендишской лаборатории Кембриджского университета . Роль ДНК в наследственности была подтверждена в 1952 году, когда Альфред Херши и Марта Чейз в эксперименте Херши–Чейза показали, что ДНК является генетическим материалом энтеробактериального фага T2 . [205]
В мае 1952 года Рэймонд Гослинг , аспирант, работавший под руководством Розалинды Франклин , сделал рентгеновское дифракционное изображение, обозначенное как « Фото 51 » [206] , при высоких уровнях гидратации ДНК. Это фото было передано Уотсону и Крику Морисом Уилкинсом и имело решающее значение для получения ими правильной структуры ДНК. Франклин сказал Крику и Уотсону, что остовы должны быть снаружи. До этого у Лайнуса Полинга, Уотсона и Крика были ошибочные модели с цепями внутри и основаниями, направленными наружу. Определение Франклином пространственной группы для кристаллов ДНК показало Крику, что две нити ДНК были антипараллельными [207] В феврале 1953 года Лайнус Полинг и Роберт Кори предложили модель для нуклеиновых кислот, содержащих три переплетенные цепи, с фосфатами вблизи оси и основаниями снаружи . [208] Уотсон и Крик завершили свою модель, которая теперь принята как первая правильная модель двойной спирали ДНК . 28 февраля 1953 года Крик прервал обеденное время посетителей паба The Eagle в Кембридже, Англия, чтобы объявить, что он и Уотсон «открыли секрет жизни». [209]

В выпуске журнала Nature от 25 апреля 1953 года была опубликована серия из пяти статей, в которых была представлена структура двойной спирали ДНК Уотсона и Крика и подтверждающие ее доказательства. [210] Структура была описана в письме под названием « МОЛЕКУЛЯРНАЯ СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ. Структура дезоксирибозонуклеиновой кислоты » , в котором они заявили: «От нашего внимания не ускользнуло то, что постулируемое нами специфическое спаривание немедленно предполагает возможный механизм копирования генетического материала». [9] За этим письмом последовало письмо от Франклина и Гослинга, которое стало первой публикацией их собственных данных рентгеновской дифракции и их оригинального метода анализа. [48] [211] Затем последовало письмо Уилкинса и двух его коллег, в котором содержался анализ рентгеновских картин B-ДНК in vivo , и которое подтверждало наличие in vivo структуры Уотсона и Крика. [49]
В апреле 2023 года ученые, основываясь на новых доказательствах, пришли к выводу, что Розалинда Франклин внесла свой вклад и была «равноправным игроком» в процессе открытия ДНК, а не наоборот, как это могло быть представлено впоследствии, после времени открытия. [212] [213] [214]
В 1962 году, после смерти Франклина, Уотсон, Крик и Уилкинс совместно получили Нобелевскую премию по физиологии и медицине . [215] Нобелевские премии присуждаются только живым лауреатам. Продолжаются дебаты о том, кто должен получить признание за это открытие. [216]
В влиятельной презентации в 1957 году Крик изложил центральную догму молекулярной биологии , которая предсказала связь между ДНК, РНК и белками, и сформулировал «гипотезу адаптера». [217] Окончательное подтверждение механизма репликации, который подразумевался двойной спиральной структурой, последовало в 1958 году в эксперименте Мезельсона-Шталя . [218] Дальнейшая работа Крика и его коллег показала, что генетический код основан на неперекрывающихся триплетах оснований, называемых кодонами , что позволило Хар Гобинду Коране , Роберту В. Холли и Маршаллу Уоррену Ниренбергу расшифровать генетический код. [219] Эти открытия представляют собой рождение молекулярной биологии . [220]
В 1986 году анализ ДНК впервые был использован в целях уголовного расследования, когда полиция Великобритании попросила Алека Джеффриса из Университета Лестера проверить или опровергнуть «признание» подозреваемого в изнасиловании-убийстве. В этом конкретном случае подозреваемый признался в двух изнасилованиях-убийствах, но позже отказался от своего признания. Тестирование ДНК в университетских лабораториях вскоре опровергло правдивость первоначального «признания» подозреваемого, и подозреваемый был оправдан по обвинениям в убийстве-изнасиловании. [221]
Если бы мы жили достаточно долго, рано или поздно мы все заболели бы раком.
Определенную неснижаемую фоновую заболеваемость раком следует ожидать независимо от обстоятельств: мутаций никогда нельзя полностью избежать, поскольку они являются неизбежным следствием фундаментальных ограничений точности репликации ДНК, как обсуждалось в Главе 5. Если бы человек мог жить достаточно долго, неизбежно, что по крайней мере одна из его или ее клеток в конечном итоге накопила бы набор мутаций, достаточный для развития рака.
[стр. 456]
Ich habe mich daher später mit meinen Versuchen an die ganzen Kerne gehalten, die Trennung der Körper, die ich einstweilen ohne weiteres Präjudiz als lösliches und unlösliches Nuclein bezeichnen will, einem günstigeren Material überlassend.
(Поэтому в своих экспериментах я впоследствии ограничился целым ядром, предоставив более благоприятному материалу разделение веществ, которые в настоящее время, без дальнейших предубеждений, я буду обозначать как растворимый и нерастворимый ядерный материал («нуклеин»)) )
{{cite book}}: CS1 maint: location missing publisher (link)На стр. 264, Коссель прозорливо заметил: «Der Erforschung der Quantitative Verhältnisse der vier Stickstoffreichen Basen, der Abhängigkeit ihrer Menge von den Physiologischen Zuständen der Zelle, verspricht wichtige Aufschlüsse über die elementaren psyologisch-chemischen Vorgänge». (Изучение количественных соотношений четырех азотистых оснований — [и] зависимости их количества от физиологического состояния клетки — обещает важные знания о фундаментальных физиолого-химических процессах.)
Со страницы 313: «Я думаю, что размер хромосом в слюнных железах [дрозофилы] определяется посредством умножения генонемы
.
Этим термином я обозначаю осевую нить хромосомы, в которой генетики располагают линейную комбинацию генов; … В нормальной хромосоме обычно имеется только одна генонема; перед делением клетки эта генонема разделяется на две нити».