
Белки — это крупные биомолекулы и макромолекулы , состоящие из одной или нескольких длинных цепочек аминокислотных остатков . Белки выполняют широкий спектр функций в организмах, включая катализ метаболических реакций , репликацию ДНК , реагирование на стимулы , обеспечение структуры клеток и организмов и транспортировку молекул из одного места в другое. Белки отличаются друг от друга в первую очередь последовательностью аминокислот, которая определяется последовательностью нуклеотидов их генов и которая обычно приводит к сворачиванию белка в определенную трехмерную структуру , определяющую его активность.
Линейная цепочка аминокислотных остатков называется полипептидом . Белок содержит по крайней мере один длинный полипептид. Короткие полипептиды, содержащие менее 20–30 остатков, редко считаются белками и обычно называются пептидами . Отдельные аминокислотные остатки связаны между собой пептидными связями и соседними аминокислотными остатками. Последовательность аминокислотных остатков в белке определяется последовательностью гена , которая закодирована в генетическом коде . В общем, генетический код определяет 20 стандартных аминокислот; но в некоторых организмах генетический код может включать селеноцистеин и — в некоторых археях — пирролизин . Вскоре после или даже во время синтеза остатки в белке часто химически модифицируются путем посттрансляционной модификации , которая изменяет физические и химические свойства, сворачивание, стабильность, активность и, в конечном счете, функцию белков. Некоторые белки имеют присоединенные непептидные группы, которые можно назвать простетическими группами или кофакторами . Белки также могут работать вместе для достижения определенной функции и часто объединяются, образуя стабильные белковые комплексы .
После образования белки существуют только в течение определенного периода, а затем разрушаются и перерабатываются клеточным аппаратом в процессе оборота белков . Продолжительность жизни белка измеряется с точки зрения его периода полураспада и охватывает широкий диапазон. Они могут существовать в течение минут или лет, при этом средняя продолжительность жизни составляет 1–2 дня в клетках млекопитающих. Аномальные или неправильно свернутые белки разрушаются быстрее либо из-за того, что они предназначены для разрушения, либо из-за своей нестабильности.
Как и другие биологические макромолекулы, такие как полисахариды и нуклеиновые кислоты , белки являются неотъемлемыми частями организмов и участвуют практически во всех процессах внутри клеток . Многие белки являются ферментами , которые катализируют биохимические реакции и жизненно важны для метаболизма . Белки также имеют структурные или механические функции, такие как актин и миозин в мышцах и белки в цитоскелете , которые образуют систему лесов , поддерживающую форму клетки. Другие белки важны для передачи сигналов клетками, иммунных реакций , клеточной адгезии и клеточного цикла . У животных белки необходимы в рационе для обеспечения незаменимых аминокислот, которые не могут быть синтезированы . Пищеварение расщепляет белки для метаболического использования.
Белки изучались и распознавались с 1700-х годов Антуаном Фуркрой и другими, [1] [2] которые часто собирательно называли их « альбуминами » или «белковыми материалами» ( Eiweisskörper , на немецком языке). [2] Глютен , например, был впервые выделен из пшеницы в опубликованном исследовании около 1747 года, а позже было установлено, что он существует во многих растениях. [1] В 1789 году Антуан Фуркрой выделил три различных разновидности животных белков: альбумин , фибрин и желатин . [3] Растительные белки, изученные в конце 1700-х и начале 1800-х годов, включали глютен , растительный альбумин , глиадин и легумин . [1]
Белки были впервые описаны голландским химиком Герардом Йоханнесом Мульдером и названы шведским химиком Йенсом Якобом Берцелиусом в 1838 году. [4] [5] [ нужен лучший источник ] Мульдер провел элементный анализ обычных белков и обнаружил, что почти все белки имеют одинаковую эмпирическую формулу , C 400 H 620 N 100 O 120 P 1 S 1 . [6] Он пришел к ошибочному выводу, что они могут состоять из одного типа (очень большой) молекулы. Термин «белок» для описания этих молекул был предложен коллегой Мульдера Берцелиусом; белок происходит от греческого слова πρώτειος ( proteios ), что означает «первичный», [7] «во главе» или «стоящий впереди», [2] + -in . Малдер продолжил идентифицировать продукты распада белка, такие как аминокислота лейцин, для которой он нашел (почти точную) молекулярную массу 131 Да . [6]
Ранние ученые-диетологи, такие как немец Карл фон Фойт, считали, что белок является наиболее важным питательным веществом для поддержания структуры тела, поскольку обычно считалось, что «плоть создает плоть». [8] Около 1862 года Карл Генрих Риттхаузен выделил аминокислоту глутаминовую кислоту . [9] Томас Берр Осборн составил подробный обзор растительных белков на Коннектикутской сельскохозяйственной экспериментальной станции . Затем, работая с [ необходимо разъяснение ] Лафайетом Менделем и применяя закон минимума Либиха , который гласит, что рост ограничивается самым дефицитным ресурсом, к кормлению лабораторных крыс, были установлены незаменимые с точки зрения питания аминокислоты . Работа была продолжена и передана Уильямом Каммингом Роузом .
Трудность очистки белков в больших количествах сделала их изучение очень сложным для ранних биохимиков белков. Поэтому ранние исследования были сосредоточены на белках, которые можно было очистить в больших количествах, включая белки крови, яичные белки и различные токсины, а также пищеварительные и метаболические ферменты, полученные на скотобойнях. [ необходимо разъяснение ] В 1950-х годах компания Armour Hot Dog Company очистила 1 кг чистой бычьей панкреатической рибонуклеазы А и предоставила ее ученым в свободный доступ; этот жест помог рибонуклеазе А стать основной целью биохимических исследований на последующие десятилетия. [6]

Понимание белков как полипептидов , или цепочек аминокислот, пришло благодаря работам Франца Хофмейстера и Германа Эмиля Фишера в 1902 году. [10] [11] Центральная роль белков как ферментов в живых организмах, которые катализируют реакции, не была полностью оценена до 1926 года, когда Джеймс Б. Самнер показал, что фермент уреаза на самом деле является белком. [12]
Лайнус Полинг считается автором успешного предсказания регулярных вторичных структур белков на основе водородных связей , идея впервые была выдвинута Уильямом Эстбери в 1933 году. [13] Более поздняя работа Вальтера Каузмана по денатурации , [14] [15] основанная частично на предыдущих исследованиях Кая Линдерстрёма-Ланга , [16] способствовала пониманию сворачивания и структуры белков, опосредованных гидрофобными взаимодействиями .
Первым белком, аминокислотная цепь которого была секвенирована, был инсулин , его исследовал Фредерик Сенгер в 1949 году. Сенгер правильно определил аминокислотную последовательность инсулина, тем самым окончательно показав, что белки состоят из линейных полимеров аминокислот, а не из разветвленных цепей, коллоидов или циклолов . [17] За это достижение он получил Нобелевскую премию в 1958 году . [18] Исследования Кристиана Анфинсена по окислительному процессу сворачивания рибонуклеазы А, за которые он получил Нобелевскую премию в 1972 году, укрепили термодинамическую гипотезу сворачивания белка, согласно которой свернутая форма белка представляет собой минимум его свободной энергии . [19] [20]

С развитием рентгеновской кристаллографии стало возможным определять структуры белков, а также их последовательности. [21] Первыми структурами белков, которые были решены, были гемоглобин Макса Перуца и миоглобин Джона Кендрю в 1958 году. [22] [23] Использование компьютеров и увеличение вычислительной мощности также способствовало секвенированию сложных белков. В 1999 году Роджер Корнберг преуспел в секвенировании очень сложной структуры РНК-полимеразы с использованием рентгеновских лучей высокой интенсивности от синхротронов . [21]
С тех пор была разработана криоэлектронная микроскопия (крио-ЭМ) больших макромолекулярных ансамблей [24] . Крио-ЭМ использует образцы белков, которые заморожены, а не кристаллы, и пучки электронов, а не рентгеновские лучи. Это наносит меньший ущерб образцу, позволяя ученым получать больше информации и анализировать более крупные структуры. [21] Вычислительное предсказание структуры белка небольших структурных доменов белка [25] также помогло исследователям приблизиться к разрешению структур белка на атомном уровне. По состоянию на апрель 2024 года [обновлять]Банк данных белков содержит 181 018 рентгеновских, 19 809 ЭМ и 12 697 ЯМР- структур белков. [26]
Белки в первую очередь классифицируются по последовательности и структуре, хотя обычно используются и другие классификации. В частности, для ферментов система счисления EC предоставляет функциональную схему классификации. Аналогично, онтология генов классифицирует как гены, так и белки по их биологической и биохимической функции, а также по их внутриклеточному расположению.
Сходство последовательностей используется для классификации белков как с точки зрения эволюционного, так и функционального сходства. Это может использовать как целые белки, так и домены белков , особенно в многодоменных белках . Домены белков позволяют классифицировать белки по комбинации последовательности, структуры и функции, и их можно комбинировать многими различными способами. В раннем исследовании 170 000 белков около двух третей были назначены по крайней мере один домен, причем более крупные белки содержали больше доменов (например, белки, более 600 аминокислот , имеющие в среднем более 5 доменов). [27]

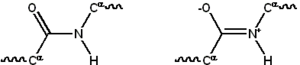
Большинство белков состоят из линейных полимеров , построенных из серий до 20 различных L -α- аминокислот. Все протеиногенные аминокислоты обладают общими структурными особенностями, включая α-углерод , с которым связаны аминогруппа , карбоксильная группа и переменная боковая цепь . Только пролин отличается от этой базовой структуры, поскольку он содержит необычное кольцо для N-концевой аминогруппы, которое заставляет амидную часть CO–NH принимать фиксированную конформацию. [28] Боковые цепи стандартных аминокислот, подробно описанные в списке стандартных аминокислот , имеют большое разнообразие химических структур и свойств; именно объединенный эффект всех боковых цепей аминокислот в белке в конечном итоге определяет его трехмерную структуру и его химическую реактивность. [29] Аминокислоты в полипептидной цепи связаны пептидными связями . После связывания в белковой цепи отдельная аминокислота называется остатком , а связанный ряд атомов углерода, азота и кислорода известен как основная цепь или остов белка. [30] : 19
Пептидная связь имеет две резонансные формы, которые вносят некоторый характер двойной связи и подавляют вращение вокруг своей оси, так что альфа-углероды примерно копланарны . Два других двугранных угла в пептидной связи определяют локальную форму, принимаемую остовом белка. [30] : 31 Конец со свободной аминогруппой известен как N-конец или аминоконец, тогда как конец белка со свободной карбоксильной группой известен как C-конец или карбоксильный конец (последовательность белка записывается от N-конца к C-концу слева направо).
Слова «белок» , «полипептид» и «пептид» немного двусмысленны и могут пересекаться по значению. «Белок» обычно используется для обозначения полной биологической молекулы в стабильной конформации , тогда как «пептид» обычно зарезервирован для коротких аминокислотных олигомеров, часто не имеющих стабильной трехмерной структуры. Но граница между ними нечетко определена и обычно проходит около 20–30 остатков. [31] «Полипептид» может относиться к любой одиночной линейной цепи аминокислот, обычно независимо от длины, но часто подразумевает отсутствие определенной конформации .
Белки могут взаимодействовать со многими типами молекул, в том числе с другими белками , с липидами , с углеводами и с ДНК . [32] [33] [30] [34]
Было подсчитано, что бактерии среднего размера содержат около 2 миллионов белков на клетку (например, E. coli и Staphylococcus aureus ). Более мелкие бактерии, такие как Mycoplasma или спирохеты, содержат меньше молекул, порядка 50 000–1 миллиона. Напротив, эукариотические клетки крупнее и, таким образом, содержат гораздо больше белка. Например, дрожжевые клетки, по оценкам, содержат около 50 миллионов белков, а человеческие клетки — порядка 1–3 миллиардов. [35] Концентрация отдельных копий белка колеблется от нескольких молекул на клетку до 20 миллионов. [36] Не все гены, кодирующие белки, экспрессируются в большинстве клеток, и их количество зависит, например, от типа клеток и внешних стимулов. Например, из примерно 20 000 белков, кодируемых человеческим геномом, только 6 000 обнаружены в лимфобластоидных клетках. [37]


Белки собираются из аминокислот с использованием информации, закодированной в генах. Каждый белок имеет свою собственную уникальную последовательность аминокислот, которая определяется последовательностью нуклеотидов гена, кодирующего этот белок. Генетический код представляет собой набор из трех нуклеотидных наборов, называемых кодонами , и каждая трехнуклеотидная комбинация обозначает аминокислоту, например, AUG ( аденин – урацил – гуанин ) является кодом для метионина . Поскольку ДНК содержит четыре нуклеотида, общее количество возможных кодонов равно 64; следовательно, в генетическом коде есть некоторая избыточность, при этом некоторые аминокислоты определяются более чем одним кодоном. [34] : 1002–42 Гены, закодированные в ДНК, сначала транскрибируются в пре- мессенджерную РНК (мРНК) белками, такими как РНК-полимераза . Большинство организмов затем обрабатывают пре-мРНК (также известную как первичный транскрипт ), используя различные формы посттранскрипционной модификации , чтобы сформировать зрелую мРНК, которая затем используется в качестве шаблона для синтеза белка рибосомой . У прокариот мРНК может либо использоваться сразу после ее производства, либо быть связанной рибосомой после перемещения от нуклеоида . Напротив, эукариоты производят мРНК в ядре клетки , а затем транслоцируют ее через ядерную мембрану в цитоплазму , где затем происходит синтез белка . Скорость синтеза белка у прокариот выше, чем у эукариот, и может достигать 20 аминокислот в секунду. [38]
Процесс синтеза белка из шаблона мРНК известен как трансляция . мРНК загружается на рибосому и считывается по три нуклеотида за раз путем сопоставления каждого кодона с его антикодоном спаривания оснований , расположенным на молекуле транспортной РНК , которая несет аминокислоту, соответствующую кодону, который она распознает. Фермент аминоацил тРНК синтетаза «заряжает» молекулы тРНК правильными аминокислотами. Растущий полипептид часто называют зарождающейся цепью . Белки всегда биосинтезируются от N-конца к C-концу . [34] : 1002–42
Размер синтезированного белка можно измерить по количеству аминокислот, которые он содержит, и по его общей молекулярной массе , которая обычно указывается в единицах дальтон (синоним атомной единицы массы ), или производной единице килодальтон (кДа). Средний размер белка увеличивается от архей к бактериям и эукариотам (283, 311, 438 остатков и 31, 34, 49 кДа соответственно) из-за большего количества доменов белка, составляющих белки в высших организмах. [39] Например, белки дрожжей в среднем имеют длину 466 аминокислот и массу 53 кДа. [31] Самые большие известные белки - это тайтины , компонент мышечного саркомера , с молекулярной массой почти 3000 кДа и общей длиной почти 27 000 аминокислот. [40]

Короткие белки также могут быть синтезированы химически с помощью семейства методов, известных как пептидный синтез , которые основаны на методах органического синтеза, таких как химическое лигирование, для получения пептидов с высоким выходом. [41] Химический синтез позволяет вводить неприродные аминокислоты в полипептидные цепи, например, прикрепляя флуоресцентные зонды к боковым цепям аминокислот. [42] Эти методы полезны в лабораторной биохимии и клеточной биологии , хотя, как правило, не для коммерческих приложений. Химический синтез неэффективен для полипептидов длиннее примерно 300 аминокислот, и синтезированные белки не могут легко принять свою нативную третичную структуру . Большинство методов химического синтеза идут от C-конца к N-концу, в противоположность биологической реакции. [43]

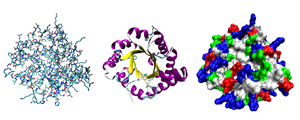
Большинство белков сворачиваются в уникальные трехмерные структуры. Форма, в которую белок естественным образом сворачивается, известна как его нативная конформация . [30] : 36 Хотя многие белки могут сворачиваться без посторонней помощи, просто благодаря химическим свойствам их аминокислот, другим требуется помощь молекулярных шаперонов , чтобы свернуться в их нативные состояния. [30] : 37 Биохимики часто ссылаются на четыре различных аспекта структуры белка: [30] : 30–34
Белки не являются полностью жесткими молекулами. В дополнение к этим уровням структуры, белки могут перемещаться между несколькими связанными структурами, выполняя свои функции. В контексте этих функциональных перестроек эти третичные или четвертичные структуры обычно называются « конформациями », а переходы между ними называются конформационными изменениями. Такие изменения часто вызываются связыванием молекулы субстрата с активным сайтом фермента или физической областью белка, которая участвует в химическом катализе. В растворе белки также претерпевают изменения в структуре посредством тепловой вибрации и столкновения с другими молекулами. [34] : 368–75

Белки можно неформально разделить на три основных класса, которые коррелируют с типичными третичными структурами: глобулярные белки , фибриллярные белки и мембранные белки . Почти все глобулярные белки растворимы , и многие из них являются ферментами. Фибриллярные белки часто являются структурными, такими как коллаген , основной компонент соединительной ткани, или кератин , белковый компонент волос и ногтей. Мембранные белки часто служат рецепторами или обеспечивают каналы для прохождения полярных или заряженных молекул через клеточную мембрану . [34] : 165–85
Особый случай внутримолекулярных водородных связей внутри белков, плохо защищенных от воздействия воды и, следовательно, способствующих их собственной дегидратации , называется дегидронами . [44]
Многие белки состоят из нескольких доменов белка , т. е. сегментов белка, которые складываются в отдельные структурные единицы. Домены обычно также имеют определенные функции, такие как ферментативная активность (например, киназа ) или они служат в качестве модулей связывания (например, домен SH3 связывается с богатыми пролином последовательностями в других белках).
Короткие аминокислотные последовательности в белках часто действуют как сайты распознавания для других белков. [45] Например, домены SH3 обычно связываются с короткими мотивами PxxP (т. е. 2 пролина [P], разделенных двумя неопределенными аминокислотами [x], хотя окружающие аминокислоты могут определять точную специфичность связывания). Многие такие мотивы были собраны в базе данных Eukaryotic Linear Motif (ELM).
Топология белка описывает запутанность остова и расположение контактов внутри свернутой цепи. [46] Для характеристики топологии белка были применены две теоретические основы: теория узлов и топология цепей . Возможность описать топологию белка открывает новые пути для белковой инженерии и фармацевтической разработки, а также расширяет наше понимание заболеваний, связанных с неправильным сворачиванием белка, таких как нервно-мышечные расстройства и рак.
Белки являются главными действующими лицами в клетке, как говорят, выполняя обязанности, указанные информацией, закодированной в генах. [31] За исключением определенных типов РНК , большинство других биологических молекул являются относительно инертными элементами, на которые воздействуют белки. Белки составляют половину сухого веса клетки Escherichia coli , тогда как другие макромолекулы, такие как ДНК и РНК, составляют всего 3% и 20% соответственно. [47] Набор белков, экспрессируемых в определенной клетке или типе клеток, известен как ее протеом .

Главной характеристикой белков, которая также позволяет им выполнять разнообразные функции, является их способность специфически и прочно связывать другие молекулы. Область белка, ответственная за связывание другой молекулы, известна как участок связывания и часто представляет собой углубление или «карман» на молекулярной поверхности. Эта способность связывания опосредована третичной структурой белка, которая определяет карман участка связывания, и химическими свойствами боковых цепей окружающих аминокислот. Связывание белка может быть необычайно прочным и специфическим; например, белок- ингибитор рибонуклеазы связывается с человеческим ангиогенином с субфемтомолярной константой диссоциации (<10−15 М ), но вообще не связывается со своим гомологом амфибий онконазой (> 1 М). Крайне незначительные химические изменения, такие как добавление одной метильной группы к связывающему партнеру, иногда могут быть достаточными для почти полного устранения связывания; например, аминоацил-тРНК-синтетаза, специфичная для аминокислоты валина, дискриминирует очень похожую боковую цепь аминокислоты изолейцина . [48]
Белки могут связываться с другими белками, а также с низкомолекулярными субстратами. Когда белки специфически связываются с другими копиями той же молекулы, они могут олигомеризоваться, образуя фибриллы; этот процесс часто происходит в структурных белках, которые состоят из глобулярных мономеров, которые самоассоциируются, образуя жесткие волокна. Взаимодействия белок-белок также регулируют ферментативную активность, контролируют прогрессирование клеточного цикла и позволяют собирать большие белковые комплексы , которые выполняют множество тесно связанных реакций с общей биологической функцией. Белки также могут связываться с клеточными мембранами или даже интегрироваться в них. Способность партнеров по связыванию вызывать конформационные изменения в белках позволяет строить чрезвычайно сложные сигнальные сети. [34] : 830–49 Поскольку взаимодействия между белками обратимы и в значительной степени зависят от доступности различных групп белков-партнеров для образования агрегатов, способных выполнять дискретные наборы функций, изучение взаимодействий между конкретными белками является ключом к пониманию важных аспектов клеточной функции и, в конечном счете, свойств, которые отличают определенные типы клеток. [49] [50]
Наиболее известная роль белков в клетке — это роль ферментов , которые катализируют химические реакции. Ферменты обычно высокоспецифичны и ускоряют только одну или несколько химических реакций. Ферменты выполняют большинство реакций, участвующих в метаболизме , а также манипулируют ДНК в таких процессах, как репликация ДНК , репарация ДНК и транскрипция . Некоторые ферменты действуют на другие белки, чтобы добавлять или удалять химические группы в процессе, известном как посттрансляционная модификация. Известно, что около 4000 реакций катализируются ферментами. [51] Ускорение скорости, придаваемое ферментативным катализом, часто огромно — до 10 17 -кратного увеличения скорости по сравнению с некатализируемой реакцией в случае оротатдекарбоксилазы (78 миллионов лет без фермента, 18 миллисекунд с ферментом). [52]
Молекулы, которые связываются и подвергаются воздействию ферментов, называются субстратами . Хотя ферменты могут состоять из сотен аминокислот, обычно только небольшая часть остатков контактирует с субстратом, а еще меньшая часть — в среднем три-четыре остатка — напрямую участвует в катализе. [53] Область фермента, которая связывает субстрат и содержит каталитические остатки, известна как активный центр .
Диригентные белки являются представителями класса белков, которые определяют стереохимию соединения, синтезируемого другими ферментами. [54]
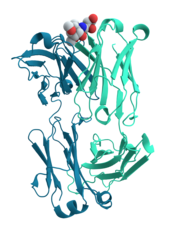
Многие белки участвуют в процессе клеточной сигнализации и передачи сигнала . Некоторые белки, такие как инсулин , являются внеклеточными белками, которые передают сигнал от клетки, в которой они были синтезированы, к другим клеткам в отдаленных тканях . Другие являются мембранными белками , которые действуют как рецепторы , основная функция которых заключается в связывании сигнальной молекулы и вызове биохимического ответа в клетке. Многие рецепторы имеют сайт связывания, выставленный на поверхности клетки, и эффекторный домен внутри клетки, который может иметь ферментативную активность или может подвергаться конформационному изменению, обнаруживаемому другими белками внутри клетки. [33] : 251–81
Антитела являются белковыми компонентами адаптивной иммунной системы , основная функция которых заключается в связывании антигенов или чужеродных веществ в организме и нацеленности на их разрушение. Антитела могут секретироваться во внеклеточную среду или закрепляться в мембранах специализированных В-клеток, известных как плазматические клетки . В то время как ферменты ограничены в своем связывающем сродстве к своим субстратам необходимостью проведения своей реакции, антитела не имеют таких ограничений. Связывающее сродство антитела к его цели необычайно велико. [34] : 275–50
Многие белки-транспортеры лигандов связывают определенные небольшие биомолекулы и транспортируют их в другие места в теле многоклеточного организма. Эти белки должны иметь высокое сродство к связыванию, когда их лиганд присутствует в высоких концентрациях, но также должны высвобождать лиганд, когда он присутствует в низких концентрациях в целевых тканях. Каноническим примером белка, связывающего лиганд, является гемоглобин , который переносит кислород из легких в другие органы и ткани у всех позвоночных и имеет близких гомологов в каждом биологическом царстве . [34] : 222–29 Лектины — это белки, связывающие сахар , которые высокоспецифичны для своих сахарных фрагментов. Лектины обычно играют роль в явлениях биологического распознавания , связанных с клетками и белками. [55] Рецепторы и гормоны — это высокоспецифичные связывающие белки.
Трансмембранные белки также могут служить лигандными транспортными белками, которые изменяют проницаемость клеточной мембраны для малых молекул и ионов. Мембрана сама по себе имеет гидрофобное ядро, через которое полярные или заряженные молекулы не могут диффундировать . Мембранные белки содержат внутренние каналы, которые позволяют таким молекулам входить и выходить из клетки. Многие белки ионных каналов специализированы для выбора только определенного иона; например, калиевые и натриевые каналы часто различают только один из двух ионов. [33] : 232–34

Структурные белки придают жесткость и ригидность в противном случае жидким биологическим компонентам. Большинство структурных белков являются фиброзными белками ; например, коллаген и эластин являются критическими компонентами соединительной ткани , такой как хрящ , а кератин содержится в твердых или нитевидных структурах, таких как волосы , ногти , перья , копыта и некоторые панцири животных . [34] : 178–81 Некоторые глобулярные белки также могут выполнять структурные функции, например, актин и тубулин являются глобулярными и растворимыми как мономеры, но полимеризуются , образуя длинные жесткие волокна, составляющие цитоскелет , который позволяет клетке сохранять свою форму и размер.
Другие белки, которые выполняют структурные функции, — это моторные белки, такие как миозин , кинезин и динеин , которые способны генерировать механические силы. Эти белки имеют решающее значение для клеточной подвижности одноклеточных организмов и спермы многих многоклеточных организмов, которые размножаются половым путем . Они также генерируют силы, оказываемые сокращающимися мышцами [34] : 258–64, 272 и играют существенную роль во внутриклеточном транспорте.
Ключевым вопросом в молекулярной биологии является то, как эволюционируют белки, т. е. как мутации (или, скорее, изменения в аминокислотной последовательности) могут привести к новым структурам и функциям? Большинство аминокислот в белке могут быть изменены без нарушения активности или функции, как это можно увидеть на примере многочисленных гомологичных белков у разных видов (собранных в специализированных базах данных для семейств белков , например, PFAM ). [56] Чтобы предотвратить драматические последствия мутаций, ген может быть продублирован до того, как он сможет свободно мутировать. Однако это также может привести к полной потере функции гена и, таким образом, к псевдогенам . [57] Чаще всего изменения одной аминокислоты имеют ограниченные последствия, хотя некоторые из них могут существенно изменить функцию белка, особенно в ферментах . Например, многие ферменты могут изменить свою субстратную специфичность одной или несколькими мутациями. [58] Изменения в субстратной специфичности облегчаются субстратной неоднородностью , т. е. способностью многих ферментов связывать и обрабатывать несколько субстратов . Когда происходят мутации, специфичность фермента может увеличиваться (или уменьшаться) и, таким образом, его ферментативная активность. [58] Таким образом, бактерии (или другие организмы) могут адаптироваться к различным источникам пищи, включая неестественные субстраты, такие как пластик. [59]
Методы, обычно используемые для изучения структуры и функции белков, включают иммуногистохимию , направленный мутагенез , рентгеновскую кристаллографию , ядерный магнитный резонанс и масс-спектрометрию .
Активность и структуры белков могут быть исследованы in vitro , in vivo и in silico . Исследования in vitro очищенных белков в контролируемых средах полезны для изучения того, как белок выполняет свою функцию: например, исследования кинетики ферментов изучают химический механизм каталитической активности фермента и его относительное сродство к различным возможным молекулам субстрата. Напротив, эксперименты in vivo могут предоставить информацию о физиологической роли белка в контексте клетки или даже целого организма . Исследования in silico используют вычислительные методы для изучения белков.
Белки можно очищать от других клеточных компонентов с помощью различных методов, таких как ультрацентрифугирование , осаждение , электрофорез и хроматография ; появление генной инженерии сделало возможным появление ряда методов, облегчающих очистку.
Для проведения анализа in vitro белок должен быть очищен от других клеточных компонентов. Этот процесс обычно начинается с лизиса клеток , при котором мембрана клетки разрушается, а ее внутреннее содержимое высвобождается в раствор, известный как сырой лизат . Полученную смесь можно очистить с помощью ультрацентрифугирования , которое фракционирует различные клеточные компоненты на фракции, содержащие растворимые белки; мембранные липиды и белки; клеточные органеллы и нуклеиновые кислоты . Осаждение методом, известным как высаливание, может концентрировать белки из этого лизата. Затем используются различные типы хроматографии для выделения интересующего белка или белков на основе таких свойств, как молекулярная масса, чистый заряд и сродство связывания. [30] : 21–24 Уровень очистки можно контролировать с помощью различных типов гель-электрофореза, если известны молекулярная масса и изоэлектрическая точка желаемого белка , с помощью спектроскопии , если белок имеет различимые спектроскопические характеристики, или с помощью ферментных анализов, если белок обладает ферментативной активностью. Кроме того, белки можно изолировать в соответствии с их зарядом с помощью электрофокусировки . [60]
Для природных белков может потребоваться ряд этапов очистки, чтобы получить белок, достаточно чистый для лабораторных применений. Чтобы упростить этот процесс, часто используется генная инженерия для добавления химических свойств к белкам, которые облегчают их очистку, не влияя на их структуру или активность. Здесь «тег», состоящий из определенной аминокислотной последовательности, часто серии остатков гистидина (« His-тег »), присоединяется к одному концу белка. В результате, когда лизат пропускают через хроматографическую колонку, содержащую никель , остатки гистидина лигируют никель и присоединяются к колонке, в то время как немаркированные компоненты лизата проходят беспрепятственно. Было разработано несколько различных тегов, чтобы помочь исследователям очищать определенные белки из сложных смесей. [61]

Изучение белков in vivo часто связано с синтезом и локализацией белка внутри клетки. Хотя многие внутриклеточные белки синтезируются в цитоплазме , а мембраносвязанные или секретируемые белки — в эндоплазматическом ретикулуме , специфика того, как белки направляются в определенные органеллы или клеточные структуры, часто неясна. Полезный метод оценки клеточной локализации использует генную инженерию для экспрессии в клетке слитого белка или химеры, состоящей из интересующего природного белка, связанного с « репортером », таким как зеленый флуоресцентный белок (GFP). [62] Затем положение слитого белка внутри клетки можно четко и эффективно визуализировать с помощью микроскопии , [63], как показано на рисунке напротив.
Другие методы выяснения клеточного расположения белков требуют использования известных маркеров компартментов для таких областей, как ЭР, Гольджи, лизосомы или вакуоли, митохондрии, хлоропласты, плазматическая мембрана и т. д. С использованием флуоресцентно меченых версий этих маркеров или антител к известным маркерам становится намного проще определить локализацию интересующего белка. Например, непрямая иммунофлуоресценция позволит провести колокализацию флуоресценции и продемонстрировать местоположение. Флуоресцентные красители используются для маркировки клеточных компартментов с аналогичной целью. [64]
Существуют и другие возможности. Например, иммуногистохимия обычно использует антитело к одному или нескольким интересующим белкам, которые конъюгированы с ферментами, дающими либо люминесцентные, либо хромогенные сигналы, которые можно сравнивать между образцами, что позволяет получить информацию о локализации. Другой применимый метод — это кофракционирование в градиентах сахарозы (или другого материала) с использованием изопикнического центрифугирования . [65] Хотя этот метод не доказывает колокализации компартмента известной плотности и интересующего белка, он увеличивает вероятность и более пригоден для крупномасштабных исследований.
Наконец, золотым стандартом клеточной локализации является иммуноэлектронная микроскопия . Эта техника также использует антитело к интересующему белку, наряду с классическими методами электронной микроскопии. Образец подготавливается для обычного электронного микроскопического исследования, а затем обрабатывается антителом к интересующему белку, которое конъюгировано с чрезвычайно электроплотным материалом, обычно золотом. Это позволяет локализовать как ультраструктурные детали, так и интересующий белок. [66]
С помощью другого применения генной инженерии, известного как направленный мутагенез , исследователи могут изменять последовательность белка и, следовательно, его структуру, клеточную локализацию и восприимчивость к регуляции. Эта техника даже позволяет включать неестественные аминокислоты в белки, используя модифицированные тРНК, [67] и может позволить рациональный дизайн новых белков с новыми свойствами. [68]
Полный набор белков, присутствующих в клетке или типе клеток в определенный момент времени, называется ее протеомом , а изучение таких крупномасштабных наборов данных определяет область протеомики , названную по аналогии с родственной областью геномики . Ключевые экспериментальные методы в протеомике включают двумерный электрофорез , [69] который позволяет разделять многие белки, масс-спектрометрию , [70] которая позволяет быстро и высокопроизводительно идентифицировать белки и секвенировать пептиды (чаще всего после расщепления в геле ), белковые микрочипы , которые позволяют определять относительные уровни различных белков, присутствующих в клетке, и двухгибридный скрининг , который позволяет систематически исследовать белок-белковые взаимодействия . [71] Полный набор биологически возможных таких взаимодействий известен как интерактом . [72] Систематическая попытка определить структуры белков, представляющих каждую возможную складку, известна как структурная геномика . [73]
Обнаружение третичной структуры белка или четвертичной структуры его комплексов может дать важные подсказки о том, как белок выполняет свою функцию и как на него можно повлиять, например, при разработке лекарств . Поскольку белки слишком малы, чтобы их можно было увидеть под световым микроскопом , для определения их структуры приходится использовать другие методы. Обычные экспериментальные методы включают рентгеновскую кристаллографию и ЯМР-спектроскопию , оба из которых могут производить структурную информацию с атомным разрешением. Однако эксперименты с ЯМР способны предоставить информацию, из которой можно оценить подмножество расстояний между парами атомов, а окончательные возможные конформации для белка определяются путем решения задачи геометрии расстояний . Двойная поляризационная интерферометрия является количественным аналитическим методом измерения общей конформации белка и конформационных изменений, вызванных взаимодействиями или другими стимулами. Круговой дихроизм является еще одним лабораторным методом определения внутреннего β-слоя / α-спирального состава белков. Криоэлектронная микроскопия используется для получения структурной информации с более низким разрешением об очень больших белковых комплексах, включая собранные вирусы ; [33] : 340–41 вариант, известный как электронная кристаллография, может также давать информацию с высоким разрешением в некоторых случаях, особенно для двумерных кристаллов мембранных белков. [74] Решенные структуры обычно размещаются в Банке данных о белках (PDB), свободно доступном ресурсе, из которого структурные данные о тысячах белков могут быть получены в форме декартовых координат для каждого атома в белке. [75]
Известно гораздо больше последовательностей генов, чем структур белков. Кроме того, набор решенных структур смещен в сторону белков, которые могут быть легко подвергнуты условиям, требуемым в рентгеновской кристаллографии , одном из основных методов определения структуры. В частности, глобулярные белки сравнительно легко кристаллизуются при подготовке к рентгеновской кристаллографии. Мембранные белки и большие белковые комплексы, напротив, трудно кристаллизуются и недостаточно представлены в PDB. [76] Инициативы структурной геномики пытались исправить эти недостатки путем систематического решения репрезентативных структур основных классов складок. Методы прогнозирования структуры белка пытаются предоставить средства для создания правдоподобной структуры для белков, структуры которых не были экспериментально определены. [77]

В дополнение к области структурной геномики, предсказание структуры белка разрабатывает эффективные математические модели белков для вычислительного предсказания молекулярных образований в теории, вместо обнаружения структур с помощью лабораторных наблюдений. [78] Наиболее успешный тип предсказания структуры, известный как моделирование гомологии , опирается на существование «шаблонной» структуры с последовательностью, схожей с моделируемым белком; цель структурной геномики состоит в том, чтобы обеспечить достаточное представление в решенных структурах для моделирования большинства из тех, которые остаются. [79] Хотя создание точных моделей остается проблемой, когда доступны только отдаленно связанные шаблонные структуры, было высказано предположение, что выравнивание последовательностей является узким местом в этом процессе, поскольку довольно точные модели могут быть получены, если известно «идеальное» выравнивание последовательностей. [80] Многие методы предсказания структуры послужили источником информации для новой области белковой инженерии , в которой уже были разработаны новые белковые складки. [81] Кроме того, белки (у эукариот ~33%) содержат большие неструктурированные, но биологически функциональные сегменты и могут быть классифицированы как внутренне неупорядоченные белки . [82] Таким образом, прогнозирование и анализ нарушений белков является важной частью характеристики структуры белков. [83]
Разработано огромное количество вычислительных методов для анализа структуры, функции и эволюции белков. Разработка таких инструментов была обусловлена большим количеством геномных и протеомных данных, доступных для различных организмов, включая геном человека . Просто невозможно изучить все белки экспериментально, поэтому только некоторые из них подвергаются лабораторным экспериментам, в то время как вычислительные инструменты используются для экстраполяции на похожие белки. Такие гомологичные белки могут быть эффективно идентифицированы в отдаленно родственных организмах путем выравнивания последовательностей . Геномные и генные последовательности могут быть найдены различными инструментами для определенных свойств. Инструменты профилирования последовательностей могут находить сайты ферментов рестрикции , открывать рамки считывания в нуклеотидных последовательностях и предсказывать вторичные структуры . Филогенетические деревья могут быть построены и эволюционные гипотезы разработаны с использованием специального программного обеспечения, такого как ClustalW, относительно происхождения современных организмов и генов, которые они экспрессируют. Область биоинформатики в настоящее время незаменима для анализа генов и белков.
Более сложной вычислительной проблемой является прогнозирование межмолекулярных взаимодействий, таких как стыковка молекул , [84] сворачивание белков , взаимодействие белок-белок и химическая реактивность. Математические модели для моделирования этих динамических процессов включают молекулярную механику , в частности, молекулярную динамику . В этой связи, моделирование in silico обнаружило сворачивание небольших α-спиральных доменов белка, таких как головка виллина , [85] вспомогательный белок ВИЧ [ 86], а гибридные методы, объединяющие стандартную молекулярную динамику с квантово-механической математикой, исследовали электронные состояния родопсинов . [87]
Помимо классической молекулярной динамики, методы квантовой динамики позволяют моделировать белки в атомистических деталях с точным описанием квантово-механических эффектов. Примерами служат метод многослойной многоконфигурационной зависимости Хартри от времени (MCTDH) и подход иерархических уравнений движения (HEOM), которые были применены к растительным криптохромам [88] и бактериальным комплексам сбора света [89] соответственно. Как квантовое, так и классическое механическое моделирование систем биологического масштаба чрезвычайно требовательны к вычислительным ресурсам, поэтому распределенные вычислительные инициативы (например, проект Folding@home [90] ) облегчают молекулярное моделирование , используя достижения в параллельной обработке на GPU и методах Монте-Карло .
Общее содержание азота в органическом веществе в основном формируется аминогруппами в белках. Общий азот по Кьельдалю ( TKN ) — это мера азота, широко используемая при анализе (сточных) вод, почвы, продуктов питания, кормов и органических веществ в целом. Как следует из названия, применяется метод Кьельдаля . Существуют более чувствительные методы. [91] [92]
Большинство микроорганизмов и растений могут биосинтезировать все 20 стандартных аминокислот , в то время как животные (включая людей) должны получать некоторые аминокислоты из рациона . [47] Аминокислоты, которые организм не может синтезировать самостоятельно, называются незаменимыми аминокислотами . Ключевые ферменты, которые синтезируют определенные аминокислоты, отсутствуют у животных, например, аспартокиназа , которая катализирует первый этап синтеза лизина , метионина и треонина из аспартата . Если аминокислоты присутствуют в окружающей среде, микроорганизмы могут сохранять энергию, забирая аминокислоты из своего окружения и подавляя свои биосинтетические пути.
У животных аминокислоты поступают в организм с пищей, содержащей белок. Затем потребленные белки расщепляются на аминокислоты в процессе пищеварения , которое обычно включает денатурацию белка под воздействием кислоты и гидролиз ферментами, называемыми протеазами . Некоторые потребленные аминокислоты используются для биосинтеза белка, в то время как другие преобразуются в глюкозу посредством глюконеогенеза или поступают в цикл лимонной кислоты . Такое использование белка в качестве топлива особенно важно в условиях голодания , поскольку оно позволяет использовать собственные белки организма для поддержания жизни, особенно те, которые находятся в мышцах . [93]
У животных, таких как собаки и кошки , белок поддерживает здоровье и качество кожи, способствуя росту волосяных фолликулов и кератинизации, и, таким образом, снижая вероятность проблем с кожей, вызывающих неприятный запах. [94] Некачественные белки также играют роль в здоровье желудочно-кишечного тракта, увеличивая вероятность метеоризма и образования пахучих соединений у собак, поскольку, когда белки достигают толстой кишки в непереваренном состоянии, они ферментируются, образуя сероводород, индол и скатол. [95] Собаки и кошки переваривают животные белки лучше, чем растительные, но продукты животного происхождения низкого качества перевариваются плохо, включая кожу, перья и соединительную ткань. [95]
Механические свойства белков весьма разнообразны и часто являются центральными для их биологической функции, как в случае таких белков, как кератин и коллаген . [96] Например, способность мышечной ткани постоянно расширяться и сокращаться напрямую связана с эластичными свойствами их основного белкового состава. [97] [98] Помимо фибриллярных белков, конформационная динамика ферментов [99] и структура биологических мембран , среди других биологических функций, регулируются механическими свойствами белков. За пределами их биологического контекста уникальные механические свойства многих белков, наряду с их относительной устойчивостью по сравнению с синтетическими полимерами , сделали их желанными целями для разработки материалов следующего поколения. [100] [101]
Модуль Юнга , E, рассчитывается как осевое напряжение σ по результирующей деформации ε. Это мера относительной жесткости материала. В контексте белков эта жесткость часто напрямую коррелирует с биологической функцией. Например, коллаген , обнаруженный в соединительной ткани , костях и хрящах , и кератин , обнаруженный в ногтях, когтях и волосах, имеют наблюдаемую жесткость, которая на несколько порядков выше, чем у эластина , [102] который, как полагают, придает эластичность таким структурам, как кровеносные сосуды , легочная ткань и ткань мочевого пузыря , среди прочих. [103] [104] По сравнению с этим, глобулярные белки , такие как бычий сывороточный альбумин , которые относительно свободно плавают в цитозоле и часто функционируют как ферменты (и, таким образом, подвергаются частым конформационным изменениям), имеют сравнительно гораздо более низкие модули Юнга. [105] [106]
Модуль Юнга одного белка можно найти с помощью моделирования молекулярной динамики . Используя либо атомистические силовые поля, такие как CHARMM или GROMOS , либо крупнозернистые силовые поля, такие как Martini, [107] одна молекула белка может быть растянута одноосной силой, в то время как полученное расширение регистрируется для расчета деформации. [108] [109] Экспериментально для получения аналогичных данных можно использовать такие методы, как атомная силовая микроскопия . [110]
На макроскопическом уровне модуль Юнга сшитых белковых сетей может быть получен посредством более традиционного механического тестирования . Экспериментально наблюдаемые значения для нескольких белков можно увидеть ниже.
Помимо того, что глобулярные белки служат ферментами внутри клетки, они часто действуют как ключевые транспортные молекулы. Например, сывороточные альбумины , ключевой компонент крови , необходимы для транспортировки множества малых молекул по всему телу. [114] Из-за этого зависимое от концентрации поведение этих белков в растворе напрямую связано с функцией кровеносной системы . Одним из способов количественной оценки этого поведения является вязкость раствора.
Вязкость, η, как правило, является мерой сопротивления жидкости деформации. Ее можно рассчитать как отношение между приложенным напряжением и скоростью изменения результирующей деформации сдвига, то есть скоростью деформации. Вязкость сложных жидких смесей, таких как кровь, часто сильно зависит от температуры и концентрации растворенного вещества. [115] Для сывороточного альбумина, в частности бычьего сывороточного альбумина , можно использовать следующее соотношение между вязкостью, температурой и концентрацией . [116]
Где c — концентрация, T — температура, R — газовая постоянная , а α, β, B , D и Δ E — константы свойств, основанные на материалах. Это уравнение имеет форму уравнения Аррениуса , определяющего экспоненциальную зависимость вязкости от температуры и концентрации.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )