Рак яичников – раковая опухоль яичника . [10] Он может исходить из самого яичника или, чаще, из сообщающихся близлежащих структур, таких как маточные трубы или внутренняя оболочка живота . [3] [11] Яичник состоит из трех различных типов клеток, включая эпителиальные клетки, половые клетки и стромальные клетки. [12] Когда эти клетки становятся аномальными, они приобретают способность делиться и образовывать опухоли. Эти клетки также могут проникать или распространяться на другие части тела. [13] Когда этот процесс начинается, симптомы могут отсутствовать или быть лишь неопределенными. [1] Симптомы становятся более заметными по мере прогрессирования рака. [1] [14] Эти симптомы могут включать, среди прочего, вздутие живота , вагинальное кровотечение , боль в области таза , вздутие живота, запор и потерю аппетита . [1] Обычные области, в которые рак может распространиться, включают слизистую оболочку живота , лимфатические узлы , легкие и печень . [15]
Риск рака яичников увеличивается с возрастом. Большинство случаев рака яичников развивается после менопаузы. [16] Это также чаще встречается у женщин, у которых в течение жизни наблюдалось больше овуляции . [17] Сюда входят те, у кого никогда не было детей , те, у кого овуляция началась в более молодом возрасте, и те, кто достигает менопаузы в более старшем возрасте. [5] Другие факторы риска включают гормональную терапию после менопаузы , лекарства от бесплодия и ожирение . [4] [6] Факторы, снижающие риск, включают гормональный контроль над рождаемостью , перевязку маточных труб , беременность и кормление грудью . [6] Около 10% случаев связаны с наследственным генетическим риском; женщины с мутациями в генах BRCA1 или BRCA2 имеют вероятность развития заболевания примерно 50%. [5] Некоторые семейные раковые синдромы, такие как наследственный неполипозный рак толстой кишки и синдром Пейтца-Егерса, также повышают риск развития рака яичников. [16] Эпителиальная карцинома яичников является наиболее распространенным типом рака яичников, составляющим более 95% случаев. [5] Существует пять основных подтипов рака яичников, из которых наиболее распространенным является серозный рак высокой степени злокачественности (HGSC). [5] Менее распространенные типы рака яичников включают опухоли зародышевых клеток [18] и стромальные опухоли полового канатика . [5] Диагноз рака яичников подтверждается биопсией ткани , обычно удаляемой во время операции. [1]
Скрининг не рекомендуется женщинам, которые входят в группу среднего риска, поскольку данные не подтверждают снижение смертности, а высокий уровень ложноположительных результатов тестов может привести к ненужному хирургическому вмешательству, которое сопровождается собственными рисками. [19] Тем, кто находится в группе очень высокого риска, в качестве профилактической меры могут удалить яичники. [4] При обнаружении и лечении на ранней стадии рак яичников часто излечим. [1] Лечение обычно включает в себя комбинацию хирургического вмешательства, лучевой терапии и химиотерапии . [1] Результаты зависят от степени заболевания, подтипа рака и других заболеваний. [5] [20] Общая пятилетняя выживаемость в США составляет 49%. [7] Результаты хуже в развивающихся странах. [5]
В 2020 году новые случаи произошли примерно у 313 000 женщин. [21] В 2019 году в США от этого заболевания погибло 13 445 человек. [22] Смертность от рака яичников увеличилась во всем мире в период с 1990 по 2017 год на 84,2%. [23] Рак яичников является вторым по распространенности гинекологическим раком в Соединенных Штатах. Он вызывает больше смертей, чем любой другой рак женской репродуктивной системы. [24] Среди женщин он занимает пятое место по смертности от рака. [25] Типичный возраст постановки диагноза — 63 года. [2] Смерть от рака яичников чаще встречается в Северной Америке и Европе, чем в Африке и Азии. [5] В Соединенных Штатах это чаще встречается у белых и латиноамериканских женщин, чем у чернокожих или американских индейцев. [22]
Ранние признаки и симптомы рака яичников могут отсутствовать или быть едва заметными. В большинстве случаев симптомы существуют в течение нескольких месяцев, прежде чем их распознают и диагностируют . [26] [27] Симптомы часто ошибочно принимают за синдром раздраженного кишечника . [28] Ранние стадии рака яичников, как правило, безболезненны, что затрудняет его раннее обнаружение. Симптомы могут варьироваться в зависимости от подтипа. [26] Пограничные опухоли яичников , также известные как опухоли яичников с низким злокачественным потенциалом (LMP), не вызывают повышения уровней CA125 и не поддаются идентификации с помощью ультразвука. Типичные симптомы опухоли LMP могут включать вздутие живота или боль в области таза. Особенно большие массы имеют тенденцию быть доброкачественными или пограничными. [29] [26]
Наиболее типичные симптомы рака яичников включают вздутие живота, боль или дискомфорт в животе или тазу, боль в спине, нерегулярные менструации или вагинальные кровотечения в постменопаузе, боль или кровотечение после или во время полового акта , потерю аппетита , утомляемость , диарею , расстройство желудка , изжогу , запор . тошнота , чувство переполнения и, возможно, симптомы мочеиспускания (включая частое и ургентное мочеиспускание ). [27]

Более поздние симптомы рака яичников обусловлены растущей массой, вызывающей боль при надавливании на другие органы брюшной полости или метастазы. [26] [30] [31] Из-за анатомического расположения яичников глубоко в тазу, большинство образований на момент постановки диагноза являются большими и развитыми. [32] Растущая масса может вызывать боль, если развивается перекрут яичника . Если эти симптомы начинают возникать чаще или тяжелее, чем обычно, особенно после отсутствия в анамнезе таких симптомов, можно предположить рак яичников. [26] [29] Метастазы могут стать причиной образования узла сестры Марии Джозеф . [31] В редких случаях тератомы могут вызывать синдром растущей тератомы или перитонеальный глиоматоз. [31] В большинстве случаев после менопаузы у некоторых наблюдаются менометроррагия и аномальные вагинальные кровотечения . Другие распространенные симптомы включают гирсутизм , боль в животе, вирилизацию и образование придатков . [33]
У подростков или детей с опухолями яичников симптомы могут включать сильную боль в животе, раздражение брюшины или кровотечение . [34] Стромальные опухоли полового канатика вырабатывают гормоны, которые могут привести к преждевременному развитию вторичных половых признаков. Стромальные опухоли полового канатика у детей препубертатного возраста могут проявляться признаками раннего полового созревания ; Также часто наблюдаются боль и вздутие живота . У подростков с опухолями стромы полового канатика может наблюдаться аменорея . По мере того, как рак становится более запущенным, он может вызвать скопление жидкости в брюшной полости и привести к вздутию живота. Если злокачественное новообразование не было диагностировано к моменту возникновения асцита, оно обычно диагностируется вскоре после этого. [26] Поздние стадии рака также могут вызывать образования в брюшной полости, лимфатических узлах или плевральный выпот . [31]
Существует множество известных факторов риска, которые могут увеличить риск развития рака яичников у женщины. Риск развития рака яичников зависит от количества времени, в течение которого женщина проводит овуляцию. [35] Факторы, которые увеличивают количество овуляторных циклов у женщины, могут увеличить риск развития рака яичников. [35] Во время овуляции клетки стимулируются к делению. Если это деление регулируется неправильно, могут образовываться опухоли, которые могут быть злокачественными. Раннее менархе и поздняя менопауза увеличивают количество овуляторных циклов, которые женщина испытывает в течение жизни, и, таким образом, увеличивает риск развития рака яичников. [29] [35] [36] Поскольку овуляция подавляется во время беременности, отсутствие детей также увеличивает риск рака яичников. [36] Таким образом, женщины, которые не рожали детей, подвергаются в два раза большему риску рака яичников, чем те, у кого есть дети. [26] И ожирение, и заместительная гормональная терапия также повышают риск. [26]
Риск развития рака яичников меньше у женщин, у которых меньше менструальных циклов, нет менструальных циклов, кормят грудью , принимают оральные контрацептивы, имеют многоплодную беременность и беременность в раннем возрасте. Риск развития рака яичников снижается у женщин, перенесших перевязку маточных труб (в просторечии это называется «перевязывание труб»), удаление обоих яичников или гистерэктомию (операцию, при которой удаляется матка). [27] Возраст также является фактором риска. [26] [20] Негенетические факторы, такие как сахарный диабет, высокий индекс массы тела, табакокурение и употребление алкоголя, также являются факторами риска развития рака яичников. [23]
Использование лекарств от бесплодия может способствовать образованию пограничной опухоли яичников , но связь между этими двумя явлениями оспаривается и ее трудно изучить. [28] Препараты для лечения бесплодия могут быть связаны с более высоким риском возникновения пограничных опухолей. [31] Те, кто лечился от бесплодия, но остаются нерожавшими, подвергаются более высокому риску эпителиального рака яичников из-за гормонального воздействия, которое может привести к пролиферации клеток. Однако те, кто успешно лечится от бесплодия и впоследствии рожает, не подвергаются более высокому риску. Это может быть связано с выделением предраковых клеток во время беременности, но причина остается неясной. [29] Вместо этого фактором риска может быть само бесплодие, а не лечение. [35]
Гормональные состояния, такие как синдром поликистозных яичников и эндометриоз , связаны с раком яичников, но связь полностью не подтверждена. [28] Заместительная гормональная терапия (ЗГТ) в постменопаузе с эстрогеном, вероятно, увеличивает риск рака яичников. Эта связь не была подтверждена в крупномасштабном исследовании [29] [37] , но известные исследования, включая исследование миллиона женщин, подтвердили эту связь. ЗГТ в постменопаузе с комбинированным эстрогеном и прогестероном может увеличить одновременный риск при использовании в течение более 5 лет, но этот риск возвращается к норме после прекращения терапии. [35] Эстрогенная ЗГТ с прогестинами или без них увеличивает риск эндометриоидных и серозных опухолей, но снижает риск муцинозных опухолей. Более высокие дозы эстрогена увеличивают этот риск. [31] Эндометриоз является еще одним фактором риска рака яичников [35] , как и боль при менструации. Эндометриоз связан со светлоклеточными и эндометриоидными подтипами, серозными опухолями низкой степени злокачественности, опухолями I и II стадий, опухолями 1 степени и более низкой смертностью. [31]
До менопаузы ожирение может увеличить риск развития рака яичников, но после менопаузы этот риск отсутствует. Этот риск также актуален для тех, кто страдает ожирением и никогда не использовал ЗГТ. Аналогичная связь с раком яичников наблюдается у более высоких женщин. [35]

Семейный анамнез рака яичников является фактором риска развития рака яичников. Женщины с наследственным неполипозным раком толстой кишки (синдром Линча) и женщины с генетическими аномалиями BRCA-1 и BRCA-2 подвергаются повышенному риску.
Основным генетическим фактором риска рака яичников является мутация в генах BRCA1 или BRCA2 или в генах репарации несоответствия ДНК , которая присутствует в 10% случаев рака яичников. Чтобы подвергнуть человека высокому риску, достаточно мутировать только один аллель . Ген может наследоваться как по материнской, так и по отцовской линии, но имеет различную пенетрантность . [26] [29] Хотя мутации в этих генах обычно связаны с повышенным риском рака молочной железы, они также несут существенный риск развития рака яичников на протяжении всей жизни, риск, который достигает пика в возрасте 40 и 50 лет. Самый низкий риск составляет 30%, а самый высокий — 60%. [28] [26] [29] Мутации в BRCA1 имеют пожизненный риск развития рака яичников 15–45%. [31] Мутации в BRCA2 менее опасны, чем мутации в BRCA1 : пожизненный риск составляет от 10% (указан самый низкий риск) до 40% (указан самый высокий риск). [26] [31] В среднем рак, связанный с BRCA, развивается на 15 лет раньше, чем его спорадические аналоги, поскольку людям, унаследовавшим мутации в одной копии своего гена, нужна только одна мутация, чтобы начать процесс канцерогенеза, тогда как людям с двумя нормальными генами необходимо приобрести две мутации. [29]
В Соединенных Штатах пять из 100 женщин, у которых родственники первой степени родства больны раком яичников, в конечном итоге сами заболеют раком яичников, в результате чего женщины, у которых есть пораженные члены семьи, подвергаются тройному риску по сравнению с женщинами, у которых не поражены раком яичников. Семь из 100 женщин, у которых двое или более родственников страдают раком яичников, в конечном итоге заболеют раком яичников. [29] [38] В целом, 5–10% случаев рака яичников имеют генетическую причину. [29] Мутации BRCA связаны с серозным немуцинозным эпителиальным раком яичников высокой степени злокачественности. [31]

Наличие в семейном анамнезе рака эндометрия , рака толстой кишки или других видов рака желудочно-кишечного тракта может указывать на наличие синдрома, известного как наследственный неполипозный колоректальный рак (также известный как синдром Линча), который повышает риск развития ряда видов рака, включая рак яичников. рак. Синдром Линча вызван мутациями в генах репарации несоответствия, включая MSH2 , MLH1 , MLH6, PMS1 и PMS2 . [26] Риск рака яичников у человека с синдромом Линча составляет от 10 до 12 процентов. [26] [29] Женщины исландского происхождения , европейского еврейского происхождения / еврейского происхождения ашкенази и венгерского происхождения подвергаются более высокому риску развития эпителиального рака яичников. [29] Ген бета-рецептора эстрогена ( ESR2 ), по-видимому, является ключом к патогенезу и реакции на терапию. [39] Другими генами, которые связаны с раком яичников, являются BRIP1 , MSH6 , RAD51C и RAD51D . [40] CDH1 , CHEK2 , PALB2 и RAD50 также связаны с раком яичников. [41]
Несколько редких генетических нарушений связаны с конкретными подтипами рака яичников. Синдром Пейтца-Егерса , редкое генетическое заболевание, также предрасполагает женщин к опухоли полового канатика с кольцевидными канальцами . [28] [26] Болезнь Оллиера и синдром Маффуччи связаны с гранулезоклеточными опухолями у детей, а также могут быть связаны с опухолями Сертоли-Лейдига. Доброкачественные фибромы связаны с синдромом невоидной базальноклеточной карциномы . [26]
Употребление алкоголя, по-видимому, не связано с раком яичников. [31] [42]
Американское онкологическое общество рекомендует здоровое питание, включающее большое количество фруктов, овощей, цельнозерновых продуктов , а также диету, избегающую или ограничивающую красное и обработанное мясо и обработанный сахар. [43] Высокое потребление общих, насыщенных и трансжиров увеличивает риск рака яичников. [44] Общий обзор 2021 года показал, что потребление кофе, яиц и жиров значительно увеличивает риск рака яичников. [45] Существуют неоднозначные данные исследований о риске рака яичников и потреблении молочных продуктов . [46] [47]
Промышленно развитые страны, за исключением Японии, имеют высокий уровень заболеваемости эпителиальным раком яичников, что может быть связано с питанием в этих странах. Белые женщины подвергаются на 30–40% более высокому риску развития рака яичников по сравнению с чернокожими и латиноамериканками, вероятно, из-за социально-экономических факторов; белые женщины, как правило, рожают меньше детей и имеют разную частоту гинекологических операций, которые влияют на риск рака яичников. [29]
Предварительные данные свидетельствуют о том, что тальк , пестициды и гербициды повышают риск рака яичников. [48] Американское онкологическое общество отмечает, что на данный момент ни одно исследование не смогло точно связать какое-либо отдельное химическое вещество в окружающей среде или в рационе человека непосредственно с мутациями, вызывающими рак яичников. [49]
Другие факторы, которые были исследованы, такие как курение , низкий уровень витамина D в крови, [50] наличие включенных кист яичников и инфекция вирусом папилломы человека (причина некоторых случаев рака шейки матки ), были опровергнуты как Факторы риска рака яичников. [28] [31] Канцерогенность промежностного талька является спорной, поскольку он может действовать как раздражитель, если проходит через репродуктивные пути к яичникам. [31] [29] [35] Исследования «случай-контроль» показали, что использование промежностного талька действительно увеличивает риск рака яичников, но более частое использование талька не создает большего риска. [31] Использование талька на других участках тела не связано с раком яичников. [35] Регулярное сидение в течение длительного времени связано с более высокой смертностью от эпителиального рака яичников. Риск не устраняется регулярными физическими упражнениями, хотя и снижается. [51]
Пожилой возраст (до 70 лет) является фактором риска развития эпителиального рака яичников, поскольку в клетках может накапливаться больше мутаций и в конечном итоге вызывать рак. Люди старше 80 лет подвергаются несколько меньшему риску. [29]
Курение табака связано с более высоким риском развития муцинозного рака яичников ; после прекращения курения риск в конечном итоге возвращается к норме. Более высокие уровни С-реактивного белка связаны с более высоким риском развития рака яичников. [31]
Подавление овуляции, которое в противном случае могло бы привести к повреждению эпителия яичников и, как следствие, к воспалению , обычно является защитным. Такого эффекта можно достичь, рожая детей , принимая комбинированные оральные контрацептивы и кормя грудью , которые являются защитными факторами. [26] Более длительный период грудного вскармливания коррелирует с большим снижением риска рака яичников. [35] Каждое рождение ребенка снижает риск рака яичников еще больше, и этот эффект наблюдается при пяти родах. Комбинированные пероральные контрацептивы снижают риск рака яичников до 50%, а защитный эффект комбинированных пероральных контрацептивов может сохраняться в течение 25–30 лет после их отмены. [29] [35] Регулярное употребление аспирина или ацетаминофена (парацетамола) может быть связано с более низким риском рака яичников; другие НПВП, похоже, не оказывают подобного защитного эффекта. [31]
Перевязка маточных труб является защитным средством, поскольку канцерогены не могут достичь яичников и бахромок через влагалище, матку и фаллопиевы трубы. [26] Перевязка маточных труб также защитна у женщин с мутацией BRCA1, но не у женщин с мутацией BRCA2. [31] Гистерэктомия снижает риск, а удаление фаллопиевых труб и яичников (двусторонняя сальпингоофорэктомия ) резко снижает риск не только рака яичников, но и рака молочной железы. [28] Это все еще тема исследований, поскольку связь между гистерэктомией и снижением риска рака яичников противоречива. Причины, по которым гистерэктомия может быть защитной, по состоянию на 2015 год не выяснены. [35]
Диета, включающая большое количество каротина , клетчатки и витаминов с низким содержанием жиров, в частности диета с некрахмалистыми овощами (например, брокколи и луком ), может оказаться защитной. [29] Пищевая клетчатка связана со значительным снижением риска рака яичников. [52] Обзор 2021 года показал, что потребление зеленолистных овощей, лука, клетчатки, флавоноидов и зеленого чая может значительно снизить риск рака яичников. [53]
Рак яичников формируется, когда происходят нарушения нормального роста клеток яичников . Обычно, когда клетки стареют или повреждаются, они умирают , и их место занимают новые клетки. Рак начинается, когда новые клетки образуются ненужными, а старые или поврежденные клетки не умирают должным образом. Накопление дополнительных клеток часто образует массу ткани, называемую опухолью или наростом яичника . Эти аномальные раковые клетки имеют множество генетических аномалий , которые заставляют их чрезмерно расти. [55] Когда яичник выпускает яйцеклетку , яйцеклеточный фолликул разрывается и становится желтым телом . Эту структуру необходимо восстановить путем деления клеток яичника. [35] Непрерывная овуляция в течение длительного времени означает большее восстановление яичника путем деления клеток, которые могут приобретать мутации в каждом делении. [29]
В целом, наиболее распространенные генные мутации при раке яичников происходят в NF1 , BRCA1, BRCA2 и CDK12 . Рак яичников I типа, который имеет тенденцию быть менее агрессивным, имеет тенденцию иметь микросателлитную нестабильность в нескольких генах, включая как онкогены (особенно BRAF и KRAS ), так и опухолевые супрессоры (особенно PTEN ). [28] Наиболее распространенными мутациями при раке I типа являются KRAS, BRAF, ERBB2, PTEN, PIK3CA и ARID1A. [31] Рак типа II, более агрессивный тип, имеет мутации в разных генах, включая p53 , BRCA1 и BRCA2 . [28] Рак низкой степени злокачественности, как правило, имеет мутации в KRAS, тогда как рак любой степени злокачественности, развивающийся из опухолей с низким потенциалом злокачественности, как правило, имеет мутации в р53. [29] Рак типа I имеет тенденцию развиваться из предшествующих поражений, тогда как рак типа II может развиваться из серозной трубной интраэпителиальной карциномы. [31] Серозный рак с мутациями BRCA также неизбежно имеет мутации p53, что указывает на то, что удаление обоих функциональных генов важно для развития рака. [29]
В 50% случаев серозного рака высокой степени злокачественности репарация гомологичной рекомбинационной ДНК является дисфункциональной, как и сигнальные пути notch и FOXM1 . У них также почти всегда есть мутации р53. Помимо этого, мутации при серозной карциноме высокой степени тяжести трудно охарактеризовать, за исключением высокой степени геномной нестабильности . BRCA1 и BRCA2 необходимы для репарации гомологичной рекомбинации ДНК, а мутации зародышевой линии в этих генах обнаруживаются примерно у 15% женщин с раком яичников. [28] Наиболее распространенными мутациями в BRCA1 и BRCA2 являются мутации сдвига рамки считывания , которые возникли у небольшой основной популяции евреев-ашкенази. [29]
Почти 100% редких муцинозных карцином имеют мутации KRAS и амплификации ERBB2 (также известного как Her2/neu ). [28] В целом, 20% случаев рака яичников имеют мутации Her2/neu . [26]
Серозные карциномы могут развиваться из серозной трубной интраэпителиальной карциномы, а не развиваться спонтанно из ткани яичника. Другие карциномы развиваются из кортикальных кист включения, которые представляют собой группы эпителиальных клеток яичника внутри стромы . [29]


Диагностика рака яичников начинается с физического осмотра (включая осмотр органов малого таза ), анализа крови (на CA-125 и иногда другие маркеры) и трансвагинального УЗИ . [26] [56] Иногда ректовагинальное исследование используется для планирования операции. [29] Диагноз должен быть подтвержден хирургическим путем осмотра брюшной полости , взятия биопсии (образцов тканей для микроскопического анализа ) и поиска раковых клеток в брюшной жидкости. Это помогает определить, является ли образование яичника доброкачественным или злокачественным. [26]
Ранние стадии рака яичников (I/II) трудно диагностировать, поскольку большинство симптомов неспецифичны и поэтому малопригодны для диагностики; в результате его редко диагностируют, пока он не распространится и не перейдет на более поздние стадии (III/IV). [57] Кроме того, симптомы рака яичников могут быть похожи на синдром раздраженного кишечника . У женщин, у которых возможна беременность, уровень БХГЧ можно измерить в процессе диагностики. Сывороточный альфа-фетопротеин , нейрон-специфическую енолазу и лактатдегидрогеназу можно измерить у молодых девушек и подростков с подозрением на опухоли яичников , поскольку у более молодых женщин с раком яичников чаще возникают злокачественные опухоли зародышевых клеток. [26] [31]
Физикальное обследование, включая осмотр органов малого таза, и УЗИ органов малого таза (трансвагинальное или иное) необходимы для постановки диагноза: физикальное обследование может выявить увеличение обхвата живота и/или асцит (жидкость в брюшной полости), тогда как при гинекологическом осмотре может быть выявлено поражение яичников. или брюшная масса. [28] Образование придатков является важным признаком, который часто указывает на рак яичников, особенно если оно фиксированное, узловое, неравномерное, солидное и/или двустороннее. 13–21% новообразований придатков вызваны злокачественными новообразованиями; однако существуют и другие доброкачественные причины образования придатков, в том числе фолликулярная киста яичника , лейомиома , эндометриоз , внематочная беременность , гидросальпинкс , тубоовариальный абсцесс, перекрут яичника , дермоидная киста , цистаденома (серозная или муцинозная), дивертикулярный или аппендикулярный абсцесс, опухоль нервной оболочки , тазовая почка , дивертикул мочеточника или мочевого пузыря , доброкачественная кистозная мезотелиома брюшины, туберкулез брюшины или параовариальная киста . Яичники, которые можно прощупать, также являются признаком рака яичников у женщин в постменопаузе. Другие части медицинского обследования при подозрении на рак яичников могут включать осмотр молочных желез и пальцевое ректальное исследование . При пальпации надключичных , подмышечных и паховых лимфатических узлов может быть выявлена лимфаденопатия , которая может указывать на метастазирование. Другим показателем может быть наличие плеврального выпота , который можно отметить при аускультации . [31]
Когда злокачественное новообразование яичников включено в список диагностических возможностей, показано ограниченное количество лабораторных исследований. Обычно проводят полный анализ крови и анализ электролитов сыворотки; [58] при наличии рака яичников эти тесты часто показывают высокое количество тромбоцитов (20–25% пациентов) и низкий уровень натрия в крови из-за химических сигналов, секретируемых опухолью. [29] Положительный тест на ингибин А и ингибин В может указывать на гранулезоклеточную опухоль. [31]
Анализ крови на маркерную молекулу СА-125 полезен при дифференциальной диагностике и наблюдении за заболеванием, но сам по себе он не является эффективным методом скрининга ранней стадии рака яичников из-за неприемлемо низкого уровня ее содержания. чувствительность и специфичность. [58] Уровни CA-125 у женщин в пременопаузе более 200 Ед/мл могут указывать на рак яичников, как и любое повышение CA-125 выше 35 Ед/мл у женщин в постменопаузе. Уровни CA-125 не являются точными при раке яичников на ранней стадии, поскольку половина пациентов с раком яичников I стадии имеют нормальный уровень CA-125. [31] [29] CA-125 также может повышаться при доброкачественных (нераковых) состояниях, включая эндометриоз , беременность , миому матки , менструацию , кисты яичников , системную красную волчанку , заболевания печени , воспалительные заболевания кишечника , воспалительные заболевания органов малого таза , и лейомиома . [31] [59] HE4 является еще одним кандидатом на исследование рака яичников, хотя он не подвергался тщательным испытаниям. Другие опухолевые маркеры рака яичников включают CA19-9 , CA72-4, CA15-3 , иммуносупрессивный кислый белок, гаптоглобин-альфа, OVX1, мезотелин , лизофосфатидную кислоту , остеопонтин и фактор роста фибробластов 23 . [31]
Использование панелей анализа крови может помочь в диагностике. [31] [58] Панель OVA1 включает CA-125, бета-2 микроглобулин , трансферрин , аполипопротеин А1 и транстиретин . OVA1 выше 5,0 у женщин в пременопаузе и 4,4 у женщин в постменопаузе указывает на высокий риск развития рака. [29] Для выявления стромальных опухолей полового канатика используется другой набор лабораторных исследований. Высокие уровни тестостерона или дегидроэпиандростеронсульфата в сочетании с другими симптомами и высокими уровнями ингибина А и ингибина В могут указывать на ПКСТ любого типа. [33]
Текущие исследования изучают способы рассмотрения протеомики опухолевых маркеров в сочетании с другими индикаторами заболевания (т.е. радиологическими данными и/или симптомами) для повышения точности диагностики. Проблема такого подхода заключается в том, что несопоставимая распространенность рака яичников означает, что даже тестирование с очень высокой чувствительностью и специфичностью все равно приведет к ряду ложноположительных результатов, что, в свою очередь, может привести к таким проблемам, как выполнение хирургических процедур, при которых рак интраоперационно не обнаруживается. [ нужна цитация ] Подходы геномики еще не разработаны для лечения рака яичников. [31]
КТ предпочтительнее для оценки размера опухоли в брюшно-тазовой полости, хотя также можно использовать магнитно-резонансную томографию . [28] КТ также может быть полезна для обнаружения сальника или дифференциации жидкости от солидной опухоли в брюшной полости, особенно при опухолях с низким потенциалом злокачественности. Однако он может не обнаружить опухоли меньшего размера. Иногда рентген грудной клетки применяют для обнаружения метастазов в грудной клетке или плеврального выпота . Еще одним тестом на метастатическое заболевание, хотя он используется нечасто, является бариевая клизма , которая может показать, вовлечен ли в заболевание ректосигмовидный отдел толстой кишки. Позитронно-эмиссионная томография , сканирование костей и парацентез имеют ограниченное применение; на самом деле, парацентез может привести к образованию метастазов в месте введения иглы и не может дать полезных результатов. [29] Однако парацентез можно использовать в тех случаях, когда новообразований в области таза нет и асцит все еще присутствует. [29] Врач, подозревающий рак яичников, может также выполнить маммографию или биопсию эндометрия (в случае аномального кровотечения), чтобы оценить возможность злокачественных новообразований молочной железы и злокачественного новообразования эндометрия соответственно. Вагинальное УЗИ часто является методом визуализации первой линии, выполняемым при обнаружении образования придатков. Некоторые характеристики образования придатков указывают на злокачественность яичника; они обычно сплошные, неправильной формы, многокамерные и/или крупные; и они обычно имеют папиллярные особенности, центральные сосуды и/или неравномерные внутренние перегородки. [31] Однако SCST не имеет четких характеристик при рентгенографическом исследовании. [33]
Чтобы окончательно диагностировать рак яичников, требуется хирургическая процедура для осмотра брюшной полости. Это может быть открытая процедура ( лапаротомия , разрез брюшной стенки ) или операция через замочную скважину ( лапароскопия ). Во время этой процедуры подозрительная ткань удаляется и отправляется на микроскопический анализ . Обычно сюда входит односторонняя сальпингоофорэктомия , удаление единственного пораженного яичника и маточной трубы. Жидкость из брюшной полости также можно проанализировать на наличие раковых клеток . Если обнаружен рак, эту процедуру также можно использовать для определения степени его распространения (что является формой определения стадии опухоли ). [26]
Пафолацианин показан для использования у взрослых с раком яичников , чтобы помочь выявить раковые поражения во время операции. [60] Это диагностическое средство, которое вводят в виде внутривенной инъекции перед операцией. [60]
Широко признанным методом оценки риска злокачественного рака яичников является индекс риска злокачественности (RMI), рассчитываемый на основе первоначального обследования . [28] [61] Оценка RMI более 200 или 250 обычно считается показателем высокого риска рака яичников. [28] [31]
RMI рассчитывается как:
Для определения оценки УЗИ и оценки менопаузы можно использовать два метода, при этом полученные оценки обозначаются как RMI 1 и RMI 2 соответственно, в зависимости от того, какой метод используется.
Другим методом количественной оценки риска рака яичников является алгоритм риска рака яичников (ROCA), который наблюдает за уровнями с течением времени и определяет, достаточно ли быстро они увеличиваются, чтобы оправдать трансвагинальное УЗИ. [29] Алгоритм риска злокачественного новообразования яичников использует уровни CA-125 и уровни HE4 для расчета риска рака яичников; он может быть более эффективным, чем RMI. Модели IOTA можно использовать для оценки вероятности того, что опухоль придатков является злокачественной. [63] Они включают модель риска LR2, расчет риска по простым правилам (SRrisk) и модель оценки различных неоплазий в придатках (ADNEX), которую можно использовать для оценки риска злокачественного новообразования в придаточном образовании на основе его характеристик и факторов риска. . Алгоритм QCancer (Яичник) используется для прогнозирования вероятности рака яичников на основе факторов риска. [31]

Рак яичников классифицируется в зависимости от микроскопического вида их структур ( гистология или гистопатология ). Гистология определяет многие аспекты клинического лечения, ведения и прогноза . Общая патология рака яичников очень схожа независимо от гистологического типа: опухоли яичников имеют солидные и кистозные массы. [29] По данным SEER , типы рака яичников у женщин в возрасте 20 лет и старше: [64]
Рак яичников гистологически и генетически подразделяется на тип I или тип II. Рак типа I имеет низкую гистологическую степень и включает эндометриоидный, муцинозный и светлоклеточный рак. Рак типа II имеет более высокую гистологическую степень и включает серозную карциному и карциносаркому. [28]

Эпителиальный рак яичников обычно развивается на поздней стадии и возникает в результате злокачественной трансформации эпителия поверхности яичника, брюшины или фаллопиевой трубы. [65] Это наиболее распространенная причина смерти от гинекологического рака. [65] Существуют различные типы эпителиального рака яичников, включая серозную опухоль, эндометриоидную опухоль, светлоклеточную опухоль, муцинозную опухоль, а также недифференцированные или неклассифицированные опухоли. [66] Ежегодно во всем мире диагноз ставится 230 000 женщинам и 150 000 умирают. [67] Пятилетняя выживаемость после постановки диагноза составляет 46% из-за поздней стадии заболевания на момент постановки диагноза. [67] Обычно около 75% пациентов диагностируют позднюю стадию заболевания из-за бессимптомного характера его проявления. [67] Существует геномная предрасположенность к эпителиальному раку яичников, и было обнаружено, что гены BRCA1 и BRCA2 являются причинными генами в 65-75% случаев наследственного эпителиального рака яичников. [67]
.jpg/440px-Serous_carcinoma_(3061775966).jpg)
Серозный рак яичников является наиболее распространенным типом эпителиального рака яичников и составляет около двух третей случаев эпителиального рака яичников. [28] Серозная карцинома низкой степени злокачественности менее агрессивна, чем серозная карцинома высокой степени злокачественности, хотя обычно она плохо поддается химиотерапии или гормональному лечению. [28] Считается, что серозная карцинома начинается в фаллопиевой трубе . [68] [69] Серозная карцинома высокой степени злокачественности составляет 75% всех случаев эпителиального рака яичников. [67] Около 15–20% серозных карцином высокой степени злокачественности имеют мутации BRCA1 и BRCA2 зародышевой линии. [67] Гистологически характер роста серозной карциномы высокой степени злокачественности неоднороден и имеет некоторые папиллярные или солидные модели роста. [67] Опухолевые клетки атипичны, с большими ядрами неправильной формы. [67] Он имеет высокую скорость распространения. [67] В 50% случаев серозные карциномы являются двусторонними, а в 85% случаев на момент постановки диагноза они распространяются за пределы яичника. [70]
Серозная трубная интраэпителиальная карцинома (СТИК) в настоящее время признана предшественником большинства так называемых серозных карцином яичников высокой степени злокачественности. [70] STIC характеризуется

Мелкоклеточная карцинома яичников встречается редко и агрессивно и имеет два основных подтипа: гиперкальциемический и легочный. [71] Это редкое злокачественное новообразование чаще всего поражает молодых женщин в возрасте до 40 лет в диапазоне от 14 месяцев до 58 лет. [71] Средний возраст постановки диагноза 24 года. [71] Примерно у двух третей пациентов развивается паранеопластическая гиперкальциемия, что означает высокий уровень кальция в крови по неизвестной причине. [71] [72] Опухоль секретирует белок, родственный паратироидному гормону, который действует аналогично ПТГ и связывает рецепторы ПТГ в костях и почках, вызывая гиперкальциемию. [71] Недавние исследования обнаружили инактивирующую зародышевую и соматическую мутацию гена SMARCA4 . [71] [73] Гиперкальциемический подтип очень агрессивен и имеет общую выживаемость 16% с частотой рецидивов 65% у пациентов, получающих лечение. [71] Пациенты, у которых заболевание распространилось на другие части тела, как правило, умирают через 2 года после постановки диагноза. [71] Экстраовариальное распространение наблюдается в 50% случаев, а распространение в лимфатические узлы - в 55% случаев. [72] Наиболее частым начальным проявлением является быстро растущее одностороннее образование в области таза средним размером 15 см. [71] Гистологически он характеризуется множеством листов мелких, круглых, плотно упакованных клеток с скоплениями, гнездами и тяжами. [71] [72] Иммуногистохимия обычно положительна на виментин, цитокератин, CD10, p53 и WT-1. [71] [73]
Мелкоклеточная карцинома яичников легочного подтипа проявляется иначе, чем гиперкальциемический подтип. [71] Как правило, легочный мелкоклеточный рак яичников обычно поражает оба яичника у пожилых женщин и выглядит как овсяноклеточная карцинома легкого . [29] Средний возраст начала заболевания составляет 59 лет, и примерно 45% случаев легочного подтипа являются двусторонними. [71] Кроме того, при легочном подтипе может повышаться уровень некоторых гормонов, включая серотонин, соматостатин, инсулин, гастрин и кальцитонин. [71]
Первичные карциномы брюшины развиваются из брюшины — оболочки, покрывающей брюшную полость и имеющей то же эмбриональное происхождение, что и яичник. Их часто обсуждают и классифицируют как рак яичников, когда они поражают яичник. [68] [74] Они могут развиваться даже после удаления яичников и могут выглядеть похожими на мезотелиому . [29]

Светлоклеточный рак яичника — редкий подтип эпителиального рака яичников. Лица, у которых диагностирована светлоклеточная карцинома яичника, обычно моложе в возрасте постановки диагноза и диагностируются на более ранних стадиях, чем другие подтипы эпителиального рака яичников. [75] [76] Самая высокая заболеваемость светлоклеточным раком яичника наблюдалась среди молодых азиатских женщин, особенно корейского, тайваньского и японского происхождения. [75] [76] Эндометриоз считается основным фактором риска развития светлоклеточного рака яичника, и было обнаружено, что он присутствует у 50% женщин с диагнозом светлоклеточный рак яичника. [75] Сообщается, что образование тромбов в ногах, таких как тромбоэмболия глубоких вен, или в легких при тромбоэмболии легочной артерии, на 40% выше у пациентов со светлоклеточным раком, чем у других подтипов эпителиального рака яичников. [76] Было обнаружено, что мутации в молекулярных путях, таких как ARID1A, PIK3 и PIK3CA, связаны со светлоклеточной карциномой. [75] [76] Обычно они представляют собой большие односторонние образования со средним размером от 13 до 15 см. [75] 90% случаев являются односторонними. [75] Светлоклеточный рак яичника обычно плохо реагирует на химиотерапию из-за внутренней химиорезистентности, поэтому лечение обычно проводится с помощью агрессивной циторедуктивной хирургии и химиотерапии на основе платины. [28] [75]

Светлоклеточные аденокарциномы гистопатологически сходны с другими светлоклеточными карциномами , со светлыми клетками и клетками «гвоздей» . Они составляют примерно 5–10% случаев эпителиального рака яичников и связаны с эндометриозом в полости таза. Обычно они развиваются на ранней стадии и поэтому излечиваются хирургическим путем, но прогрессирующие светлоклеточные аденокарциномы (приблизительно 20%) имеют плохой прогноз и часто устойчивы к химиотерапии платиной. [29]
Эндометриоидные аденокарциномы составляют примерно 13-15% всех случаев рака яичников. [77] Поскольку они, как правило, имеют низкую степень злокачественности, эндометриоидные аденокарциномы имеют хороший прогноз. [77] Средний возраст постановки диагноза составляет около 53 лет. [77] Эти опухоли часто сочетаются с эндометриозом или раком эндометрия. [29] [77] Уровни ракового антигена 125 обычно повышены, и семейный анамнез родственников первой степени родства с эндометриоидным раком яичников связан с повышенным риском развития эндометриоидного рака яичников. [77] Средний размер опухоли превышает 10 см. [77]
Смешанные мюллеровы опухоли составляют менее 1% случаев рака яичников. У них видны эпителиальные и мезенхимальные клетки, и прогноз, как правило, плохой. [29]
Муцинозные опухоли включают муцинозную аденокарциному и муцинозную цистаденокарциному. [29]
Муцинозные аденокарциномы составляют 5–10% случаев эпителиального рака яичников. Гистологически они похожи на аденокарциномы кишечника или шейки матки и часто на самом деле являются метастазами рака аппендикса или толстой кишки . Распространенные муцинозные аденокарциномы имеют плохой прогноз, обычно хуже, чем серозные опухоли, и часто устойчивы к химиотерапии препаратами платины, хотя и встречаются редко. [29]

Псевдомиксома брюшины представляет собой скопление инкапсулированного слизистой или студенистого материала в брюшно-тазовой полости, которое очень редко вызвано первичной муцинозной опухолью яичника. Чаще всего это связано с метастазами рака кишечника в яичники. [29]
Недифференцированные раки – те, при которых тип клеток не может быть определен – составляют около 10% эпителиального рака яичников и имеют сравнительно плохой прогноз. [29] [68] При исследовании под микроскопом эти опухоли имеют очень аномальные клетки, которые расположены в виде скоплений или листов. Обычно внутри опухоли имеются узнаваемые скопления серозных клеток. [29]

Злокачественные опухоли Бреннера встречаются редко. Гистологически они имеют плотную фиброзную строму с участками переходного эпителия и некоторой плоскоклеточной дифференцировкой. Чтобы быть классифицированным как злокачественная опухоль Бреннера, она должна иметь очаги опухоли Бреннера и переходно-клеточную карциному. Компонент переходно-клеточной карциномы обычно плохо дифференцирован и напоминает рак мочевыводящих путей. [29]
Переходно-клеточная карцинома составляет менее 5% случаев рака яичников. Гистологически они похожи на рак мочевого пузыря . Прогноз средний: лучше, чем при большинстве эпителиальных раков, но хуже, чем при злокачественных опухолях Бреннера. [29]
Стромальные опухоли полового канатика , включая эстроген -продуцирующие гранулезоклеточную опухоль , доброкачественную текому и вирилизирующую опухоль из клеток Сертоли-Лейдига или арренобластому , составляют 7% случаев рака яичников. Чаще всего они встречаются у женщин в возрасте от 50 до 69 лет, но могут возникать у женщин любого возраста, включая молодых девушек. Обычно они не агрессивны и обычно односторонние; [26] поэтому их обычно лечат только хирургическим путем. Стромальные опухоли полового канатика являются основными гормонпродуцирующими опухолями яичников. [33]
Несколько различных клеток мезенхимы могут вызывать опухоли полового канатика или стромальные опухоли. К ним относятся фибробласты и эндокринные клетки. Симптомы опухоли полового тяжа или стромальной опухоли яичника могут отличаться от других типов рака яичников. Общие признаки и симптомы включают перекрут яичника , кровотечение или разрыв опухоли, образование в брюшной полости и гормональные нарушения. У детей изосексуальное преждевременное псевдополовое созревание может возникать при гранулезоклеточных опухолях, поскольку они продуцируют эстроген. Эти опухоли вызывают нарушения менструального цикла ( чрезмерное кровотечение , нечастые менструации или отсутствие менструаций ) или кровотечения в постменопаузе. Поскольку эти опухоли вырабатывают эстроген, они могут вызывать или возникать одновременно с раком эндометрия или раком молочной железы . Другие опухоли полового канатика/стромы проявляются отчетливыми симптомами. Опухоли из клеток Сертоли-Лейдига вызывают вирилизацию и чрезмерный рост волос из-за выработки тестостерона и андростендиона , что в редких случаях также может вызывать синдром Кушинга . Также встречаются стромальные опухоли полового канатика, не вызывающие гормонального дисбаланса, в том числе доброкачественные фибромы, вызывающие асцит и гидроторакс . [26] Среди герминогенных опухолей стромальные опухоли полового канатика являются наиболее частым раком яичников, диагностируемым у женщин в возрасте до 20 лет. [33]
Гранулезоклеточные опухоли являются наиболее распространенными стромальными опухолями полового канатика, составляя 70% случаев, и делятся на два гистологических подтипа: взрослые гранулезоклеточные опухоли, развивающиеся у женщин старше 50 лет, и ювенильные гранулезные опухоли, развивающиеся до полового созревания или до полового созревания. до 30 лет. Оба развиваются в фолликуле яичника из популяции клеток, окружающих зародышевые клетки. [33]
Для взрослых гранулезоклеточных опухолей характерно более позднее начало (30+ лет, в среднем 50 лет). Эти опухоли продуцируют высокий уровень эстрогена, что вызывает характерные симптомы: менометроррагию ; гиперплазия эндометрия ; нежная , увеличенная грудь ; постменопаузальные кровотечения ; и вторичная аменорея . Масса опухоли может вызывать другие симптомы, включая боль и вздутие живота, или симптомы, похожие на внематочную беременность , если опухоль кровоточит и разрывается. [33]
Опухоли Сертоли-Лейдига чаще всего встречаются у женщин в возрасте до 30 лет и особенно часто в период до полового созревания. [33]
Склерозирующие стромальные опухоли обычно возникают у девочек до полового созревания или у женщин в возрасте до 30 лет. [33]
Герминогенные опухоли яичников развиваются из половых клеток яичника . [68] Герминогенные опухоли составляют около 30% опухолей яичников, но только 5% случаев рака яичников, поскольку большинство герминогенных опухолей являются тератомами , а большинство тератом доброкачественными. Злокачественные тератомы, как правило, возникают у пожилых женщин, когда один из зародышевых слоев опухоли развивается в плоскоклеточный рак . [26] Герминогенные опухоли, как правило, возникают у молодых женщин (20–30 лет) и девушек, составляя 70% случаев рака яичников, наблюдаемых в этой возрастной группе. [34] Герминогенные опухоли могут включать дисгерминомы, тератомы, опухоли желточного мешка/опухоли эндодермального синуса и хориокарциномы, если они возникают в яичнике. Некоторые опухоли зародышевых клеток имеют изохромосому 12, в которой одно плечо хромосомы 12 удалено и заменено дубликатом другого. [26] Большинство видов герминогенного рака имеют лучший прогноз, чем другие подтипы, и более чувствительны к химиотерапии. На момент постановки диагноза они с большей вероятностью будут на I стадии. [33] В целом, они метастазируют чаще, чем эпителиальный рак яичников. Кроме того, используемые маркеры рака различаются в зависимости от типа опухоли: хориокарциномы контролируются с помощью бета-ХГЧ , а опухоли эндодермального синуса - с помощью альфа-фетопротеина . [26]
Герминогенные опухоли обычно обнаруживаются, когда они становятся большими, пальпируемыми образованиями. Однако, как и опухоли полового канатика, они могут вызывать перекрут яичника или кровотечение, а у детей – изосексуальное преждевременное половое созревание. Они часто метастазируют в близлежащие лимфатические узлы, особенно в парааортальные и тазовые лимфатические узлы. [26] Наиболее частым симптомом герминогенных опухолей является подострая боль в животе , вызванная кровотечением, некротизацией или растяжением капсулы яичника. Если опухоль разрывается, вызывает значительное кровотечение или перекручивает яичник, это может вызвать острую боль в животе , которая возникает менее чем у 10% пациентов с герминогенными опухолями. Они также могут выделять гормоны, которые изменяют менструальный цикл . В 25% случаев герминогенных опухолей рак обнаруживается при обычном обследовании и не вызывает симптомов. [33]
Диагностика опухолей зародышевых клеток может быть затруднена, поскольку нормальный менструальный цикл и период полового созревания могут вызывать боль и симптомы в области таза, а молодая женщина может даже считать эти симптомы симптомами беременности и не обращаться за лечением из-за стигматизации подростковой беременности . Анализы крови на альфа-фетопротеин, кариотип , хорионический гонадотропин человека и функцию печени используются для диагностики герминогенной опухоли и потенциальной сопутствующей дисгенезии гонад. Герминогенную опухоль можно первоначально принять за доброкачественную кисту яичника . [33]

Дисгерминома составляет 35% случаев рака яичников у молодых женщин и является наиболее вероятной герминогенной опухолью, метастазирующей в лимфатические узлы; узловые метастазы встречаются в 25–30% случаев. [34] [33] Эти опухоли могут иметь мутации в гене KIT , мутации, известной своей ролью в стромальных опухолях желудочно-кишечного тракта . Люди с кариотипом XY и яичниками ( дисгенезия гонад ) или кариотипом X,0 и яичниками ( синдром Тернера ), у которых развивается односторонняя дисгерминома, подвергаются риску развития гонадобластомы в другом яичнике, и в этом случае оба яичника обычно удаляются при одностороннюю дисгерминому обнаруживают, чтобы избежать риска возникновения другой злокачественной опухоли. Гонадобластомы у людей с синдромом Свайера или Тернера перерастают в злокачественные примерно в 40% случаев. Однако в целом в 10–20% случаев дисгерминомы являются двусторонними. [26] [33]

Они состоят из клеток, которые не могут дальше дифференцироваться и развиваются непосредственно из половых клеток или из гонадобластомы. Примерно в 5% случаев дисгерминомы содержат синцитиотрофобласты и поэтому могут вызывать повышенный уровень ХГЧ. На внешний вид дисгерминомы обычно имеют цвет от розового до желтовато-коричневого, имеют несколько долей и являются твердыми. Микроскопически они идентичны семиномам и очень близки к эмбриональным зародышевым клеткам , имеют большие, многогранные, округлые прозрачные клетки . Ядра однородные, круглые или квадратные, с выступающими ядрышками , а цитоплазма имеет высокий уровень гликогена . Воспаление является еще одной заметной гистологической особенностью дисгермином. [33]
Хориокарцинома может возникать как первичная опухоль яичника, развивающаяся из зародышевой клетки, хотя обычно это гестационное заболевание, которое метастазирует в яичник. Первичная хориокарцинома яичников имеет плохой прогноз и может возникнуть без беременности. Они производят высокие уровни ХГЧ и могут вызывать раннее половое созревание у детей или менометроррагию (нерегулярные, обильные менструации) после менархе. [33]
.jpg/440px-Mature_Cystic_Teratoma_of_the_Ovary_(5560431170).jpg)
Незрелые, или солидные, тератомы являются наиболее распространенным типом герминогенных опухолей яичников, составляя 40–50% случаев. Тератомы характеризуются наличием дезорганизованных тканей, возникающих из всех трех эмбриональных зародышевых листков : эктодермы , мезодермы и энтодермы ; незрелые тератомы также содержат недифференцированные стволовые клетки , что делает их более злокачественными, чем зрелые тератомы (дермоидные кисты). Различные ткани видны при грубой патологии и часто включают кости, хрящи, волосы, слизь или кожное сало , но эти ткани не видны снаружи и представляют собой сплошную массу с долями и кистами. Гистологически они имеют большое количество нейроэктодермы , организованной в листы и канальцы вместе с глией ; количество нервной ткани определяет гистологическую степень. Незрелые тератомы обычно поражают только один яичник (в 10% случаев сочетаются с дермоидными кистами) и обычно метастазируют по всей брюшине. Они также могут вызвать рост зрелых имплантатов тератомы по всему животу при заболевании, называемом синдромом растущей тератомы ; они обычно доброкачественные, но продолжают расти во время химиотерапии и часто требуют дальнейшего хирургического вмешательства. В отличие от зрелых тератом, незрелые тератомы образуют множество спаек , что снижает вероятность перекрута яичника. Специфического маркера незрелых тератом не существует, но карциноэмбриональный антиген (СЕА), СА-125, СА19-9 или АФП иногда могут указывать на незрелую тератому. [33]
Тератомы I стадии составляют большинство (75%) случаев и имеют лучший прогноз: 98% пациентов выживают в течение пяти лет; если опухоль I стадии также относится к 1 степени, ее можно лечить только односторонним хирургическим вмешательством. Опухоли стадий II–IV составляют оставшуюся четверть случаев и имеют худший прогноз: 73–88% пациентов выживают в течение пяти лет. [33]
Зрелые тератомы, или дермоидные кисты, — это редкие опухоли, состоящие преимущественно из доброкачественной ткани, которые развиваются после менопаузы. Опухоли состоят из дезорганизованной ткани с узелками злокачественной ткани, которые могут быть различных типов. Наиболее распространенной злокачественной опухолью является плоскоклеточный рак , но частью дермоидной кисты также могут быть аденокарцинома , базальноклеточная карцинома , карциноидная опухоль , нейроэктодермальная опухоль , злокачественная меланома , саркома , опухоль сальной железы и струма яичника . Их лечат хирургическим путем и адъювантной платиновой химиотерапией или лучевой терапией. [33]
Опухоли желточного мешка , ранее называемые опухолями энтодермального синуса, составляют примерно 10–20% злокачественных опухолей яичников зародышевых клеток и имеют худший прогноз среди всех опухолей яичников зародышевых клеток . Они возникают как до менархе (в трети случаев), так и после менархе (оставшиеся две трети случаев). У половины людей с опухолями желточного мешка диагностируется стадия I. Обычно они являются односторонними до тех пор, пока не появятся метастазы, которые возникают в брюшной полости и через кровоток в легкие. Опухоли желточного мешка быстро растут и легко рецидивируют, и после рецидива их нелегко вылечить. Опухоли желточного мешка I стадии хорошо поддаются лечению: 5-летняя безрецидивная выживаемость составляет 93%, но опухоли II-IV стадии менее поддаются лечению: выживаемость составляет 64–91%. [33]
Внешний вид их твердый, рыхлый, желтый, с некротическими и геморрагическими участками. Они также часто содержат кисты, которые могут перерождаться или разрываться. Гистологически опухоли желточного мешка характеризуются наличием телец Шиллера-Дюваля (патогномоничных для опухолей желточного мешка) и ретикулярного рисунка. Опухоли желточного мешка обычно секретируют альфа-фетопротеин и на его присутствие можно провести иммуногистохимическое окрашивание; уровень альфа-фетопротеина в крови является полезным маркером рецидива. [33]
Эмбриональные карциномы, редкий тип опухоли, обычно встречающийся в смешанных опухолях, развиваются непосредственно из зародышевых клеток, но не являются окончательно дифференцированными; в редких случаях они могут развиваться в дисгенетических гонадах. В дальнейшем они могут перерасти во множество других новообразований, включая хориокарциному, опухоль желточного мешка и тератому. Они встречаются у более молодых людей, средний возраст на момент постановки диагноза 14 лет, и секретируют как альфа-фетопротеин (в 75% случаев), так и ХГЧ. [33]
Гистологически эмбриональная карцинома похожа на эмбриональный диск , состоящий из эпителиальных анапластических клеток в неорганизованных пластах, с железоподобными пространствами и папиллярными структурами. [33]
Полиэмбриомы, наиболее незрелая форма тератомы и очень редкие опухоли яичников, гистологически характеризуются наличием нескольких эмбрионоподобных тел со структурами, напоминающими зародышевый диск, желточный мешок и амниотический мешок . Гигантские клетки синцитиотрофобласта также встречаются в полиэмбриомах. [33]
Основная статья : Плоскоклеточный рак яичника
Первичные плоскоклеточные карциномы яичников встречаются редко и имеют плохой прогноз при прогрессировании. Чаще всего плоскоклеточный рак яичников представляет собой метастазы шейки матки, области дифференцировки эндометриоидной опухоли или происходит из зрелой тератомы. [29]
Смешанные опухоли содержат элементы более чем одного из вышеперечисленных классов гистологии опухолей. Чтобы классифицировать опухоль как смешанную, малый тип должен составлять более 10% опухоли. [31] Хотя смешанные карциномы могут иметь любую комбинацию типов клеток, смешанный рак яичников обычно бывает серозным/эндометриоидным или светлоклеточным/эндометриоидным. [29] Смешанные герминогенные опухоли составляют примерно 25–30% всех герминогенных опухолей яичников с сочетанием дисгерминомы, опухоли желточного мешка и/или незрелой тератомы. Прогноз и лечение варьируются в зависимости от типов составляющих клеток. [33]
Рак яичников также может быть вторичным раком, результатом метастазирования первичного рака в другие части тела. [26] Около 5-30% случаев рака яичников возникают из-за метастазов, а остальные являются первичными раками. [78] Распространенными первичными видами рака являются рак молочной железы , рак толстой кишки , рак аппендикса и рак желудка (первичный рак желудка, который метастазирует в яичник, называется опухолями Крукенберга ). [26] Опухоли Крукенберга имеют перстневидные и муцинозные клетки. [29] Рак эндометрия и лимфомы также могут метастазировать в яичник. [79]
Пограничные опухоли яичников , иногда называемые опухолями яичников с низким злокачественным потенциалом (LMP), имеют некоторые доброкачественные и некоторые злокачественные особенности. [29] Опухоли LMP составляют примерно 10–15% всех опухолей яичников. [31] [68] Они развиваются раньше, чем эпителиальный рак яичников, примерно в возрасте 40–49 лет. Обычно у них нет обширного вторжения; 10% опухолей LMP имеют участки стромальной микроинвазии (<3 мм, <5% опухоли). Опухоли LMP имеют и другие аномальные особенности, включая повышенный митоз, изменения размера клеток или размера ядра , аномальные ядра , расслоение клеток и небольшие выступы на клетках (папиллярные выступы). Серозные и/или муцинозные характеристики можно увидеть при гистологическом исследовании, а серозная гистология составляет подавляющее большинство опухолей поздних стадий LMP. Более 80% опухолей LMP относятся к стадии I; 15% относятся к стадиям II и III и менее 5% — к стадии IV. [29] Имплантаты опухолей LMP часто неинвазивны. [68]
Стадирование рака яичников осуществляется с использованием системы стадирования Figo и информации, полученной после хирургического вмешательства, которое может включать тотальную абдоминальную гистерэктомию через срединную лапаротомию , удаление (обычно) обоих яичников и маточных труб , (обычно) сальника , промывания тазового (перитонеального) кишечника , оценка забрюшинных лимфатических узлов (включая тазовые и парааортальные лимфатические узлы ), аппендэктомия при подозрении на муцинозные опухоли и биопсия таза/брюшины для цитопатологии . [28] [26] [31] [80] Около 30% случаев рака яичников, которые кажутся ограниченными яичниками, имеют микроскопические метастазы, поэтому даже рак I стадии должен быть полностью стадирован. [26] В 22% случаев рака, предположительно находящейся на I стадии, наблюдаются лимфатические метастазы. [31] Этап AJCC аналогичен этапу Figo. Система стадирования AJCC описывает степень первичной опухоли (T), отсутствие или наличие метастазов в близлежащие лимфатические узлы (N), а также отсутствие или наличие отдаленных метастазов (M). [81] Наиболее распространенной стадией диагностики является стадия IIIc, на которую приходится более 70% диагнозов. [26]

Система стадирования AJCC/TNM указывает, где опухоль развилась, распространилась на лимфатические узлы и метастазовала. [31]
Этапы AJCC/TNM можно соотнести с этапами Figo: [31]
Опухоли 1 степени имеют хорошо дифференцированные клетки (очень похожи на нормальную ткань) и имеют лучший прогноз. Опухоли 2 степени также называются умеренно высокодифференцированными и состоят из клеток, напоминающих нормальную ткань. Опухоли 3-й степени имеют худший прогноз, их клетки аномальны и называются низкодифференцированными. [82]
Метастазирование при раке яичника очень часто встречается в брюшной полости и происходит путем отслоения, когда раковые клетки прорываются через капсулу яичника и могут свободно перемещаться по брюшной полости. Метастазы рака яичников обычно растут на поверхности органов, а не внутри; они также часто встречаются на сальнике и слизистой оболочке брюшины. Раковые клетки также могут перемещаться по лимфатической системе и метастазировать в лимфатические узлы, связанные с яичниками через кровеносные сосуды; т.е. лимфатические узлы вдоль воронко-тазовой связки , широкой связки и круглой связки . Наиболее часто поражаются парааортальные , подчревные, наружные подвздошные , запирательные и паховые лимфатические узлы . Обычно рак яичников не метастазирует в печень, легкие, мозг или почки, если только это не рецидивирующее заболевание; это отличает рак яичников от многих других форм рака. [29]
Женщины с высоким генетическим риском рака яичников могут рассматривать хирургическое удаление яичников в качестве профилактической меры. Часто это делается после завершения детородного возраста. Это снижает вероятность развития как рака молочной железы (примерно на 50%), так и рака яичников (примерно на 96%) у женщин из группы высокого риска. Женщинам с мутациями гена BRCA обычно одновременно удаляют маточные трубы (сальпингоофорэктомия), поскольку они также имеют повышенный риск рака фаллопиевых труб . Однако эта статистика может переоценивать снижение риска из-за того, как она изучалась. [26] [83]
Женщин со значительной семейной историей рака яичников часто направляют к генетическому консультанту , чтобы узнать, будет ли полезно тестирование на мутации BRCA. [29] Использование оральных контрацептивов, отсутствие «менструаций» во время менструального цикла и перевязка маточных труб снижают риск. [84] Возможна связь между развитием рака яичников и стимуляцией яичников во время лечения бесплодия. Эндометриоз связан с раком яичников. Инфекция вируса папилломы человека , курение и тальк не повышают риск развития рака яичников. [28]
Не существует простого и надежного способа проверить наличие рака яичников у женщин, у которых нет каких-либо признаков или симптомов. Скрининг не рекомендуется женщинам, которые входят в группу среднего риска, поскольку данные не подтверждают снижение смертности, а высокий уровень ложноположительных тестов может привести к ненужному хирургическому вмешательству, которое сопровождается собственными рисками. [19] Женщинам с высоким риском рака яичников, который в настоящее время выявлен на основании семейного анамнеза и генетического тестирования, может быть полезен скрининг. [85] Пап- тест не позволяет выявить рак яичников. [27]
Рак яичников обычно пальпируется только на поздних стадиях. [29] Эта группа высокого риска выиграла от более раннего выявления. [28] [26] [83] Скрининг с использованием измерений CA-125 , уровней HE4 , ультразвука или пальпации придатков не рекомендуется у женщин со средним риском. В настоящее время в Великобритании не существует национальной программы скрининга рака яичников. Можно использовать CA125 и трансвагинальное ультразвуковое исследование, но имеется минимальное количество доказательств того, что это снижает смертность. Совсем недавно было показано, что алгоритм риска рака яичников (ROMA) обнаруживает более ранние виды рака с использованием CA125 и возраста, но в настоящее время опять же не обеспечивает надежную меру снижения смертности. [86]
Рак яичников имеет низкую распространенность даже в группе высокого риска среди женщин в возрасте от 50 до 60 лет (около одной в 2000 году), а скрининг женщин со средним риском с большей вероятностью даст неоднозначные результаты, чем выявит проблему, требующую лечения. . Поскольку неоднозначные результаты более вероятны, чем обнаружение поддающейся лечению проблемы, и поскольку обычным ответом на неоднозначные результаты являются инвазивные вмешательства, у женщин среднего риска потенциальный вред от скрининга без показаний перевешивает потенциальную пользу. Цель скрининга – диагностировать рак яичников на ранней стадии, когда вероятность его успешного лечения выше. [26] [83]
Скрининг с помощью трансвагинального УЗИ , гинекологического исследования и определения уровня CA-125 можно использовать вместо профилактического хирургического вмешательства у женщин с мутациями BRCA1 или BRCA2. Эта стратегия показала определенный успех. [29]
В крупномасштабном исследовании в Великобритании было показано, что скрининг на CA125, химическое вещество, выделяемое опухолями яичников, с последующим контролем с помощью ультразвука, неэффективен для снижения смертности. [87]
Было проведено несколько скрининговых исследований, в которых использовался возраст, семейный анамнез рака яичников и мутационный статус для определения целевых групп населения для скрининга. [85]
Как только будет установлено, что имеется рак яичников, фаллопиевых труб или первичный рак брюшины, лечение назначает гинеколог-онколог (врач, специализирующийся на лечении рака репродуктивной системы женщины). Гинекологи-онкологи могут проводить операции и проводить химиотерапию женщинам с раком яичников. Разрабатывается план лечения. [88]
Лечение обычно включает хирургическое вмешательство и химиотерапию , а иногда и лучевую терапию , независимо от подтипа рака яичников. [68] [89] Хирургическое лечение может быть достаточным для хорошо дифференцированных злокачественных опухолей, ограниченных яичником. Добавление химиотерапии может потребоваться при более агрессивных опухолях, ограниченных яичником. Для пациентов с запущенным заболеванием стандартным является сочетание хирургической редукции с комбинированным режимом химиотерапии. С 1980 года препараты на основе платины играют важную роль в лечении рака яичников. [ нужна цитация ] Пограничные опухоли , даже после распространения за пределы яичника, хорошо лечатся хирургическим путем, а химиотерапия не считается полезной. [90] Повторное хирургическое вмешательство и поддерживающая химиотерапия не принесли пользы. [29]
Хирургическое вмешательство было стандартом лечения на протяжении десятилетий и может быть необходимо для получения образца для диагностики . Операция зависит от степени инвазии рака в близлежащие ткани на момент постановки диагноза. Эта степень рака описывается путем присвоения ему стадии, предполагаемого типа и степени рака. Хирург-гинеколог может удалить один (односторонняя овариэктомия) или оба яичника (двусторонняя овариэктомия). Также могут быть удалены маточные трубы (сальпингэктомия), матка (гистерэктомия) и сальник ( сальникэктомия). Обычно все эти органы удаляются. [91]
Для тех, у кого положительный результат теста на дефектные гены BRCA1 или BRCA2, возможно проведение операции по снижению риска . Все больше женщин выбирают это. При этом среднее время ожидания прохождения процедуры составляет два года, что значительно превышает рекомендуемый срок. [92] [93]
При низкосортном одностороннем раке стадии IA удаляются только пораженный яичник (который должен быть неразрывным) и маточная труба. Это можно сделать особенно у молодых людей, которые хотят сохранить свою фертильность. Однако существует риск микроскопических метастазов, и необходимо провести стадирование. [28] При обнаружении метастазов необходима повторная операция по удалению оставшегося яичника и матки. [90] Транексамовую кислоту можно вводить до операции, чтобы уменьшить потребность в переливании крови из-за кровопотери во время операции. [31]
Если во время операции опухоль у женщины в пременопаузе определяется как опухоль с низким потенциалом злокачественности и это явно рак I стадии, удаляют только пораженный яичник. Для женщин в постменопаузе с опухолями с низким потенциалом злокачественности гистерэктомия с двусторонней сальпингоофорэктомией по-прежнему остается предпочтительным вариантом. Во время постановки аппендикс можно осмотреть или удалить. Это особенно важно при муцинозных опухолях. [29] У детей или подростков с раком яичников хирурги обычно пытаются сохранить один яичник, чтобы обеспечить завершение полового созревания , но если рак распространился, это не всегда возможно. Дисгерминомы, в частности, имеют тенденцию поражать оба яичника: 8–15% дисгермином присутствуют в обоих яичниках. [34] Людей с низкосортными (высокодифференцированными) опухолями обычно лечат только хирургическим путем, [26] который часто приводит к излечению. [68] В целом, герминогенные опухоли можно лечить односторонним хирургическим вмешательством, если только рак не является широко распространенным или фертильность не является фактором. [33] Исследования показывают, что у женщин с распространенным эпителиальным раком яичников хирургической стадии (стадии III и IV) следует предпринять все усилия для достижения полной циторедукции (хирургических усилий по удалению основной массы опухоли). [94]
При запущенных формах рака, когда полное удаление невозможно, удаляется как можно больше опухоли с помощью процедуры, называемой хирургическим удалением . Эта операция не всегда успешна и с меньшей вероятностью будет успешной у женщин с обширными метастазами в брюшине, IV стадией заболевания, раком поперечной щели печени , брыжейки или диафрагмы, а также обширными участками асцита. Операцию по уменьшению объема опухоли обычно проводят только один раз [28] , но недавнее исследование показало более высокую общую выживаемость при рецидиве рака яичников, когда операция проводилась в сочетании с химиотерапией, по сравнению с лечением только химиотерапией. [95] Компьютерная томография (КТ брюшной полости) часто используется для оценки возможности первичной операции по уменьшению объема, но доказательства с низкой степенью достоверности также позволяют предположить, что ПЭТ/КТ и МРТ с фтордезоксиглюкозой-18 (ФДГ) могут быть полезны в качестве дополнения для оценки макроскопического неполного уменьшения объема. [96] Более полное удаление объема связано с лучшими результатами: женщины без макроскопических признаков заболевания после удаления объема имеют среднюю выживаемость 39 месяцев, в отличие от 17 месяцев при менее полном хирургическом вмешательстве. [26] При удалении метастазов удаляются многие клетки, устойчивые к химиотерапии, а также удаляются любые скопления отмерших клеток. Это позволяет химиотерапии лучше достичь оставшихся раковых клеток, которые, скорее всего, будут быстрорастущими и, следовательно, химиочувствительными. [29]
Интервальная операция по уменьшению объема - это еще один используемый протокол, при котором проводится неоадъювантная химиотерапия, проводится операция по уменьшению объема и химиотерапия заканчивается после уменьшения объема. [90] Хотя никаких окончательных исследований не проводилось, показано, что она примерно эквивалентна первичной операции по уменьшению объема с точки зрения выживаемости и демонстрирует несколько меньшую заболеваемость. [29] Предыдущие исследования показали разные результаты при первичном и интервальном уменьшении объема. Продолжающееся исследование TRUST может уточнить критерии выбора для каждого хирургического подхода. [97]
Существует несколько различных хирургических процедур, которые можно использовать для лечения рака яичников. При раке I и II стадии можно использовать лапароскопическую операцию (замочную скважину), но метастазы могут не быть обнаружены. При запущенном раке лапароскопия не используется, поскольку для удаления метастазов требуется доступ ко всей брюшной полости. В зависимости от степени рака процедуры могут включать двустороннюю сальпингоофорэктомию, биопсию брюшины и лимфатической системы брюшной полости, сальникэктомию , спленэктомию , резекцию кишечника , удаление или резекцию диафрагмы, аппендэктомию или даже заднюю экзентерацию таза . [29]
Чтобы полностью определить стадию рака яичников, в операцию можно включить лимфаденэктомию , но эта практика может не принести существенного улучшения выживаемости. [28] Это особенно важно при герминогенных опухолях, поскольку они часто метастазируют в близлежащие лимфатические узлы. [26]
Если рак яичников рецидивирует, иногда вариантом лечения является вторичное хирургическое вмешательство. Это зависит от того, насколько легко удастся удалить опухоль, сколько жидкости скопилось в брюшной полости и общее состояние здоровья. [28] Эффективность этой операции зависит от хирургической техники, полноты циторедукции и распространенности заболевания. [98] Это также может быть полезно людям, перенесшим первую операцию у врача общей практики, а также при эпителиальном раке яичников. [31] Вторичная хирургия может быть эффективной при дисгерминомах и незрелых тератомах. [33] Имеющиеся данные свидетельствуют о том, что хирургическое вмешательство при рецидивирующем эпителиальном раке яичников может быть связано с продлением жизни у некоторых женщин с чувствительным к платине заболеванием. [99]
Основным побочным эффектом овариэктомии у молодых женщин является ранняя менопауза , которая может вызвать остеопороз . После операции можно рассмотреть возможность заместительной гормональной терапии, особенно у молодых женщин. Эта терапия может состоять из комбинации эстрогена и прогестерона или только эстрогена. Только эстроген безопасен после гистерэктомии; когда матка все еще присутствует, беспрепятственный прием эстрогена резко повышает риск рака эндометрия . [28] Терапия эстрогенами после операции не влияет на выживаемость. [31] Людей, перенесших операцию по поводу рака яичников, обычно после этого госпитализируют на 3–4 дня, и они проводят около месяца, восстанавливаясь дома. [100] Наилучшие результаты операций наблюдаются в больницах, где проводится большое количество операций по поводу рака яичников. [29]
Неясно, является ли лапароскопия или лапаротомия лучше или хуже при раке яичников I стадии Figo. [101] Также нет очевидной разницы между тотальной абдоминальной гистерэктомией и надцервикальной гистерэктомией при поздних стадиях рака. Примерно 2,8% людей, перенесших первую операцию по поводу распространенного рака яичников, умирают в течение двух недель после операции ( уровень периоперационной смертности 2,8% ). [31] Более агрессивные операции связаны с лучшими результатами при распространенном (стадии III или IV) раке яичников. [29]
Химиотерапия была общим стандартом лечения рака яичников на протяжении десятилетий, хотя и с различными протоколами. Химиотерапия используется после операции для лечения остаточного заболевания, если это необходимо. В некоторых случаях может возникнуть необходимость сначала провести химиотерапию, а затем операцию. Это называется «неоадъювантной химиотерапией» и часто применяется, когда опухоль не может быть полностью удалена или оптимально уменьшена хирургическим путем. Хотя не было доказано, что это увеличивает выживаемость, оно может снизить риск осложнений после операции. Если выполняется односторонняя сальпингоофорэктомия или другая операция, может быть назначена дополнительная химиотерапия, называемая «адъювантной химиотерапией». [28] [31] Адъювантная химиотерапия используется при раке 1 стадии, как правило, если опухоль имеет высокую гистологическую степень (степень 3) или самую высокую подстадию (стадия 1c), при условии, что во время операции была выбрана оптимальная стадия рака. [31] [90] Бевацизумаб можно использовать в качестве адъювантной химиотерапии, если опухоль не удалена полностью во время операции или если рак находится на IV стадии; он может продлить выживаемость без прогрессирования, но не было показано, что он увеличивает общую выживаемость. [31] Химиотерапия излечивает примерно 20% случаев рака яичников на поздних стадиях; [29] он чаще излечивает злокачественные герминогенные опухоли, чем эпителиальные опухоли. [33] Было обнаружено, что адъювантная химиотерапия улучшает выживаемость и снижает риск рецидива рака яичников по сравнению с отсутствием адъювантной терапии у женщин с эпителиальным раком яичников на ранней стадии. [102]
Химиотерапия рака яичников обычно состоит из платинов , группы препаратов на основе платины , в сочетании с неплатинами. [103] Препараты на основе платины используются с 1980 года. Общие методы лечения могут включать паклитаксел , цисплатин , топотекан , доксорубицин, эпирубицин и гемцитабин . Карбоплатин обычно назначают в сочетании с паклитакселом или доцетакселом ; типичная комбинация — карбоплатин с паклитакселом. [28] [31] Карбоплатин превосходит цисплатин в том, что он менее токсичен и имеет меньше побочных эффектов, что обычно позволяет улучшить качество жизни по сравнению с ним, хотя оба препарата одинаково эффективны. [31] Схемы с тремя препаратами не оказались более эффективными, [28] а сами по себе платины или неплатины менее эффективны, чем платины и неплатины в комбинации. [31] Существует небольшое преимущество химиотерапии на основе платины по сравнению с терапией, не содержащей платину. [104] Комбинации платины могут обеспечить лучшую выживаемость по сравнению с одной платиной. Данные свидетельствуют о том, что у людей с рецидивом рака яичников топотекан оказывает такое же влияние на общую выживаемость, как паклитаксел и топотекан в сочетании с талидомидом, хотя он превосходит треосульфан и не так эффективен, как пегилированный липосомальный доксорубицин, у людей, чувствительных к платине. [105]
Химиотерапию можно проводить внутривенно или в брюшную полость . [26] Хотя внутрибрюшинная химиотерапия связана с более длительной выживаемостью без прогрессирования и общей выживаемостью, она также вызывает больше побочных эффектов, чем внутривенная химиотерапия. [31] Его в основном используют, когда рак оптимально уменьшен. Внутрибрюшинная химиотерапия может быть очень эффективной, поскольку рак яичников в основном распространяется внутри брюшной полости, и таким путем более высокие дозы лекарств могут достичь опухоли. [29]
Химиотерапия может вызвать анемию ; Было обнаружено, что внутривенное введение железа более эффективно, чем пероральные добавки железа , в снижении потребности в переливании крови . [31] Типичные циклы лечения включают одну процедуру каждые 3 недели, повторяемую в течение 6 недель или более. [106] Лечение менее 6 недель (циклов) менее эффективно, чем 6 недель и более. [31] Герминогенные новообразования лечат иначе, чем другие виды рака яичников: используется схема блеомицина , этопозида и цисплатина (BEP) с 5-дневной химиотерапией, проводимой каждые 3 недели в течение 3–4 циклов. [26] [33] Не было доказано, что химиотерапия опухолей зародышевых клеток вызывает аменорею , бесплодие, врожденные дефекты или выкидыш . [33] Эффективность поддерживающей химиотерапии не доказана. [31]
У людей с мутациями BRCA химиотерапия платиной более эффективна. [28] Герминогенные опухоли и злокачественные опухоли полового канатика/стромы лечатся химиотерапией, хотя дисгерминомы и опухоли полового канатика обычно не очень хорошо реагируют. [26] [34]
Если рак яичников рецидивирует, он считается частично платиночувствительным или платинорезистентным, в зависимости от времени, прошедшего с момента последнего рецидива лечения платинами: частично платиночувствительный рак рецидивировал через 6–12 месяцев после последнего лечения, а платинорезистентный рак имеет интервал менее 6 месяцев. Химиотерапию второй линии можно назначать после появления симптомов рака, поскольку не наблюдается разницы в выживаемости между лечением бессимптомных (повышенный CA-125) и симптоматических рецидивов. [ нужна медицинская ссылка ]
При опухолях, чувствительных к платине, платины являются препаратами выбора для химиотерапии второй линии в сочетании с другими цитотоксическими агентами. Схемы включают карбоплатин в сочетании с пегилированным липосомальным доксорубицином , гемцитабином или паклитакселом . [26] В некоторых случаях терапию карбоплатином-дуплетом можно комбинировать с паклитакселом для повышения эффективности. Другой потенциальной адъювантной терапией рецидивов, чувствительных к платине, является олапариб , который может улучшить выживаемость без прогрессирования , но не было показано, что он улучшает общую выживаемость . [31] ( Олапариб , ингибитор PARP , был одобрен FDA США для использования при BRCA-ассоциированном раке яичников, который ранее лечился химиотерапией. [107] [108] ) При рецидивирующих герминогенных опухолях необходимы дополнительные 4 цикла Химиотерапия BEP является лечением первой линии для тех, кто лечился хирургическим путем или платинами.
Если установлено, что опухоль устойчива к платине, в качестве терапии второй линии можно использовать винкристин , дактиномицин и циклофосфамид (VAC) или некоторую комбинацию паклитаксела, гемцитабина и оксалиплатина . [33]
Для платинорезистентных опухолей не существует высокоэффективных вариантов химиотерапии. Схемы с одним препаратом (доксорубицин или топотекан ) не дают высоких показателей ответа [28] , но в некоторых случаях используются схемы с одним препаратом (топотекан, пегилированный липосомальный доксорубицин или гемцитабин). [26] [31] Топотекан нельзя применять людям с кишечной непроходимостью. Паклитаксел, используемый отдельно, является еще одной возможной схемой, или его можно комбинировать с липосомальным доксорубицином, гемцитабином, цисплатином, топотеканом , этопозидом или циклофосфамидом . [106] (См. также «Паллиативная помощь» ниже.)
Разрабатываются новые агенты для ингибирования развития новых кровеносных сосудов (ангиогенеза) у женщин с раком яичников, у которых развивается устойчивость к химиотерапевтическим препаратам. По состоянию на 2023 год эти методы лечения, по-видимому, будут иметь значение, но из-за дополнительной нагрузки на лечение и стоимости поддерживающего лечения соотношение риска и пользы требует тщательного рассмотрения. [109]
Novocure спонсировала исследование фазы 2, доказывающее эффективность методов лечения опухолей при рецидивирующей карциноме яичников, резистентной к препаратам платины, в сочетании с еженедельной химиотерапией паклитакселом. [46]
Дисгерминомы наиболее эффективно лечатся лучевой терапией, [34] хотя она может вызвать бесплодие и постепенно отменяется в пользу химиотерапии. [26] Лучевая терапия не улучшает выживаемость у людей с высокодифференцированными опухолями. [26]
При раке стадий 1c и 2 лучевая терапия используется после операции, если существует вероятность остаточного заболевания в области таза, но в брюшной полости нет рака. Лучевая терапия также может использоваться в паллиативном лечении поздних стадий рака. Типичный курс лучевой терапии рака яичников составляет 5 дней в неделю в течение 3–4 недель. Общие побочные эффекты лучевой терапии включают диарею, запор и частое мочеиспускание. [110]
Несмотря на то, что 60% опухолей яичников имеют рецепторы эстрогена , рак яичников лишь в редких случаях поддается гормональному лечению. Кокрейновский обзор обнаружил отсутствие доказательств о влиянии тамоксифена на людей с рецидивом рака яичников. [111] Эстроген сам по себе не оказывает влияния на рак, а тамоксифен и летрозол редко оказываются эффективными. [28] «Некоторые женщины с пограничным злокачественным раком яичников и стромальным раком яичников могут получать гормональную терапию». [91]
Иммунотерапия является темой текущих исследований рака яичников. В некоторых случаях препарат на основе антител бевацизумаб , хотя и является предметом активных исследований, используется для лечения запущенного рака наряду с химиотерапией. [90] Он был одобрен для такого использования в Европейском Союзе. [112]
Конкретное наблюдение зависит, например, от типа и стадии рака яичников, лечения и наличия каких-либо симптомов. Обычно осмотр проводится примерно каждые 2–3 месяца, а затем два раза в год в течение 5 лет. [113] При эпителиальном раке яичников наиболее распространенным тестом при последующем наблюдении является уровень CA-125. Однако лечение, основанное только на повышенных уровнях CA-125, а не на каких-либо симптомах, может усилить побочные эффекты без какого-либо продления жизни, поэтому значение результатов теста на CA-125 можно обсудить перед его проведением. [114] Согласно рекомендациям 2014 года, рецидив рака может наблюдаться, если уровень CA-125 в два раза превышает норму. [28] Лечение рецидива, обнаруженного с помощью CA-125, не улучшает выживаемость. [31]
Для женщин с герминогенными опухолями последующие тесты обычно включают анализ на альфа-фетопротеин (АФП) и/или хорионический гонадотропин человека . Женщинам со стромальным раком иногда полезны анализы на такие гормоны, как эстроген, тестостерон и ингибин . [114] Ингибин также может быть полезен для мониторинга прогрессирования опухолей полового канатика наряду с мюллеровым ингибирующим веществом . АФП также можно использовать для мониторинга опухолей Сертоли-Лейдига. [26] При дисгерминомах лактатдегидрогеназа и два ее изозима (ЛДГ-1 и ЛДГ-2) используются для проверки рецидива. [33]
Женщинам с раком яичников может не потребоваться регулярное наблюдение для наблюдения за раком, если только не появятся новые симптомы или не начнут расти маркеры опухоли . [115] Визуализация без этих показаний не рекомендуется, поскольку маловероятно, что она позволит обнаружить рецидив, улучшить выживаемость, а также потому, что она имеет свои собственные затраты и побочные эффекты. [115] Однако при желании можно использовать компьютерную томографию, хотя это не является распространенным явлением. [28] Если опухоль легко визуализируется, визуализацию можно использовать для мониторинга хода лечения. [116]
Паллиативная помощь направлена на облегчение симптомов и улучшение или поддержание качества жизни. Цель этого типа лечения – не вылечить рак, а сделать женщину более комфортной, живя с неизлечимым раком. Его рекомендовали как часть плана лечения для любого человека с запущенным раком яичников или пациентов с выраженными симптомами. [117] В случаях, резистентных к платине и платине, основным методом лечения является другая паллиативная химиотерапия. [29] [91]
Паллиативная помощь может включать лечение симптомов и осложнений рака, включая боль, тошноту, запор, асцит, непроходимость кишечника , отеки , плевральный выпот и мукозит . Особенно если рак прогрессирует и становится неизлечимым, лечение симптомов становится одной из основных целей терапии. Паллиативная помощь также может включать в себя помощь в принятии решений, например, о том, уместна ли и когда хосписная помощь , а также о предпочтительном месте для пациента в конце жизни. [31]
Непроходимость кишечника можно лечить с помощью паллиативной хирургии ( колостомы , илеостомы или внутреннего шунтирования) или медикаментозного лечения, но было доказано, что хирургическое вмешательство увеличивает время выживания. [28] [31] Паллиативная хирургия может привести к синдрому короткой кишки , кожно-кишечному свищу или повторной непроходимости; или может оказаться невозможным из-за степени обструкции. [29] Другие методы лечения осложнений могут включать полное парентеральное питание , диету с низким содержанием остатков , паллиативную гастростомию и адекватный контроль боли. [28] Непроходимость кишечника также можно лечить октреотидом, если паллиативная операция невозможна. Рак также может блокировать мочеточники , что можно облегчить с помощью нефростомии или установки мочеточникового стента . Асцит можно облегчить повторным парацентезом или установкой дренажа для повышения комфорта. [118] Плевральный выпот можно лечить аналогичным образом, с помощью повторного торакоцентеза , плевродеза или установки дренажа. [29]
Лучевая терапия может использоваться как часть паллиативной помощи при распространенном раке яичников, поскольку она может помочь уменьшить опухоли, вызывающие симптомы. [91] Паллиативная лучевая терапия обычно длится всего несколько процедур, что является гораздо более коротким курсом терапии, чем непаллиативная лучевая терапия. [110] Он также используется для паллиативного лечения герминогенных опухолей, устойчивых к химиотерапии. [33]
Рак яичников оказывает существенное влияние на качество жизни , психологическое здоровье и благополучие. Доступны меры для удовлетворения потребностей и социальной поддержки. Многие люди, пережившие рак яичников, сообщают о хорошем качестве жизни и оптимизме . Другие сообщили о «духовных изменениях», которые помогли им найти смысл во время своего опыта. Другие рассказали о своей потере веры после того, как им поставили диагноз «рак яичников». Те, кто прошел лечение, иногда испытывают социальную изоляцию , но получают пользу от общения с другими выжившими. Некоторые из тех, кто заявил о своей неспособности заботиться о своей семье, описывали разочарование и чувство вины . [119]
Изменения самооценки и образа тела могут произойти из-за выпадения волос , удаления яичников и других репродуктивных структур, а также шрамов . После отрастания волос наступает некоторое улучшение. Могут развиться сексуальные проблемы. Удаление яичников приводит к хирургически вызванной менопаузе , которая может привести к болезненности полового акта , сухости влагалища, потере сексуального влечения и усталости. Хотя прогноз лучше для более молодых выживших, влияние на сексуальность все равно может быть существенным. [119]
Тревога , депрессия и дистресс наблюдаются у тех, кто пережил рак яичников, чаще, чем в общей популяции. [119] [120] Те же психосоциальные проблемы могут возникнуть и у членов семьи. Эмоциональные эффекты могут включать страх смерти , печаль , проблемы с памятью и трудности с концентрацией внимания. Когда те, кто начинал лечение, проявляли оптимизм, у них была меньшая вероятность развития дистресса. Тем, кто боится рецидива рака, может быть трудно выразить радость , даже если у них нет болезни. Чем больше процедур проходит женщина, тем вероятнее выражена потеря надежды . Женщины часто могут справиться с негативными психосоциальными последствиями и уменьшить их с помощью ряда стратегий. Такие виды деятельности, как путешествия, проведение дополнительного времени с семьей и друзьями, игнорирование статистики , ведение дневника и более активное участие в духовных мероприятиях, являются адаптивными. [119]
Женщины с раком яичников также могут испытывать трудности с питанием и подвергаются риску недоедания. [121]
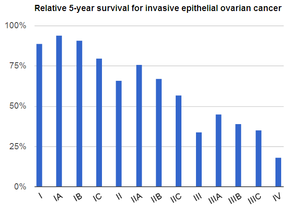
Рак яичников обычно имеет относительно плохой прогноз . Он непропорционально смертелен, поскольку для него не существует четких методов раннего выявления или скрининга, а это означает, что большинство случаев не диагностируются до тех пор, пока они не достигнут поздних стадий. [115] [28]
Рак яичников метастазирует на ранних стадиях своего развития, часто до того, как его диагностируют. Опухоли высокой степени злокачественности метастазируют легче, чем опухоли низкой степени злокачественности. Обычно опухолевые клетки начинают метастазировать, разрастаясь в брюшной полости. [26] Более 60% женщин с раком яичников имеют рак III или IV стадии, когда он уже распространился за пределы яичников. Рак яичников выделяет клетки в естественную жидкость брюшной полости. Эти клетки могут затем имплантироваться в другие структуры брюшной полости (брюшины), включая матку, мочевой пузырь , кишечник , слизистую оболочку стенки кишечника и сальник , образуя новые опухолевые разрастания еще до того, как возникает подозрение на рак.
Пятилетняя выживаемость при всех стадиях рака яичников составляет 46%; годовая выживаемость составляет 72%, а десятилетняя выживаемость составляет 35%. [123] В случаях, когда диагноз ставится на ранних стадиях заболевания, когда рак все еще ограничен первичной локализацией, пятилетняя выживаемость составляет 92,7%. [124] Около 70% женщин с запущенной стадией заболевания реагируют на первоначальное лечение, большинство из которых достигают полной ремиссии, но у половины из этих женщин наблюдается рецидив через 1–4 года после лечения. [26] Метастазы в головной мозг чаще встречаются при раке III/IV стадии, но все же могут встречаться и при раке I/II стадии. Люди с метастазами в головной мозг выживают в среднем 8,2 месяца, хотя хирургическое вмешательство, химиотерапия и лучевая терапия всего мозга могут улучшить выживаемость. [31]
Выживаемость при раке яичников значительно варьируется в зависимости от подтипа. Дисгерминомы имеют очень благоприятный прогноз. На ранних стадиях пятилетняя выживаемость составляет 96,9%. [34] Около двух третей дисгермином диагностируются на стадии I. [33] Дисгерминомы стадии III имеют пятилетнюю выживаемость 61%; при лечении химиотерапией BEP после неполного хирургического удаления дисгерминомы имеют двухлетнюю выживаемость 95%. Злокачественные новообразования стромы полового канатика также имеют благоприятный прогноз; поскольку они растут медленно, даже те, у кого есть метастатическое заболевание, могут прожить десятилетие и более. [26] Опухоли с низким потенциалом злокачественности обычно имеют плохой прогноз только в том случае, если в брюшной полости обнаружены инвазивные опухолевые имплантаты. [29]
Осложнения рака яичников могут включать распространение рака на другие органы, прогрессирующую потерю функций различных органов, асцит и кишечную непроходимость, что может привести к летальному исходу. Кишечная непроходимость множественных локализаций является наиболее распространенной непосредственной причиной смерти. [28] Кишечная непроходимость при раке яичников может быть либо истинной непроходимостью, когда опухоль блокирует просвет кишечника , либо псевдообструкцией, когда опухоль препятствует нормальной перистальтике . [125] Непрерывное накопление асцита можно лечить путем установки дренажа, который может быть самодренируемым. [28]
Существует ряд прогностических факторов рака яичников. Положительные прогностические факторы, указывающие на лучшие шансы на выживание, включают отсутствие остаточной болезни после операции (стадия III/IV), полную макроскопическую резекцию (стадия IV), мутации BRCA2, молодой возраст (до 45 лет), несерозный тип, низкий гистологический класс, ранняя стадия, сочетание с раком эндометрия и низкие уровни CA-125. Существуют противоречивые данные о том, что BRCA1 является прогностическим фактором. И наоборот, отрицательные прогностические факторы – те, которые указывают на худшие шансы на выживание – включают разрыв капсулы яичника во время операции, пожилой возраст (старше 45 лет), муцинозный тип, IV стадия, высокий гистологический класс, светлоклеточный тип, поражение верхних отделов брюшной полости. , высокие уровни CA-125, наличие опухолевых клеток в крови и повышенная циклооксигеназа-2 . [31]
Экспрессия различных мРНК также может быть прогностической для рака яичников. Высокие уровни Drosha и Dicer связаны с улучшением выживаемости, тогда как высокие уровни let-7b, HIF1A , EphA1 и поли(ADP-рибозы)-полимеразы связаны с худшей выживаемостью. Рак, положительный на WT1, имеет худший прогноз; Рак, положительный по эстрогеновым рецепторам, имеет лучший прогноз. [31]
Общая пятилетняя выживаемость при всех типах рака яичников представлена ниже по стадиям и гистологическим классам: [26]
По данным Американского онкологического общества , приведенные ниже показатели выживаемости относятся к различным типам рака яичников . [122] Они взяты из Национального института рака (SEER) и основаны на пациентах, диагностированных в период с 2004 по 2010 год.
После лечения рак яичников часто рецидивирует. В целом за 5-летний период 20% случаев рака I и II стадии рецидивируют. Большинство рецидивов возникают в брюшной полости. [29] Если рецидив возникает на поздних стадиях заболевания, он обычно возникает в течение 18 месяцев после первоначального лечения (18-месячная выживаемость без прогрессирования ). Рецидивы можно лечить, но безрецидивный период имеет тенденцию к сокращению, а химиорезистентность увеличивается с каждым рецидивом. [28] Когда дисгерминома рецидивирует, она, скорее всего, повторится в течение года после постановки диагноза, а другие злокачественные опухоли зародышевых клеток рецидивируют в течение 2 лет в 90% случаев. Опухоли зародышевых клеток, кроме дисгерминомы, имеют плохой прогноз при рецидиве: долгосрочная выживаемость составляет 10%. [33] Опухоли с низким потенциалом злокачественности редко рецидивируют, даже если методом выбора является хирургическое вмешательство, сохраняющее фертильность. 15% опухолей LMP рецидивируют после одностороннего хирургического вмешательства на ранее непораженном яичнике, и они обычно легко поддаются хирургическому лечению. Рецидив более поздних опухолей может занять до 20 лет, если они вообще рецидивируют, и лечатся только хирургическим путем, если только опухоль не изменила свои гистологические характеристики или не выросла очень быстро. В этих случаях и при значительном асците также можно использовать химиотерапию. На рецидив обычно указывает повышение уровня CA-125, которое затем прогрессирует до симптоматического рецидива в течение 2–6 месяцев. [29] Рецидивирующие стромальные опухоли полового канатика обычно не поддаются лечению, но не агрессивны. [33]
Это самый смертоносный гинекологический рак. [29]
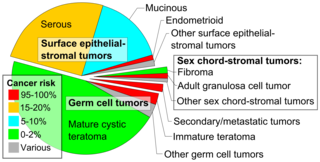
Во всем мире в 2018 году заболеваемость раком яичников составила 6,6 на 100 000, а смертность — 3,9. [128] Во всем мире от рака яичников в 2010 году умерло около 160 000 человек. Это больше, чем 113 000 в 1990 году. [129] Число новых случаев в год в Европе составляет примерно 5–15 на 100 000 женщин. [31] В Европе Литва , Латвия , Ирландия , Словакия и Чехия имеют самый высокий уровень заболеваемости раком яичников, тогда как Португалия и Кипр имеют самый низкий уровень заболеваемости. [31] В 2008 году пятилетняя выживаемость составила 44%. Этот показатель увеличился с 1977 года, когда выживаемость составляла 36%. [119]


По оценкам, в 2022 году в США от рака яичников было диагностировано 19 880 новых случаев и 12 810 женщин умерли. [131] Пятилетняя относительная выживаемость составляет 49,7%. [132] Около 57% случаев имели метастазы на момент постановки диагноза. [132]
В 2014 году ежегодно устанавливалось более 220 000 диагнозов эпителиального рака яичников. [28] Общий пожизненный риск в США составляет около 1,6% [26] [31] В США рак яичников поражает 1,3–1,4% и является причиной смерти около 1% женщин. [29] [133] В Соединенных Штатах это также пятый по распространенности вид рака у женщин и четвертая по распространенности причина смерти от рака. [31] Это снижение сделало его девятым по распространенности раком у женщин. [29]
Риски развития конкретных типов рака яичников различаются. Герминогенные опухоли и стромальные опухоли полового канатика встречаются реже, чем эпителиальные опухоли. Число новых случаев в год в США составляет 0,4 на 100 000 женщин и 0,2 на 100 000 женщин соответственно. У молодых людей стромальные опухоли полового канатика и опухоли зародышевых клеток составляют 1% от общего числа случаев рака яичников. [33] Рак яичников составляет примерно 4% случаев рака, диагностированных у женщин. [31]
Это 5-е место по распространенности рака среди женщин Великобритании (около 7100 случаев было диагностировано в 2011 году) и 5-е место по распространенности среди женщин среди причин смертности от рака (около 4300 человек умерли в 2012 году). [134] [31] [35] Уровень заболеваемости среди всего населения Великобритании составляет 21,6 на 100 000 человек.
По состоянию на 2014 год в Великобритании ежегодно становилось около 7 000–7 100 диагнозов и 4 200 случаев смерти. [28] [35] В статье The Times за 2022 год оценивается, что в Великобритании ежегодно регистрируется 7500 новых случаев. [135] Ранние симптомы часто ошибочно принимают за распространенные заболевания, такие как цистит или синдром раздраженного кишечника, и около 40 процентов британских женщин ошибочно полагают, что скрининг шейки матки выявляет рак яичников, что больше, чем 30 процентов в 2016 году. [135] Еврейки-ашкенази женщины являются носителями мутировавших аллелей BRCA в пять раз чаще, чем остальная часть населения, что повышает риск развития рака яичников. [28]
У чернокожих женщин риск развития стромальных опухолей полового канатика в два раза выше, чем у нечернокожих женщин. [33] Самая высокая распространенность наблюдается у женщин европеоидной и латиноамериканской расы, за ними следуют афроамериканки и азиатки. [128] Самая высокая смертность от рака яичников наблюдается у афроамериканок. [128]
В США уровень заболеваемости среди женщин старше 50 лет составляет примерно 33 на 100 000 человек. [136] Заболеваемость раком яичников в период с 1993 по 2008 год снизилась у женщин возрастной группы 40–49 лет и возрастной группы 50–64 лет. [28] Рак яичников чаще всего диагностируется после менопаузы, [35] в возрасте от 60 до 64 лет. Девяносто процентов рака яичников встречается у женщин старше 45 лет, а 80% — у женщин старше 50 лет. [31] Пожилые женщины более вероятно, что у них будет распространенный рак яичников. [20]
Злокачественные герминогенные опухоли — это тип рака яичников, который чаще всего возникает во время беременности . Обычно их диагностируют, когда при осмотре обнаруживают образование придатков (в 1–2% всех беременностей), опухоль обнаруживают на УЗИ или повышен уровень альфа-фетопротеина у родителя. Дермоидные кисты и дисгерминомы являются наиболее распространенными герминогенными опухолями во время беременности. Герминогенные опухоли, диагностированные во время беременности, вряд ли дадут метастазы и поддаются лечению хирургическим путем, а в некоторых случаях — химиотерапией, которая несет в себе риск врожденных дефектов. Опухоли желточного мешка и незрелые тератомы растут особенно быстро и обычно лечатся химиотерапией даже во время беременности; однако дисгерминомы, размеры которых были оптимально уменьшены, можно лечить после родов. [33]
Опухоли яичников были зарегистрированы у кобыл . Сообщаемые типы опухолей включают тератому, [137] [138] цистаденокарциному [139] и особенно гранулезоклеточную опухоль . [140] [141] [142] [143] [144] [ чрезмерное цитирование ]
Разрабатывается скрининг методом гистероскопии для получения образцов клеток для гистологического исследования. Это похоже на нынешний мазок Папаниколау, который используется для выявления рака шейки матки. [145] Совместное исследование скрининга рака яичников в Великобритании тестирует метод скрининга, который сочетает в себе анализы крови CA-125 и трансвагинальное ультразвуковое исследование. [28] Другие исследования показывают, что эта процедура скрининга может быть эффективной. [112] Хотя результаты, опубликованные в 2015 году, не были окончательными, были некоторые свидетельства того, что скрининг может спасти жизни в долгосрочной перспективе. [146] В результате исследование было продлено, и окончательные результаты будут опубликованы в конце 2019 года. Одной из основных проблем скрининга является отсутствие четкого прогрессирования заболевания от стадии I (неинвазивной) к стадии III (инвазивной), и может оказаться невозможным обнаружить рак до того, как он достигнет стадии III. Другая проблема заключается в том, что методы скрининга, как правило, выявляют слишком много подозрительных поражений, большинство из которых не являются раком, но злокачественность можно оценить только хирургическим путем. [28] Метод ROCA в сочетании с трансвагинальным УЗИ исследуется у женщин из группы высокого риска, чтобы определить, является ли он жизнеспособным методом скрининга. Его также исследуют на женщинах из группы нормального риска, поскольку он показал многообещающие результаты среди более широких слоев населения. [29] Также проводятся исследования, чтобы определить, помогает ли скрининг выявлять рак на более ранних стадиях у людей с мутациями BRCA. [112]
Также продолжаются исследования различных прогностических факторов рака яичников. Недавние исследования показывают, что тромбоцитоз предсказывает более низкую выживаемость и более высокую стадию рака. [28] Продолжающиеся исследования также изучают преимущества хирургического вмешательства при рецидиве рака яичников. [112]
Хотя это активная область исследований, по состоянию на 2018 год нет убедительных доказательств того, что иммунотерапия эффективна при раке яичников. [147] Однако испытания антитела и ингибитора VEGF бевацизумаба , который может замедлять рост новых кровеносных сосудов при раке, показали многообещающие результаты, особенно в сочетании с пазопанибом , который также замедляет процесс роста кровеносных сосудов. Бевацизумаб был особенно эффективен в предварительных исследованиях рака III и IV стадий [28] и, как сообщается, имел показатель ответа не менее 15%. [26] Его исследуют, в частности, при муцинозном раке яичников. [112]
Ингибиторы mTOR были широко исследованным потенциальным методом лечения в 2000-х и 2010-х годах, но побочные эффекты этих препаратов (особенно гипергликемия и гиперлипидемия ) плохо переносились, а польза для выживаемости не была подтверждена. Ингибиторы киназы PI3 представляют интерес, но они, как правило, высокотоксичны и вызывают диарею . Еще одним исследуемым препаратом является селуметиниб , ингибитор МАРК . Это улучшило выживаемость, но не коррелировало с какими-либо мутациями, обнаруженными в опухолях. [28]
Бевацизумаб также можно комбинировать с химиотерапией платиной, комбинация, которая имела положительные предварительные результаты в отношении ВБП, но сомнительные результаты в отношении общей выживаемости. Одним из недостатков этих методов лечения является профиль побочных эффектов, который включает высокое кровяное давление и протеинурию . Препарат также может усугубить заболевание кишечника, что приведет к образованию свищей или перфорации кишечника . Винтафолид , который состоит из антифолата , конъюгированного с винбластином , также проходит клинические испытания; это может оказаться полезным, поскольку рецепторы фолиевой кислоты сверхэкспрессируются при многих видах рака яичников. [28] Другой потенциальной иммунотерапией является трастузумаб , который активен против опухолей, позитивных по мутациям Her2/neu. [26] Другие ингибиторы ангиогенеза также исследуются в качестве потенциальных методов лечения рака яичников. Комбретастатин и пазопаниб исследуются в комбинации при рецидиве рака яичников. Требананиб и тасквинимод являются другими исследуемыми ингибиторами ангиогенеза. Моноклональное антитело фарлетузумаб исследуется в качестве адъюванта к традиционной химиотерапии. Другой тип иммунотерапии включает вакцины , в том числе TroVax . [112]
Альтернатива химиотерапии BEP, схема из 3 циклов карбоплатина и этопозида , является текущей темой исследований злокачественных опухолей зародышевых клеток. [33]
Внутрибрюшинная химиотерапия также исследовалась в 2000-х и 2010-х годах на предмет ее способности доставлять более высокие дозы цитотоксического агента к опухолям. Предварительные испытания цисплатина и паклитаксела показали, что он плохо переносится, но улучшает выживаемость, и в настоящее время исследуются более переносимые схемы лечения. [28] Цисплатин и паклитаксел исследуются в качестве средств внутрибрюшинной химиотерапии. Также изучается специфическая схема химиотерапии для редкого светлоклеточного рака: иринотекан в сочетании с цисплатином. [112]
Ингибиторы PARP также показали многообещающие результаты в ранних исследованиях, особенно у людей с мутациями гена BRCA , поскольку белок BRCA взаимодействует с путем PARP. Его также изучают при рецидиве рака яичников в целом, где предварительные исследования показали более длительную ВБП. В частности, олапариб показал большую выживаемость по сравнению с доксорубицином, хотя этот метод лечения все еще исследуется. Пока неясно, какие биомаркеры позволяют прогнозировать реакцию на ингибиторы PARP. [28] Рукапариб — еще один ингибитор PARP, исследуемый при BRCA-положительном и BRCA-негативном рецидивирующем распространенном раке яичников. Нирапариб — ингибитор PARP, который тестируется при BRCA-положительном рецидиве рака яичников. [112]
Ингибиторы тирозинкиназы — еще один исследуемый класс препаратов, который может найти применение при раке яичников. Было также показано , что ингибиторы ангиогенеза в группе ингибиторов рецепторной тирозинкиназы , включая пазопаниб , цедираниб и нинтеданиб , увеличивают выживаемость без прогрессирования (ВБП), но их польза для общей выживаемости по состоянию на 2015 год не изучалась. [28] Предварительные исследования показали, что цедираниб в сочетании с платинами при рецидиве рака яичников увеличивает время до второго рецидива на 3–4 месяца и увеличивает выживаемость на 3 месяца. [112] МК-1775 представляет собой ингибитор тирозинкиназы, который используется в сочетании с паклитакселом и карбоплатином при чувствительном к платине раке с мутациями р53. Нинтеданиб исследуется как потенциальная терапия в сочетании с циклофосфамидом для людей с рецидивами. [112]
Ингибиторы гистондеацетилазы (HDACi) являются еще одной областью исследований.
Гормональная терапия является темой текущих исследований рака яичников, в частности, ценности некоторых лекарств, используемых для лечения рака молочной железы. К ним относятся тамоксифен , летрозол и анастрозол . Предварительные исследования показали пользу тамоксифена у небольшого числа людей с распространенным раком яичников. Летрозол может помочь замедлить или остановить рост рака яичников, положительного по рецептору эстрогена . Анастрозол исследуется у людей в постменопаузе с раком, положительным по рецепторам эстрогена. [112]
Также продолжаются исследования по смягчению побочных эффектов лечения рака яичников. Радиационный фиброз, образование рубцовой ткани в области, обработанной радиацией, можно облегчить с помощью гипербарической кислородной терапии , но исследования в этой области еще не завершены. Лечение рака яичников может также вызвать у людей психические проблемы, включая депрессию . Продолжаются исследования, чтобы определить, как консультирование и психотерапия могут помочь людям, больным раком яичников, во время лечения. [112]
Есть некоторые признаки того, что воспалительные заболевания органов малого таза могут быть связаны с раком яичников, особенно в незападных странах. Это может быть связано с воспалительным процессом, присутствующим при воспалительном заболевании органов малого таза. [148]
Клинические испытания контролируются и финансируются правительственными организациями США для проверки вариантов лечения и проверки их безопасности и эффективности. К ним относятся NIH Clinical Research Trials and You ( Национальные институты здравоохранения ), [149] Learn About Clinical Trials ( Национальный институт рака ), [150] Поиск клинических испытаний (Национальный институт рака), [151] ClinicalTrials.gov (Национальные институты). здравоохранения). [152] [88] Клинические испытания также проводятся в Канаде. [153]
{{cite book}}: |work=игнорируется ( помощь ){{cite book}}: |work=игнорируется ( помощь ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: |work=игнорируется ( помощь )