Репарация ДНК представляет собой совокупность процессов, посредством которых клетка идентифицирует и исправляет повреждения молекул ДНК , кодирующих ее геном . [1] В клетках человека как нормальная метаболическая активность, так и факторы окружающей среды, такие как радиация , могут вызывать повреждение ДНК, что приводит к десяткам тысяч отдельных молекулярных повреждений на клетку в день. [2] Многие из этих повреждений вызывают структурное повреждение молекулы ДНК и могут изменить или устранить способность клетки транскрибировать ген , который кодирует затронутая ДНК. Другие повреждения вызывают потенциально вредные мутации в геноме клетки, которые влияют на выживание ее дочерних клеток после того, как она претерпевает митоз . Как следствие, процесс репарации ДНК постоянно активен, поскольку он реагирует на повреждение в структуре ДНК. Когда нормальные процессы репарации не работают и когда клеточный апоптоз не происходит, может произойти непоправимое повреждение ДНК. Это может в конечном итоге привести к злокачественным опухолям или раку в соответствии с гипотезой двух ударов .
Скорость восстановления ДНК зависит от различных факторов, включая тип клетки, возраст клетки и внеклеточную среду. Клетка, накопившая большое количество повреждений ДНК или больше не способная эффективно восстанавливать свою ДНК, может перейти в одно из трех возможных состояний:
Способность клетки к восстановлению ДНК жизненно важна для целостности ее генома и, следовательно, для нормальной функциональности этого организма. Многие гены, которые изначально были показаны как влияющие на продолжительность жизни, оказались вовлеченными в восстановление и защиту от повреждений ДНК. [3]
Нобелевская премия по химии 2015 года была присуждена Томасу Линдалю , Полу Модричу и Азизу Санкару за их работу над молекулярными механизмами процессов восстановления ДНК. [4] [5]
Повреждение ДНК, вызванное факторами окружающей среды и нормальными метаболическими процессами внутри клетки, происходит со скоростью от 10 000 до 1 000 000 молекулярных повреждений на клетку в день. [2] Хотя это составляет не более 0,0003125% от приблизительно 3,2 миллиарда оснований человеческого генома, неисправленные повреждения в критических генах (таких как гены-супрессоры опухолей ) могут препятствовать способности клетки выполнять свою функцию и значительно увеличивать вероятность образования опухолей , а также способствовать гетерогенности опухоли .
Подавляющее большинство повреждений ДНК затрагивает первичную структуру двойной спирали; то есть, сами основания химически модифицируются. Эти модификации, в свою очередь, могут нарушить регулярную спиральную структуру молекул, вводя неродные химические связи или объемные аддукты , которые не вписываются в стандартную двойную спираль. В отличие от белков и РНК , ДНК обычно не имеет третичной структуры , и поэтому повреждение или нарушение не происходит на этом уровне. ДНК, однако, сверхспирализована и намотана вокруг "упаковочных" белков, называемых гистонами (у эукариот), и обе суперструктуры уязвимы для последствий повреждения ДНК.
Повреждения ДНК можно разделить на два основных типа:
Репликация поврежденной ДНК перед делением клетки может привести к включению неправильных оснований напротив поврежденных. Дочерние клетки, которые наследуют эти неправильные основания, несут мутации, из-за которых исходная последовательность ДНК не может быть восстановлена (за исключением редкого случая обратной мутации , например, посредством генной конверсии ).
Существует несколько типов повреждений ДНК, вызванных эндогенными клеточными процессами:
Ущерб, наносимый экзогенными агентами, может иметь множество форм. Вот некоторые примеры:
Примерами индуцированных повреждений являются повреждения под воздействием УФ-излучения, алкилирования/метилирования, рентгеновского излучения и окислительного повреждения. Спонтанные повреждения могут включать потерю основания, дезаминирование, сморщивание сахарного кольца и таутомерный сдвиг. Конститутивное (спонтанное) повреждение ДНК, вызванное эндогенными окислителями, может быть обнаружено как низкий уровень фосфорилирования гистона H2AX в необработанных клетках. [9]
В клетках человека и эукариотических клетках в целом ДНК находится в двух клеточных местах — внутри ядра и внутри митохондрий . Ядерная ДНК (яДНК) существует в виде хроматина во время нерепликативных стадий клеточного цикла и конденсируется в агрегатные структуры, известные как хромосомы, во время деления клетки . В любом состоянии ДНК сильно уплотнена и намотана вокруг бусинкообразных белков, называемых гистонами . Всякий раз, когда клетке необходимо выразить генетическую информацию, закодированную в ее яДНК, требуемая хромосомная область распутывается, гены, расположенные в ней, экспрессируются, а затем область конденсируется обратно в свою конформацию покоя. Митохондриальная ДНК (мтДНК) находится внутри органелл митохондрий , существует в нескольких копиях, а также тесно связана с рядом белков, образуя комплекс, известный как нуклеоид. Внутри митохондрий активные формы кислорода (ROS) или свободные радикалы , побочные продукты постоянного производства аденозинтрифосфата (АТФ) посредством окислительного фосфорилирования , создают высокоокислительную среду, которая, как известно, повреждает мтДНК. Важнейшим ферментом в противодействии токсичности этих видов является супероксиддисмутаза , которая присутствует как в митохондриях, так и в цитоплазме эукариотических клеток.
Старение, необратимый процесс, при котором клетка больше не делится , является защитной реакцией на укорочение концов хромосом, называемых теломерами . Теломеры представляют собой длинные области повторяющейся некодирующей ДНК , которые покрывают хромосомы и подвергаются частичной деградации каждый раз, когда клетка подвергается делению (см. предел Хейфлика ). [10] Напротив, покой является обратимым состоянием клеточного покоя, которое не связано с повреждением генома (см. клеточный цикл ). Старение в клетках может служить функциональной альтернативой апоптозу в случаях, когда физическое присутствие клетки по пространственным причинам требуется организму, [11] что служит механизмом «последнего средства» для предотвращения ненадлежащей репликации клетки с поврежденной ДНК в отсутствие способствующей росту клеточной сигнализации . Нерегулируемое деление клеток может привести к образованию опухоли (см. рак ), которая потенциально смертельна для организма. Поэтому индукция старения и апоптоза считается частью стратегии защиты от рака. [12]
Важно различать повреждение ДНК и мутацию, два основных типа ошибок в ДНК. Повреждение ДНК и мутация принципиально различны. Повреждение приводит к физическим аномалиям в ДНК, таким как одно- и двухцепочечные разрывы, остатки 8-гидроксидезоксигуанозина и полициклические ароматические углеводородные аддукты. Повреждение ДНК может быть распознано ферментами и, таким образом, может быть правильно восстановлено, если избыточная информация, такая как неповрежденная последовательность в комплементарной цепи ДНК или в гомологичной хромосоме, доступна для копирования. Если клетка сохраняет повреждение ДНК, транскрипция гена может быть предотвращена, и, таким образом, трансляция в белок также будет заблокирована. Репликация также может быть заблокирована или клетка может умереть.
В отличие от повреждения ДНК, мутация — это изменение в последовательности оснований ДНК. Мутация не может быть распознана ферментами, если изменение основания присутствует в обеих цепях ДНК, и, таким образом, мутация не может быть исправлена. На клеточном уровне мутации могут вызывать изменения в функции и регуляции белка. Мутации реплицируются, когда клетка реплицируется. В популяции клеток частота мутантных клеток будет увеличиваться или уменьшаться в зависимости от влияния мутации на способность клетки выживать и размножаться.
Хотя повреждения ДНК и мутации существенно отличаются друг от друга, они связаны, поскольку повреждения ДНК часто вызывают ошибки синтеза ДНК во время репликации или восстановления; эти ошибки являются основным источником мутаций.
Учитывая эти свойства повреждения ДНК и мутации, можно увидеть, что повреждение ДНК является особой проблемой в неделящихся или медленно делящихся клетках, где неисправленные повреждения будут иметь тенденцию накапливаться с течением времени. С другой стороны, в быстро делящихся клетках неисправленные повреждения ДНК, которые не убивают клетку, блокируя репликацию, будут иметь тенденцию вызывать ошибки репликации и, таким образом, мутацию. Подавляющее большинство мутаций, которые не являются нейтральными по своему эффекту, пагубны для выживания клетки. Таким образом, в популяции клеток, составляющих ткань с реплицирующимися клетками, мутантные клетки будут иметь тенденцию теряться. Однако редкие мутации, которые обеспечивают преимущество в выживании, будут иметь тенденцию клонально расширяться за счет соседних клеток в ткани. Это преимущество для клетки невыгодно для всего организма, поскольку такие мутантные клетки могут вызывать рак. Таким образом, повреждение ДНК в часто делящихся клетках, поскольку оно приводит к мутациям, является важной причиной рака. Напротив, повреждение ДНК в редко делящихся клетках, вероятно, является важной причиной старения. [13]
Клетки не могут функционировать, если повреждение ДНК нарушает целостность и доступность существенной информации в геноме (но клетки остаются поверхностно функциональными, когда несущественные гены отсутствуют или повреждены). В зависимости от типа повреждения, нанесенного двойной спиральной структуре ДНК, для восстановления утраченной информации были разработаны различные стратегии восстановления. Если это возможно, клетки используют немодифицированную комплементарную цепь ДНК или сестринскую хроматиду в качестве шаблона для восстановления исходной информации. Без доступа к шаблону клетки используют подверженный ошибкам механизм восстановления, известный как синтез через повреждение, в качестве последнего средства.
Повреждение ДНК изменяет пространственную конфигурацию спирали, и такие изменения могут быть обнаружены клеткой. После локализации повреждения специфические молекулы восстановления ДНК связываются с местом повреждения или около него, побуждая другие молекулы связываться и образовывать комплекс, который позволяет осуществить фактическое восстановление.
Известно, что клетки устраняют три типа повреждений своей ДНК путем ее химического обращения. Эти механизмы не требуют шаблона, поскольку типы повреждений, которым они противодействуют, могут возникать только в одном из четырех оснований. Такие прямые механизмы обращения специфичны для типа нанесенного повреждения и не подразумевают разрыв фосфодиэфирного остова. Образование пиримидиновых димеров при облучении УФ-светом приводит к аномальной ковалентной связи между соседними пиримидиновыми основаниями. Процесс фотореактивации напрямую обращает это повреждение под действием фермента фотолиазы , активация которого обязательно зависит от энергии, поглощенной из синего/УФ-света ( длина волны 300–500 нм ), для содействия катализу. [14] Фотолиаза, старый фермент, присутствующий в бактериях , грибах и большинстве животных , больше не функционирует у людей, [15] которые вместо этого используют эксцизионный ремонт нуклеотидов для восстановления повреждений от УФ-облучения. Другой тип повреждения, метилирование оснований гуанина, напрямую устраняется ферментом метилгуанинметилтрансферазой (MGMT), бактериальный эквивалент которого называется ogt . Это дорогостоящий процесс, поскольку каждая молекула MGMT может быть использована только один раз; то есть реакция является стехиометрической, а не каталитической . [16] Обобщенный ответ на метилирующие агенты у бактерий известен как адаптивный ответ и обеспечивает уровень устойчивости к алкилирующим агентам при постоянном воздействии путем повышения регуляции ферментов репарации алкилирования. [17] Третий тип повреждения ДНК, устраняемого клетками, — это определенное метилирование оснований цитозина и аденина.

Когда только одна из двух нитей двойной спирали имеет дефект, другая нить может быть использована в качестве шаблона для руководства исправлением поврежденной нити. Для того чтобы восстановить повреждение одной из двух парных молекул ДНК, существует ряд механизмов эксцизионной репарации , которые удаляют поврежденный нуклеотид и заменяют его неповрежденным нуклеотидом, комплементарным тому, который находится в неповрежденной нити ДНК. [16]
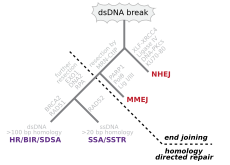
Двухцепочечные разрывы, при которых обе цепи в двойной спирали разрываются, особенно опасны для клетки, поскольку они могут привести к перестройкам генома . Фактически, когда двухцепочечный разрыв сопровождается поперечной сшивкой, соединяющей две цепи в одной и той же точке, ни одна из цепей не может быть использована в качестве шаблона для механизмов восстановления, так что клетка не сможет завершить митоз при следующем делении и либо умрет, либо, в редких случаях, подвергнется мутации. [22] [23] Существует три механизма восстановления двухцепочечных разрывов (DSB): негомологичное соединение концов (NHEJ), микрогомологичное соединение концов (MMEJ) и гомологичная рекомбинация (HR): [16] [24]

В системе in vitro MMEJ наблюдался в клетках млекопитающих на уровне 10–20% от HR, когда были доступны как механизмы HR, так и NHEJ. [32]
Экстремофил Deinococcus radiodurans обладает замечательной способностью выживать при повреждении ДНК ионизирующим излучением и другими источниками. По крайней мере две копии генома со случайными разрывами ДНК могут образовывать фрагменты ДНК посредством отжига . Частично перекрывающиеся фрагменты затем используются для синтеза гомологичных областей посредством движущейся D-петли , которая может продолжать расширение до тех пор, пока не будут найдены комплементарные партнерские нити. На последнем этапе происходит кроссинговер посредством RecA -зависимой гомологичной рекомбинации . [35]
Топоизомеразы вносят как одно-, так и двухцепочечные разрывы в ходе изменения состояния суперспирализации ДНК , что особенно распространено в областях вблизи открытой репликационной вилки. Такие разрывы не считаются повреждением ДНК, поскольку они являются естественным промежуточным продуктом в биохимическом механизме топоизомеразы и немедленно восстанавливаются ферментами, которые их создали.
Другой тип разрывов двухцепочечной ДНК происходит из термочувствительных или термолабильных участков ДНК. Эти участки ДНК не являются начальными DSB. Однако они преобразуются в DSB после обработки повышенной температурой. Ионизирующее облучение может вызывать очень сложную форму повреждения ДНК в виде кластерного повреждения. Оно состоит из различных типов повреждений ДНК в различных местах спирали ДНК. Некоторые из этих близко расположенных повреждений, вероятно, могут преобразовываться в DSB под воздействием высоких температур. Но точная природа этих повреждений и их взаимодействия пока не известны [36]
Синтез транслезионных повреждений (TLS) — это процесс устойчивости к повреждениям ДНК, который позволяет механизму репликации ДНК реплицировать прошлые повреждения ДНК, такие как тиминовые димеры или AP-сайты . [37] Он включает переключение обычных ДНК-полимераз на специализированные полимеразы транслезионных повреждений (т. е. ДНК-полимеразу IV или V из семейства Y-полимераз), часто с более крупными активными сайтами, которые могут способствовать вставке оснований напротив поврежденных нуклеотидов. Считается, что переключение полимеразы опосредовано, среди прочего, посттрансляционной модификацией фактора процессивности репликации PCNA . Полимеразы синтеза транслезионных повреждений часто имеют низкую точность (высокую склонность к вставке неправильных оснований) на неповрежденных матрицах по сравнению с обычными полимеразами. Однако многие из них чрезвычайно эффективны при вставке правильных оснований напротив определенных типов повреждений. Например, Pol η опосредует безошибочный обход повреждений, вызванных УФ-облучением , тогда как Pol ι вносит мутации в эти сайты. Известно, что Pol η добавляет первый аденин через фотодимер T^T с использованием спаривания оснований Уотсона-Крика , а второй аденин будет добавлен в его syn-конформации с использованием спаривания оснований Хугстина . С клеточной точки зрения риск введения точечных мутаций во время синтеза транслезии может быть предпочтительнее, чем прибегать к более радикальным механизмам репарации ДНК, которые могут вызвать грубые хромосомные аберрации или гибель клетки. Короче говоря, процесс включает специализированные полимеразы, которые либо обходят, либо восстанавливают повреждения в местах остановки репликации ДНК. Например, человеческая ДНК-полимераза eta может обходить сложные повреждения ДНК, такие как гуанин-тиминовая внутрицепочечная сшивка, G[8,5-Me]T, хотя она может вызывать целевые и полуцелевые мутации. [38] Паромита Рейчаудхури и Ашис Басу [39] изучали токсичность и мутагенез одного и того же поражения в Escherichia coli, реплицируя плазмиду, модифицированную G[8,5-Me]T, в E. coli со специфическими нокаутами ДНК-полимеразы. Жизнеспособность была очень низкой в штамме, лишенном pol II, pol IV и pol V, трех SOS-индуцируемых ДНК-полимераз, что указывает на то, что синтез транслезии осуществляется в основном этими специализированными ДНК-полимеразами. Обходная платформа предоставляется этим полимеразам пролиферирующим ядерным антигеном клеток (PCNA). При нормальных обстоятельствах PCNA, связанный с полимеразами, реплицирует ДНК. В месте поражения PCNA убиквитинируется или модифицируется белками RAD6 / RAD18 чтобы предоставить платформу для специализированных полимераз, чтобы обойти повреждение и возобновить репликацию ДНК. [40] [41] После синтеза транслезии требуется расширение. Это расширение может быть выполнено репликативной полимеразой, если TLS безошибочен, как в случае Pol η, но если TLS приводит к несоответствию, необходима специализированная полимераза для его расширения; Pol ζ . Pol ζ уникален тем, что может расширять терминальные несоответствия, тогда как более процессивные полимеразы не могут. Поэтому, когда встречается повреждение, репликативная вилка остановится, PCNA переключится с процессивной полимеразы на полимеразу TLS, такую как Pol ι, чтобы исправить повреждение, затем PCNA может переключиться на Pol ζ, чтобы расширить несоответствие, и последний PCNA переключится на процессивную полимеразу, чтобы продолжить репликацию.
Клетки, подвергшиеся воздействию ионизирующего излучения , ультрафиолетового света или химических веществ, склонны приобретать множественные участки объемных повреждений ДНК и двухцепочечных разрывов. Более того, агенты, повреждающие ДНК, могут повреждать другие биомолекулы , такие как белки , углеводы , липиды и РНК . Накопление повреждений, а именно двухцепочечных разрывов или аддуктов, останавливающих репликационные вилки , являются одними из известных сигналов стимуляции для глобального ответа на повреждение ДНК. [42] Глобальный ответ на повреждение - это действие, направленное на собственное сохранение клеток и запускающее множественные пути макромолекулярного восстановления, обхода повреждений, толерантности или апоптоза . Общими чертами глобального ответа являются индукция множественных генов , остановка клеточного цикла и ингибирование деления клеток .
Упаковка эукариотической ДНК в хроматин представляет собой барьер для всех основанных на ДНК процессов, которые требуют привлечения ферментов к их участкам действия. Чтобы обеспечить репарацию ДНК, хроматин должен быть ремоделирован . У эукариот зависимые от АТФ комплексы ремоделирования хроматина и гистон-модифицирующие ферменты являются двумя преобладающими факторами, используемыми для выполнения этого процесса ремоделирования. [43]
Релаксация хроматина происходит быстро в месте повреждения ДНК. [44] [45] На одном из самых ранних этапов стресс-активируемая протеинкиназа, c-Jun N-терминальная киназа (JNK) , фосфорилирует SIRT6 на серине 10 в ответ на двухцепочечные разрывы или другие повреждения ДНК. [46] Эта посттрансляционная модификация облегчает мобилизацию SIRT6 к местам повреждения ДНК и необходима для эффективного привлечения поли (АДФ-рибоза) полимеразы 1 (PARP1) к местам разрыва ДНК и для эффективного восстановления DSB. [46] Белок PARP1 начинает появляться в местах повреждения ДНК менее чем за секунду, с полумаксимальным накоплением в течение 1,6 секунды после возникновения повреждения. [47] PARP1 синтезирует полимерные аденозиндифосфатрибозы (поли (АДФ-рибоза) или PAR) цепи на себе. Затем ремоделер хроматина ALC1 быстро присоединяется к продукту действия PARP1, цепи поли-АДФ рибозы, и ALC1 завершает прибытие к повреждению ДНК в течение 10 секунд с момента возникновения повреждения. [45] Около половины максимальной релаксации хроматина, предположительно из-за действия ALC1, происходит в течение 10 секунд. [45] Затем это позволяет рекрутировать фермент репарации ДНК MRE11 , чтобы инициировать репарацию ДНК в течение 13 секунд. [47]
γH2AX, фосфорилированная форма H2AX, также участвует в ранних этапах, ведущих к деконденсации хроматина после двухцепочечных разрывов ДНК. Гистоновый вариант H2AX составляет около 10% гистонов H2A в хроматине человека. [48] γH2AX (H2AX, фосфорилированный по серину 139) можно обнаружить уже через 20 секунд после облучения клеток (с образованием двухцепочечного разрыва ДНК), а половина максимального накопления γH2AX происходит через одну минуту. [48] Степень хроматина с фосфорилированным γH2AX составляет около двух миллионов пар оснований в месте двухцепочечного разрыва ДНК. [48] Сам по себе γH2AX не вызывает деконденсации хроматина, но в течение 30 секунд после облучения можно обнаружить белок RNF8 в ассоциации с γH2AX. [49] RNF8 опосредует обширную деконденсацию хроматина посредством его последующего взаимодействия с CHD4 , [50] компонентом комплекса ремоделирования нуклеосом и деацетилазы NuRD .
DDB2 встречается в гетеродимерном комплексе с DDB1 . Этот комплекс далее образует комплексы с белком убиквитинлигазы CUL4A [51] и с PARP1 . [52] Этот более крупный комплекс быстро ассоциируется с повреждениями, вызванными УФ-излучением, в хроматине, при этом ассоциация на уровне половины максимума завершается за 40 секунд. [51] Белок PARP1, прикрепленный как к DDB1, так и к DDB2, затем PARylates (создает поли-АДФ рибозную цепь) на DDB2, который привлекает белок ремоделирования ДНК ALC1 . [52] Действие ALC1 расслабляет хроматин в месте повреждения ДНК УФ-излучением. Эта релаксация позволяет другим белкам в пути эксцизионной репарации нуклеотидов проникать в хроматин и восстанавливать повреждения димера циклобутана пиримидина, вызванные УФ-излучением .
После быстрого ремоделирования хроматина активируются контрольные точки клеточного цикла , чтобы обеспечить восстановление ДНК до того, как клеточный цикл начнется. Сначала активируются две киназы , ATM и ATR, в течение 5 или 6 минут после повреждения ДНК. За этим следует фосфорилирование белка контрольной точки клеточного цикла Chk1 , инициирующее его функцию, примерно через 10 минут после повреждения ДНК. [53]
После повреждения ДНК активируются контрольные точки клеточного цикла . Активация контрольной точки приостанавливает клеточный цикл и дает клетке время для восстановления повреждения перед продолжением деления. Контрольные точки повреждения ДНК возникают на границах G1 / S и G2 / M. Также существует контрольная точка внутри S. Активация контрольной точки контролируется двумя главными киназами , ATM и ATR . ATM реагирует на двухцепочечные разрывы ДНК и нарушения в структуре хроматина, [54] тогда как ATR в первую очередь реагирует на остановившиеся репликационные вилки . Эти киназы фосфорилируют нисходящие мишени в каскаде передачи сигнала , в конечном итоге приводя к остановке клеточного цикла. Также был идентифицирован класс белков-медиаторов контрольной точки, включая BRCA1 , MDC1 и 53BP1 . [55] Эти белки, по-видимому, необходимы для передачи сигнала активации контрольной точки нижестоящим белкам.
Контрольная точка повреждения ДНК — это путь передачи сигнала , который блокирует прогрессирование клеточного цикла в фазах G1, G2 и метафазе и замедляет скорость прогрессирования фазы S при повреждении ДНК . Это приводит к паузе в клеточном цикле, давая клетке время для восстановления повреждения перед продолжением деления.
Белки контрольных точек можно разделить на четыре группы: протеинкиназа, подобная фосфатидилинозитол-3-киназе (PI3K) , группа, подобная ядерному антигену пролиферирующих клеток (PCNA), две сериновые/треониновые (S/T) киназы и их адаптеры. Центральными для всех реакций контрольных точек, вызванных повреждением ДНК, являются пара крупных протеинкиназ, принадлежащих к первой группе протеинкиназ, подобных PI3K, — киназы ATM ( мутировавшая Ataxia telangiectasia ) и ATR (Ataxia- и Rad-related), последовательность и функции которых хорошо сохранились в ходе эволюции. Для любого ответа на повреждение ДНК требуются либо ATM, либо ATR, поскольку они обладают способностью связываться с хромосомами в месте повреждения ДНК, вместе со вспомогательными белками, которые являются платформами, на которых могут собираться компоненты ответа на повреждение ДНК и комплексы восстановления ДНК.
Важной нисходящей целью ATM и ATR является p53 , поскольку он необходим для индукции апоптоза после повреждения ДНК. [56] Ингибитор циклинзависимой киназы p21 индуцируется как p53-зависимыми, так и p53-независимыми механизмами и может останавливать клеточный цикл в контрольных точках G1/S и G2/M путем дезактивации комплексов циклин / циклинзависимая киназа . [57]
SOS -ответ — это изменения в экспрессии генов в Escherichia coli и других бактериях в ответ на обширное повреждение ДНК. Прокариотическая система SOS регулируется двумя ключевыми белками: LexA и RecA . Гомодимер LexA — это транскрипционный репрессор , который связывается с последовательностями операторов, обычно называемыми SOS-боксами. Известно, что в Escherichia coli LexA регулирует транскрипцию приблизительно 48 генов, включая гены lexA и recA. [58] Известно, что SOS-ответ широко распространен в домене бактерий, но в основном отсутствует в некоторых бактериальных типах, таких как спирохеты . [59] Наиболее распространенными клеточными сигналами, активирующими SOS-ответ, являются области одноцепочечной ДНК (ssDNA), возникающие из-за остановившихся репликационных вилок или двухцепочечных разрывов, которые обрабатываются ДНК-хеликазой для разделения двух цепей ДНК. [42] На этапе инициации белок RecA связывается с одноцепочечной ДНК в реакции гидролиза АТФ , создавая филаменты RecA–одноцепочечной ДНК. Филаменты RecA–одноцепочечной ДНК активируют активность аутопротеазы LexA , что в конечном итоге приводит к расщеплению димера LexA и последующей деградации LexA. Потеря репрессора LexA индуцирует транскрипцию генов SOS и позволяет осуществить дальнейшую индукцию сигнала, ингибирование деления клеток и повышение уровней белков, ответственных за обработку повреждений.
В Escherichia coli SOS-боксы представляют собой последовательности длиной 20 нуклеотидов вблизи промоторов с палиндромной структурой и высокой степенью консервации последовательности. В других классах и типах последовательность SOS-боксов значительно варьируется, имеет разную длину и состав, но она всегда высококонсервативна и является одним из самых сильных коротких сигналов в геноме. [59] Высокое информационное содержание SOS-боксов позволяет дифференциально связывать LexA с различными промоторами и позволяет определять время ответа SOS. Гены восстановления повреждений индуцируются в начале ответа SOS. Подверженные ошибкам полимеразы транслезии, например, UmuCD'2 (также называемая ДНК-полимеразой V), индуцируются позже в качестве крайней меры. [60] После того, как повреждение ДНК устранено или обойдено с помощью полимераз или посредством рекомбинации, количество одноцепочечной ДНК в клетках уменьшается, а уменьшение количества нитей RecA снижает активность расщепления гомодимера LexA, который затем связывается с SOS-боксами вблизи промоторов и восстанавливает нормальную экспрессию генов.
Эукариотические клетки, подвергшиеся воздействию агентов, повреждающих ДНК, также активируют важные защитные пути, индуцируя множественные белки, участвующие в восстановлении ДНК, контроле контрольных точек клеточного цикла , транспортировке белков и деградации. Такой транскрипционный ответ генома очень сложен и жестко регулируется, что позволяет скоординировать глобальный ответ на повреждение. Воздействие агентов, повреждающих ДНК, на дрожжи Saccharomyces cerevisiae приводит к перекрывающимся, но различным транскрипционным профилям. Сходство с реакцией на экологический шок указывает на то, что общий глобальный путь ответа на стресс существует на уровне транскрипционной активации. Напротив, различные типы человеческих клеток реагируют на повреждение по-разному, что указывает на отсутствие общего глобального ответа. Вероятное объяснение этого различия между дрожжевыми и человеческими клетками может заключаться в гетерогенности клеток млекопитающих . У животного различные типы клеток распределены по разным органам, которые развили различную чувствительность к повреждению ДНК. [61]
В целом глобальный ответ на повреждение ДНК включает экспрессию нескольких генов, ответственных за пострепликационную репарацию , гомологичную рекомбинацию, репарацию нуклеотидов, контрольную точку повреждения ДНК , глобальную транскрипционную активацию, гены, контролирующие распад мРНК, и многие другие. Большое количество повреждений клетки ставит ее перед важным решением: подвергнуться апоптозу и умереть или выжить ценой жизни с измененным геномом. Увеличение толерантности к повреждениям может привести к повышению уровня выживания, что позволит большему накоплению мутаций. Дрожжи Rev1 и человеческая полимераза η являются членами семейства Y- полимераз транслезионной ДНК , присутствующих во время глобального ответа на повреждение ДНК, и отвечают за усиленный мутагенез во время глобального ответа на повреждение ДНК у эукариот. [42]

Экспериментальные животные с генетическими недостатками в репарации ДНК часто демонстрируют сокращение продолжительности жизни и увеличение заболеваемости раком. [13] Например, мыши с дефицитом доминирующего пути NHEJ и механизмов поддержания теломер чаще заболевают лимфомой и инфекциями и, как следствие, имеют более короткую продолжительность жизни, чем мыши дикого типа. [62] Аналогичным образом, мыши с дефицитом ключевого белка репарации и транскрипции, который раскручивает спирали ДНК, имеют преждевременное начало заболеваний, связанных со старением, и последующее сокращение продолжительности жизни. [63] Однако не каждый дефицит репарации ДНК создает именно те предсказанные эффекты; мыши с дефицитом пути NER показали сокращение продолжительности жизни без соответственно более высоких показателей мутаций. [64]
Максимальная продолжительность жизни мышей , голых землекопов и людей составляет соответственно ~3, ~30 и ~129 лет. [65] Из них, самый короткоживущий вид, мышь, экспрессирует гены репарации ДНК, включая основные гены в нескольких путях репарации ДНК, на более низком уровне, чем у людей и голых землекопов. [ 65] Кроме того, несколько путей репарации ДНК у людей и голых землекопов активизируются по сравнению с мышами. Эти наблюдения показывают, что повышенная репарация ДНК способствует большей продолжительности жизни . [65]
Если скорость повреждения ДНК превышает способность клетки восстанавливать ее, накопление ошибок может подавить клетку и привести к раннему старению, апоптозу или раку. Наследственные заболевания, связанные с неисправным функционированием репарации ДНК, приводят к преждевременному старению [13] , повышенной чувствительности к канцерогенам и, соответственно, повышенному риску рака (см. ниже). С другой стороны, организмы с улучшенными системами репарации ДНК, такие как Deinococcus radiodurans , наиболее устойчивый к радиации известный организм, проявляют замечательную устойчивость к двухцепочечным разрывам, вызываемым радиоактивностью , вероятно, из-за повышенной эффективности репарации ДНК и особенно NHEJ. [66]
Было выявлено несколько отдельных генов, влияющих на вариации продолжительности жизни в популяции организмов. Эффекты этих генов сильно зависят от окружающей среды, в частности, от рациона организма. Ограничение калорийности воспроизводимо приводит к увеличению продолжительности жизни у различных организмов, вероятно, через пути восприятия питательных веществ и снижение скорости метаболизма . Молекулярные механизмы, посредством которых такое ограничение приводит к увеличению продолжительности жизни, пока неясны (см. [67] для некоторого обсуждения); однако поведение многих генов, которые, как известно, участвуют в восстановлении ДНК, изменяется в условиях ограничения калорийности. Было показано, что несколько агентов, которые, как сообщается, обладают свойствами против старения, ослабляют конститутивный уровень сигнализации mTOR , что свидетельствует о снижении метаболической активности , и одновременно снижают конститутивный уровень повреждения ДНК , вызванного эндогенно генерируемыми активными формами кислорода. [68]
Например, увеличение дозы гена SIR-2, который регулирует упаковку ДНК у нематодного червя Caenorhabditis elegans , может значительно увеличить продолжительность жизни. [69] Известно, что гомолог SIR-2 у млекопитающих индуцирует факторы репарации ДНК, участвующие в NHEJ, активности, которая особенно усиливается в условиях ограничения калорийности. [70] Ограничение калорийности тесно связано со скоростью репарации оснований в ядерной ДНК грызунов, [71] хотя подобные эффекты не наблюдались в митохондриальной ДНК. [72]
Ген AGE-1 C. elegans , эффектор путей восстановления ДНК, значительно увеличивает продолжительность жизни в условиях свободного питания, но приводит к снижению репродуктивной способности в условиях ограничения калорийности. [73] Это наблюдение подтверждает теорию плейотропии биологического происхождения старения , которая предполагает, что гены, дающие большое преимущество в выживании в раннем возрасте, будут отобраны, даже если они несут соответствующий недостаток в позднем возрасте.
Дефекты механизма NER являются причиной ряда генетических заболеваний, в том числе:
Последние два расстройства часто сопровождаются умственной отсталостью, что свидетельствует о повышенной уязвимости нейронов развития.
Другие нарушения репарации ДНК включают:
Все вышеперечисленные заболевания часто называют «сегментарными прогериями » (« болезнями ускоренного старения »), поскольку больные выглядят пожилыми и страдают от болезней, связанных со старением, в необычно молодом возрасте, при этом не проявляя всех симптомов старости.
Другие заболевания, связанные с пониженной функцией восстановления ДНК, включают анемию Фанкони , наследственный рак молочной железы и наследственный рак толстой кишки .
Из-за присущих механизмов репарации ДНК ограничений, если бы люди жили достаточно долго, у всех них в конечном итоге развился бы рак. [74] [75] Существует по крайней мере 34 унаследованных мутации генов репарации ДНК человека, которые увеличивают риск рака . Многие из этих мутаций приводят к тому, что репарация ДНК становится менее эффективной, чем обычно. В частности, наследственный неполипозный колоректальный рак (HNPCC) тесно связан со специфическими мутациями в пути репарации несоответствий ДНК. BRCA1 и BRCA2 , два важных гена, мутации которых значительно повышают риск рака молочной железы у носителей, [76] оба связаны с большим количеством путей репарации ДНК, особенно с NHEJ и гомологичной рекомбинацией.
Процедуры терапии рака, такие как химиотерапия и радиотерапия, работают, подавляя способность клетки восстанавливать повреждения ДНК, что приводит к гибели клетки. Клетки, которые делятся наиболее быстро — чаще всего раковые клетки — преимущественно поражаются. Побочным эффектом является то, что другие нераковые, но быстро делящиеся клетки, такие как клетки-предшественники в кишечнике, коже и кроветворной системе, также поражаются. Современные методы лечения рака пытаются локализовать повреждение ДНК в клетках и тканях, связанных только с раком, либо физическими средствами (концентрируя терапевтическое средство в области опухоли), либо биохимическими средствами (используя особенность, уникальную для раковых клеток в организме). В контексте терапии, нацеленной на гены ответа на повреждение ДНК, последний подход был назван «синтетической летальностью». [77]
Возможно, самым известным из этих «синтетических летальных» препаратов является ингибитор поли(АДФ-рибоза) полимеразы 1 ( PARP1 ) олапариб , который был одобрен Управлением по контролю за продуктами и лекарствами в 2015 году для лечения женщин с раком яичников, дефектным по гену BRCA. Опухолевые клетки с частичной потерей ответа на повреждение ДНК (в частности, репарация гомологичной рекомбинации ) зависят от другого механизма — репарации одноцепочечных разрывов, который представляет собой механизм, состоящий, частично, из продукта гена PARP1. [78] Олапариб сочетается с химиотерапевтическими средствами для ингибирования репарации одноцепочечных разрывов, вызванных повреждением ДНК, вызванным совместно вводимой химиотерапией. Опухолевые клетки, полагающиеся на этот остаточный механизм репарации ДНК, не способны восстанавливать повреждения и, следовательно, не способны выживать и размножаться, тогда как нормальные клетки могут восстанавливать повреждения с помощью функционирующего механизма гомологичной рекомбинации.
В настоящее время изучаются многие другие препараты для использования против других остаточных механизмов восстановления ДНК, которые обычно встречаются при раке. Однако синтетические летальные терапевтические подходы были поставлены под сомнение из-за появляющихся доказательств приобретенной резистентности, достигнутой посредством перестройки путей ответа на повреждение ДНК и реверсии ранее подавленных дефектов. [79]
За последние несколько лет стало очевидно, что реакция на повреждение ДНК действует как барьер для злокачественной трансформации пренеопластических клеток. [80] Предыдущие исследования показали повышенную реакцию на повреждение ДНК в моделях клеточной культуры с активацией онкогенов [81] и пренеопластическими аденомами толстой кишки. [82] Механизмы реакции на повреждение ДНК запускают остановку клеточного цикла и пытаются восстановить повреждения ДНК или способствовать гибели/старению клеток, если восстановление невозможно. Стресс репликации наблюдается в пренеопластических клетках из-за повышенных сигналов пролиферации от онкогенных мутаций. Стресс репликации характеризуется : повышенным инициированием репликации/возбуждением; повышенной транскрипцией и столкновениями комплексов транскрипции-репликации; дефицитом нуклеотидов; увеличением активных форм кислорода (ROS). [83]
Стресс репликации, наряду с выбором для инактивирующих мутаций в генах ответа на повреждение ДНК в эволюции опухоли, [84] приводит к снижению регуляции и/или потере некоторых механизмов ответа на повреждение ДНК и, следовательно, потере восстановления ДНК и/или старения/запрограммированной гибели клеток. В экспериментальных моделях мышей потеря старения клеток, опосредованного ответом на повреждение ДНК, наблюдалась после использования короткой шпилечной РНК (shRNA) для ингибирования реакции на двухцепочечный разрыв киназы атаксии телеангиэктазии ( ATM ), что приводит к увеличению размера опухоли и инвазивности. [82] Люди, рожденные с наследственными дефектами механизмов восстановления ДНК (например, синдром Ли-Фраумени ), имеют более высокий риск рака. [85]
Распространенность мутаций ответа на повреждение ДНК различается в зависимости от типа рака; например, 30% инвазивных карцином молочной железы имеют мутации в генах, участвующих в гомологичной рекомбинации. [80] При раке наблюдается снижение регуляции во всех механизмах ответа на повреждение ДНК (репарация эксцизии оснований (BER), репарация эксцизии нуклеотидов (NER), репарация несоответствия ДНК (MMR), репарация гомологичной рекомбинации (HR), негомологичное соединение концов (NHEJ) и синтез ДНК через повреждения (TLS). [86] Помимо мутаций в генах репарации повреждений ДНК, мутации также возникают в генах, ответственных за остановку клеточного цикла , чтобы дать достаточно времени для восстановления ДНК, а некоторые гены участвуют как в восстановлении повреждений ДНК, так и в контроле контрольных точек клеточного цикла, например, ATM и киназа контрольной точки 2 (CHEK2) — супрессор опухоли, который часто отсутствует или подавлен при немелкоклеточном раке легких. [87]
Классически рак рассматривался как набор заболеваний, вызванных прогрессирующими генетическими аномалиями, включающими мутации в генах-супрессорах опухолей и онкогенах, а также хромосомные аберрации. Однако стало очевидно, что рак также вызван эпигенетическими изменениями . [88]
Эпигенетические изменения относятся к функционально значимым модификациям генома, которые не подразумевают изменения в последовательности нуклеотидов. Примерами таких модификаций являются изменения в метилировании ДНК (гиперметилирование и гипометилирование) и модификации гистонов , [89] изменения в хромосомной архитектуре (вызванные ненадлежащей экспрессией белков, таких как HMGA2 или HMGA1 ) [90] и изменения, вызванные микроРНК . Каждое из этих эпигенетических изменений служит для регулирования экспрессии генов без изменения базовой последовательности ДНК . Эти изменения обычно сохраняются в ходе деления клеток , длятся в течение нескольких поколений клеток и могут считаться эпимутациями (эквивалентными мутациям).
Хотя большое количество эпигенетических изменений обнаружено при раке, эпигенетические изменения в генах репарации ДНК, вызывающие снижение экспрессии белков репарации ДНК, кажутся особенно важными. Считается, что такие изменения происходят на ранних стадиях развития рака и являются вероятной причиной генетической нестабильности , характерной для рака. [91] [92] [93]
Сниженная экспрессия генов репарации ДНК вызывает недостаточную репарацию ДНК. Когда репарация ДНК недостаточна, повреждения ДНК остаются в клетках на более высоком, чем обычно, уровне, и эти избыточные повреждения вызывают повышенную частоту мутаций или эпимутаций. Скорость мутаций существенно увеличивается в клетках, дефектных в репарации несоответствий ДНК [94] [95] или в гомологичной рекомбинационной репарации (HRR). [96] Хромосомные перестройки и анеуплоидия также увеличиваются в клетках с дефектом HRR. [97]
Более высокие уровни повреждения ДНК не только вызывают повышенную мутацию, но и вызывают повышенную эпимутацию. Во время восстановления двуцепочечных разрывов ДНК или восстановления других повреждений ДНК не полностью очищенные участки восстановления могут вызывать эпигенетическое подавление генов. [98] [99]
Недостаточная экспрессия белков репарации ДНК из-за наследственной мутации может привести к повышенному риску рака. Люди с наследственным нарушением в любом из 34 генов репарации ДНК (см. статью Расстройство дефицита репарации ДНК ) имеют повышенный риск рака, при этом некоторые дефекты вызывают до 100% вероятности рака в течение жизни (например, мутации p53). [100] Однако такие мутации зародышевой линии (которые вызывают синдромы высокопенетрантного рака) являются причиной лишь около 1 процента случаев рака. [101]

Дефицит ферментов репарации ДНК иногда вызывается вновь возникающей соматической мутацией в гене репарации ДНК, но гораздо чаще они вызваны эпигенетическими изменениями, которые снижают или подавляют экспрессию генов репарации ДНК. Например, когда 113 случаев колоректального рака были исследованы последовательно, только четыре имели миссенс-мутацию в гене репарации ДНК MGMT , в то время как большинство имели сниженную экспрессию MGMT из-за метилирования промоутерной области MGMT (эпигенетическое изменение). [102] Пять различных исследований показали, что от 40% до 90% случаев колоректального рака имеют сниженную экспрессию MGMT из-за метилирования промоутерной области MGMT. [103] [104] [105] [106] [107]
Аналогично, из 119 случаев колоректального рака с дефицитом репарации несоответствий, в которых отсутствовала экспрессия гена репарации ДНК PMS2 , дефицит PMS2 наблюдался в 6 случаях из-за мутаций в гене PMS2, тогда как в 103 случаях экспрессия PMS2 была дефицитной, поскольку его партнер по спариванию MLH1 был подавлен из-за метилирования промотора (белок PMS2 нестабилен при отсутствии MLH1). [108] В других 10 случаях потеря экспрессии PMS2, вероятно, была вызвана эпигенетической сверхэкспрессией микроРНК , miR -155 , которая подавляет MLH1. [109]
В другом примере эпигенетические дефекты были обнаружены при различных видах рака (например, молочной железы, яичников, колоректального рака, рака головы и шеи). Два или три недостатка в экспрессии ERCC1 , XPF или PMS2 возникают одновременно в большинстве из 49 видов рака толстой кишки, оцененных Facista et al. [110]
На диаграмме в этом разделе показаны некоторые часто встречающиеся агенты, повреждающие ДНК, примеры повреждений ДНК, которые они вызывают, и пути, которые справляются с этими повреждениями ДНК. По крайней мере 169 ферментов либо напрямую задействованы в восстановлении ДНК, либо влияют на процессы восстановления ДНК. [111] Из них 83 напрямую задействованы в восстановлении 5 типов повреждений ДНК, показанных на диаграмме. [ требуется ссылка ]
Некоторые из наиболее хорошо изученных генов, центральных для этих процессов восстановления, показаны на диаграмме. Обозначения генов, показанные красным, серым или голубым цветом, указывают на гены, часто эпигенетически измененные при различных типах рака. Статьи Википедии по каждому из генов, выделенных красным, серым или голубым цветом, описывают эпигенетические изменения и рак(и), при которых эти эпимутации обнаружены. Обзорные статьи [112] и статьи широкого экспериментального обзора [113] [114] также документируют большинство этих эпигенетических дефектов репарации ДНК при раке.
Выделенные красным гены часто сокращаются или подавляются эпигенетическими механизмами при различных видах рака. Когда эти гены имеют низкую или отсутствующую экспрессию, повреждения ДНК могут накапливаться. Ошибки репликации за пределами этих повреждений (см. синтез транслезии) могут привести к увеличению мутаций и, в конечном итоге, к раку. Эпигенетическая репрессия генов репарации ДНК в точных путях репарации ДНК, по-видимому, играет центральную роль в канцерогенезе .
Два выделенных серым гена RAD51 и BRCA2 необходимы для гомологичной рекомбинационной репарации. Иногда они эпигенетически сверхэкспрессированы, а иногда недостаточно экспрессированы при определенных видах рака. Как указано в статьях Википедии о RAD51 и BRCA2 , такие виды рака обычно имеют эпигенетические дефициты в других генах репарации ДНК. Эти дефициты репарации, вероятно, приведут к увеличению нерепарированных повреждений ДНК. Сверхэкспрессия RAD51 и BRCA2, наблюдаемая при этих видах рака, может отражать селективное давление для компенсаторной сверхэкспрессии RAD51 или BRCA2 и увеличенной гомологичной рекомбинационной репарации, чтобы хотя бы частично справиться с такими избыточными повреждениями ДНК. В тех случаях, когда RAD51 или BRCA2 недостаточно экспрессированы, это само по себе приведет к увеличению нерепарированных повреждений ДНК. Ошибки репликации, выходящие за рамки этих повреждений (см. синтез через повреждение), могут привести к увеличению числа мутаций и рака, поэтому недостаточная экспрессия RAD51 или BRCA2 сама по себе может быть канцерогенной.
Гены, выделенные цианом, находятся в пути микрогомологически-опосредованного соединения концов (MMEJ) и активируются при раке. MMEJ — это дополнительный подверженный ошибкам неточный путь репарации для двухцепочечных разрывов. При репарации двухцепочечного разрыва MMEJ гомологии 5–25 комплементарных пар оснований между обеими парными цепями достаточно для выравнивания цепей, но обычно присутствуют несовпадающие концы (лоскуты). MMEJ удаляет дополнительные нуклеотиды (лоскуты) в местах соединения цепей, а затем лигирует цепи для создания неповрежденной двойной спирали ДНК. MMEJ почти всегда включает по крайней мере небольшую делецию, так что это мутагенный путь. [24] FEN1 , эндонуклеаза лоскута в MMEJ, эпигенетически увеличивается за счет гипометилирования промотора и сверхэкспрессируется в большинстве видов рака молочной железы, [115] простаты, [116] желудка, [117] [118] нейробластом, [119] поджелудочной железы, [120] и легких. [121] PARP1 также сверхэкспрессируется, когда его участок промотора ETS эпигенетически гипометилирован , и это способствует прогрессированию рака эндометрия [122] и серозного рака яичников с мутацией BRCA. [123] Другие гены в пути MMEJ также сверхэкспрессируются в ряде видов рака (см. резюме в MMEJ ) и также показаны голубым цветом.
Дифференциальная активность путей репарации ДНК в различных регионах человеческого генома приводит к тому, что мутации очень неравномерно распределены в геномах опухолей. [124] [125] В частности, богатые генами, рано реплицирующиеся регионы человеческого генома демонстрируют более низкие частоты мутаций, чем бедный генами, поздно реплицирующийся гетерохроматин . Один из механизмов, лежащих в основе этого, включает модификацию гистонов H3K36me3 , которая может привлекать белки репарации несоответствий , [126] тем самым снижая частоту мутаций в регионах, отмеченных H3K36me3 . [127] Другой важный механизм касается эксцизионной репарации нуклеотидов , которая может привлекаться транскрипционным аппаратом, снижая частоту соматических мутаций в активных генах [125] и других открытых регионах хроматина. [128]
Повреждение ДНК очень распространено и постоянно восстанавливается. Эпигенетические изменения могут сопровождать восстановление ДНК после окислительного повреждения или двухцепочечных разрывов. В клетках человека окислительное повреждение ДНК происходит примерно 10 000 раз в день, а двухцепочечные разрывы ДНК происходят примерно от 10 до 50 раз за клеточный цикл в соматических реплицирующихся клетках (см. Повреждение ДНК (естественное) ). Избирательное преимущество восстановления ДНК заключается в том, что клетка может выжить, несмотря на повреждение ДНК. Избирательное преимущество эпигенетических изменений, которые происходят при восстановлении ДНК, не ясно. [ необходима цитата ]
В устойчивом состоянии (при возникновении и восстановлении эндогенных повреждений) в ДНК средней клетки млекопитающего имеется около 2400 окислительно поврежденных гуанинов, которые образуют 8-оксо-2'-дезоксигуанозин (8-OHdG). [129] 8-OHdG составляет около 5% окислительных повреждений, обычно присутствующих в ДНК. [130] Окисленные гуанины не встречаются случайным образом среди всех гуанинов в ДНК. Существует предпочтение последовательности для гуанина в метилированном сайте CpG (цитозин, за которым следует гуанин вдоль его направления 5' → 3' , и где цитозин метилирован (5-mCpG)). [131] Сайт 5-mCpG имеет самый низкий потенциал ионизации для окисления гуанина.

Окисленный гуанин имеет потенциал для неправильного спаривания и является мутагенным. [133] Оксогуанингликозилаза (OGG1) является основным ферментом, ответственным за удаление окисленного гуанина во время репарации ДНК. OGG1 находит и связывается с 8-OHdG в течение нескольких секунд. [134] Однако OGG1 не сразу удаляет 8-OHdG. В клетках HeLa полумаксимальное удаление 8-OHdG происходит за 30 минут, [135] а у облученных мышей 8-OHdG, индуцированные в печени мыши, удаляются с периодом полураспада 11 минут. [130]
Когда OGG1 присутствует в окисленном гуанине в метилированном сайте CpG, он привлекает TET1 к поражению 8-OHdG (см. рисунок). Это позволяет TET1 деметилировать соседний метилированный цитозин. [136] Деметилирование цитозина является эпигенетическим изменением. [137]
Например, когда эпителиальные клетки молочной железы человека обрабатывались H 2 O 2 в течение шести часов, 8-OHdG увеличился примерно в 3,5 раза в ДНК, и это вызвало около 80% деметилирования 5-метилцитозинов в геноме. [132] Деметилирование CpG в промоторе гена активностью фермента TET увеличивает транскрипцию гена в информационную РНК. [138] В клетках, обработанных H 2 O 2 , был исследован один конкретный ген, BACE1 . [132] Уровень метилирования острова CpG BACE1 был снижен (эпигенетическое изменение), и это позволило примерно в 6,5 раза увеличить экспрессию информационной РНК BACE1 . [ необходима цитата ]
В то время как шестичасовая инкубация с H 2 O 2 вызывает значительное деметилирование участков 5-mCpG, более короткое время инкубации с H 2 O 2 , по-видимому, способствует другим эпигенетическим изменениям. Обработка клеток H 2 O 2 в течение 30 минут заставляет гетеродимер белка репарации несоответствий MSH2-MSH6 привлекать ДНК-метилтрансферазу 1 (DNMT1) к участкам некоторых видов окислительного повреждения ДНК. [139] Это может вызвать повышенное метилирование цитозинов (эпигенетические изменения) в этих местах.
Цзян и др. [140] обработали клетки HEK 293 агентами, вызывающими окислительное повреждение ДНК ( бромат калия (KBrO3) или хромат калия (K2CrO4)). Репарация окислительного повреждения путем удаления оснований (BER) происходила с помощью фермента репарации ДНК полимеразы бета, локализующегося в окисленных гуанинах. Полимераза бета является основной полимеразой человека в короткозаплаточном BER окислительного повреждения ДНК. Цзян и др. [140] также обнаружили, что полимераза бета привлекала белок ДНК-метилтрансферазы DNMT3b к сайтам репарации BER. Затем они оценили схему метилирования на уровне отдельных нуклеотидов в небольшой области ДНК, включая область промотора и раннюю область транскрипции гена BRCA1 . Окислительное повреждение ДНК броматом модулировало схему метилирования ДНК (вызывало эпигенетические изменения) на участках CpG в пределах изучаемой области ДНК. В необработанных клетках CpG, расположенные в −189, −134, −29, −19, +16 и +19 гена BRCA1, имели метилированные цитозины (где нумерация ведется от сайта начала транскрипции мРНК-мессенджера , а отрицательные числа указывают на нуклеотиды в области восходящего промотора ). Окисление, вызванное обработкой броматом, привело к потере метилирования цитозина в −189, −134, +16 и +19, а также привело к образованию нового метилирования в CpG, расположенных в −80, −55, −21 и +8 после того, как была разрешена репарация ДНК. [ необходима цитата ]
По крайней мере в четырех статьях сообщается о привлечении ДНК-метилтрансферазы 1 (DNMT1) к участкам двухцепочечных разрывов ДНК. [141] [142] [98] [143] Во время гомологичной рекомбинационной репарации (HR) двухцепочечного разрыва участие DNMT1 приводит к тому, что две восстановленные цепи ДНК имеют разные уровни метилированных цитозинов. Одна цепь часто становится метилированной примерно в 21 сайте CpG ниже по течению от восстановленного двухцепочечного разрыва. Другая цепь ДНК теряет метилирование примерно в шести сайтах CpG, которые ранее были метилированы ниже по течению от двухцепочечного разрыва, а также теряет метилирование примерно в пяти сайтах CpG, которые ранее были метилированы выше по течению от двухцепочечного разрыва. Когда хромосома реплицируется, это приводит к появлению одной дочерней хромосомы, которая сильно метилирована ниже по течению от предыдущего сайта разрыва, и одной, которая неметилирована в области как выше, так и ниже по течению от предыдущего сайта разрыва. Что касается гена, который был сломан двухцепочечным разрывом, половина клеток потомства экспрессирует этот ген на высоком уровне, а в другой половине клеток потомства экспрессия этого гена подавлена. Когда клоны этих клеток поддерживались в течение трех лет, новые паттерны метилирования сохранялись в течение этого периода времени. [144]
У мышей с вставкой гомологически направленной рекомбинации, опосредованной CRISPR, в их геноме наблюдалось большое количество повышенных метилирований участков CpG в пределах вставки, связанной с двухцепочечным разрывом. [145]
Репарация негомологичного соединения концов (NHEJ) двухцепочечного разрыва может вызвать небольшое количество деметилирований уже существующих метилирований цитозина ДНК ниже по течению от репарированного двухцепочечного разрыва. [142] Дальнейшая работа Аллена и др. [146] показала, что NHEJ двухцепочечного разрыва ДНК в клетке может привести к тому, что некоторые клетки-потомки будут иметь подавленную экспрессию гена, несущего начальный двухцепочечный разрыв, и некоторые клетки-потомки будут иметь высокую экспрессию этого гена из-за эпигенетических изменений, связанных с репарацией NHEJ. Частота эпигенетических изменений, вызывающих репрессию гена после репарации NHEJ двухцепочечного разрыва ДНК в этом гене, может составлять около 0,9%. [98]
Основные процессы репарации ДНК в высокой степени консервативны как среди прокариот , так и среди эукариот и даже среди бактериофагов ( вирусов , которые заражают бактерии ); однако, более сложные организмы с более сложными геномами имеют соответственно более сложные механизмы репарации. [147] Способность большого количества структурных мотивов белка катализировать соответствующие химические реакции сыграла значительную роль в разработке механизмов репарации в ходе эволюции. Для чрезвычайно подробного обзора гипотез, касающихся эволюции репарации ДНК, см. [148]
Ископаемые останки указывают на то, что одноклеточная жизнь начала распространяться на планете в какой-то момент докембрийского периода, хотя точное время, когда впервые появилась узнаваемая современная жизнь, неясно. Нуклеиновые кислоты стали единственным и универсальным средством кодирования генетической информации, требуя механизмов репарации ДНК, которые в своей базовой форме были унаследованы всеми существующими формами жизни от их общего предка. Появление богатой кислородом атмосферы Земли (известное как « кислородная катастрофа ») из-за фотосинтезирующих организмов, а также наличие потенциально опасных свободных радикалов в клетке из-за окислительного фосфорилирования , потребовали эволюции механизмов репарации ДНК, которые действуют специально для противодействия типам повреждений, вызванных окислительным стрессом . Однако механизм, посредством которого это произошло, неясен. [ необходима цитата ]
В некоторых случаях повреждение ДНК не восстанавливается или восстанавливается с помощью подверженного ошибкам механизма, который приводит к изменению исходной последовательности. Когда это происходит, мутации могут распространяться в геномах потомства клетки. Если такое событие происходит в клетке зародышевой линии , которая в конечном итоге произведет гамету , мутация имеет потенциал для передачи потомству организма. Скорость эволюции у конкретного вида (или в конкретном гене) является функцией скорости мутации. Как следствие, скорость и точность механизмов восстановления ДНК оказывают влияние на процесс эволюционных изменений. [149] Защита от повреждений ДНК и их восстановление не влияют на скорость адаптации путем регуляции генов и рекомбинации и отбора аллелей. С другой стороны, восстановление и защита от повреждений ДНК влияют на скорость накопления непоправимых, выгодных, расширяющих код, наследуемых мутаций и замедляют эволюционный механизм расширения генома организмов с новыми функциями. Напряжение между эволюционируемостью и исправлением мутаций и защитой требует дальнейшего изучения. [ необходима цитата ]
Технология, названная кластеризованным регулярно интерспейсированным коротким палиндромным повтором (сокращенно CRISPR -Cas9), была открыта в 2012 году. Новая технология позволяет любому человеку с образованием в области молекулярной биологии изменять гены любого вида с точностью, вызывая повреждение ДНК в определенной точке, а затем изменяя механизмы восстановления ДНК для вставки новых генов. [150] Это дешевле, эффективнее и точнее, чем другие технологии. С помощью CRISPR–Cas9 ученые могут редактировать части генома, удаляя, добавляя или изменяя части в последовательности ДНК. [ требуется ссылка ]
Если бы мы жили достаточно долго, рано или поздно мы все заболели бы раком.
Определенную неснижаемую фоновую заболеваемость раком следует ожидать независимо от обстоятельств: мутаций никогда нельзя полностью избежать, поскольку они являются неизбежным следствием фундаментальных ограничений точности репликации ДНК, как обсуждалось в Главе 5. Если бы человек мог жить достаточно долго, неизбежно, что по крайней мере одна из его или ее клеток в конечном итоге накопила бы набор мутаций, достаточный для развития рака.