Хлор — химический элемент ; он имеет символ Cl и атомный номер 17. Второй по легкости из галогенов , он появляется между фтором и бромом в периодической таблице, и его свойства в основном промежуточные между ними. Хлор — это желто-зеленый газ при комнатной температуре. Это чрезвычайно реактивный элемент и сильный окислитель : среди элементов он имеет самое высокое сродство к электрону и третью по величине электроотрицательность по пересмотренной шкале Полинга , уступая только кислороду и фтору.
Хлор играл важную роль в экспериментах, проводимых средневековыми алхимиками , которые обычно включали нагревание хлоридных солей, таких как хлорид аммония ( нашатырный спирт ) и хлорид натрия ( поваренная соль ), в результате чего получались различные химические вещества, содержащие хлор, такие как хлористый водород , хлорид ртути (II) (сулема) и царская водка . Однако природа свободного газообразного хлора как отдельного вещества была признана только около 1630 года Яном Баптистом ван Гельмонтом . Карл Вильгельм Шееле написал описание газообразного хлора в 1774 году, предположив, что это оксид нового элемента. В 1809 году химики предположили, что газ может быть чистым элементом, и это подтвердил сэр Гемфри Дэви в 1810 году, который назвал его в честь древнегреческого χλωρός ( khlōrós , «бледно-зеленый») из-за его цвета.
Из-за своей высокой реакционной способности весь хлор в земной коре находится в форме ионных хлоридных соединений, включая поваренную соль. Это второй по распространенности галоген (после фтора) и 20-й по распространенности элемент в земной коре. Тем не менее, эти кристаллические отложения меркнут по сравнению с огромными запасами хлорида в морской воде.
Элементарный хлор в коммерческих целях производится из рассола электролизом , преимущественно в хлорщелочном процессе . Высокий окислительный потенциал элементарного хлора привел к разработке коммерческих отбеливателей и дезинфицирующих средств , а также реагента для многих процессов в химической промышленности. Хлор используется в производстве широкого спектра потребительских товаров, около двух третей из которых - это органические химикаты, такие как поливинилхлорид (ПВХ), многие промежуточные продукты для производства пластмасс и другие конечные продукты, не содержащие этот элемент. В качестве обычного дезинфицирующего средства элементарный хлор и хлоргенерирующие соединения используются более непосредственно в плавательных бассейнах для поддержания их санитарных условий . Элементарный хлор в высокой концентрации чрезвычайно опасен и ядовит для большинства живых организмов. Как химическое боевое вещество, хлор впервые был использован в Первой мировой войне в качестве отравляющего газового оружия.
В форме ионов хлора хлор необходим всем известным видам жизни. Другие типы соединений хлора редки в живых организмах, а искусственно созданные хлорированные органические вещества варьируются от инертных до токсичных. В верхних слоях атмосферы хлорсодержащие органические молекулы, такие как хлорфторуглероды, были вовлечены в истощение озонового слоя . Небольшие количества элементарного хлора генерируются путем окисления ионов хлора в нейтрофилах как часть ответа иммунной системы против бактерий.
Наиболее распространенное соединение хлора, хлорид натрия, известно с древних времен; археологи обнаружили доказательства того, что каменная соль использовалась еще в 3000 году до нашей эры, а рассол — еще в 6000 году до нашей эры. [10]
Около 900 года авторы арабских сочинений, приписываемых Джабиру ибн Хайяну (лат. Geber), и персидский врач и алхимик Абу Бакр ар-Рази ( ок. 865–925, лат. Rhazes) экспериментировали с нашатырным спиртом ( хлоридом аммония ), который при перегонке с купоросом (гидратированными сульфатами различных металлов) давал хлористый водород . [11] Однако, по-видимому, в этих ранних экспериментах с хлоридными солями газообразные продукты отбрасывались, и хлористый водород, возможно, получался много раз, прежде чем было обнаружено, что его можно использовать в химии. [12] Одним из первых таких применений был синтез хлорида ртути (едкого сулемы), производство которого путем нагревания ртути либо с квасцами и хлоридом аммония, либо с купоросом и хлоридом натрия было впервые описано в De aluminibus et salibus («О квасцах и солях», арабском тексте одиннадцатого или двенадцатого века, ложно приписываемом Абу Бакру ар-Рази и переведенном на латынь во второй половине двенадцатого века Герардом Кремонским , 1144–1187). [13] Другим важным достижением стало открытие псевдо-Гебера (в De inventione veritatis , «Об открытии истины», после ок. 1300 г.), что путем добавления хлорида аммония к азотной кислоте можно получить сильный растворитель, способный растворять золото (т. е. царскую водку ). [14] Хотя царская водка является нестабильной смесью, которая постоянно выделяет пары, содержащие свободный газообразный хлор, этот газообразный хлор, по-видимому, игнорировался до 1630 года, когда его природа как отдельного газообразного вещества была признана брабантским химиком и врачом Яном Баптистом ван Гельмонтом . [15] [en 1]

Элемент был впервые подробно изучен в 1774 году шведским химиком Карлом Вильгельмом Шееле , и ему приписывают это открытие. [16] [17] Шееле получил хлор путем реакции MnO 2 (в виде минерала пиролюзита ) с HCl: [15]
Шееле наблюдал несколько свойств хлора: отбеливающий эффект на лакмус , смертельный эффект на насекомых, желто-зеленый цвет и запах, похожий на запах царской водки . [18] Он назвал его « дефлогистированным солянокислым воздухом », поскольку это газ (тогда называемый «воздухом»), и он произошел от соляной кислоты (тогда известной как «соляная кислота»). [17] Ему не удалось установить хлор как элемент. [17]
Распространенная химическая теория того времени утверждала, что кислота — это соединение, содержащее кислород (остатки этого сохранились в немецких и голландских названиях кислорода : sauerstoff или zuurstof , оба перевода на английский язык означают кислотное вещество ), поэтому ряд химиков, включая Клода Бертолле , предположили, что дефлогистированный воздух соляной кислоты Шееле должен быть комбинацией кислорода и еще не открытого элемента muriaticum . [19] [20]
В 1809 году Жозеф Луи Гей-Люссак и Луи-Жак Тенар попытались разложить дефлогистированный воздух с соляной кислотой , вступая в реакцию с древесным углем, чтобы высвободить свободный элемент muriaticum (и диоксид углерода). [17] Им это не удалось, и они опубликовали отчет, в котором рассмотрели возможность того, что дефлогистированный воздух с соляной кислотой является элементом, но не были в этом убеждены. [21]
В 1810 году сэр Гемфри Дэви снова попытался провести тот же эксперимент и пришел к выводу, что вещество является элементом, а не соединением. [17] Он объявил о своих результатах Королевскому обществу 15 ноября того же года. [15] В то время он назвал этот новый элемент «хлором», от греческого слова χλωρος ( chlōros , «зелено-желтый»), в связи с его цветом. [22] Название « галоген », означающее «производитель соли», было первоначально использовано для хлора в 1811 году Иоганном Саломо Кристофом Швайггером . [23] Этот термин позже использовался как общий термин для описания всех элементов семейства хлора (фтор, бром, йод) по предложению Йенса Якоба Берцелиуса в 1826 году . [24] [25] В 1823 году Майкл Фарадей впервые сжижил хлор, [26] [27] [28] и продемонстрировал, что то, что тогда было известно как «твердый хлор», имеет структуру гидрата хлора (Cl2 · H2O ) . [15]
Газообразный хлор был впервые использован французским химиком Клодом Бертолле для отбеливания тканей в 1785 году. [29] [30] Современные отбеливатели стали результатом дальнейшей работы Бертолле, который впервые получил гипохлорит натрия в 1789 году в своей лаборатории в городе Жавель (ныне часть Парижа , Франция), пропуская газообразный хлор через раствор карбоната натрия. Полученная жидкость, известная как « Eau de Javel » (« Жавельская вода »), представляла собой слабый раствор гипохлорита натрия . Этот процесс был не очень эффективным, и были найдены альтернативные методы производства. Шотландский химик и промышленник Чарльз Теннант сначала получил раствор гипохлорита кальция («хлорная известь»), затем твердый гипохлорит кальция (отбеливающий порошок). [29] Эти соединения производили низкие уровни элементарного хлора и могли транспортироваться более эффективно, чем гипохлорит натрия, который оставался в виде разбавленных растворов, потому что при очистке от воды он становился опасно сильным и нестабильным окислителем. Ближе к концу девятнадцатого века Э. С. Смит запатентовал метод производства гипохлорита натрия, включающий электролиз рассола для получения гидроксида натрия и газообразного хлора, которые затем смешивались для образования гипохлорита натрия. [31] Это известно как хлорщелочной процесс , впервые представленный в промышленных масштабах в 1892 году, и в настоящее время являющийся источником большинства элементарного хлора и гидроксида натрия. [32] В 1884 году немецкая компания Chemischen Fabrik Griesheim разработала еще один хлорщелочной процесс , который был запущен в коммерческое производство в 1888 году. [33]
Растворы элементарного хлора, растворенные в химически щелочной воде (гипохлорит натрия и кальция ), впервые были использованы в качестве противогнилостных и дезинфицирующих средств в 1820-х годах во Франции, задолго до создания микробной теории болезней . Эта практика была впервые применена Антуаном-Жерменом Лабарраком , который адаптировал отбеливатель «Жавелева вода» Бертолле и другие препараты хлора. [34] С тех пор элементарный хлор непрерывно выполняет функцию местной антисептики (растворы для промывания ран и т. п.) и общественной санитарии, особенно в воде для плавания и питья. [18]
Впервые хлорный газ был использован в качестве оружия 22 апреля 1915 года во время Второй битвы при Ипре немецкой армией . [35] [36] Эффект для союзников был разрушительным, поскольку существующие противогазы было трудно развернуть, и они не были широко распространены. [37] [38]



Хлор является вторым галогеном , будучи неметаллом в группе 17 периодической таблицы. Таким образом, его свойства аналогичны фтору , брому и йоду и в значительной степени являются промежуточными между свойствами первых двух. Хлор имеет электронную конфигурацию [Ne]3s23p5 , причем семь электронов в третьей и самой внешней оболочке действуют как его валентные электроны . Как и все галогены, ему не хватает одного электрона до полного октета, и, следовательно , он является сильным окислителем, реагирующим со многими элементами, чтобы завершить свою внешнюю оболочку. [39] В соответствии с периодическими тенденциями , он является промежуточным по электроотрицательности между фтором и бромом (F: 3,98, Cl: 3,16, Br: 2,96, I: 2,66), и менее реакционноспособен, чем фтор, и более реакционноспособен, чем бром. Он также является более слабым окислителем, чем фтор, но более сильным, чем бром. Наоборот, хлорид- ион является более слабым восстановителем, чем бромид, но более сильным, чем фторид. [39] Он занимает промежуточное положение по атомному радиусу между фтором и бромом, и это приводит к тому, что многие его атомные свойства аналогично продолжают тенденцию от йода к брому вверх, например, первая энергия ионизации , сродство к электрону , энтальпия диссоциации молекулы X2 ( X = Cl, Br, I), ионный радиус и длина связи X–X. (Фтор аномален из-за своего малого размера.) [39]
Все четыре стабильных галогена испытывают межмолекулярные силы притяжения Ван-дер-Ваальса , и их сила увеличивается вместе с числом электронов среди всех гомоядерных двухатомных молекул галогенов. Таким образом, температуры плавления и кипения хлора являются промежуточными между температурами плавления и кипения фтора и брома: хлор плавится при -101,0 °C и кипит при -34,0 °C. В результате увеличения молекулярной массы галогенов вниз по группе, плотность и теплоты плавления и испарения хлора снова являются промежуточными между таковыми брома и фтора, хотя все их теплоты испарения довольно низкие (что приводит к высокой летучести) благодаря их двухатомной молекулярной структуре. [39] Галогены темнеют по мере того, как группа спускается вниз: так, в то время как фтор представляет собой бледно-желтый газ, хлор отчетливо желто-зеленый. Эта тенденция возникает из-за того, что длины волн видимого света, поглощаемого галогенами, увеличиваются вниз по группе. [39] В частности, цвет галогена, такого как хлор, является результатом электронного перехода между самой высокой занятой антисвязывающей молекулярной орбиталью π g и самой низкой вакантной антисвязывающей молекулярной орбиталью σ u . [40] Цвет исчезает при низких температурах, так что твердый хлор при температуре −195 °C почти бесцветен. [39]
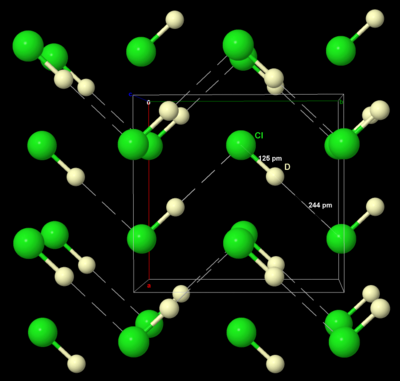
Подобно твёрдым брому и йоду, твёрдый хлор кристаллизуется в орторомбической кристаллической системе , в слоистой решётке молекул Cl 2. Расстояние Cl–Cl составляет 198 пм (близко к газообразному расстоянию Cl–Cl, равному 199 пм), а расстояние Cl···Cl между молекулами составляет 332 пм внутри слоя и 382 пм между слоями (сравните радиус Ван-дер-Ваальса хлора, 180 пм). Такая структура означает, что хлор является очень плохим проводником электричества, и действительно, его проводимость настолько мала, что её практически невозможно измерить. [39]
У хлора есть два стабильных изотопа, 35 Cl и 37 Cl. Это единственные два природных изотопа, встречающиеся в большом количестве, причем 35 Cl составляет 76% природного хлора, а 37 Cl составляет оставшиеся 24%. Оба синтезируются в звездах в процессах горения кислорода и кремния . [41] Оба имеют ядерный спин 3/2+ и, таким образом, могут использоваться для ядерного магнитного резонанса , хотя величина спина, превышающая 1/2, приводит к несферическому распределению ядерного заряда и, таким образом, к резонансному расширению в результате ненулевого ядерного квадрупольного момента и результирующей квадрупольной релаксации. Все другие изотопы хлора радиоактивны, с периодами полураспада, слишком короткими, чтобы изначально встречаться в природе . Из них наиболее часто используемыми в лаборатории являются 36 Cl ( t 1/2 = 3,0×10 5 лет) и 38 Cl ( t 1/2 = 37,2 мин), которые могут быть получены путем нейтронной активации природного хлора. [39]
Наиболее стабильным радиоизотопом хлора является 36Cl . Основной режим распада изотопов легче 35Cl — захват электронов изотопами серы ; изотопов тяжелее 37Cl — бета-распад изотопами аргона ; и 36Cl может распадаться любым из этих режимов до стабильных 36S или 36Ar . [42] 36Cl встречается в природе в следовых количествах как космогенный нуклид в соотношении примерно (7–10) × 10−13 к 1 со стабильными изотопами хлора: он образуется в атмосфере путем расщепления 36Ar при взаимодействии с протонами космических лучей . В верхнем метре литосферы 36Cl образуется в основном путем активации тепловыми нейтронами 35Cl и расщепления 39K и 40Ca . В подземной среде захват мюонов 40Ca становится более важным как способ получения 36Cl . [43] [ 44]
Хлор занимает промежуточное положение по реакционной способности между фтором и бромом и является одним из самых реакционноспособных элементов. Хлор является более слабым окислителем, чем фтор, но более сильным, чем бром или йод. Это можно увидеть из стандартных электродных потенциалов пар X 2 /X − (F, +2,866 В; Cl, +1,395 В; Br, +1,087 В; I, +0,615 В; At , приблизительно +0,3 В). Однако эта тенденция не отображается в энергиях связи, поскольку фтор является сингулярным из-за своего малого размера, низкой поляризуемости и неспособности проявлять гипервалентность . Еще одним отличием является то, что хлор имеет значительную химию в положительных степенях окисления, а фтор — нет. Хлорирование часто приводит к более высоким степеням окисления, чем бромирование или йодирование, но к более низким степеням окисления, чем фторирование. Хлор имеет тенденцию реагировать с соединениями, содержащими связи M–M, M–H или M–C, с образованием связей M–Cl. [40]
Учитывая, что E°( 1/2 O 2 /H 2 O) = +1,229 В, что меньше +1,395 В, можно было бы ожидать, что хлор должен быть способен окислять воду до кислорода и соляной кислоты. Однако кинетика этой реакции неблагоприятна, и необходимо также учитывать эффект пузырькового перенапряжения , так что электролиз водных растворов хлорида выделяет газообразный хлор, а не газообразный кислород, что очень полезно для промышленного производства хлора. [45]
Простейшим соединением хлора является хлористый водород , HCl, основной химикат в промышленности, а также в лаборатории, как в виде газа, так и растворенный в воде в виде соляной кислоты . Его часто получают путем сжигания газообразного водорода в газообразном хлоре или в качестве побочного продукта хлорирования углеводородов . Другой подход заключается в обработке хлорида натрия концентрированной серной кислотой для получения соляной кислоты, также известный как процесс «соляного пирога»: [46]
В лаборатории хлористый водород может быть получен путем сушки кислоты концентрированной серной кислотой. Хлорид дейтерия, DCl, может быть получен путем реакции бензоилхлорида с тяжелой водой (D2O ) . [46]
При комнатной температуре хлористый водород представляет собой бесцветный газ, как и все галогениды водорода, за исключением фтористого водорода , поскольку водород не может образовывать прочные водородные связи с большим электроотрицательным атомом хлора; однако слабые водородные связи присутствуют в твердом кристаллическом хлористом водороде при низких температурах, подобно структуре фтористого водорода, до того, как беспорядок начнет преобладать по мере повышения температуры. [46] Соляная кислота является сильной кислотой (p K a = −7), поскольку водородные связи с хлором слишком слабы, чтобы ингибировать диссоциацию. Система HCl/H 2 O имеет много гидратов HCl· n H 2 O для n = 1, 2, 3, 4 и 6. За пределами смеси 1:1 HCl и H 2 O система полностью разделяется на две отдельные жидкие фазы. Соляная кислота образует азеотроп с температурой кипения 108,58 °C при 20,22 г HCl на 100 г раствора; Таким образом, соляная кислота не может быть сконцентрирована выше этой точки путем перегонки. [47]
В отличие от фтористого водорода, с безводным жидким хлористым водородом трудно работать в качестве растворителя, поскольку его температура кипения низкая, он имеет небольшой интервал жидкого состояния, его диэлектрическая проницаемость низкая и он не диссоциирует в значительной степени на H2Cl + и HCl .−
2ионы – последние, в любом случае, гораздо менее стабильны, чем ионы бифторида ( HF−
2) из-за очень слабой водородной связи между водородом и хлором, хотя его соли с очень большими и слабо поляризующими катионами, такими как Cs + и NR+
4(R = Me , Et , Bu n ) все еще может быть выделен. Безводный хлористый водород является плохим растворителем, способным растворять только небольшие молекулярные соединения, такие как нитрозилхлорид и фенол , или соли с очень низкой энергией решетки, такие как галогениды тетраалкиламмония. Он легко протонирует электрофилы , содержащие неподеленные пары или π-связи. Сольволиз , реакции замены лиганда и окисления хорошо охарактеризованы в растворе хлористого водорода: [48]
-chloride-hexahydrate-sample.jpg/440px-Nickel(II)-chloride-hexahydrate-sample.jpg)
Почти все элементы в периодической таблице образуют бинарные хлориды. Исключения решительно составляют меньшинство и в каждом случае обусловлены одной из трех причин: крайней инертностью и нежеланием участвовать в химических реакциях ( благородные газы , за исключением ксенона в крайне нестабильных XeCl 2 и XeCl 4 ); крайней ядерной нестабильностью, затрудняющей химические исследования до распада и трансмутации (многие из самых тяжелых элементов после висмута ); и наличием электроотрицательности выше, чем у хлора ( кислород и фтор ), так что полученные бинарные соединения формально являются не хлоридами, а скорее оксидами или фторидами хлора. [49] Несмотря на то, что азот в NCl 3 несет отрицательный заряд, соединение обычно называют трихлоридом азота .
Хлорирование металлов с Cl 2 обычно приводит к более высокой степени окисления, чем бромирование с Br 2 , когда доступны несколько степеней окисления, например, в MoCl 5 и MoBr 3 . Хлориды могут быть получены путем реакции элемента или его оксида, гидроксида или карбоната с соляной кислотой, а затем дегидратированы умеренно высокими температурами в сочетании с низким давлением или безводным газообразным хлористым водородом. Эти методы работают лучше всего, когда хлоридный продукт стабилен к гидролизу; в противном случае возможности включают высокотемпературное окислительное хлорирование элемента хлором или хлористым водородом, высокотемпературное хлорирование оксида металла или другого галогенида хлором, летучим хлоридом металла, четыреххлористым углеродом или органическим хлоридом. Например, диоксид циркония реагирует с хлором при стандартных условиях с образованием тетрахлорида циркония , а триоксид урана реагирует с гексахлорпропеном при нагревании с обратным холодильником с образованием тетрахлорида урана . Второй пример также включает в себя снижение степени окисления , что также может быть достигнуто путем восстановления высшего хлорида с использованием водорода или металла в качестве восстановителя. Это также может быть достигнуто путем термического разложения или диспропорционирования следующим образом: [49]
Большинство хлоридов металлов с металлом в низких степенях окисления (от +1 до +3) являются ионными. Неметаллы, как правило, образуют ковалентные молекулярные хлориды, как и металлы в высоких степенях окисления от +3 и выше. Как ионные, так и ковалентные хлориды известны для металлов в степени окисления +3 (например, хлорид скандия в основном ионный, а хлорид алюминия — нет). Хлорид серебра очень нерастворим в воде и поэтому часто используется в качестве качественного теста на хлор. [49]
Хотя дихлор является сильным окислителем с высокой первой энергией ионизации, он может окисляться в экстремальных условиях с образованием катиона [Cl 2 ] + . Он очень нестабилен и был охарактеризован только по своему электронному полосовому спектру при получении в разрядной трубке низкого давления. Желтый катион [Cl 3 ] + более стабилен и может быть получен следующим образом: [50]
Эта реакция проводится в окисляющем растворителе пентафториде мышьяка . Трихлорид-анион, [Cl 3 ] − , также был охарактеризован; он аналогичен трииодиду . [51]
Три фторида хлора образуют подмножество межгалогеновых соединений, все из которых являются диамагнитными . [51] Известны некоторые катионные и анионные производные, такие как ClF−
2, КлФ−
4, КлФ+
2, и Cl 2 F + . [52] Также известны некоторые псевдогалогениды хлора, такие как цианогенхлорид (ClCN, линейный), цианат хлора (ClNCO), тиоцианат хлора (ClSCN, в отличие от своего кислородного аналога) и азид хлора (ClN 3 ). [51]
Монофторид хлора (ClF) чрезвычайно термически стабилен и продается в 500-граммовых стальных лекционных флаконах. Это бесцветный газ, который плавится при температуре -155,6 °C и кипит при -100,1 °C. Он может быть получен реакцией его элементов при 225 °C, хотя затем его необходимо отделить и очистить от трифторида хлора и его реагентов. Его свойства в основном промежуточные между свойствами хлора и фтора. Он будет реагировать со многими металлами и неметаллами от комнатной температуры и выше, фторируя их и высвобождая хлор. Он также будет действовать как хлорфторирующий агент, добавляя хлор и фтор через кратную связь или путем окисления: например, он будет атаковать оксид углерода, образуя карбонилхлорфторид, COFCl. Аналогично он реагирует с гексафторацетоном (CF 3 ) 2 CO, с катализатором фторидом калия , образуя гептафторизопропилгипохлорит (CF 3 ) 2 CFOCl; с нитрилами RCN, образуя RCF 2 NCl 2 ; и с оксидами серы SO 2 и SO 3, образуя ClSO 2 F и ClOSO 2 F соответственно. Он также будет экзотермически реагировать с соединениями, содержащими группы –OH и –NH, такими как вода: [51]
Трифторид хлора (ClF 3 ) — летучая бесцветная молекулярная жидкость, которая плавится при температуре -76,3 °C и кипит при температуре 11,8 °C. Он может быть образован прямым фторированием газообразного хлора или монофторида хлора при температуре 200–300 °C. Одно из самых реактивных известных химических соединений, список элементов, которые он поджигает, разнообразен и содержит водород , калий , фосфор , мышьяк , сурьму , серу , селен , теллур , бром , йод и порошкообразные молибден , вольфрам , родий , иридий и железо . Он также поджигает воду, а также многие вещества, которые в обычных обстоятельствах считались бы химически инертными, такие как асбест , бетон, стекло и песок. При нагревании он даже разъедает благородные металлы, такие как палладий , платина и золото , и даже благородные газы ксенон и радон не избегают фторирования. Непроницаемый фторидный слой образуется натрием , магнием , алюминием , цинком , оловом и серебром , который может быть удален при нагревании. Обычно используются никелевые , медные и стальные контейнеры из-за их большой устойчивости к воздействию трифторида хлора, обусловленной образованием нереакционноспособного слоя фторида металла. Его реакция с гидразином с образованием фтористого водорода, азота и хлорных газов использовалась в экспериментальном ракетном двигателе, но имеет проблемы, в основном связанные с его чрезвычайной гиперголичностью, что приводит к воспламенению без какой-либо измеримой задержки. Сегодня он в основном используется при переработке ядерного топлива, для окисления урана до гексафторида урана для его обогащения и отделения его от плутония , а также в полупроводниковой промышленности, где он используется для очистки камер химического осаждения из паровой фазы . [53] Он может действовать как донор или акцептор фторид-ионов (основание или кислота Льюиса), хотя он не диссоциирует в значительной степени на ClF+
2и ClF−
4ионы. [54]
Пентафторид хлора (ClF 5 ) производится в больших масштабах прямым фторированием хлора избытком газообразного фтора при 350 °C и 250 атм, а в малых масштабах — реакцией хлоридов металлов с газообразным фтором при 100–300 °C. Он плавится при температуре -103 °C и кипит при -13,1 °C. Это очень сильный фторирующий агент, хотя он все еще не так эффективен, как трифторид хлора. Было охарактеризовано лишь несколько конкретных стехиометрических реакций. Пентафторид мышьяка и пентафторид сурьмы образуют ионные аддукты вида [ClF 4 ] + [MF 6 ] − (M = As, Sb), а вода бурно реагирует следующим образом: [55]
Продукт, хлорилфторид , является одним из пяти известных фторидов оксида хлора. Они варьируются от термически нестабильного FClO до химически нереактивного перхлорилфторида (FClO 3 ), остальные три - FClO 2 , F 3 ClO и F 3 ClO 2 . Все пять ведут себя подобно фторидам хлора, как структурно, так и химически, и могут действовать как кислоты или основания Льюиса, приобретая или теряя ионы фтора соответственно или как очень сильные окислители и фторирующие агенты. [56]


Оксиды хлора хорошо изучены, несмотря на их нестабильность (все они являются эндотермическими соединениями). Они важны, поскольку образуются, когда хлорфторуглероды подвергаются фотолизу в верхних слоях атмосферы и вызывают разрушение озонового слоя. Ни один из них не может быть получен путем прямой реакции элементов. [57]
Монооксид дихлора (Cl 2 O) — это коричневато-желтый газ (красно-коричневый в твердом или жидком состоянии), который может быть получен путем реакции газообразного хлора с желтым оксидом ртути (II) . Он хорошо растворяется в воде, в которой находится в равновесии с хлорноватистой кислотой (HOCl), ангидридом которой он является. Таким образом, он является эффективным отбеливателем и в основном используется для получения гипохлоритов . Он взрывается при нагревании или искрении или в присутствии газообразного аммиака. [57]
Диоксид хлора (ClO 2 ) был первым оксидом хлора, который был открыт в 1811 году Гемфри Дэви . Это желтый парамагнитный газ (темно-красный в твердом или жидком состоянии), как и ожидалось, поскольку он имеет нечетное число электронов: он стабилен к димеризации из-за делокализации неспаренного электрона. Он взрывается при температуре выше −40 °C как жидкость и под давлением как газ и поэтому должен производиться в низких концентрациях для отбеливания древесной массы и очистки воды. Обычно его получают путем восстановления хлората следующим образом: [57]
Таким образом, его производство тесно связано с окислительно-восстановительными реакциями оксокислот хлора. Это сильный окислитель, реагирующий с серой , фосфором , галогенидами фосфора и боргидридом калия . Он экзотермически растворяется в воде, образуя темно-зеленые растворы, которые очень медленно разлагаются в темноте. Кристаллические клатратные гидраты ClO2 · nH2O ( n ≈ 6–10 ) выделяются при низких температурах. Однако в присутствии света эти растворы быстро фоторазлагаются, образуя смесь хлорноватой и соляной кислот. Фотолиз отдельных молекул ClO2 приводит к образованию радикалов ClO и ClOO, тогда как при комнатной температуре в основном образуются хлор, кислород и некоторое количество ClO3 и Cl2O6. Cl2O3 также образуется при фотолизе твердого вещества при температуре -78 °C: это темно-коричневое твердое вещество, которое взрывается при температуре ниже 0 °C. Радикал ClO приводит к истощению атмосферного озона и, таким образом, имеет следующее экологическое значение: [57]
Перхлорат хлора (ClOClO 3 ) — бледно-желтая жидкость, которая менее стабильна, чем ClO 2 и разлагается при комнатной температуре с образованием хлора, кислорода и дихлоргексоксида (Cl 2 O 6 ). [57] Перхлорат хлора также можно считать хлорпроизводным хлорной кислоты (HOClO 3 ), аналогичным термически нестабильным хлорпроизводным других оксокислот: примеры включают нитрат хлора (ClONO 2 , энергично реактивный и взрывоопасный) и фторсульфат хлора (ClOSO 2 F, более стабильный, но все еще чувствительный к влаге и высокореактивный). [58] Дихлоргексоксид — темно-красная жидкость, которая замерзает, образуя твердое вещество, которое становится желтым при -180 °C: его обычно получают путем реакции диоксида хлора с кислородом. Несмотря на попытки рационализировать его как димер ClO 3 , он реагирует скорее как хлорилперхлорат, [ClO 2 ] + [ClO 4 ] − , что, как было подтверждено, является правильной структурой твердого вещества. Он гидролизуется в воде, давая смесь хлорноватой и хлорной кислот: аналогичная реакция с безводным фтористым водородом не доходит до конца. [57]
Гептоксид дихлора (Cl 2 O 7 ) является ангидридом хлорной кислоты (HClO 4 ) и может быть легко получен из него путем дегидратации его фосфорной кислотой при −10 °C и последующей перегонки продукта при −35 °C и 1 мм рт. ст. Это чувствительная к ударам, бесцветная маслянистая жидкость. Это наименее реакционноспособный из оксидов хлора, будучи единственным, который не поджигает органические материалы при комнатной температуре. Его можно растворить в воде для регенерации хлорной кислоты или в водных щелочах для регенерации перхлоратов. Однако он термически взрывообразно разлагается, разрывая одну из центральных связей Cl–O, образуя радикалы ClO 3 и ClO 4 , которые немедленно разлагаются на элементы через промежуточные оксиды. [57]
Хлор образует четыре оксокислоты: хлорноватистую кислоту (HOCl), хлористую кислоту (HOClO), хлорную кислоту (HOClO 2 ) и перхлорную кислоту (HOClO 3 ). Как видно из окислительно-восстановительных потенциалов, приведенных в соседней таблице, хлор гораздо более устойчив к диспропорционированию в кислых растворах, чем в щелочных: [45]
Ионы гипохлорита также диспропорционируют далее, образуя хлорид и хлорат (3 ClO − ⇌ 2 Cl − + ClO−
3) но эта реакция довольно медленная при температурах ниже 70 °C, несмотря на очень благоприятную константу равновесия 10 27 . Ионы хлората сами могут диспропорционировать, образуя хлорид и перхлорат (4 ClO−
3⇌ Cl − + 3 ClO−
4) но это все еще очень медленно даже при 100 °C, несмотря на очень благоприятную константу равновесия 10 20 . Скорости реакции для оксианионов хлора увеличиваются по мере уменьшения степени окисления хлора. Силы оксикислот хлора увеличиваются очень быстро по мере увеличения степени окисления хлора из-за увеличивающейся делокализации заряда по все большему количеству атомов кислорода в их сопряженных основаниях. [45]
Большинство оксокислот хлора можно получить, используя эти реакции диспропорционирования. Хлорноватистая кислота (HOCl) очень реактивна и довольно нестабильна; ее соли в основном используются из-за их отбеливающих и стерилизующих свойств. Они являются очень сильными окислителями, переносящими атом кислорода к большинству неорганических видов. Хлористая кислота (HOClO) еще более нестабильна и не может быть выделена или сконцентрирована без разложения: она известна по разложению водного диоксида хлора. Однако хлорит натрия является стабильной солью и полезен для отбеливания и очистки тканей, как окислитель и как источник диоксида хлора. Хлорноватая кислота (HOClO 2 ) является сильной кислотой, которая довольно стабильна в холодной воде до концентрации 30%, но при нагревании дает хлор и диоксид хлора. Испарение при пониженном давлении позволяет сконцентрировать ее еще больше примерно до 40%, но затем она разлагается на хлорную кислоту, хлор, кислород, воду и диоксид хлора. Его самая важная соль — хлорат натрия , в основном используемый для производства диоксида хлора для отбеливания бумажной массы. Разложение хлората на хлорид и кислород — это распространенный способ получения кислорода в лабораторных условиях в небольших масштабах. Хлорид и хлорат могут пропорционировать, образуя хлор следующим образом: [59]
Перхлораты и хлорная кислота (HOClO 3 ) являются наиболее стабильными оксосоединениями хлора, в соответствии с тем фактом, что соединения хлора наиболее стабильны, когда атом хлора находится в своей самой низкой (−1) или самой высокой (+7) возможной степени окисления. Хлорная кислота и водные перхлораты являются энергичными и иногда агрессивными окислителями при нагревании, в резком контрасте с их в основном неактивной природой при комнатной температуре из-за высоких энергий активации для этих реакций по кинетическим причинам. Перхлораты производятся путем электролитического окисления хлората натрия, а хлорная кислота производится путем реакции безводного перхлората натрия или перхлората бария с концентрированной соляной кислотой, фильтрацией осажденного хлорида и перегонкой фильтрата для его концентрирования. Безводная хлорная кислота представляет собой бесцветную подвижную жидкость, чувствительную к удару, которая взрывается при контакте с большинством органических соединений, поджигает йодистый водород и тионилхлорид и даже окисляет серебро и золото. Хотя это слабый лиганд, слабее воды, несколько соединений, включающих координированный ClO−
4[59] В таблице ниже представлены типичные степени окисления элемента хлора, как их преподают в средних школах или колледжах. Существуют более сложные химические соединения, структуру которых можно объяснить только с помощью современных квантово-химических методов, например, кластерный хлорид технеция [(CH 3 ) 4 N ] 3 [Tc 6 Cl 14 ], в котором 6 из 14 атомов хлора формально двухвалентны, а степени окисления дробные. [60] [61] Кроме того, все вышеперечисленные химические закономерности справедливы для «нормальных» или близких к нормальным условий, тогда как при сверхвысоких давлениях (например, в ядрах больших планет) хлор может проявлять степень окисления -3, образуя с натрием соединение Na3Cl, что не укладывается в традиционные представления о химии. [62]

Как и другие связи углерод-галоген, связь C–Cl является общей функциональной группой, которая является частью основной органической химии . Формально соединения с этой функциональной группой можно считать органическими производными хлорид-аниона. Из-за разницы в электроотрицательности между хлором (3,16) и углеродом (2,55), углерод в связи C–Cl является электронодефицитным и, следовательно, электрофильным . Хлорирование изменяет физические свойства углеводородов несколькими способами: хлоруглероды, как правило, плотнее воды из-за более высокого атомного веса хлора по сравнению с водородом, а алифатические органохлориды являются алкилирующими агентами , поскольку хлорид является уходящей группой . [63]
Алканы и арильные алканы могут быть хлорированы в условиях свободных радикалов с помощью УФ-света. Однако степень хлорирования трудно контролировать: реакция не является региоселективной и часто приводит к смеси различных изомеров с различной степенью хлорирования, хотя это может быть допустимо, если продукты легко разделяются. Арильные хлориды могут быть получены галогенированием по Фриделю-Крафтсу с использованием хлора и катализатора кислоты Льюиса . [63] Галоформная реакция с использованием хлора и гидроксида натрия также способна генерировать алкилгалогениды из метилкетонов и родственных соединений. Хлор также присоединяется к кратным связям на алкенах и алкинах , давая ди- или тетрахлорсоединения. Однако из-за стоимости и реакционной способности хлора хлорорганические соединения чаще производятся с использованием хлористого водорода или с хлорирующими агентами, такими как пентахлорид фосфора (PCl 5 ) или тионилхлорид (SOCl 2 ). Последнее очень удобно в лаборатории, поскольку все побочные продукты газообразны и их не нужно перегонять. [63]
Многие хлорорганические соединения были выделены из природных источников, начиная от бактерий и заканчивая людьми. [64] [65] Хлорированные органические соединения обнаружены почти в каждом классе биомолекул, включая алкалоиды , терпены , аминокислоты , флавоноиды , стероиды и жирные кислоты . [64] [66] Органохлориды, включая диоксины , производятся в условиях высоких температур лесных пожаров, а диоксины были обнаружены в сохранившемся пепле пожаров, вызванных молнией, которые предшествовали синтетическим диоксинам. [67] Кроме того, из морских водорослей были выделены различные простые хлорированные углеводороды, включая дихлорметан, хлороформ и четыреххлористый углерод . [68] Большая часть хлорметана в окружающей среде производится естественным образом в результате биологического разложения, лесных пожаров и вулканов. [69]
Некоторые типы органохлоридов, хотя и не все, обладают значительной токсичностью для растений или животных, включая людей. Диоксины, образующиеся при сжигании органических веществ в присутствии хлора, и некоторые инсектициды, такие как ДДТ , являются стойкими органическими загрязнителями , которые представляют опасность при попадании в окружающую среду. Например, ДДТ, который широко использовался для борьбы с насекомыми в середине 20-го века, также накапливается в пищевых цепях и вызывает репродуктивные проблемы (например, истончение яичной скорлупы) у некоторых видов птиц. [70] Из-за легкого гомолитического расщепления связи C–Cl для создания радикалов хлора в верхних слоях атмосферы, хлорфторуглероды были постепенно выведены из обращения из-за вреда, который они наносят озоновому слою. [57]

Хлор слишком реактивен, чтобы встречаться в природе как свободный элемент, но очень распространен в форме своих хлоридных солей. Он является 20-м наиболее распространенным элементом [71] в земной коре и составляет 126 частей на миллион из-за больших залежей хлоридных минералов, особенно хлорида натрия , которые испаряются из водоемов. Все это меркнет по сравнению с запасами хлоридных ионов в морской воде: меньшие количества при более высоких концентрациях встречаются в некоторых внутренних морях и подземных рассолах , таких как Большое Соленое озеро в Юте и Мертвое море в Израиле. [72]
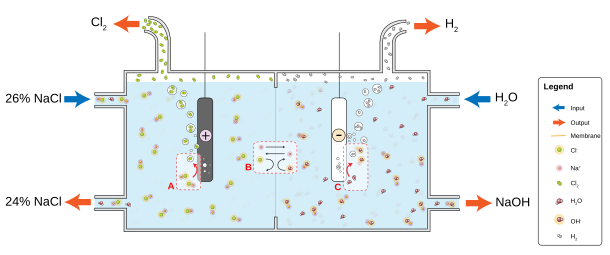
Небольшие партии газообразного хлора готовятся в лаборатории путем соединения соляной кислоты и диоксида марганца , но необходимость в этом возникает редко из-за его доступности. В промышленности элементарный хлор обычно производится электролизом хлорида натрия, растворенного в воде. Этот метод, хлорщелочной процесс, внедренный в промышленность в 1892 году, в настоящее время обеспечивает большую часть промышленного газообразного хлора. [32] Наряду с хлором этот метод дает газообразный водород и гидроксид натрия , который является наиболее ценным продуктом. Процесс протекает в соответствии со следующим химическим уравнением : [73]
Хлор в основном производится хлорщелочным процессом , хотя существуют и нехлорщелочные процессы. Мировое производство в 2006 году оценивалось в 65 миллионов коротких тонн. [74] Наиболее заметное применение хлора — дезинфекция воды . 35–40 % производимого хлора используется для производства поливинилхлорида через этилендихлорид и винилхлорид . [75] Производимый хлор доступен в баллонах размером от 450 г до 70 кг, а также в бочках (865 кг), цистернах (15 тонн по дорогам; 27–90 тонн по железной дороге) и баржах (600–1200 тонн). [76] Из-за сложности транспортировки элементарного хлора производство обычно располагается рядом с местом его потребления. Например, производители винилхлорида, такие как Westlake Chemical [77] и Formosa Plastics [78], имеют интегрированные хлорщелочные активы.
Электролиз хлоридных растворов протекает по следующим уравнениям:
В обычном случае электролиза хлорида натрия побочными продуктами являются гидроксид натрия и хлор.
В промышленности используются три хлорщелочных процесса:
Процесс Кастнера-Кельнера был первым методом, использованным в конце девятнадцатого века для производства хлора в промышленных масштабах. [79] [80] Ртуть (которая токсична) использовалась в качестве электрода для амальгамирования натриевого продукта, предотвращая нежелательные побочные реакции.
В электролизе с диафрагмой асбестовая (или полимерно-волокнистая) диафрагма разделяет катод и анод , предотвращая повторное смешивание хлора, образующегося на аноде, с гидроксидом натрия и водородом, образующимися на катоде. [81] Солевой раствор (рассол) непрерывно подается в анодное отделение и протекает через диафрагму в катодное отделение, где образуется едкая щелочь , а рассол частично истощается. Методы диафрагмы производят разбавленную и слегка загрязненную щелочь, но они не обременены проблемой утилизации ртути и являются более энергоэффективными. [32]
Электролиз мембранных ячеек использует проницаемую мембрану в качестве ионообменника . Насыщенный раствор хлорида натрия (или калия) пропускается через анодное отделение, оставляя его при более низкой концентрации . Этот метод также производит очень чистый гидроксид натрия (или калия), но имеет недостаток, заключающийся в необходимости очень чистого рассола при высоких концентрациях. [82]
В процессе Дикона хлористый водород, извлеченный из производства хлорорганических соединений, восстанавливается в виде хлора. Процесс основан на окислении с использованием кислорода:
Реакция требует катализатора. Как представил Дикон, ранние катализаторы были основаны на меди. Коммерческие процессы, такие как Mitsui MT-Chlorine Process, перешли на катализаторы на основе хрома и рутения. [83]
.jpg/440px-Tank_car_with_placard_1017_(chlorine).jpg)
Хлорид натрия является наиболее распространенным соединением хлора и является основным источником хлора для химической промышленности. Около 15000 соединений, содержащих хлор, продаются в коммерческих целях, включая такие разнообразные соединения, как хлорированный метан , этаны , винилхлорид , поливинилхлорид (ПВХ), трихлорид алюминия для катализа , хлориды магния , титана , циркония и гафния, которые являются прекурсорами для получения чистой формы этих элементов. [18]
Количественно из всего произведенного элементарного хлора около 63% используется в производстве органических соединений и 18% в производстве неорганических соединений хлора. [85] Около 15 000 соединений хлора используются в коммерческих целях. [86] Остальные 19% произведенного хлора используются для отбеливателей и дезинфицирующих средств. [76] Наиболее значимыми из органических соединений с точки зрения объема производства являются 1,2-дихлорэтан и винилхлорид , промежуточные продукты в производстве ПВХ . Другими особенно важными хлорорганическими соединениями являются метилхлорид , метиленхлорид , хлороформ , винилиденхлорид , трихлорэтилен , перхлорэтилен , аллилхлорид , эпихлоргидрин , хлорбензол , дихлорбензолы и трихлорбензолы . Основные неорганические соединения включают HCl , Cl2O , HOCl , NaClO3 , AlCl3 , SiCl4 , SnCl4 , PCl3 , PCl5 , POCl3 , AsCl3 , SbCl3 , SbCl5 , BiCl3 и ZnCl2 . [ 76 ]
Во Франции (как и везде) кишки животных перерабатывались для изготовления струн музыкальных инструментов, кожи Голдбитера и других продуктов. Это делалось на «фабриках по производству кишок» ( boyauderies ), и это был вонючий и нездоровый процесс. Примерно в 1820 году Société d'encouragement pour l'industrie nationale предложило премию за открытие метода, химического или механического, для отделения брюшинной оболочки кишок животных без гниения . [87] [88] Премию выиграл Антуан-Жермен Лабаррак , 44-летний французский химик и фармацевт, который обнаружил, что хлорированные отбеливающие растворы Бертолле (« Eau de Javel ») не только уничтожали запах гниения разложения тканей животных, но и фактически замедляли разложение. [88] [34]
Исследования Лабаррака привели к использованию хлоридов и гипохлоритов извести ( гипохлорит кальция ) и натрия ( гипохлорит натрия ) в бойодериях. Те же химикаты оказались полезными при обычной дезинфекции и дезодорации туалетов , канализации , рынков, скотобоен , анатомических театров и моргов. [89] Они были успешны в больницах , лазаретах , тюрьмах , лазаретах (как на суше, так и на море), магнанериях , конюшнях , хлевах для скота и т. д.; и они были полезны во время эксгумаций , [90] бальзамирования , вспышек эпидемических заболеваний, лихорадки и черного чумы у крупного рогатого скота. [87]
Растворы хлорированной извести и соды Лабаррака пропагандировались с 1828 года для предотвращения инфекции (называемой «заразной инфекцией», предположительно передаваемой « миазмами ») и для лечения гниения существующих ран, включая септические раны. [91] В своей работе 1828 года Лабаррак рекомендовал врачам вдыхать хлор, мыть руки в хлорированной извести и даже посыпать хлорированной известью кровати пациентов в случаях «заразной инфекции». В 1828 году заражение инфекциями было хорошо известно, хотя действие микроба было обнаружено только более чем полвека спустя.
Во время вспышки холеры в Париже в 1832 году для дезинфекции столицы использовались большие количества так называемого хлористого кальция . Это был не просто современный хлорид кальция , а хлорный газ, растворенный в известковой воде (разбавленный гидроксид кальция ) для образования гипохлорита кальция (хлорированной извести). Открытие Лабаррака помогло устранить ужасный смрад гниения из больниц и анатомических комнат, и тем самым эффективно дезодорировало Латинский квартал Парижа. [92] Многие считали, что эти «гнилые миазмы» вызывают распространение «заражения» и «инфекции» — оба слова использовались до появления микробной теории заражения. Хлористый кальций использовался для уничтожения запахов и «гнилых веществ». Один источник утверждает, что хлористый кальций использовался доктором Джоном Сноу для дезинфекции воды из зараженного холерой колодца, который питал насос на Брод-стрит в Лондоне в 1854 году, [93] хотя три других авторитетных источника, описывающих ту знаменитую эпидемию холеры, не упоминают об этом инциденте. [94] [95] [96] В одном из источников ясно указано, что хлорид извести использовался для дезинфекции отходов и грязи на улицах вокруг водокачки на Брод-стрит — обычная практика в Англии середины девятнадцатого века. [94] : 296

Возможно, самое известное применение хлора и химических щелочных растворов Лабаррака произошло в 1847 году, когда Игнац Земмельвейс использовал хлорную воду (хлор, растворенный в чистой воде, что было дешевле, чем растворы хлорированной извести) для дезинфекции рук австрийских врачей, которые, как заметил Земмельвейс, все еще передавали запах разложения из анатомических залов в комнаты для осмотра пациентов. Задолго до появления микробной теории болезней Земмельвейс предположил, что «трупные частицы» переносят гниение от свежих медицинских трупов к живым пациентам, и он использовал известные «растворы Лабаррака» как единственный известный метод удаления запаха разложения и разложения тканей (с чем, как он обнаружил, мыло не справляется). Растворы оказались гораздо более эффективными антисептиками, чем мыло (Земмельвейс также знал об их большей эффективности, но не знал причину), и это привело к знаменитому успеху Земмельвейса в остановке передачи родильной горячки («родильной лихорадки») в родильных отделениях Венской городской больницы в Австрии в 1847 году. [97]
Гораздо позже, во время Первой мировой войны в 1916 году, стандартизированная и разбавленная модификация раствора Лабаррака, содержащая гипохлорит (0,5%) и борную кислоту в качестве кислотного стабилизатора, была разработана Генри Драйсдейлом Дейкином (который отдал должное предыдущей работе Лабаррака в этой области). Названный раствором Дейкина , метод орошения ран хлорированными растворами позволил проводить антисептическую обработку широкого спектра открытых ран задолго до современной эры антибиотиков. Модифицированная версия этого раствора продолжает использоваться для орошения ран в наше время, где она остается эффективной против бактерий, устойчивых к нескольким антибиотикам (см. Century Pharmaceuticals ). [98]


Первое непрерывное применение хлорирования питьевой воды в США было установлено в Джерси-Сити , штат Нью-Джерси, в 1908 году. [99] К 1918 году Министерство финансов США потребовало дезинфекции всей питьевой воды хлором. В настоящее время хлор является важным химикатом для очистки воды (например, на водоочистных станциях), в дезинфицирующих средствах и в отбеливателе . Даже небольшие запасы воды теперь регулярно хлорируются. [100]
Хлор обычно используется (в форме хлорноватистой кислоты ) для уничтожения бактерий и других микробов в питьевой воде и общественных бассейнах. В большинстве частных бассейнов используется не сам хлор, а гипохлорит натрия , образованный из хлора и гидроксида натрия , или твердые таблетки хлорированных изоциануратов. Недостатком использования хлора в бассейнах является то, что хлор реагирует с аминокислотами в белках человеческих волос и кожи. Вопреки распространенному мнению, характерный «аромат хлора», связанный с бассейнами, является не результатом самого элементарного хлора, а хлорамина , химического соединения, получаемого в результате реакции свободного растворенного хлора с аминами в органических веществах, включая те, что содержатся в моче и поте. [101] В качестве дезинфицирующего средства в воде хлор более чем в три раза эффективнее против кишечной палочки, чем бром , и более чем в шесть раз эффективнее йода . [102] Все чаще монохлорамин добавляют непосредственно в питьевую воду в целях дезинфекции, этот процесс известен как хлораминирование . [103]
Часто нецелесообразно хранить и использовать ядовитый хлорный газ для очистки воды, поэтому используются альтернативные методы добавления хлора. К ним относятся растворы гипохлорита , которые постепенно выделяют хлор в воду, и такие соединения, как дихлор-s-триазинтрион натрия (дигидрат или безводный), иногда называемый «дихлор», и трихлор-s-триазинтрион , иногда называемый «трихлор». Эти соединения стабильны в твердом состоянии и могут использоваться в порошкообразной, гранулированной или таблетированной форме. При добавлении в небольших количествах в воду бассейна или промышленные водные системы атомы хлора гидролизуются из остальной части молекулы, образуя хлорноватистую кислоту (HOCl), которая действует как общий биоцид , убивая микробы, микроорганизмы, водоросли и так далее. [104] [105]
Хлорный газ, также известный как бертолит, был впервые использован в качестве оружия в Первой мировой войне Германией 22 апреля 1915 года во Второй битве при Ипре . [106] [107] По описаниям солдат, он имел характерный запах смеси перца и ананаса. [108] Он также имел металлический привкус и обжигал заднюю часть горла и грудь. Хлор реагирует с водой в слизистой оболочке легких, образуя соляную кислоту , разрушительную для живых тканей и потенциально смертельную. Человеческие дыхательные системы могут быть защищены от хлорного газа противогазами с активированным углем или другими фильтрами, что делает хлорный газ гораздо менее смертоносным, чем другое химическое оружие. Он был впервые использован немецким ученым, впоследствии ставшим лауреатом Нобелевской премии, Фрицем Габером из Института кайзера Вильгельма в Берлине, в сотрудничестве с немецким химическим конгломератом IG Farben , который разработал методы выпуска хлорного газа против укрепившегося противника. [109] После первого применения обе стороны конфликта использовали хлор в качестве химического оружия, но вскоре его заменили более смертоносные фосген и горчичный газ . [110]
Хлорный газ также использовался во время иракской войны в провинции Анбар в 2007 году, когда повстанцы наполняли грузовики бомбами с минометными снарядами и цистернами с хлором. В результате атак погибло два человека от взрывчатки и более 350 человек заболели. Большинство смертей были вызваны силой взрывов, а не воздействием хлора, поскольку токсичный газ легко рассеивается и разбавляется в атмосфере взрывом. В некоторых бомбардировках более ста мирных жителей были госпитализированы из-за проблем с дыханием. Иракские власти ужесточили меры безопасности для элементарного хлора, который необходим для обеспечения населения безопасной питьевой водой. [111] [112]
23 октября 2014 года было сообщено, что Исламское государство Ирака и Леванта использовало хлорный газ в городе Дулуйя, Ирак . [113] Лабораторный анализ одежды и образцов почвы подтвердил использование хлорного газа против курдских сил Пешмерга в ходе атаки с использованием самодельного взрывного устройства, установленного на автомобиле, 23 января 2015 года на перекрестке шоссе 47 Киске недалеко от Мосула. [114]
Другая страна на Ближнем Востоке, Сирия , использовала хлор в качестве химического оружия [115], доставляемого с помощью бочковых бомб и ракет. [116] [117] В 2016 году Совместный следственный механизм ОЗХО-ООН пришел к выводу, что сирийское правительство использовало хлор в качестве химического оружия в трех отдельных атаках. [118] Более поздние расследования Группы по расследованию и идентификации ОЗХО пришли к выводу, что сирийские ВВС были ответственны за атаки с применением хлора в 2017 и 2018 годах. [119]
Хлористый анион является важным питательным веществом для метаболизма. Хлор необходим для выработки соляной кислоты в желудке и для функций клеточного насоса. [120] Основным источником хлорида в рационе является поваренная соль или хлорид натрия. Слишком низкие или высокие концентрации хлорида в крови являются примерами нарушений электролитного баланса . Гипохлоремия (слишком мало хлорида) редко возникает при отсутствии других отклонений. Иногда она связана с гиповентиляцией . [121] Она может быть связана с хроническим респираторным ацидозом . [122] Гиперхлоремия (слишком много хлорида) обычно не вызывает симптомов. Когда симптомы возникают, они, как правило, напоминают симптомы гипернатриемии (слишком много натрия ). Снижение уровня хлорида в крови приводит к церебральной дегидратации; симптомы чаще всего вызваны быстрой регидратацией, которая приводит к отеку мозга . Гиперхлоремия может влиять на транспорт кислорода. [123]
Хлор — токсичный газ, поражающий дыхательную систему, глаза и кожу. [126] Поскольку он плотнее воздуха, он имеет тенденцию скапливаться на дне плохо проветриваемых помещений. Хлорный газ — сильный окислитель, который может вступать в реакцию с легковоспламеняющимися материалами. [127] [128]
Хлор можно обнаружить с помощью измерительных приборов в концентрациях всего 0,2 частей на миллион (ppm), а по запаху — при 3 ppm. Кашель и рвота могут возникнуть при 30 ppm, а повреждение легких — при 60 ppm. Около 1000 ppm могут быть смертельными после нескольких глубоких вдохов газа. [ 18] Концентрация IDLH (непосредственно опасная для жизни и здоровья) составляет 10 ppm. [129] Вдыхание более низких концентраций может ухудшить состояние дыхательной системы, а воздействие газа может вызвать раздражение глаз. [130] При вдыхании хлора в концентрациях более 30 ppm он вступает в реакцию с водой в легких, образуя соляную кислоту (HCl) и хлорноватистую кислоту (HOCl).
При использовании в определенных концентрациях для дезинфекции воды реакция хлора с водой не представляет серьезной проблемы для здоровья человека. Другие материалы, присутствующие в воде, могут генерировать побочные продукты дезинфекции , которые связаны с негативным воздействием на здоровье человека. [131] [132]
В Соединенных Штатах Управление по охране труда и промышленной гигиене (OSHA) установило допустимый предел воздействия элементарного хлора в 1 ppm или 3 мг/м 3 . Национальный институт охраны труда и промышленной гигиене установил рекомендуемый предел воздействия в 0,5 ppm в течение 15 минут. [129]
В домашних условиях несчастные случаи происходят, когда растворы отбеливателя гипохлорита вступают в контакт с некоторыми кислотными очистителями стоков, в результате чего образуется газообразный хлор. [133] Гипохлоритный отбеливатель (популярная добавка для стирки ) в сочетании с аммиаком (еще одна популярная добавка для стирки) производит хлорамины , еще одну токсичную группу химикатов. [134]

Хлор широко используется для очистки воды, особенно питьевой воды и воды, используемой в бассейнах. Несколько катастрофических обрушений потолков бассейнов произошло из-за вызванного хлором коррозионного растрескивания под напряжением подвесных стержней из нержавеющей стали . [135] Некоторые полимеры также чувствительны к воздействию, включая ацетальную смолу и полибутен . Оба материала использовались в бытовых водопроводах с горячей и холодной водой, а коррозионное растрескивание под напряжением вызвало массовые аварии в США в 1980-х и 1990-х годах. [136]
Элемент железо может соединяться с хлором при высоких температурах в сильной экзотермической реакции, создавая пожар хлора и железа . [137] [138] Пожары хлора и железа представляют опасность на химических заводах, где большая часть трубопроводов, по которым транспортируется газообразный хлор, изготовлена из стали. [137] [138]
{{cite web}}: CS1 maint: бот: исходный статус URL неизвестен ( ссылка ){{cite web}}: CS1 maint: бот: исходный статус URL неизвестен ( ссылка )